唑来膦酸通过抑制Wnt5a介导的软骨下异常骨吸收减轻大鼠膝骨关节炎
丁 一,马贵英,王丽梅,丁 冬,刘国强
骨性关节炎(OA)是一种慢性、进行性和退行性疾病,严重影响患者的生活质量,近几年发病率呈上升趋势[1]。在OA早期,破骨细胞介导的骨吸收增强,软骨下骨小梁丢失,这种形态结构的改变导致关节软骨响应载负荷的生物力学功能改变,导致软骨退变[2]。Wnt5a在某些疾病中具有双向调节作用,它的表达与甲状腺癌、结直肠癌的发生呈负相关性,与黑色素瘤、胃癌的发生呈正相关性[3]。另有研究表明,Wnt5a对Wnt3a既有促进作用[4],也有抑制作用[5]。因此,Wnt5a信号的功能是复杂的,在不同的微环境中结合不同的受体后,Wnt5a信号所发挥的生物学作用也不同。破骨细胞的分化受NF-κB受体配体(RANKL)/RANK/骨保护素(OPG)轴调控[6],这一调节作用是否与Wnt5a共同参与早期OA的软骨下异常骨吸收仍然不清楚。唑来膦酸(ZOL)具有抑制破骨细胞形成和骨吸收的功能。本文通过内侧半月板失稳法(DMM)建立大鼠膝OA模型,确认OA早期的骨吸收时间窗,应用ZOL干预DMM所致的SD大鼠OA模型作为阳性对照,检测ZOL对软骨下骨重塑、关节软骨的退变及破骨细胞的活性等作用。为了进一步明确其机制,本文检测了Wnt5a信号以及RANKL等与破骨细胞形成相关的分子在早期OA中的表达情况。
1 资料与方法
1.1 实验材料:健康8周龄雄性SD大鼠90只,质量(287±12)g,由宁夏医科大学实验动物中心提供,scxk(宁)2020-0012。ZOL(诺华制药,瑞士),光学显微镜(奥林巴斯,日本),恒冷式冰冻切片机(LEICA CM1850,德国),Elisa试剂盒(联硕,上海)。兔抗大鼠一抗:Wnt5a、RANKL(Proteintech,中国),HRP标记的羊抗兔二抗(博士德,武汉),番红O-固绿染色试剂盒与抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(赛维尔,武汉),逆转录试剂盒、RT-qPCR试剂盒(全式金,北京)。
1.2 方法
1.2.1 动物分组及处理:将90只大鼠中的72只随机分为Sham+PBS组、DMM+PBS组和DMM+ZOL组。分别于OA诱导后2、4、8、12周处死大鼠(n=6),观察ZOL对OA大鼠膝软骨和软骨下骨的影响。在此基础上,将另外18只大鼠随机分为与上述相同的3组(每组6只),术后4周取材检测,评价破骨细胞在OA早期的活化情况,并探讨其相关的分子机制。大鼠适应性饲养1周后,用1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉,应用DMM方法建立大鼠OA模型[7]。切断右膝的内侧半月板胫侧副韧带,将内侧半月板翻转至股骨近端,然后逐层缝合创面。Sham+PBS组,大鼠仅暴露内侧半月板胫侧副韧带后缝合创面。为了观察ZOL对软骨下骨中破骨细胞的活性的影响,DMM+ZOL组于造模后次日予以ZOL腹腔注射 (100 μg/kg溶于1 mL PBS缓冲液),每周2次,连续4周。Sham+PBS组和DMM+PBS组,均给予等量PBS缓冲液。
1.2.2 Micro-CT(μCT)检测:将膝关节置于4%多聚甲醛溶液中固定48 h,采用SKYSCAN1076扫描仪(扫描参数:像素10 μm,峰值管电压40 kV,电流250 μA,旋转角度0.6°)进行三维CT成像。胫骨内侧平台负重区域(前后范围3.5 mm)被确定为感兴趣区(ROI),计算各组骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁间距(Tb.Sp)、骨小梁数目(Tb.N)和连接密度(CD)。
1.2.3 组织形态学染色:获取μCT图像后,膝关节标本在10% EDTANa2中脱钙4周,石蜡包埋,沿冠状面以5 μm厚切片,按照试剂盒说明进行番红O-固绿染色和TRAP染色。切片在二甲苯中脱蜡2次,20 min/次;用无水乙醇浸泡2次,5 min/次。固绿染色5 min,洗涤,脱水,番红O染色2 min,光镜下拍片后按照OARSI评分方法评估关节软骨的退变程度[8]。切片在TRAP工作液中孵育2 h,蒸馏水冲洗3次,苏木精染色3 min,光镜下随机选择切片的5个区域,应用ImageJ 1.48v软件计算代表软骨下骨的骨吸收活性与破骨细胞表面占比(Oc.S/BS)。
1.2.4 免疫组织化学染色:各组冠状切片在4 ℃下与兔抗大鼠Wnt5a、RANKL(稀释比例1∶200)孵育过夜。PBS缓冲液洗涤3次,5 min/次,HRP标记的羊抗兔IgG二抗在37 ℃孵育1 h,PBS缓冲液洗涤后加入DAB显色后,苏木素复染3 min。光镜下随机选取切片的5个视野拍照,并用ImageJ 1.48v软件计算阳性细胞比例。
1.2.5 RT-qPCR检测:术后4周,每组取6只大鼠用过量戊巴比妥钠(100 mg/kg)麻醉后处死,去除关节软骨,保留胫骨近端的软骨下骨,按照试剂盒说明提取总RNA。应用Transscript®All-in-One First-Strand cDNA Synthesis Kits合成第一链cDNA,应用Perfect StartTM Green qPCR SuperMix进行RT-qPCR,具体引物序列如表1。反应条件如下:94 ℃维持30 s,54 ℃反应30 s,72 ℃反应34 s,持续45个循环。采用2-ΔΔCt法对相对基因表达水平进行定量,内参选择β-actin。

表1 引物序列

2 结果
2.1 ZOL抑制DMM导致的OA大鼠膝关节软骨下异常骨重塑:膝关节μCT结果显示,与Sham+PBS组比较,DMM+PBS组在术后4周时软骨下骨吸收加快,BV/TV、Tb.Th、Tb.N和CD降低,Tb.Sp增加(P<0.05);8周时骨形成加快,BV/TV、Tb.Th增加,Tb.N和CD降低(P<0.05)。与DMM+PBS组比较,DMM+ZOL组在术后4周时骨吸收减轻,BV/TV、Tb.Th、Tb.N和CD增加,Tb.Sp降低(P<0.05);8周时骨形成延缓,BV/TV、Tb.Th降低(P<0.05),见表2至表3。胫骨干骺端发生骨硬化,可能是由于ZOL抑制生长板中破骨细胞的活性而导致骨吸收减弱所致(图1,封三)。
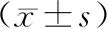
表2 2组大鼠术后4周时ZOL致DMM诱导的OA膝关节软骨下骨变化的μCT检测结果比较
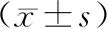
表3 3组大鼠术后8周时ZOL致DMM诱导的OA膝关节软骨下骨变化的μCT检测结果比较
2.2 ZOL抑制DMM诱导的OA大鼠膝关节软骨的退变:软骨退变发生在术后2~12周,并呈时间的依赖性。番红O-固绿染色显示,术后2周与Sham+PBS组相比,DMM+PBS组的软骨基质和细胞的降解主要发生在软骨浅层。随着OA进展,这些变化进一步延伸到深层,并在4周时产生不规则的裂缝;8周时累及关节全层,潮线复制,这些变化在12周时变得更加明显(图2,封三);DMM+ZOL组软骨退变程度减轻,进程延缓。术后各时间点OARSI评分显示,与Sham+PBS组相比,DMM+PBS组与DMM+ZOL组均增加(P<0.05);与DMM+PBS组相比,DMM+ZOL组均减低(P<0.05),见表4。

表4 3组大鼠OARSI评分比较(分,
2.3 ZOL抑制DMM诱导的OA大鼠膝关节软骨下骨中早期破骨细胞的形成:TRAP染色显示,与Sham+PBS组相比,DMM+PBS组在术后4周软骨下骨中有更多的TRAP+的破骨细胞,而ZOL显著抑制破骨细胞的形成(图3,封三)。这一结果与μCT一致,支持ZOL抑制DMM诱导的OA早期破骨细胞活化造成的骨量减少,见表5。

表5 TRAP染色检测ZOL抑制DMM诱导的OA大鼠膝关节软骨下骨中破骨细胞形成情况比较
2.4 ZOL抑制膝关节软骨下骨中Wnt5a和破骨细胞生成相关基因的表达:为了从分子水平进一步阐明OA早期破骨细胞异常活化的机制,用免疫组化检测Wnt5a、RANKL的表达,用RT-qPCR检测软骨下骨中Wnt5a、RANKL、CXCL12、活化T细胞核因子1(NFATc1)、OPG、TRAP和组织蛋白酶K(CTSK)的表达。免疫组织化学染色显示,与Sham+PBS组比较,DMM+PBS组中Wnt5a和RANKL的阳性细胞明显增多(P<0.05);与DMM+PBS组比较,DMM+ZOL组中Wnt5a和RANKL的阳性细胞明显减少(P<0.05)。软骨下骨的RT-qPCR结果显示,ZOL抑制了DMM诱导的Wnt5a和破骨细胞生成基因的表达(P<0.05),见表6。

表6 免疫组化染色检测ZOL降低DMM诱导的OA大鼠膝关节软骨下骨中Wnt5a、RANKL阳性率比较
3 讨论
本研究旨在探索ZOL对OA进展的影响及可能的分子机制,结果证实DMM可诱导SD大鼠形成OA,使膝关节OARSI评分增高。在OA早期,软骨下骨异常与骨重塑表现为破骨细胞介导的骨吸收增强,骨量减少,Micro-CT和TRAP染色的结果均证实了这一点。ZOL可通过抑制OA早期破骨细胞的活性,减弱骨吸收,从而延缓OA的病程,减轻软骨的退变。本研究结果显示,破骨细胞的异常活化可能与Wnt5a信号通路相关。
OA是一种慢性、进行性、退变性疾病,病理表现以软骨下异常骨重塑和关节软骨退变为特点。OA的分期和严重程度可以用OARSI评分来量化,这是OA软骨组织病理学评估的一种标准方法[8]。与其他评分方法相比,OARSI评分可以揭示OA的早期病理改变,为基础研究以及临床诊断和治疗提供指导。既往的研究显示,在前交叉韧带离断术(ACLT)所致 的OA模型中,术后1~2周即可发现骨小梁的丢失和软骨的退变[9]。本研究结果显示,在OA诱导后4周只有轻微的软骨退化,这种差异性可能是因为我们使用DMM法诱导了SD大鼠的OA模型所致。相较于ACLT,DMM是一种微创的方法,可以避免严重创伤、急性炎症或免疫应激对OA造成的干扰,更好地模拟退变性OA的慢性、进行性的特点[10]。
OA是一种全关节疾病,关节软骨和软骨下骨形成一个结构和功能单位,共同参与OA的病理进程[11]。动物实验和临床研究均证实,在OA早期软骨下骨中存在骨囊肿,这是针对异常骨重塑的适应性改变,这种改变与破骨细胞的活化相关[12]。本研究结果也发现,通过DMM诱导OA 4周后,软骨下骨中破骨细胞数量增加,骨吸收增强,骨量减少。ZOL对骨质疏松症的疗效已在临床得到证实,因此我们将ZOL在DMM诱导的SD大鼠OA早期予以干预,发现骨吸收被ZOL抑制,而且μCT、OARSI评分和TRAP染色均证实ZOL可减轻OA早期软骨下骨中的异常骨吸收,减轻并延缓关节软骨的退变,这或许是改善OA的一种治疗策略。
最新的研究证实Wnt/β-catenin信号通路参与了OA晚期的异常骨形成[13]。MAEDA等研究发现Wnt5a缺陷的小鼠表现为骨吸收功能障碍[5]。与此相反的研究发现,Wnt5a通过上调Lrp5/6的表达,启动Wnt/β-catenin信号通路从而促进成骨分化而抑制成脂分化[4]。Wnt5a在一些肿瘤疾病中也表现出双重调节作用[3]。因此,我们推测在不同的微环境中,来源于不同细胞的Wnt5a结合差异性受体后形成不同复合物,从而激活下游的转录因子发挥相应的调节作用,调节破骨细胞的形成和骨吸收功能。破骨细胞来源于造血干细胞中的单核-巨噬细胞系,通过分泌酸性蛋白酶类分解骨基质,实现骨吸收。破骨细胞的形成和活化与微环境中的细胞因子有关,包括RANKL、OPG、肿瘤坏死因子受体相关因子6(TRAF6)和破骨细胞分化因子[14]。RANKL/RANK/OPG轴在破骨细胞形成过程中起着重要的调控作用。来自成骨细胞和骨髓间充质干细胞(BMSCs)的RANKL与破骨前体细胞表面的RANK结合,随后激活一系列转录因子,包括NF-κB、激活蛋白1(AP1)、NFATc1和丝裂原活化蛋白激酶(MAPK)相关的生物分子。这些下游因子的激活启动了与破骨细胞分化和骨吸收功能相关的基因转录,包括TRAP、CTSK、降钙素受体(CTR)和MMP-9,最终形成成熟的多核破骨细胞[15]。OPG可以作为诱饵受体取代RANK并与RANKL结合,从而抑制成熟破骨细胞的形成和骨吸收。C-X-C趋化因子配体12(CXCL12)主要来源于BMSCs,可与破骨细胞前体表面的C-X-C趋化因子受体4(CXCR4)结合,促进细胞向骨吸收位点迁移[16]。这些与各自信号通路相关的生物分子,可能是调控破骨细胞形成和功能的潜在靶点。本研究结果显示,DMM可上调OA早期Wnt5a的表达,协同增加RANKL的蛋白水平和破骨细胞形成相关的基因表达水平,包括TRAP和CTSK,而ZOL可以抑制这种效应。这可能是由于ZOL抑制破骨细胞诱导的骨吸收,改变了软骨下骨中的酸性微环境,间接抑制了RANKL的表达和Wnt5a介导的破骨细胞形成基因。
本研究中仍存在一些局限性。首先,本研究设置了四个时间点观察OA早期软骨下骨量的丢失和晚期OA的进展,尽管如此,仍可能错过OA进展相关的关键事件。其次,由于技术限制没有追踪同一个样本的发展变化,如对活体样本进行μCT检测,这也可以节约研究的样本量。第三,缺少针对软骨下骨中与骨吸收相关的特定效应细胞的深入研究,包括细胞水平和Wnt5a信号分子水平,还需要今后进一步完善此项工作。

