红杆菌NBS58-1产胞外多糖发酵条件优化及其保湿性研究
李春雨,杨棒棒,周 佳,罗 宇,屈建航*
(河南工业大学 生物工程学院,河南 郑州 450001)
多糖(即多聚糖)一般是通过10个以上的单糖由糖苷键连接起来而形成的聚合糖高分子碳水化合物[1],种类繁多,结构复杂。根据来源不同,多糖分为动物多糖、植物多糖、微生物多糖[2]。微生物多糖是由细菌、真菌、藻类等微生物在代谢过程中产生的对其本身有保护作用的生物高聚物,相较于动物多糖与植物多糖,微生物多糖获取成本低,方法简便,且不受地域、季节、虫害、光照等条件限制,同时还具有发酵条件易调控、多糖易分离等优点[3]。
微生物多糖以胞外多糖(exopolysaccharides,EPS)为主,微生物胞外多糖具有保湿、乳化[4]、流变[5]、粘合、金属络合[6]等特性以及抗氧化[7]、抗炎症[8]、抗肿瘤[9]、免疫调节[10]等生物活性,在食品、生物技术、化妆品和制药工业中具有较大的潜在应用价值。其中部分细菌多糖的化学结构中存在大量亲水性羟基,使得多糖具有较强的吸湿保湿活性[11],在化妆品行业中具有广阔的应用前景。周璇[12]研究发现,地衣芽孢杆菌Ⅱ4-01胞外多糖在相对湿度为43%和81%环境中,纯多糖的吸湿能力强于壳聚糖和黄原胶;在干硅胶环境下,多糖的保湿性要明显优于壳聚糖和黄原胶。杨棒棒等[13]研究发现,类芽孢杆菌ZX-5胞外多糖在干燥环境中具有优于甘油和壳聚糖的保湿性。
目前产胞外多糖优良菌种的筛选及其发酵条件优化,仍是微生物胞外多糖研究的关键。张丽等[14]对培养基成分进行优化,优化后齐整小核菌产糖量提高了54.42%。王琪等[15]对筛选的一株产胞外多糖罗汉果内生菌株进行发酵条件优化,优化后产糖量是优化前的1.9倍。
本研究对本实验室自主分离筛选和鉴定的一株细菌新种红杆菌(Rufibacter hautae)NBS58-1进行发酵产糖条件的优化,并研究其保湿性,为微生物胞外多糖的菌种资源开发及其相关应用奠定理论基础和技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红杆菌(Rufibacter hautae)NBS58-1:本实验室自主分离筛选和鉴定[16]。
1.1.2 试剂
葡萄糖、丙酮酸钠、硝酸钠、尿素、蔗糖、麦芽糖、棉子糖、阿拉伯糖、琼脂粉、无水乙醇、苯酚(均为分析纯):天津市科密欧化学试剂有限公司;酵母浸粉、酸水解酪蛋白、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限公司。
1.1.3 培养基
R2A培养基[16]:酵母浸粉0.5 g/L、酸水解酪蛋白0.5 g/L、胰蛋白胨0.5 g/L、葡萄糖0.5 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O0.3g/L、MgSO4·7H2O0.05g/L、丙酮酸钠0.3g/L,pH 7.0、115 ℃灭菌30 min。固体R2A培养基加入琼脂粉15 g。
1.2 仪器与设备
VS-840-2洁净工作台、SPX-250B-D培养箱、BSDYX2400立式双层智能精密摇床:上海博迅实业有限公司医疗设备厂;UV-2450紫外可见分光光度计:日本岛津公司;TGL-16G高速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 菌株NBS58-1生长曲线及其产胞外多糖曲线绘制
R2A固体培养基上挑取NBS58-1新鲜菌种,接种至R2A液体培养基,28 ℃、150 r/min培养48 h作为种子液。将种子液以5%(V/V)的接种量接至R2A液体培养基中,在28 ℃、150 r/min、装液量100 mL/250 mL条件下进行发酵产糖。分别于不同时间(0、15 h、22 h、27 h、39 h、46 h、52 h、58 h、65 h、75 h、87 h)取3 mL发酵液样品,测定波长600 nm处的吸光度值,用蒸馏水作为空白对照,以发酵时间为横坐标,吸光度值为纵坐标绘制菌株生长曲线。
参照窦富超[17]的方法绘制葡萄糖标准曲线,分别于不同时间(0、15 h、22 h、27 h、39 h、46 h、52 h、58 h、65 h、75 h、87 h)取3 mL发酵液样品,采用硫酸苯酚法[18]测定多糖含量,以发酵时间为横坐标,胞外多糖产量为纵坐标,绘制菌株产胞外多糖曲线。
1.3.2 单因素试验
以R2A培养基的成分为基础,固定R2A培养基起始pH 7,温度28 ℃,接种量5%。分别考察碳源(葡萄糖、蔗糖、麦芽糖、棉子糖、阿拉伯糖)及碳源添加量(0.5 g/L、1 g/L、2 g/L、5 g/L、10 g/L、15 g/L、20 g/L、40 g/L),氮源(酵母浸粉、胰蛋白胨、酸水解酪蛋白、尿素、硝酸钠)及氮源添加量(0.5 g/L、1.0 g/L、2.0 g/L),pH(6.0、6.5、7.0、7.5、8.0),温度(10 ℃、20 ℃、28 ℃、37 ℃、45 ℃),接种量(3%、5%、8%、10%、15%)对NBS58-1产胞外多糖量的影响。
1.3.3 胞外多糖发酵条件优化响应面试验设计
在单因素试验的基础上,使用Design Expert12软件进行响应面设计,选取3个影响显著的因素蔗糖添加量(A)、初始pH(B)、温度(C)设计3因素3水平的试验组合,考察因素变化对胞外多糖产量(Y)的影响。

表1 胞外多糖发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for extracellular polysaccharide fermentation condition optimization
1.3.4 胞外多糖保湿性评价
参照WANG Z C等[19]的方法提取纯化胞外多糖。参照周璇[12]吸湿保湿试验方法,并稍作修改。
(1)吸湿性试验:精密称取胞外多糖冻干样品、烘干至质量恒定的壳聚糖和透明质酸各0.1 g,置于干燥平皿中,将平皿分别放置在装有适量饱和碳酸钠溶液(相对湿度43%)和饱和硫酸铵溶液(相对湿度81%)的20 ℃恒温干燥器中,定时称量样品质量。每组每个样品3次平行。样品吸湿率计算公式如下:

式中:mt为t时间样品质量,g;m0为干燥样品质量,g。
(2)保湿性试验:精密称取胞外多糖冻干样品、烘干至恒重的壳聚糖和透明质酸各0.1 g,分别加入3倍体积去离子水,将样品均匀完全浸润后,放置于盛有干硅胶的干燥器中(相对湿度0%),定时称量样品质量。样品保湿率计算公式如下:

式中:mt为t时间样品质量,g;m0为干燥样品质量,g;m水为加入去离子水质量,g。
1.3.5 数据统计分析
所有试验设置3个平行,结果以“平均值±标准差”形式表示。单因素试验采用SPASS 22.0软件进行显著性分析,采用Origin 2021b软件作图。响应面试验设计及分析采用DesignExpert 12软件。
2 结果与分析
2.1 菌株NBS58-1生长曲线及其产胞外多糖曲线
菌株NBS58-1生长曲线及产胞外多糖曲线如图1所示。由图1可知,菌株NBS58-1在52 h时生长量达到最大,在58 h时EPS产量达到最大。

图1 菌株NBS58-1生长曲线及产胞外多糖曲线Fig.1 Growth curve and extracellular polysaccharide production curve of strain NBS58-1
2.2 单因素结果分析
2.2.1 碳源对菌株NBS58-1产EPS的影响
由图2(A)可知,5种不同碳源均能促进菌株NBS58-1产生一定量的胞外多糖,蔗糖作为单一碳源时效果最佳,组间差异显著(P<0.05)。由图2(B)可知,在蔗糖添加量为0.5~15 g/L时,菌株NBS58-1产EPS量不断增加;在15 g/L时达到最大,为100.77 mg/L;在15~40 g/L时,随着蔗糖添加量的增大而减小,可能是由于培养基中蔗糖含量过高,导致菌体内外渗透压失衡,其生长受到抑制,从而影响菌株胞外多糖的合成[20]。因此选择蔗糖添加量为15 g/L。

图2 碳源种类(A)及蔗糖添加量(B)对菌株NBS58-1产胞外多糖的影响Fig.2 Effect of carbon source (A) and sugar addition (B) on extracellular polysaccharide production by strain NBS58-1
2.2.2 氮源对菌株NBS58-1产EPS的影响
氮源对微生物的生长至关重要,而不同的微生物有自身的氮源需求[21]。由图3(A)可知,不同氮源对NBS58-1产EPS量的影响有显著差异(P<0.05),有机氮源明显优于无机氮源,以酵母浸粉作为氮源时,更有利于菌株NBS58-1产胞外多糖。由图3(B)可知,适当提高酵母浸粉浓度有利于菌株产糖。当酵母浸粉浓度过低时,细胞合成菌株生长繁殖时所需的蛋白质、核酸等受到影响,进而影响产糖量[22];当酵母浸粉质量浓度为1 g/L时,产糖量最大,为33.98 mg/L;当酵母浸粉质量浓度>1 g/L时,NBS58-1产EPS开始下降,原因可能是氮源添加量过高,发酵液粘稠,溶氧量减小,导致菌株产糖的分泌与合成受到影响[23]。因此选择酵母浸粉添加量为1 g/L。

图3 氮源种类(A)及酵母浸粉添加量(B)对菌株NBS58-1产胞外多糖的影响Fig.3 Effect of nitrogen source (A) and yeast extract addition (B) on extracellular polysaccharide production by strain NBS58-1
2.2.3 温度对菌株NBS58-1产EPS的影响
由图4可知,当其他条件不变时,温度在10~28 ℃范围内随着温度升高,菌株NBS58-1产EPS量随之增大;在28 ℃时,EPS产量达到最大;28~45 ℃范围内,随着温度升高,NBS58-1产EPS量随之减小。原因可能温度过高或过低,都有可能影响酶蛋白的活性及细胞膜的通透性,进而影响菌体的正常生长及产糖[24]。因此选择温度为28 ℃。

图4 温度对菌株NBS58-1产胞外多糖的影响Fig.4 Effect of temperature on extracellular polysaccharide production by strain NBS58-1
2.2.4 初始pH对菌株NBS58-1产EPS的影响
由图5可知,初始pH对菌株NBS58-1产EPS有显著影响(P<0.05);在pH 6~8范围内,EPS产量先增大后减小,在pH 7时产量最大,因此选择pH 7。

图5 初始pH对菌株NBS58-1产胞外多糖的影响Fig.5 Effect of initial pH on extracellular polysaccharide production by strain NBS58-1
2.2.5 接种量对菌株NBS58-1产EPS的影响
接种量的多少直接影响菌体生长速率,不同菌株的种子液培养方式不同则最适接种量差异较大[25]。由图6可知,在同一发酵时间,随着接种量增加,菌株NBS58-1产EPS先增大后减小,原因可能是在营养成分一定时,接入过多菌种,营养物质加速消耗,用于合成EPS的能力不足[26]。在接种量为5%时,EPS产量最大,为44.59 mg/L。因此选择接种量为5%。

图6 接种量对菌株NBS58-1产胞外多糖的影响Fig.6 Effect of inoculum on extracellular polysaccharide production by strain NBS58-1
2.3 响应面优化试验结果及分析
对蔗糖添加量(A)、初始pH(B)、温度(C)3个因素选取3个水平进行Box Behnken试验,结果如表2所示。

表2 Box Behnken试验设计与结果Table 2 Design and results of Box Behnken tests
由表2数据可得出各因素对菌株NBS58-1产EPS影响的回归方程:Y=128.1-18.78A+19.84B-28.59C-2.44AB-14.29AC-15.83BC-53.31A2-20.86B2-33.62C2。由表3可知,模型的F值为62.41,P<0.01,模型显著,失拟项P值=0.264 0,P>0.05,不显著。决定系数R2=0.987 7,调整决定系数R2adj=0.971 9,与决定系数R2相差<0.2,信噪比=26.267 4>4,表明试验精准度和准确度高,该模型可以较好的应用于对菌株NBS58-1 EPS产量的理论预测。一次项A、B、C,二次项A2、B2、C2以及交互项AC、BC对菌株NBS58-1 EPS产量有极显著影响(P<0.01);交互项AB对菌株NBS58-1 EPS产量影响不显著。

表3 回归模型方差分析结果Table 3 Results of variance analysis of regression model
响应面可直观反映试验中不同因素以及两两因素之间交互作用。响应面的坡度越大,则显示试验因素对NBS58-1 EPS产量影响越大。等高线的椭圆程度表示两两因素之间交互作用对EPS产量影响的显著性,等高线椭圆程度越大,影响越显著。图7结果表明,碳源添加量的坡度大于初始pH的坡度,表明在碳源添加量与初始pH交互作用中碳源添加量的影响大于初始pH。碳源添加量与温度的坡度较陡峭且颜色变化快,表明两者交互作用对菌株NBS58-1 EPS产量影响显著。初始pH与温度的等高线图椭圆程度大,表明二者交互作用显著,与方差分析结果一致。

图7 蔗糖添加量、初始pH与温度间交互作用对菌株NBS58-1产胞外多糖影响的响应曲面与等高线Fig.7 Response surface plots and contour lines of effect of interaction between sucrose addition,initial pH and temperature onextracellular polysaccharide production by strain NBS58-1
为了验证模型的准确性,根据预测最优条件(pH 7.33、温度22.88 ℃、蔗糖添加量14.13 g/L、酵母浸粉添加量1 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.3 g/L)得到预测EPS产量为140.2 mg/L,为方便实际操作,修改试验条件为初始pH 7.5、温度23 ℃、蔗糖添加量14.1 g/L、酵母浸粉添加量1 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.3 g/L,在此条件下进行验证,重复3次,得到EPS产量为138.85 mg/L,与预测值接近,表明模型模拟可靠,能较好的预测真实值。
2.4 菌株NBS58-1产胞外多糖保湿性评价
2.4.1 吸湿性
透明质酸、壳聚糖、菌株NBS58-1产胞外多糖在不同相对湿度条件下吸湿能力如图8所示,在不同相对湿度环境下,3个样品的吸湿率都随时间的增加而增大。在相对湿度43%条件下,40 h时透明质酸、EPS、壳聚糖的吸湿率分别为29.15%、20.01%、18.6%;在相对湿度81%条件下,40 h时透明质酸、EPS、壳聚糖的吸湿率分别为35.7%、23.15%、20.3%,表明相对湿度越大,样品在同一时间的吸湿率越高。吸湿能力排序为透明质酸>EPS>壳聚糖,EPS的吸湿能力虽然比透明质酸吸湿能力差,但优于壳聚糖的吸湿能力,有一定开发应用潜力。

图8 透明质酸、壳聚糖和菌株NBS58-1产胞外多糖吸湿性比较Fig.8 Comparison of moisture absorption of hyaluronic acid,chitosan and extracellular polysaccharide produced by strain NBS58-1
2.4.2 保湿性
菌株NBS58-1产胞外多糖的保湿性评价如图9所示,透明质酸、EPS、壳聚糖在干燥环境下保湿率随时间的延长而降低,在48 h内,EPS的保湿率优于透明质酸与壳聚糖;在48 h时,EPS保湿率为58%,与透明质酸相当,且优于壳聚糖;48 h后,保湿率透明质酸>EPS>壳聚糖,表明该胞外多糖具有一定的保湿效果。
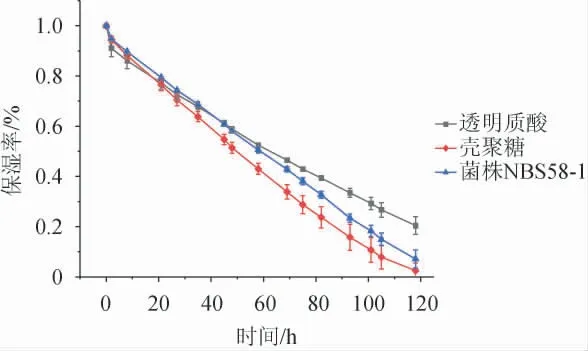
图9 透明质酸、壳聚糖和菌株NBS58-1产胞外多糖保湿性比较Fig.9 Comparison of moisture retention of hyaluronic acid,chitosan and extracellular polysaccharide produced by strain NBS58-1
3 结论
该研究通过单因素试验、Box-Behnken试验和响应面分析,优化了细菌NBS58-1产胞外多糖条件,并研究其产生的胞外多糖的吸湿保湿能力。结果表明,最佳发酵产糖工艺为初始pH 7.5、温度23 ℃、蔗糖14.1 g/L、酵母浸粉1 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.3 g/L,在此条件下发酵58 h,菌株NBS58-1的产EPS量为138.85 mg/L,是优化前的3.08倍。保湿性研究结果表明,在相对湿度0%条件下,48 h内该胞外多糖的保湿率优于透明质酸与壳聚糖。在相对湿度43%和81%条件下,吸湿能力稍低于透明质酸,但高于壳聚糖。微生物产胞外多糖结构复杂,功能多样,后续将继续探究该胞外多糖的结构及其他功能与活性。

