LAPTM4B与肺癌多基因突变状态及EGFR-TKIs耐药关系的分析
纪晓坤,马 阳,郭 晓,刘 颖,赵银环,吴家宁,董律吏,杜 芸
目前,靶向治疗是非小细胞肺癌(non-small cell lung cancer, NSCLC)临床治疗的重要手段和方法。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor recep-tor-tyrosine kinase inhibitors, EGFR-TKIs)可作为敏感表皮生长因子受体(epidermal growth factor receptor, EGFR)突变患者的一线治疗[1]。EGFR-TKIs能有效抑制EGFR敏感突变肿瘤的增殖、侵袭及转移,用药初期可获得良好的效果,但随后会出现明显耐药现象,严重影响治疗效果和预后。溶酶体相关跨膜蛋白4B(lysosomal-associated transmembrane protein 4B, LAPTM4B)缺失增加了细胞膜通透性、pH值、组织蛋白酶释放和细胞凋亡,在大多数肿瘤中过表达,与肿瘤增殖、耐药,侵袭和转移密切相关[2-4]。据文献报道LAPTM4B与EGFR关系密切[5],但是LAPTM4B与NSCLC多基因突变状态及EGFR-TKIs耐药的关系尚不完全清楚。本实验首先采用实时荧光定量PCR法及免疫细胞化学染色检测464例NSCLC细胞学标本多基因突变状态及LAPTM4B蛋白表达,探讨LAPTM4B表达与多基因突变及临床病理特征的关系;分析31例EGFR-TKIs靶向治疗前标本的LAPTM4B蛋白表达,评估EGFR-TKIs治疗继发耐药基因T790M突变后LAPTM4B表达的变化,并探究LAPTM4B在EGFR-TKIs继发耐药中的作用。
1 材料与方法
1.1 材料收集2019年1月~2021年10月河北医科大学第四医院癌检中心经HE及免疫细胞化学染色确诊为NSCLC的464例胸水及细针穿刺细胞学标本,离心沉淀,经10%中性福尔马林固定、石蜡包埋等步骤制成细胞快[6];并收集其中31例EGFR-TKIs靶向治疗前的标本及基因检测结果。
1.2 方法
1.2.1实时荧光定量PCR 采用实时荧光定量PCR法检测EGFR基因(18~21号外显子)突变、ALK基因融合、ROS1基因融合、RET基因融合、K-RAS基因(2号外显子)突变、BRAF基因(15号外显子)突变、HER-2基因(20号外显子)突变、NRAS基因(3号外显子)突变、PIK3CA基因(20/9号外显子)突变、c-MET基因(14号外显子跳跃)突变。实时荧光定量PCR试剂盒购自厦门艾德生物公司,具体操作步骤严格按试剂盒说明书进行。
1.2.2免疫细胞化学染色 细胞块4 μm厚切片,60 ℃烤片1 h,二甲苯脱蜡、乙醇梯度(100%、95%、70%)至水化,3%过氧化氢浸泡15 min,蒸馏水冲洗。pH 6.0的枸橼酸盐修复液高压2 min,自然冷却;PBS冲洗5 min。每张切片滴加50 μL LAPTM4B多克隆抗体(bs-9562R,Bioss公司),4 ℃过夜。第2天,PBS冲洗3次,每次5 min;滴加二抗,室温孵育15 min;PBS冲洗3次,每次5 min。DAB显色,终止时间视显色强度决定。苏木精复染细胞核3 min,盐酸乙醇分化,氨水返蓝后,梯度乙醇(70%、95%、100%)脱水,吹干后中性树胶封固。
1.3 LAPTM4B染色结果判断LAPTM4B染色评估由两名经验丰富的病理诊断医师判读,以阳性癌细胞百分比和染色强度为评分依据。(1)根据阳性细胞百分比进行评分:阳性细胞数<10%为0分,10%~50%为1分,>50%为2分。(2)根据细胞染色强度进行评分:未着色为0分,黄色为1分,棕黄色为2分。将两项得分结果相加:0~2分为低表达组,3~4分为高表达组。
1.4 NSCLC细胞学标本分化程度判读由两名经验丰富的病理医师,综合考虑肿瘤细胞的异型性和细胞块的组织学形态进行判读[7-9]。高分化:肿瘤细胞常聚集成团或簇状,异型性小、形态相对较温和,细胞核圆形或卵圆形,染色质均匀细腻,可见核仁;细胞质内可见分泌空泡或角化现象。细胞块中肿瘤细胞可具有腺样或鳞样分化的特征,如肿瘤细胞呈腺腔样、乳头状等排列或可见细胞间桥等;低分化:肿瘤细胞单个散在分布,高度异型性,可见瘤巨细胞,细胞核多形性明显,染色质染成粗块状、核仁不明显;细胞质内分泌空泡少见。细胞块中肿瘤细胞呈实性团块状排列,细胞拥挤、重叠,细胞核明显异型,染色质粗糙,核仁不明显。中分化:介于高分化和低分化之间。
1.5 统计学分析采用SPSS 22.0软件进行统计学分析,χ2检验或Fisher检验、Spearman相关性分析LAPTM4B蛋白表达与NSCLC临床病理特征的关系。多因素Logistic回归分析LAPTM4B蛋白表达与多基因突变状态及EGFR-TKIs耐药间的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC细胞学标本多基因突变状态464例NSCLC细胞学标本进行多基因突变联合检测,结果示单基因突变365例(78.7%)、双基因伴随突变14例(3%)、野生型85例(18.3%),阳性率为81.7%。其中EGFR、ALK、ROS1、RET、KRAS、BRAF、HER-2、NRAS、c-MET基因突变率分别为59%、6%、3%、2%、4%、2%、2%、0.2%、1%。EGFR+PIK3CA、EGFR+BRAF、EGFR+HER-2、EGFR+RET、ALK+KRAS、EGFR+KRAS及RET+HER-2双基因伴随突变率分别为1%、0.4%、0.4%、0.4%、0.4%、0.2%、0.2%(图1)。

图1 464例非小细胞肺癌细胞学标本多基因突变状态
2.2 LAPTM4B蛋白表达与NSCLC临床病理特征的关系本组464例NSCLC中男性222例,女性242例;≤65岁者253例,>65岁者211例;高分化77例,中分化120例,低分化267例。依据LAPTM4B染色评估标准判读LAPTM4B蛋白表达强度由低到高如图2所示。LAPTM4B蛋白表达与患者性别、年龄无关,与肿瘤分化程度呈正相关,差异有统计学意义(P<0.001,表1)。
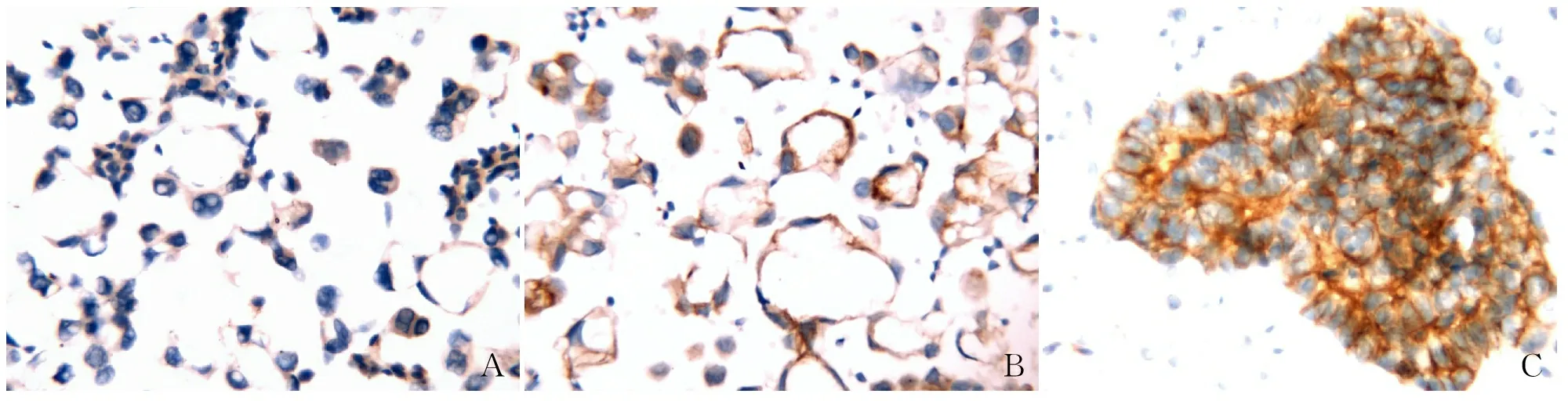
图2 免疫细胞化学法检测非小细胞肺癌中LAPTM4B蛋白表达:A.不表达;B.低表达;C.高表达

表1 LAPTM4B表达与非小细胞肺癌临床病理特征的关系
2.3 LAPTM4B蛋白表达与多基因突变状态的关系LAPTM4B蛋白表达与基因突变(P<0.001)及EGFR基因突变密切相关(P=0.001);与ALK、ROS1、RET、KRAS、BRAF、HER-2、NRAS、PIK3CA、c-MET基因突变均无关(表2)。基因突变型病例相对于基因野生型病例,LAPTM4B蛋白表达增高的风险增加(OR=2.94,95%CI:1.804~4.791)。
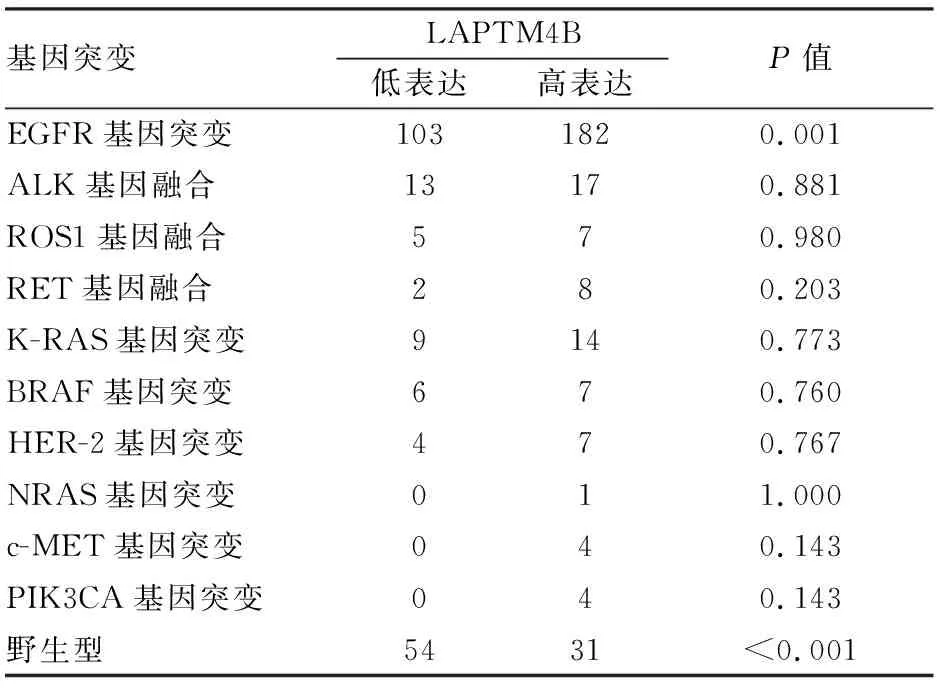
表2 LAPTM4B表达与非小细胞肺癌多基因突变状态的关系
2.4 LAPTM4B蛋白表达与EGFR-TKIs继发耐药的关系31例EGFR-TKIs继发耐药基因T790M突变的NSCLC细胞学标本,其LAPTM4B蛋白表达水平高于与其配对的EGFR-TKIs治疗前标本,差异有统计学意义(P<0.05,表3)。

表3 LAPTM4B表达与EGFR-TKIs继发耐药的关系
3 讨论
肺癌是全球癌症相关死亡的主要原因,其中NSCLC占首位,5年生存率低于15%[10]。EGFR-TKIs或阿法替尼等其他ERBB酪氨酸激酶受体家族抑制剂的药物是NSCLC患者EGFR敏感突变的标准化治疗方案,在晚期NSCLC患者中其有效缓解率为56%~74%,中位生存期为10~14个月[11-12]。然而,EGFR-TKIs治疗后继发的获得性耐药不可避免[13-14],50%的获得性耐药是由EGFR-TKIs继发EGFR基因20号外显子T790M突变所引起的[15]。尽管EGFR突变的患者对EGFR-TKIs高度敏感,但约10%EGFR突变的NSCLC患者表现为原发耐药[16]。研究发现,导致EGFR-TKIs产生耐药的机制包括T790M突变、c-Met扩增和PIK3CA突变[17-18]。由于获得性耐药的出现,大多数晚期NSCLC患者在开始EGFR-TKIs治疗1~2年内病情进展。因此,选择合适的治疗方案需要实时动态检测患者基因突变状态,但现有的基因突变检测方法成本高、耗时久,不利于EGFR-TKIs耐药的实时预测。LAPTM4B的出现可能成为监测EGFR-TKIs耐药的预测分子。
LAPTM4B首先在人肝细胞癌中被发现,是一种新型的致癌基因,定位于8q22.1染色体,其2个等位基因(AY219176和AY219177)分别编码3.5×104和4.0×104的蛋白质(LAPTM4B-35和LAPTM4B-40)。LAPTM4B-35在肝细胞癌、乳腺癌等多种肿瘤中过表达,其通过AKT信号通路促进肿瘤增殖和化疗耐药,并通过富脯氨酸的结构域与参与多种信号通路的含SH3结构域的信号分子相互作用,促进肿瘤迁移、侵袭和转移[19]。据文献报道LAPTM4B与EGFR关系密切:(1)LAPTM4B可以通过阻断活化的EGFR(active EGFR)腔内聚集并抑制其溶酶体降解来增强和延长EGFR信号传导;(2)非激酶依赖性的EGFR(inactive EGFR)与LAPTM4B共同定位于早期和晚期核内体,在无血清环境中相互作用并相互稳定[5]。虽然LAPTM4B可与EGFR相互作用,但其与NSCLC多基因突变状态及EGFR-TKIs耐药的关系尚不清楚。
本实验选用晚期NSCLC患者的细胞学标本为研究对象,避免疾病临床分期及放、化疗对实验结果的影响,发现LAPTM4B表达与NSCLC病理分化程度呈正相关,且与EGFR基因突变有关,但与KRAS、PI3CA、c-MET及NRAS等基因突变均无关。既往研究发现,KRAS、NRAS突变对EGFR-TKIs敏感性显著降低[20-21];PIK3CA与EGFR基因共突变可导致耐药,影响EGFR-TKIs的治疗疗效[18]。5%~20%的EGFR-TKIs耐药是由c-Met扩增引起的[18,22]。结果显示LAPTM4B表达与EGFR基因突变有关,为进一步证实LAPTM4B表达与EGFR-TKIs耐药的关系,本实验选取其中31例EGFR敏感突变患者接受EGFR-TKIs靶向治疗后,继发T790M突变产生继发耐药的标本,并收集比较其相应的EGFR-TKIs治疗前配对标本的LAPTM4B表达,结果显示EGFR-TKIs治疗后LAPTM4B表达显著高于EGFR-TKIs治疗前,差异有统计学意义。结果证实LAPTM4B表达与EGFR-TKIs继发耐药基因T790M突变有关。
既往研究发现,siRNAs降低LAPTM4B的表达可抑制自噬小体的成熟和自噬流的形成,而转染LAPTM4B质粒使其过表达可挽救并促进代谢应激中自噬流的形成,LAPTM4B过表达在自噬中发挥重要作用[23-24]。众所周知,自噬既是肿瘤抑制机制亦是肿瘤保护机制,此“双刃剑”的作用在肿瘤形成及治疗中存在较大争议。自噬可抵抗缺氧、营养缺乏和化疗药物暴露等恶劣环境,有助于肿瘤细胞适应压力应激并存活,因而自噬成为肿瘤的保护机制。研究发现自噬在骨肉瘤、卵巢癌和肺癌的化疗耐药中发挥重要作用[24-27]。Tan等[5]研究发现LAPTM4B与inactive EGFR核内体上的相互作用,并招募ATG5,从而促进EGFR与自噬抑制剂Rubicon的结合,进而使肿瘤促进因子Beclin 1从Rubicon-Beclin 1复合物中分离触发自噬。LAPTM4B还可通过直接激活自噬相关基因ATG3转录调控自噬[23]。Miao等[28]证实LAPTM4B的表达与EGFR的激活呈正相关;Beclin 1通过LAPTM4B的N末端和C末端的结构域与LAPTM4B相互作用,并与EGFR竞争与LAPTM4B的结合,进而介导胃癌细胞对EGFR-TKIs的耐药。这一系列机制均导致自噬增强,并发挥保护肿瘤的作用,导致EGFR-TKIs的耐药。在NSCLC中LAPTM4B表达显著增加时,可能与LAPTM4B触发自噬活性,自噬发挥肿瘤保护机制产生EGFR-TKIs的耐药,并引起EGFR-TKIs继发耐药基因T790M突变。
综上所述,LAPTM4B可能通过自噬途径参与EGFR-TKIs的耐药;还可通过增加药物外排、减少药物核定位和药物诱导的DNA损伤,参与EGFR-TKIs的耐药[24]。因此,作者认为靶向LAPTM4B可能有助于增强EGFR-TKIs的治疗效果。LAPTM4B可能是抑制肿瘤生长或使肿瘤对化疗敏感的新的重要治疗靶点。