乳酸菌细菌素plantaricin YKX 对大肠杆菌生物被膜的抑制作用
刘 哲,郝 倩,王金泽,任 婷,裴金金,郭耀东,金文刚
(陕西理工大学生物科学与工程学院 陕西汉中 723000)
生物被膜是细菌黏附在食品或接触物的表面,自身分泌多糖基质、纤维蛋白、脂质蛋白等物质,并且将自身包裹在内部,从而形成的大量细菌聚集的膜状物[1-2]。成熟的生物被膜是由高度致密的细菌群体构成,其结构及代谢非常复杂[3-4]。细菌形成生物被膜主要是为了适应复杂的环境,保护自身,更好地在不利于自身的环境中生存。生物被膜内的细菌不仅可以增强细菌对环境压力(紫外线、酸、碱等)[5]和各种各样的抑菌剂、杀菌剂的抵抗能力[6],而且有助于增强细菌对宿主免疫防御系统的抵御能力[7-9],使得细菌更易造成食品交叉污染并危害人体健康[10-11]。
大肠杆菌作为最主要的食源性致病菌之一,可形成生物被膜,增加环境抗性,造成食源性疾病[12],其广泛存在于一些生的或者未煮熟的食品中,尤其是生的或者未煮熟的肉制品和乳制品中[13]。解决大肠杆菌的污染问题成为当前我国食品工业快速、健康发展的重要科学技术问题之一[14-16]。大肠杆菌极易产生生物被膜[17],在动物体内各个管道(消化道、尿道、呼吸道)表面极易附着,形成对自身有利的生物被膜,导致动物被大肠杆菌感染,后续会出现反复感染、难以治愈现象。
乳酸菌细菌素(Bactoriocins)是乳酸菌分泌产生的具有抗菌活性的一类多肽或多肽复合物,大多数经核糖体加工合成,对与其近缘或生活环境类似的其它细菌具有抑制或杀灭效果[18-20]。一般分子质量都不大、天然无毒[21-22]。在消费者对化学防腐剂日益抵触的当今,乳酸菌细菌素被认为是用于食品防腐及人和动物医疗保健的好材料[23-25]。
目前,已有报道发现超过7 个不同属的乳酸菌能够产生细菌素[20]。基于化学结构、相对分子质量、热稳定性、作用方式和抗菌谱等特性,乳酸菌细菌素先后被分为4 大类[26]:第1 类是羊毛硫细菌素(Lantibiotics),其显著特征为分子内包含稀有的修饰氨基酸残基——羊毛硫氨基酸(Lanthionine,Lan)或β-甲基羊毛硫氨基酸(β-Methyllanthionine,Melan)。第2 类为不含羊毛硫氨基酸的细菌素,一般分子质量较小(通常小于10 ku),并且具有很强的热稳定,通常在N-末端有一段长度为18~21 个氨基酸的信号肽。第2 类细菌素又分为类片球菌素类(IIa)、二肽细菌素(IIb)和其它细菌素(IIc)3 类。IIa 具有抗李斯特氏菌特性,N 端一般包含Tyr-Gly-Asn-Gly-Val-Cys 的保守序列。乳酸菌葡萄球菌、明球菌、肠球菌、乳杆菌被报道产IIa 类细菌。IIb 由两条细菌素链组成寡聚体共同发挥抗菌作用。IIc 则为第2 类中不属于前两类细菌素的其它细菌素。第3 类是热敏感大分子蛋白(LHLP),分子质量通常大于30 ku,对热敏感,抑菌谱也较窄。第4 类是包含碳水化合物或类脂基团的蛋白复合物[18,20]。
关于乳酸菌细菌素抗菌活性机理研究,现有文献集中在乳酸菌细菌素对敏感菌自身的抑制/杀灭作用机理方面[23-26]。乳酸菌细菌素可在敏感菌细胞膜上形成疏水“孔洞”,导致细胞内容物流失,细胞死亡[18-20];也可与敏感菌胞内重要的蛋白(酶)和DNA 相结合,导致细胞死亡[24-25]。越来越多的研究发现一些乳酸菌细菌素同样可以影响敏感菌生物被膜的形成[26]。
研究团队前期筛选获得Class IIa 类乳酸菌细菌素plantaricin YKX(Lys-Tyr-Gly-Asn-Gly-Leu-Ser-Arg-Ile-Phe-Ser-Ala-Leu-Lys),对大肠感菌具有良好的杀灭效果,且能够影响其生物被膜的形成。本研究在此基础上,研究plantaricin YKX 对大肠杆菌(E.coil)ATCC25922 生物被膜的抑制及其作用机理,为大肠杆菌污染控制研究及乳酸菌细菌素抗菌机理研究提供新视角、新思路。
1 材料与方法
1.1 材料与菌株
大肠杆菌大肠杆菌ATCC25922 来自美国微生物菌种保藏中心。采用LB 培养基。培养基配方为:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,用5 mol/L NaOH 调pH 值至7.2,定容至1 L,121 ℃灭菌30 min,固体培养基加入15%琼脂粉。
细菌素产生菌为植物乳杆菌(Lactobacillus plantarum)YKX 分离自陕南秦巴富硒区富硒茶园中。采用MRS 培养基培养,配方为:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,葡萄糖20.0 g,吐温80 1.0 mL,乙酸钠5.0 g,磷酸二氢钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,琼脂18.0g,蒸馏水1 000 mL,pH 6.2~6.6。
菌株短期保藏在琼脂斜面中,存放在4 ℃冰箱中。长期保存则划线在用甘油密封的琼脂斜面中,放置在-80 ℃超低温冰箱。
1.2 细菌素plantaricin YKX 制备及纯化
将对数期中期植物乳杆菌YKX 的发酵液离心漂洗2 次(8 000×g、4 ℃、15 min),弃细胞收集上清液,经0.22 μm 滤膜过滤后,即为无细胞上清液(Cell-free supernatants,CFS)。
采用硫酸铵沉淀、SP-Sepharose 阳离子交换色谱(80 cm×2.0 cm,Sigma,USA)和反相高效液相色谱(RP-HPLC,Agilent Technologies,USA)纯化获得plantaricin YKX[11]。将植物乳杆菌YKX 菌株的CFS 采用冷冻干燥技术浓缩至初始体积的1/10。然后加入硫酸铵至体积分数80%饱和度,4 ℃下静置过夜沉淀。离心收集沉淀后复溶与20 mmol/L 磷酸缓冲液(pH 5.0)中,进一步采用SPSepharose 层析柱进行纯化。最后采用RP-HPLC制备液相进行纯化。纯化过程每一步均采用琼脂孔扩散法[9]以酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)DSMZ3922 为指示菌测定抑 菌效果。采用Bradford 法测定蛋白浓度[9]。
1.3 最小抑菌浓度(MIC)测定
将对数期中期的大肠杆菌大肠杆菌ATCC25922 发酵液100 μL 加入96 孔板中,再分别添加100 μL 的2 倍质量浓度梯度的plantaricin YKX 溶液使得样品终质量浓度分别为4,8,16,32,64,128,256,512 μg/mL。30 ℃下培养24 h 后采用平板涂布法检测存活大肠杆菌ATCC25922细胞数。大肠杆菌ATCC25922 细胞生长被抑制的第一个质量浓度为plantaricin YKX 的最小抑菌浓度(MIC)。对照组添加100 μL pH 7.0 的10 mol/L PBS 缓冲液。
1.4 结晶紫染色法检测
吸取对数期中期的大肠杆菌ATCC25922 发酵液100 μL 分别加入96 孔板中,再分别加入100 μL plantaricin YKX 溶液,使得细菌素终质量浓度为1/4MIC,1/2MIC 和3/4MIC(为避免因高质量浓度plantaricin YKX 对浮游大肠杆菌细胞的杀灭作用而造成其生物被膜的减少干扰,试验采用亚抑菌浓度的plantaricin YKX),37 ℃下培养3 d 至大肠杆菌生物被膜形成。对照组添加100 μL pH 7.0 的10 mol/L PBS 缓冲液。吸去孔内悬浮菌液,用无菌生理盐水轻轻冲洗生物被膜。用甲醇固定15 min,倒掉液体,风干。加入200 μL,2 mg/mL的结晶紫染色20 min,倒掉结晶紫,用蒸馏水清洗浮色后风干。再向各孔加入200 μL 95%乙醇摇床(100 r/min)脱色30 min 后,吸取100 μL 染液至另一洁净96 孔板中,酶标仪测定波长595 nm 下的OD 值。
1.5 大肠杆菌生物被膜菌落计数试验
参考1.4 节方法,制备大肠杆菌ATCC25922生物被膜。吸去孔内菌悬液,用蒸馏水清洗2 次去除浮游菌。用无菌枪头刮取各孔生物被膜,分别转移至另一洁净96 孔板中,加入200 μL 无菌生理盐水,超声波处理10 min 分散细胞后,涂布于LB固体培养基,37 ℃培养24 h,进行菌落计数。
1.6 扫描电镜观察
参考1.4 节方法,制备大肠杆菌ATCC25922生物被膜。使用无菌生理盐水轻轻洗掉浮游菌,加入2.5%的戊二醛溶液固定。PBS 缓冲液漂洗2 次之后分别用50%,70%,80%,90%的乙醇脱水15 min,最后用无水乙醇脱水2 次。用乙醇与醋酸异戊酯的混合液(体积比1∶1)处理样品30 min,再用纯醋酸异戊酯处理样品1 h。临界点干燥、镀膜后,使用SU-8010 型场发射扫描电镜观察样品。
1.7 激光共聚焦显微镜
参考1.4 节方法,制备大肠杆菌ATCC25922生物被膜。使用无菌生理盐水洗去浮游菌。采用LIVE/DEAD BacLight Bacterial Viability Kit(SYTO9/PI 染料)25 ℃下避光染色30 min,于激光共聚焦显微镜上(1 000 倍油镜)拍摄,SYTO 9 激发波长为480 nm,发射波长为500 nm:PI 激发波长为490 nm,发射波长为635 nm。
1.8 荧光显微镜观察
参考1.4 节方法,制备大肠杆菌ATCC25922生物被膜。使用无菌生理盐水洗去浮游菌后用10 μg/mL FITC-ConA 的染料37 ℃避光染色30 min。吸出多余染色液并用生理盐水洗去浮色后,于荧光显微镜(1 000 倍油镜)拍摄。
1.9 数据统计处理
2 结果与分析
2.1 细菌素plantaricin YKX 纯化制备
纯化所得乳酸菌细菌素plantaricin YKX 的RP-HPLC 图谱如图1 所示为,在20.8 min 时观察到一个明显的活性峰,此结构与实验室前期研究结果一致。说明本研究通过得到高纯度的plantaricin YKX,并用于后续试验。

图1 纯化所得乳酸菌细菌素plantaricin YKX 的RP-HPLC 图谱Fig.1 The RP-HPLC spectrum of purified bacteriocin plantaricin YKX
本文纯化plantaricin YKX 的三步法是乳酸菌细菌素纯化制备的经典方法,被广泛用于纯化制备其它已报道的乳酸菌细菌素,譬如plantaricin 163、plantaricin FT259、garvicin 以 及 enterocins 7A 和7B 等[14,18,21,25]。plantaricin YKX 标准化制备方法的建立为本文后续研究所需高纯度试验材料提供技术保障。
2.2 plantaricin YKX 的MIC 测定
随着plantricin YKX 质量浓度的增加,大肠杆菌ATCC25922 活细胞数下降。如图2 所示,当加入最低质量浓度细菌素时,观察不到任何抑菌效果。当细菌素质量浓度升至32 μg/mL 时,大肠杆菌ATCC25922 生长被抑制。因此,plantricin YKX 针对大肠杆菌ATCC25922 的最小抑菌浓度定义为32 μg/mL。
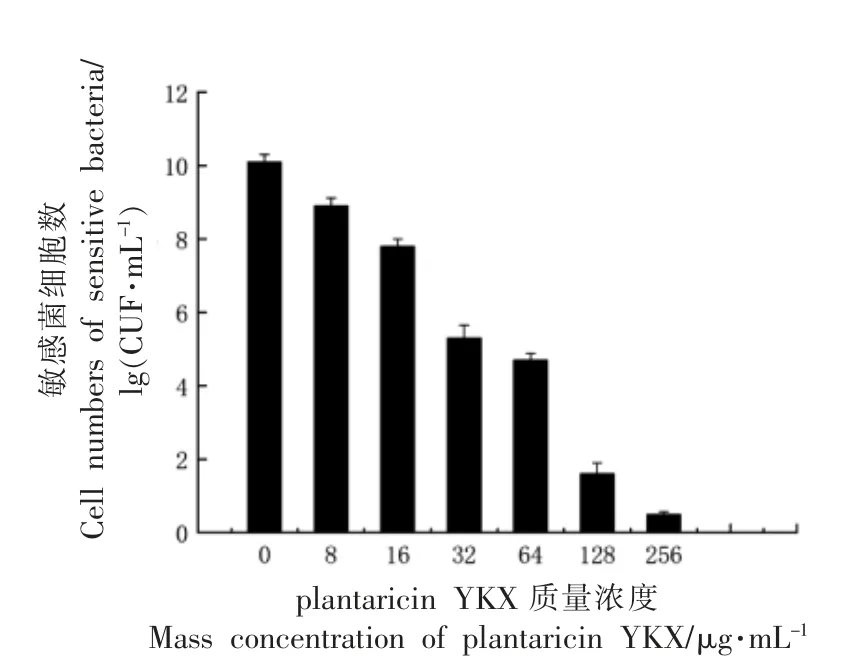
图2 plantricin YMX 对大肠杆菌大肠杆菌ATCC25922 的最小抑菌浓度Fig.2 The MIC of plantaricin YKX against E.coil ATCC25922
传统认为乳酸菌细菌素只对革兰氏阳性菌具有良好杀灭作用。抗菌谱窄成为限制乳酸菌细菌素产业化开发应用的瓶颈之一。随着乳酸菌细菌素研究的广泛深入,越来越多的学者报道筛选获得对革兰氏阳性菌和阴性菌都具有良好杀灭效果的广谱抗菌肽。不同细菌素针对大肠杆菌的MIC值有所不同,部分学者报道其所筛选纯化制备所得细菌素对大肠杆菌的MIC 范围为8~64 μg/mL,本文plantaricin YKX 针对大肠杆菌ATCC25922的MIC 为32 μg/mL。
2.3 结晶紫染色法对大肠杆菌生物被膜的形成抑制
采用结晶紫染色法定量分析plantaricin YKX对大肠杆菌ATCC25922 在微孔板内黏附并形成生物膜能力的影响。试验结果如表1 所示,亚抑菌浓度plantaricin YKX 对大肠杆菌ATCC25922 生物膜的形成均有一定的抑制作用。随着plantaricin YKX 质量浓度增大,样品OD595nm值不断减小。大肠杆菌ATCC25922 生物被膜形成量随着plantaricin YKX 质量浓度的增加呈现下降趋势,特别当plantaricin YKX 质量浓度增加到3/4MIC时,大肠杆菌ATCC25922 生物被膜形成抑制率可达到50%以上。

表1 不同质量浓度plantaricin YKX 对大肠杆菌ATCC25922 生物被膜形成抑制率的影响Table 1 The effect of different mass concentrations of plantaricin YKX on the formation of biofilm
2.4 大肠杆菌生物被膜菌落计数结果
对 以3/4MIC、1/2MIC、1/4MIC 质 量 浓 度 的plantaricin YKX 处理的和未处理过的大肠杆菌ATCC25922 生物被膜计数,结果显示,不同质量浓度plantaricin YKX 处理后的菌落总数与对照组相比,显著减少(P<0.05)。说明亚抑菌浓度的plantaricin YKX 能够减少生物被膜中的活菌数,且随着plantaricin YKX 质量浓度的增加,抑制效果相应增强。与结晶紫染色试验结果相一致,菌落计数结果也表明plantaricin YKX 能够抑制形成生物膜的大肠杆菌ATCC25922 生物量。综合生物膜结晶紫染色和菌落计数结果得出plantaricin YKX 对大肠杆菌ATCC25922 生物膜形成具有一定的抑制作用。

表2 不同质量浓度plantaricin YKX 对生物被膜菌落计数的影响Table 2 Effect of different mass concentrations of plantaricin YKX on the colony count of biofilm
2.5 细菌素plantaricin YKX 对大肠杆菌生物被膜的抑制作用
如图3 所示,未经plantaricin YKX 处理的大肠杆菌ATCC25922 形成了较为致密的生物被膜。而经1/2MIC plantaricin YKX 处理后的大肠杆菌ATCC25922 生物被膜结构遭到破坏,表面细菌附着数较少,分布较稀疏,细菌轮廓清晰。

图3 大肠杆菌ATCC25922 生物被膜扫描电镜微观形态图Fig.3 Scanning electron microscopic morphology of E.coli ATCC25922 biofilm
2.6 激光共聚焦显微镜观察生物被膜内活菌和死菌数量
进一步选用荧光探针染色进行黏附细菌观察。活菌会被SYTO-9 染为绿色,而死菌会被PI染为红色。结果如图4 所示,对照组生物膜细菌落十分密集,生物被膜内的活菌数量明显比经plantaricin YKX 处理的多。plantaricin YKX 存在时的生物膜黏附细菌较少,且死菌数量比未处理的对照组多很多。

图4 激光共聚焦观察plantaricin YKX 处理和未处理的大肠杆菌生物被膜中活菌和死菌(×1 000)Fig.4 Confocal laser observation of the live/dead cells in E.coli ATCC25922 biofilm with and without the treatment of plantaricin YKX(×1 000)
2.7 荧光显微镜观察生物被膜多糖的黏附作用
终质量浓度1/2MIC 的plantaricin YKX 与大肠杆菌大肠杆菌ATCC25922 生物被膜共培养3 d,待生物被膜形成后,在1 000 倍油镜荧光显微镜下观察大肠杆菌的胞外多糖的黏附作用,结果如图5 所示。对照组可以看出分泌了较为明显的胞外多糖,并形成团状,细菌的黏附性好,与此相比,1/2MIC plantaricin YKX 处理组荧胞外多糖分泌减少,分布较为稀疏,说明亚抑菌浓度plantaricin YKX 能够较好的抑制大肠杆菌的黏附。
生物膜形成需要经过细菌起始黏附、生物膜黏附、生长、成熟和散播等阶段,细菌黏附是生物膜形成过程中的重要步骤之一。细菌在载体表面的黏附是一个复杂的过程,黏附机制复杂,且受诸多因素影响。当细菌黏附于载体表面的数量达到一定程度后,聚集过程被启动,随后细菌之间相互黏附、分化、增殖,大量胞外基质被分泌,形成高度组织化的多细胞团块结构,最终形成生物膜结构。生物膜中的胞外聚合物由多糖、蛋白质及核酸等物质组成,在生物膜形成中,参与细菌黏附,聚集环境营养物质,够限制环境有害成分渗透、增强环境的耐受力,以及在生物膜立体结构形成中起到重要作用。胞外聚合物的瓦解不仅能够降低生物膜结构的复杂性,也会增加细菌生物膜对抗生素的敏感性。FITC-ConA 是能够与D2 甘露糖和D2葡萄糖胺结合而显色,从而可以通过荧光显微镜观察FITC-ConA 的荧光强度、分布等情况,进而直观的观察胞外多糖的变化。
3 结论
本论文探索了实验室前期分离所得plantaricin YKX 对大肠杆菌ATCC25922 生物被膜的抑制作用及其机理。plantaricin YKX 的MIC 为32 μg/mL;结晶紫染色结果显示在3/4MIC 的plantaricin YKX 作用下,大肠杆菌ATCC25922 生物被膜显著抑制,同时菌落总数减少3 个数量级。扫描电镜观察到plantaricin YKX 处理大肠杆菌ATCC25922 生物被膜可使结构遭到破坏;激光共聚焦结果显示,经plantaricin YKX 处理的大肠杆菌ATCC25922 生物被膜,死菌数量比未处理的对照组要增加很多;荧光染料结合荧光显微镜观察结果显示,1/2MIC plantaricin YKX 处理组荧胞外多糖分泌减少,分布较为稀疏。本研究所得乳酸菌细菌素plantacin YKX 能够有效抑制大肠杆菌ATCC25922 生物被膜的形成。

