食源性生物活性肽的胃肠道吸收障碍及跨膜转运研究进展
于志鹏,薛文君,武思佳,赵文竹,励建荣
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 海南大学食品科学与工程学院 海口570228 3 吉林大学食品科学与工程学院 长春 130062)
食源性生物活性肽指可食用动、植物蛋白中经酶解或发酵产生的蛋白质片段,除提供必需氨基酸外,还具有降血压[1]、降血糖[2]、抗氧化[3]、抗血栓[4]和免疫调节[5]等多种生物活性。食源性生物活性肽作为天然的功能因子,具有良好的健康促进效应,无毒副作用,低成本,高组织渗透性,容易合成及修饰等优点,具有开发为保健食品的优越潜力。
完整吸收是食源性生物活性肽在体内发挥功能作用的基础。与缓激肽、神经肽等内源性活性肽不同,大多数食源性活性肽经口摄入后需经胃肠道复杂酶解、极端pH 值变化梯度作用、小肠上皮吸收渗透等过程,以完整形式进入血液循环到达作用靶点,并需累积到一定量才能在体内发挥其生物活性[6]。这些过程影响了口服生物活性肽的生物利用度和完整吸收率,也是造成生物活性肽体外生物活性与体内生理作用不一致的主要原因,在很大程度上阻碍了它们在膳食与营养研究以及大健康产业中的应用。设计合理策略控制和延缓活性肽在胃肠道中的降解,增强肠道渗透性,才能最大程度保持肽的活性并靶向发挥功能作用,以提高其生物利用度。
生物活性肽在胃肠道中消化降解的低稳定性和在跨膜吸收过程中的低渗透性,已成为活性肽研究和产业发展亟需克服的瓶颈问题。目前,有关制约食源性活性肽生物利用度的潜在机制尚不明确,提高活性肽生物利用度的策略也较不完善。本文首先综述食源性生物活性肽的主要胃肠道吸收障碍,讨论不同理化性质和结构特点的生物活性肽的跨膜转运吸收方式和差别,并归纳提高活性肽生物利用度的最新策略,为解决当前活性肽生物利用度低的瓶颈问题提供思路,为生物活性肽在功能食品领域的广泛应用提供理论基础。
1 影响活性肽生物利用度的胃肠道障碍
口服生物活性肽在被机体吸收并进入血液循环之前会遇到各种障碍,其中活性肽在胃肠道生化屏障下的低稳定性和物理屏障下的低渗透性是制约其生物利用度的主要因素(图1)。
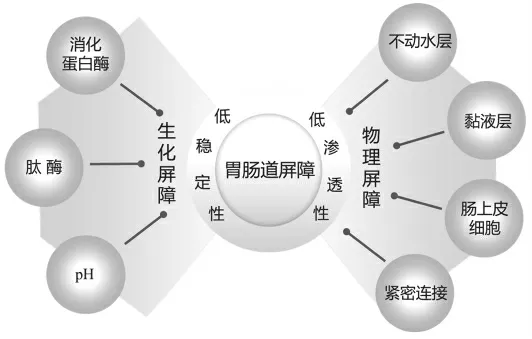
图1 影响活性肽生物利用度的胃肠道障碍Fig.1 The gastrointestinal barriers for affecting of bioactive peptides bioavailability
1.1 生化屏障
胃肠道中的各种消化蛋白酶及肽酶和pH 值是活性肽消化吸收过程中的主要生化屏障[7]。胃肠道中的高活性复杂酶系统和不同部位pH 值的变化,可能将完整的生物活性肽降解,使得有效作用于靶器官的活性肽含量极低,极大降低了生物活性肽的口服效果和生物利用度。
胃肠道中存在多种消化蛋白酶和肽酶,如胃中的胃蛋白酶,肠腔中的胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶、羧肽酶A 和羧肽酶B,以及肠刷状缘膜上的羧肽酶M、氨肽酶A、氨肽酶N、氨肽酶P、氨肽酶W 及二肽酶等,它们具有不同的裂解位点和水解机制,可将口服摄入的活性肽进一步分解成氨基酸或小肽,使其体内活性和生物利用度极大降低[8]。生物活性肽被酶解的程度主要取决于其对胃肠道消化酶的敏感程度,活性肽的氨基酸组成、肽链长度和理化性质不同对酶的敏感程度也不同,如含有脯氨酸和羟脯氨酸残基的活性肽通常能够抵抗消化酶的降解而保持结构完整[9]。值得注意的是,利用胃肠道消化蛋白酶酶解制备生物活性肽是一种提高活性肽口服生物利用度的良好策略。已有大量研究利用胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶等胃肠道消化蛋白酶酶解牛乳、鸡蛋、鱼类及植物蛋白来制备多种生物活性肽[10]。通过胃肠道消化蛋白酶酶解制备得到的活性肽经口摄入后对胃肠道消化酶具有较高稳定性,并具备刷状缘膜酶抑制活性,可以保持其完整结构,从而提高生物活性肽克服胃肠道复杂酶降解系统屏障的能力。
胃酸使胃成为体内酸性最强的环境,其pH为1~3,在这种强酸性条件下,生物活性肽的立体三维结构被破环,肽键暴露,最终导致活性肽裂解变性[11]。随后,活性肽被转移至小肠(由十二指肠、空肠和回肠组成),环境pH 值由1~3 逐渐增加至6~7 直至7.4[12]。胃肠道内不同区域的复杂pH 值变化,以及不同的胃排空率和胃肠动力,会显著改变活性肽的溶解性、二级结构、配体亲和力及其与食物基质和胃肠道环境的共价/非共价反应活性,最终使得活性肽极不稳定,易被分解,加剧了生物活性肽吸收的困难[7]。
1.2 物理屏障
小肠是体内吸收营养物质的主要场所,生物活性肽在小肠被完整吸收之前,需经历多重物理障碍,主要包括:不动水层、黏液层、肠上皮细胞和细胞间的紧密连接等[13]。
肠道屏障的组分决定了肠道的渗透性,其中,位于肠上皮细胞最表面的不动水层是活性肽完整穿过小肠的第一道物理屏障,其厚度为100~800 nm[14]。对于跨上皮细胞进行吸收的活性肽,首先需通过不动水层,才能进行跨膜吸收。Smithson 等[15]指出不动水层对活性肽组分的吸收速率起重要作用,尤其对于疏水性肽来说,需以胶束的形式才能通过。不动水层作为覆盖在肠道微绒毛上的一个细胞外屏障,随着肠道黏度的增加和食糜混合的减弱,不动水层的厚度呈比例增加,进而使肠道与吸收部位之间的转运速率减慢,严重影响机体对活性肽等营养成分的吸收[16]。活性肽是否能够突破不动水层是制约其生物利用度的关键科学问题,具有不同渗透特性的肠黏膜屏障中的不动水层对活性肽吸收的影响至关重要。然而,不动水层对活性肽吸收的限速作用往往被忽略或低估,研究进展较为缓慢,亟需进行深入系统研究。
肠道黏液层具有高度的黏弹性和黏附性,覆盖在小肠绒毛顶部和绒毛之间的肠道表面,其物理结构类似于水凝胶,含有高度分枝的多糖和带负电荷的黏蛋白[17]。人体肠道黏液层的平均孔径约为0.2 μm,它相当于一个分子过滤器,排阻分子质量为600~800 u,若肽的分子质量超过此范围则吸收相对较慢[18]。黏液层是一种智能半透膜,它允许多种营养物质通过,但同时也能阻止大多数细菌和病原体渗透到肠上皮细胞表面。然而,当生物活性肽通过黏液层时,由于氢键、静电、疏水相互作用等化学相互作用以及组分和黏液聚合物之间的缠结等的物理相互作用,生物活性肽的扩散会受到极大阻碍。生物活性肽通过黏液层的低扩散速度可能会阻碍它们进入肠上皮细胞进行进一步的吸收。此外,黏液层具有独特的流变特性和理化特性,其会显著影响疏水性生物活性肽的运输,从而改变它们在黏液层的停留时间和吸收率,而亲水性活性肽几乎不受到黏液层的影响[17]。
在体外具有某种生理活性的生物活性肽,通过肠道黏液层后还需穿过肠上皮细胞或细胞间紧密连接到达血液循环,才能与靶标结合发挥生理活性。肠上皮细胞是一层排列在肠上皮腔表面的细胞,调节物质从其顶端向基底层的运输和跨上皮流动,主要由促进营养物质吸收的肠细胞、分泌黏液的杯状细胞和参与免疫应答M 细胞构成[19]。在人体中,肠上皮覆盖了约400 m2的表面积,虽然只有一层细胞,但在肠道中起着重要的物理屏障作用。由于肠上皮细胞的亲脂性,亲水性的生物活性肽在跨膜吸收转运过程中会受到限制[20]。生物活性肽在通过相邻肠上皮细胞之间时,又会受到紧密连接等的物理限制。紧密连接是细胞间的重要渗透屏障,主要功能是限制细胞旁的水、离子和溶质的流动,使得大分子活性肽穿过肠上皮细胞时受到限制,透过率大大降低[6]。紧密连接的渗透性在不同的上皮细胞中有很大不同,上皮细胞可以瞬间改变它们的紧密连接,以允许更多的溶质通过。此外,紧密连接与支撑上皮细胞的细胞骨架相连,共同构成一个动态屏障系统,其通透性决定了整个肠上皮细胞的屏障功能[21]。
2 生物活性肽的跨膜吸收机制
当生物活性肽能抵抗酶解及低pH 值环境,且完整穿过不动水层和黏液层到达肠上皮细胞表面时,主要可通过载体转运、细胞旁路转运和胞吞转运中的一种或几种联合吸收机制被转运至血液循环(图2)。一种活性肽其具体吸收机制和转运速率主要受肽的氨基酸组成及序列、疏水性、净电荷、大小、分子质量和空间构象等多种性质的影响。为得到具有高转运效率的活性肽的特点,有必要对不同理化性质和结构特点的活性肽跨膜转运吸收方式进行深入研究。

图2 活性肽的跨膜吸收机制Fig.2 Mechanisms of transmembrane absorption of bioactive peptides
2.1 载体转运
目前已证实大约有400 种二肽和8 000 种三肽可以通过载体转运机制被吸收,该途径主要依靠寡肽转运蛋白1(PepT1)来实现[22]。PepT1 是一种存在小肠上皮刷状缘膜上的质子依赖型转运蛋白质,具有高容量/低亲和力的选择性,可优先识别短链、具有中性电荷和高疏水性的肽,并优先结合富含非极性氨基酸的残基[23]。PepT1 转运多肽的过程和速度取决于H+/Na+交换器维持的质子梯度和膜电位。PepT1 介导的吸收转运避免了氨基酸在吸收过程中相互之间的竞争性抑制作用,具有吸收效率高、消耗能量少等优点[24]。然而,尽管一些二肽、三肽能够被肠上皮细胞转运,但其完整吸收效率却普遍较低。如ACE 抑制三肽VPP 在Caco-2 单层细胞膜上的吸收率为2%[25],ACE 抑制三肽IQW 和LKP 的完整吸收率均小于1%[26]。
2.2 细胞旁路转运
细胞旁路转运途径是目前报道最多的三肽以上的活性肽被动吸收途径,其易于转运中性、带负电荷和亲水性的多肽[27]。细胞旁路途径由紧密连接介导,该途径不消耗能量,且转运的多肽可避免细胞内肽酶的降解而被完整吸收,然而,其转运速率显著低于活性肽的载体转运途径。影响活性肽细胞旁路转运的结构特征主要是分子大小、净电荷、疏水性和空间构象等。其中,活性肽的分子大小是影响该转运途径最为主要的因素,通常情况下,当活性肽的分子直径超过15 Å 时,该肽就不能利用紧密连接进行细胞旁路转运[28]。然而,对于分子尺寸较大的活性肽,若其结构具有较高的构象柔性,则仍有可能通过紧密连接进行扩散[22]。此外,由于该转运途径通常转运水溶性物质,因此具有较高水溶性的活性肽更易透过紧密连接,如玉米谷蛋白活性肽YFCLT 和GLLLPH[29]、蛋清源活性肽RVPSL[30]、QIGLF[31]均可以细胞旁转运机制进行吸收,然而,它们在Caco-2 单层细胞膜的吸收率较低,这可能是因为Caco-2 细胞膜中的肽酶将其部分水解,导致整体转运效果不佳。
2.3 胞吞转运
分子质量较小的物质可通过PepT1 载体或细胞旁路转运进入血液循环,而大部分的大分子肽段则需要通过胞吞作用被吸收,如菜籽源十肽YWDHNNPQIR[32]、乳源九肽RPPGFSPFR[33]均通过胞吞转运在Caco-2 细胞单层膜被完整吸收。胞吞转运是能量依赖性的跨细胞转运途径,活性肽通过与细胞表面受体发生作用,引发顶端细胞膜内陷,进而形成囊泡而转运进入细胞[34]。根据物质在细胞膜表面内吞作用方式的不同,胞吞作用又可分为3 大类:网格蛋白介导的转胞吞、小窝介导的转胞吞、非网格蛋白和小窝蛋白介导的转胞吞[35]。胞吞途径更倾向于转运疏水性肽,因为它们在被细胞内化之前需要通过疏水性相互作用与上皮细胞的顶端脂质膜表面相互作用[36]。然而,由于大分子肽段的生物活性肽更易被消化蛋白酶和肽酶酶解,使得完整转运率普遍较低。
3 提高生物活性肽口服生物利用度的策略
生物活性肽在被人体吸收进入血液到达靶器官之前,会遇到生化屏障、物理屏障等多种障碍,导致极低的胃肠稳定性和肠道渗透性。设计有效的策略来提高生物活性肽在体内的生物利用度并保持有效的生物活性至关重要。目前,多种策略应用于保护活性肽免受胃肠道的降解以及改善其通过肠道黏液和上皮细胞的通透性,主要包括活性肽的化学结构修饰、酶抑制剂、渗透促进剂、细胞穿透肽的使用以及各种生物活性肽胶体递送体系的使用(图3)。

图3 提高生物活性肽利用度的策略Fig.3 Strategies for enhancing of bioactive peptides bioavailability
3.1 活性肽的化学结构修饰
生物活性肽与受体的亲和力强,选择性好,是一类比较容易进行化学结构修饰的分子。修饰活性肽的结构,创造更稳定的类似物,使蛋白酶和肽酶无法识别它们的裂解位点,是提高活性肽生物利用度的一种有效策略。根据是否对活性肽肽链骨架进行修饰,可将修饰策略分为2 种:一种是针对肽链骨架的修饰,如末端结构修饰、环化修饰等;另一种是在保持肽链结构不变的基础上,引入其它基团进行修饰,如聚乙二醇修饰、N-甲基化修饰、磷酸化修饰等[37]。生物活性肽的N 端或C 端暴露时,极易受到氨基肽酶和羧肽酶的切割降解从而失去活性。然而,将N 末端和C 末端进行氨酰化和乙酰化,不仅可以提高活性肽的酶解稳定性,还可以保持甚至增强此肽的活性[38]。将活性肽进行环化修饰,特别是头尾环化,可以显著增加它们对蛋白酶酶解的抗性和分子稳定性并延长在血液中的半衰期。此外,聚乙二醇因其具有低毒性、易降解、无抗原性等的优点,被常用于对活性肽进行修饰,以减少酶的降解程度,改善活性肽在胃肠道中的生物利用度。N-甲基化、磷酸化也已被成功应用于活性肽的修饰,来提高肽分子的代谢稳定性[9]。然而,在活性肽进行化学结构修饰以提高其生物利用度时,要注意修饰过程不能影响活性肽的原有功能也不能产生有害物质。
3.2 酶抑制剂
酶抑制剂如胰蛋白酶抑制剂、糜蛋白酶抑制剂,可逆或不可逆地与目标酶结合,使酶失活从而促进活性肽的完整运输[7]。如Bowman-Birk 蛋白酶抑制剂已被证明可以保护大豆肽lunasin 免受体外胃肠道的酶解消化,提高其消化能力和生物利用度[39]。然而,由于酶抑制剂对胃肠道消化酶降解的敏感性,抑制剂必须与活性肽联合使用,且抑制剂的选择主要取决于被输送的活性肽的氨基酸序列[40]。此外,长期大量使用酶抑制剂可能会改变胃肠道的代谢模式,导致营养蛋白的不适当消化,还可能引发一系列内源性调节机制,刺激消化蛋白酶及肽酶的产生[41]。因此,将酶抑制剂与活性肽联合使用时,应尤其注意可能引发的安全问题。
3.3 渗透促进剂、细胞穿透肽
渗透促进剂和细胞穿透肽均是促进生物活性肽透过肠上皮,提高肠道通透性的两类物质。食品级渗透促进剂如柠檬酸、脂肪酸、乙二胺四乙酸可被用于改善活性肽在肠道中的传递,以克服由胃肠道屏障引起的渗透不良,是公认的在生物活性肽类功能食品和保健食品开发中有应用前景的候选物质。渗透促进剂提高肠道渗透性的机制主要包括:肠屏障结构完整性的暂时破坏、紧密连接的打开、黏液黏度的下降和膜流动性的增加[41]。Gleeson 等[42]研究发现渗透促进剂癸酸钠可使ACE 抑制肽IPP 和LKP 在离体大鼠肠上皮的体外渗透性分别增加1.4 倍和3.6 倍。渗透促进剂甘胆酸钠水合物、脱氧胆酸钠和乙二胺四乙酸二钠均可明显改善乳源性ACE 抑制肽RLSFNP 的转运[43]。
近年来,利用细胞穿透肽(Cell penetrating peptides,CPPs)直接穿透或以内吞的方式跨膜运送各种生物活性肽,引起越来越多研究者的兴趣。CCPs 是一系列能有效内化到细胞内的短肽,可与各种活性肽共价偶联以实现更高效的运输[38]。CCPs 的主要特征是没有带负电荷的残基或富含疏水氨基酸,这些疏水氨基酸及其对细胞膜疏水结构域的高度亲和力,对细胞内化过程至关重要。一些CCPs 如CNGRC、PMLKE 和VPALR,已被证明能够将生物活性肽运输到靶器官以提升其生物利用度[44]。
在选择渗透促进剂或CCPs 来提升活性肽的肠渗透性时,要确保它们对人体是安全无毒、无过敏性的,同时,要严格控制渗透促进剂或CCPs 剂量的添加。若不加控制的通透性的改变,可能会导致局部炎症和肠上皮的长期损害,造成“肠漏”将有害物质也引入血液循环中,最终引起或加重多种疾病的发生。
3.4 胶体递送体系
食源性生物活性肽对氧、温度极为敏感,当它们分散在食物基质中时可通过氢键、二硫键、疏水结合和范德华力等相互作用与还原糖或脂类、酚类化合物发生缩合和交联反应,且经上述的各种生化屏障、物理屏障后,仅有纳物质的量浓度甚至皮纳物质的量浓度的肽到达靶器官[40]。因此,许多胶体递送系统如脂质体型、固体脂质纳米颗粒型、生物聚合物微凝胶型等,被研究用于保持活性肽的活性和稳定性以提升其生物利用度[45]。
脂质体是由首尾相连的同心磷脂分子通过疏水相互作用结合在一起的类球状封闭囊泡,可保护装载的物质不被酶解,并具有低毒性、良好生物相容性、易扩展性、可降解性和非免疫原性等优点[45]。囊泡尺寸大小范围约为25 nm~2.5 μm,其决定了脂质体在体内循环的半衰期。脂质体既可将亲水性活性肽封装在其亲水性水核心内,也可将两亲性或亲脂性活性肽封装在其疏水性脂质双层内[46]。例如,利用脂质体包封乳蛋白衍生的抗高血压肽YGLF,脂质体在体外显示出肽的可持续释放性,并在原发性高血压大鼠中引起了长达5 d 的降血压作用[47]。石鱼源性活性肽[48]、花生肽[49]包封在纳米脂质体后,显著提高了肽对体外胃肠消化的稳定性。然而,脂质体递送体系易受到包封率低、稳定性差、网状内皮系统清除快及在食品的生产、加工和储存过程中存在脂质氧化的风险等的限制。虽然有较多研究已证明利用脂质体提高某些活性肽的生物利用度是可行的,但还需深入研究以确定它们是否可经济生产以及同时考虑并克服在人体健康和产品质量等方面的挑战。
固体脂质纳米粒(Solid lipid nanoparticle,SLN)是以室温下为固态的天然或合成的脂质或类脂为载体,将活性分子包封于类脂核中制成的粒径为10~1 000 nm 的胶体递送体系[50]。固体脂质主要包括固体基质(脂肪酸类、蜡质类、甘油脂类和类固醇类等)和表面活性剂(磷脂类、短链醇、胆酸盐类和非离子表面活性剂)[51]。SLN 作为一种新型的纳米递送体系,其载体材料易降解、毒性小、生物相容性高,具有生物分子的缓释和控释效果并可实现靶向给药,且其载药量与包封率都较好,能显著提高活性分子的体内生物利用度。SLN的结构和理化性质与脂肪粒相似,可借助“木马效应” 经脂肪吸收途径跨过肠道黏液层和肠上皮细胞来实现高效递送,这一特性是其它纳米载体所不具备的[52]。因此,SLN 也被认为是可应用于口服递送活性分子的理想载体。研究证实利用SLN 包埋燕麦多肽可增强其在胃肠道中对DPP-IV 的抑制作用,并可用来包埋乳清源衍生肽、鱼蛋白衍生肽等以提高其生物利用度[53]。总体而言,目前有关SLN 包埋生物活性肽的胃肠道稳定性研究相对较少。
生物聚合物微凝胶,也常被称为纳米凝胶、水凝胶珠、生物聚合物颗粒或微球等,是由一种或多种生物聚合物通过物理和/或化学键结合在一起形成的三维网络胶体颗粒,其尺寸范围通常为100 nm~1 000 μm[54]。生物活性肽可通过在微凝胶形成之前将它们与含有生物聚合物分子的溶液混合,也可以在微凝胶形成之后将它们包埋在微凝胶中[45]。选择合适的生物聚合物在很大程度上决定了封装系统是否成功,在选择时需仔细考虑聚合物的溶解性特征、凝胶机理、电学性质、降解性和与其它成分相互作用的特点等[54]。多糖、蛋白质由于其在制备微凝胶时具有低毒性、高生物相容性、可降解性等优势成为天然的生物聚合物来源。生物聚合物微凝胶体系大致可分为3 类:多糖微凝胶递送体系、蛋白质微凝胶递送体系和多糖-蛋白质微凝胶递送体系[12]。多糖微凝胶递送体系在胃部可抵抗溶胀效应,在肠部将封装的活性分子缓慢释放,最大程度提高肽的生物利用度。多糖如壳聚糖、琼脂、卡拉胶、阿拉伯树胶、菊粉和甲基纤维素等被广泛研究和用于制备多糖递送体系,其中壳聚糖是研究者最为关注的多糖之一[54]。例如,利用壳聚糖和海藻酸钠形成的微凝胶封装ACE抑制肽VLPVP 后发现,肽可以捕获在微凝胶中,且该微凝胶递送体系在模拟胃条件下可保护肽不被释放和降解[55]。蛋白质独特的优越性能也为制备不同特性的微凝胶递送体系提供了可能,如乳清蛋白、牛血清白蛋白、卵清蛋白、明胶和大豆甘氨酸等[54]。然而,蛋白质微凝胶递送体系无法抵抗在接近蛋白质等电点时存在的不可逆的沉淀问题以及克服蛋白被胃肠环境中的极酸性和各种酶降解等问题。因此,目前有较少研究利用蛋白质微凝胶递送体系来包封生物活性肽。多糖-蛋白质微凝胶递送体系相比单独的多糖或蛋白递送体系来说有更好的抑制突释、缓释和持续释放等特性[56],然而,将其用于包埋活性肽的研究并不广泛。
选择用于生物活性肽运输的载体必须较为稳定、安全无毒性,易通过肠上皮细胞进行扩散。同时,在选择胶体递送系统时需深入了解生物活性肽的化学性质、分子属性(分子尺寸、静电荷量、极性、溶解度和表面活性、成分相互作用及消化条件等,还应考虑成本、制造简易性、感官特性及这些递送系统在体内的生理行为,以设计最合适、高效的胶体递送系统提高活性肽的稳定性和生物利用度。
4 结论及展望
食源性生物活性肽在胃肠道生化屏障(酶、pH 值)和物理屏障(不动水层、黏液层、肠上皮细胞和紧密连接)的作用下往往导致极低的生物利用度。活性肽如何能完整且高效地被吸收进入血液循环成为活性肽科学界关注的重点。尽管有关生物活性肽在肠上皮细胞的完整转运机制研究已取得一定进展,但已鉴定出被完整吸收的生物活性肽的转运效率较低,且活性肽穿过不动水层到达肠上皮细胞的跨膜机制还尚未清楚,亟需进行深入研究。目前,已设计出多种提升活性肽生物利用度的策略,如化学结构修饰、酶抑制剂、渗透促进剂和细胞穿透肽的使用以及胶体递送系统(脂质体、固体脂质纳米颗粒和生物聚合物微凝胶)的使用。然而,这些策略在制备的容易程度、对产品质量和感官属性的影响、产品的稳定性及对活性肽体内活性影响等方面存在较大不同,且若使用不当可能会将有害物质也引入血液循环中,最终引起或加重多种疾病的发生(如局部炎症和系统免疫反应等)。因此,迫切需要根据不同活性肽的理化性质和结构特点及在体内的生理行为来确定最合适有效的递送策略以提高活性肽的体内生物利用度。

