一株猪源多杀性巴氏杆菌的分离及耐药性分析
徐志媛,李杰峰,孙艳玲,3,赵泽广,杨威,徐丽娜,张宁★
(1.河北省畜牧兽医研究所,河北 保定 071001;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056038;3.河北农业大学,河北 保定 071001)
多杀性巴氏杆菌(Pasteurella multocida,Pm)是一种革兰氏阴性杆菌,对多种动物和人都具有致病性错误,根据荚膜抗原的差别可分为A、B、D、E和F,5个血清型。巴氏杆菌病的发病率在30%~70%之间错误!未找到引用源。,可感染猪、牛、鸡、鸭,兔等家畜的上呼吸道错误,可引起猪肺疫、猪萎缩性鼻炎、牛出血性败血症,禽霍乱等错误。近年来,巴氏杆菌病在国内外广泛流行,危害养殖业的健康发展错误。2021年8月,河北保定某猪场的育肥猪发生一种以呼吸困难及后肢站立困难为主要症状的疫病。对分离菌株进行药敏试验和耐药基因检测,以期为该场对多杀性巴氏杆菌病的防治、临床用药、降低细菌耐药性等提供依据。
1 材料
1.1 病料病料来源于河北省保定市某养猪场发病猪肺脏样本。
1.2 试验试剂与培养基胰蛋白胨大豆肉汤(TSB)、哥伦比亚血板、生化反应管购自青岛海博生物科技有限公司。浊度管购自比克曼生物科技有限公司。药敏纸购自杭州微生物试剂有限公司。基因组DNA快速提取试剂盒购自Tiagen生化科技有限公司。M5 DL2000 DNA Maker、M5 DNA电泳琼脂糖、2×M5 HiPer HiFi PCR Mix购自北京保利美生物科技有限公司。
2 方法
2.1 细菌的分离培养无菌剪取肺脏组织放入装有500μL生理盐水的离心管中,研磨后短暂离心,取上清液,加入TSB培养基中,37℃培养24h。将TSB细菌培养液接种于血平板后于37℃培养箱中培养24h,挑取单个菌落接种于哥伦比亚血平板、麦康凯培养基、血平板上,观察菌落形态、大小、溶血情况等,挑取单菌落进行瑞氏-姬姆萨染色、革兰氏染色、荚膜染色。
2.2 PCR鉴定与分型
2.2.1 引物设计参照文献设计巴氏杆菌PCR鉴定、分型引物,引物由通用生物系统(安徽)有限公司合成,引物信息(见表1)。

表1 巴氏杆菌鉴定与分型引物信息
2.2.2 反应体系及反应条件提取细菌基因组作DNA模板,进行PCR反应。巴氏杆菌鉴定及分型反应体系均为20μL:2×EsTaq Master Mix 10μL,ddH2O 8μL,DNA模板2μL。巴氏杆菌鉴定反应条件为:95℃预变性5min;95℃变性30s,55℃退火30s,72℃延伸1min,共30个循环;72℃延伸10min。分型鉴定反应条件:95℃预变性10min;95℃变性30s,55℃退火30s,72℃延伸1min,共30个循环;72℃延伸10min。
2.3 生化试验将纯培养的菌液接种于微量生化反应管后,37℃培养24~48h,观察并记录结果。
2.4 动力实验用接种针挑取纯化培养后的单菌落,垂直从半固体培养基表面插入,于37℃培养24h,观察穿刺线上细菌生长的变化。
2.5 药敏试验将菌液浓度调整至1.5×108CFU/mL,参考美国临床和实验室标准化协会抗微生物药物敏感试验标准M100S26th,进行药敏试验、判定结果。
2.6 耐药基因检测根据文献选取β-内酰胺类、氨基糖苷类、四环素类、喹诺酮类等4类耐药基因进行检测,引物信息(见表2)。PCR反应体系同“2.2.2”,退火温度如表2所示,将PCR产物于1%琼脂糖凝胶中进行电泳检测。

表2 耐药基因引物信息
3 结果
3.1 细菌的分离分离菌于麦康凯培养基及哥伦比亚血平板上未生长,在血平板上,形成圆形微突起、灰白色、表面光滑、半透明、湿润、不溶血的露珠样菌落(图1A);瑞氏-姬姆萨染色可见两极浓染的小杆菌(图1B);革兰氏染色镜检可见革兰氏阴性、单个或成对存在、两端钝圆的短杆菌(图1C);荚膜染色可见紫色菌体周围有明亮的透明圈(图1D)。

图1 细菌形态
3.2 PCR鉴定与分型分离菌种属特异性鉴定,PCR扩增出现约460bp的特异性条带(图2),与目的条带一致,证实分离到的菌株为多杀性巴氏杆菌。分离出的多杀性巴氏杆菌荚膜分型鉴定结果(图3)显示,仅荚膜A型出现与目的条带相符的条带,证明分离的多杀性巴氏杆菌为荚膜A型多杀性巴氏杆菌。

图2 KMT1 PCR产物的凝胶电泳图M:DNA分子质量标准;1:样品。

图3 荚膜分型凝胶电泳结果M:DNA分子质量标准;A、B、D、E、F:样本。
3.3 生化试验生化鉴定结果(见表3),该菌株能够发酵葡萄糖、半乳糖、木糖、山梨醇、甘露醇,不能够分解海藻糖、阿拉伯糖、棉子糖、鼠李糖。氧化酶,靛基试验为阳性,VP-MR试验为阴性,符合多杀性巴氏杆菌的生化特性。

表3 分离菌株生化鉴定结果
3.4 动力试验动力试验为阴性,穿刺线上没有明显的细菌扩散生长痕迹。
3.5 药敏试验药敏试验结果(见表4),该菌株对氨苄西林、头孢克洛、头孢克肟、环丙沙星、左氧氟沙星、诺氟沙星、四环素、头孢曲松、头孢噻肟、丁胺卡那、阿奇霉素敏感,对链霉素耐药。
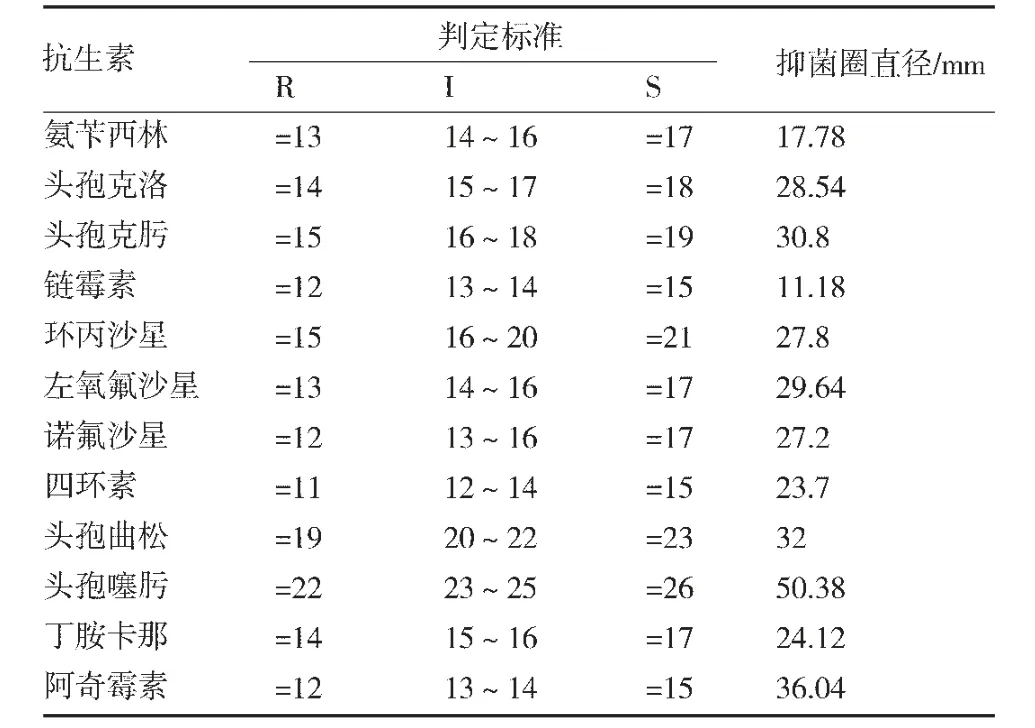
表4 分离菌的药敏试验结果
3.6 耐药基因检测结果(见图4),氨基糖苷类耐药基因aadA1检测为阳性,该分离株携带aadA1耐药基因,其他耐药基因未检出。

图4 耐药基因的鉴定M:DNA分子质量标准;1:aadA1耐药基因;2:阴性。
4 讨论
多杀性巴氏杆菌在猪群中属于条件性致病菌,常与多种病原发生混合感染,从而增加猪群呼吸道疾病的发病率,造成极大的经济损失。多杀性巴氏杆菌宿主特异性低,可以在猪、鸡等多种动物之间传播,因此,研究不同宿主源多杀性巴氏杆菌的病原及其耐药性,有助于对多杀性巴氏杆菌病的防治。
荚膜是位于细胞壁表面的一层松散的黏液物质,在多杀性巴氏杆菌逃避宿主先天免疫的过程中发挥着重要作用,根据荚膜抗原的差别可将多杀性巴氏杆菌分为A、B、D、E和F等5个血清型。荚膜A型多杀性巴氏杆菌常引起猪的肺部感染导致肺炎,B型菌株能引起猪的出血性败血症,D型菌株导致猪萎缩性鼻炎,在猪群中未见E型分离的报道,F型巴氏杆菌报道非常少见,方超等从猪中分离出了F型巴氏杆菌,但其对猪群的致病机制目前还不清楚。Emily Smith等人研究发现,猪源分离株中,荚膜血清型A(66.7%)最常见,其次是荚膜血清型D(19.0%)、F(9.5%)和B(4.8%)。多杀性巴氏杆菌的流行表现出一定的“宿主偏好性”。荚膜A型和D型多杀性巴氏杆菌主要在猪中流行,B型和E型主要在牛中流行,F型多杀性巴氏杆菌主要在家禽和野鸟中流行。分离株被鉴定为荚膜A型,与我国猪多杀性巴氏杆菌荚膜A型和D型为优势基因型的结果一致。
细菌耐药性的产生是一个复杂的过程,耐药机制大体可分为固有性耐药和获得性耐药两种,多杀性巴氏杆菌的耐药与靶基因突变、质粒介导、细胞膜通透性改变、外排泵的过量表达等因素有关。本试验选用12种临床常用抗生素对分离菌株进行药敏试验。结果表明,分离菌对链霉素表现耐药,与胡璇等报道的猪源荚膜A型多杀性巴氏杆菌对青霉素及头孢曲松等5种药物耐药的结果不同。胡星星等研究发现2017年我国猪源多杀性巴氏杆菌对链霉素的耐药率达到43.64%,对卡那霉素的耐药率达到52.73%,这表明其对氨基糖苷类药物的耐药率相对较高。因为多杀性巴氏杆菌质粒或染色体上携带多种氨基糖苷类钝化酶基因,所以巴氏杆菌对氨基糖苷类药物产生耐药。Corinna Keherenberg等对德国分离的3株多杀性巴氏杆菌进行耐药基因检测,检出编码修饰链霉素钝化基因strA和strB。本次试验检测出分离菌携带氨基糖苷类耐药基因aadA1。与王喜等人报道的分离菌株含有sul2和tetB两种耐药基因,及胡璇等报道的分离菌携带cml、tem,gyrB三种耐药基因不同,因宿主源、地区的不同多杀性巴氏杆菌之间的耐药性会存在较大差异。
由于药物的不合理使用,多杀性巴氏杆菌对多种抗生素产生耐药性,使养殖场对该种病原的防控工作越来越困难。抗生素耐药最根本的解决办法是减少抗生素的使用,从而建立快速检测MIC和耐药基因的方法,建立耐药细菌数据库,根据选择抗生素耐药基因、耐药机制,从而减少药物滥用,建立合理的给药方案,能在保证安全性的同时提高药物的有效性。
5 结论
本试验从保定某猪场病死猪肺脏中分离到1株A型多杀性巴氏杆菌,该菌株对链霉素耐药,携带氨基糖苷类耐药基因aadA1。不同地区的多杀性巴氏杆菌耐药性差异比较明显,在用药前进行耐药性分析,有助于提高多杀性巴氏杆菌病的治疗效率。

