黑色素瘤细胞PRDM1对增殖、凋亡和迁移的影响
陈 婷 苏文杨 朱希聪
·论 著·
黑色素瘤细胞PRDM1对增殖、凋亡和迁移的影响
陈 婷1苏文杨2朱希聪1
1.浙江省台州医院皮肤科,浙江台州 317000;2.浙江省台州医院神经内科,浙江台州 317000
探讨含PR/SET域蛋白1(PR/SET domain 1,PRDM1)表达水平与黑色素瘤患者预后的关系,及对黑色素瘤细胞增殖、凋亡、迁移的影响。分别通过基因表达谱数据动态分析(gene expression profiling interactive analysis,GEPIA)数据库和基因集变异分析(gene seb camcer analysis,GSCA)数据库分析PRDM1在皮肤黑色素瘤和正常组织中的表达差异及其与预后的关系。在细胞水平上将黑色素瘤A375分为两组,分别为转染siRNA-PRDM1和空载对照siRNA-NC,流式细胞仪检测各组黑色素瘤A375细胞的增殖能力、抗凋亡能力,Transwell小室检测各组黑色素瘤A375细胞的迁移能力,Western blot法检测各组黑色素瘤A375细胞中MYC的表达水平。与正常组织比较,PRDM1在黑色素瘤中低表达,且黑色素瘤患者中PRDM1高表达者预后较低表达者好。在黑色素瘤A375细胞中PRDM1低表达后细胞的增殖、迁移能力增强,而抗凋亡能力下降,且细胞中MYC蛋白表达水平上调(<0.05)。PRDM1在黑色素瘤组织中低表达,且与患者不良预后相关。PRDM1可能通过MYC抑制黑色素瘤细胞的增殖、迁移,促进凋亡,进而抑制黑色素瘤的生长发展。
黑色素瘤;PRDM1;MYC;增殖;生物信息学分析
黑色素瘤是一种易发生转移且具有致死性高的常见皮肤恶性肿瘤,目前主流治疗方案为早期手术、晚期放疗和化疗,以及近年来迅速发展的免疫抑制治疗。大部分黑色素瘤均能得到控制,但若发生远处转移、耐药及免疫逃避,其疗效则会显著降低[1-5]。探讨黑色素瘤的生长机制,寻找新的分子靶目标提供更多的选择方案具有重要意义。含PR域蛋白1(PR domain containing protein 1,PRDM1)作为近年来新发现的一种潜在抑癌基因[6-8],被发现在黑色素瘤中呈低表达,且在远处转移瘤中多呈低表达,同时证实在斑马鱼黑色素瘤模型中,缺失PRDM1的表达易促进黑色素瘤的发生、发展[9]。本研究应用生物信息学技术检测了PRDM1在黑色素瘤中的表达情况和预后相关性,并在人黑色素瘤细胞上了验证PRDM1生物学功能,为寻求黑色素瘤新的治疗方案提供思路。
1 材料与方法
1.1 基因表达谱数据动态分析(gene expression profiling interactive analysis,GEPIA)
将TCGA与GTEx数据库中肿瘤和正常组织样本数据整合后进行基因分析表达的可视化数据库,涵盖了9736个肿瘤组织和8587个正常组织的RNA数据[10]。利用GEPIA数据库分析PRDM1基因在皮肤黑色素瘤中的表达情况。
1.2 细胞和主要试剂
人黑色素瘤细胞株A375(美国模式培养物集存库ATCC),DMEM培养基、Transwell小室(美国Corning公司),胎牛血清、1%青霉素-链霉素(美国Thermo Fisher公司),Lipofectamine 2000(美国Invitrogen公司),Trizol、反转录试剂盒、SYBR Green(日本TaKaRa公司),EdU试剂盒、siRNA-PRDM1及siRNA-NC(广州锐博生物技术有限公司),RNase A、凋亡试剂盒购(南京凯基生物有限公司),PRDM1、MYC、GAPDH单克隆抗体(中国爱博泰克生物公司,引物购自上海生工生物公司)。
1.3 细胞培养和转染
黑色素瘤细胞A375 10%胎牛血清、1%青霉素-链霉素高糖培养基置于37℃、5%CO2培养箱中培养。取对数生长期的细胞接种于6孔、24孔、96孔细胞培养板上,细胞融合度达到70%时将培养基换成不含胎牛血清的DMEM饥饿6h,按照Lipofectamine 2000说明书转染siRNA-PRDM1、siRNA-NC,结束后继续培养48h。
1.4 实时荧光定量PCR检测
采用Trizol提取细胞总RNA后按照反转录说明书操作获得cDNA。以β-actin作为内参利用SYBR Green进行实时荧光定量PCR分析mRNA相对表达量。
1.5 流式细胞术检测细胞周期和凋亡实验
收集成功转染siRNA-PRDM1及siRNA-NC的A375细胞,冷冻过的100%乙醇固定过夜。重悬细胞后RNase A室温孵育5min,碘化丙啶避光室温染色15min,筛网过滤后流式细胞仪检测,FlowJo软件分析细胞周期。成功转染siRNA-PRDM1和siRNA- NC的A375细胞培养24h后,重悬细胞进行Annexin V-FITC和碘化丙啶染色,应用流式细胞仪测定细胞凋亡。
1.6 EdU细胞增殖检测
应用EdU测定细胞增殖,将A375细胞以2×105/ml的密度接种于96孔板上,在成功转染siRNA-PRDM1和空载对照48h结束前2h加入EdU,后4%多聚甲醛4℃固定过夜。甘氨酸中和残留的固定液并洗涤干净后0.5% Triton X室温孵育30min。利用EdU检测试剂盒根据操作说明书染色、避光孵育。荧光显微镜EdU阳性细胞数计数。
1.7 细胞迁移检测
转染siRNA-PRDM1及siRNA-NC,24h后A375细胞以2×105/ml的密度重悬于无FBS的DMEM中。吸取200μl细胞悬浮液至Transwell小室的上室,下室加入600μl含有10%FBS的DMEM,继续孵育37℃孵育48h。结束后弃上室液用4%多聚甲醛固定,风干后0.1%结晶紫染色,漂洗干净后倒置显微镜拍摄。
1.8 免疫蛋白印迹检测
从细胞中提取总蛋白后将等量的蛋白质样本分别进行电泳、转膜、封闭,加入抗PRDM1、MYC、GAPDH单克隆抗体(1:1000)4℃孵育过夜,再次二抗室温孵育2h,洗膜,电化学发光可视化系统显影。
1.9 统计学方法
采用SPSS 20.0统计学软件对数据进行分析处理,两组间数据比较采用Unpaired t检验,另外PRDM1在肿瘤与正常组织中的表达差异分析采用Wilcoxon检验,生存分析采用Kaplan-Meier法和Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 PRDM1在黑色素瘤和正常组织中的表达差异及与患者预后的相关性
利用GEPIA平台对最新TCGA数据库皮肤黑色素瘤和GTEx数据库正常皮肤组织进行差异表达分析,发现PRDM1在黑色素瘤中呈低表达。GSCA数据库可视化分析显示,PRDM1高表达组总体生存期(overall survival,OS)延长。
2.2 敲低PRDM1的表达对黑色素瘤细胞增殖的影响
在黑色素瘤A375细胞流式细胞术实验中,siRNA-PRDM1转染组G0/G1期细胞数(57.9±2.1)%相比siRNA-NC空载对照组(65.4±1.5)%显著减少(=4.697,<0.05),且siRNA-PRDM1转染组S期(30.6±2.3)%相比siRNA-NC空载对照组(22.5±2.5)%则明显增多(=5.055,<0.05),G2/M期比较,差异无统计学意义(=0.446,>0.05),见图1A。同样的EdU实验100倍显微镜下siRNA- PRDM1转染组每个视野的阳性细胞数(36.5±4.0)%平均要高于空载对照组(29.3±3.2)%,差异有统计学意义(=13.030,<0.05),见图1B。
2.3 敲低PRDM1的表达对黑色素瘤细胞凋亡的影响
黑色素瘤A375细胞凋亡实验中,siRNA-PRDM1转染组凋亡细胞百分比(13.4±2.9)%低于siRNA-NC空载对照组(20.7±2.0)%,差异有统计学意义(=3.966,<0.05),而siRNA-PRDM1转染组存活细胞百分比(84.4±3.3)%则要高于siRNA-NC空载对照组(76.9±2.3)%,差异有统计学意义(=4.078,<0.05),见图2。
2.4 下调PRDM1的表达对黑色素瘤细胞迁移能力的影响
黑色素瘤A375细胞迁移实验中,siRNA-PRDM1转染组100倍显微镜下每个视野的结晶紫染色阳性细胞数(230±17)明显高于siRNA-NC空载对照组(97±13)(=23.800,<0.05),见图3。
2.5 PRDM1影响黑色素细胞瘤的生长发展
利用GEPIA平台分析发现黑色素瘤中PRDM1与MYC存在相关性,见图6A。免疫蛋白印记实验证实当黑色素瘤A375细胞中PRDM1的表达下调,MYC蛋白表达水平上调,见图4。
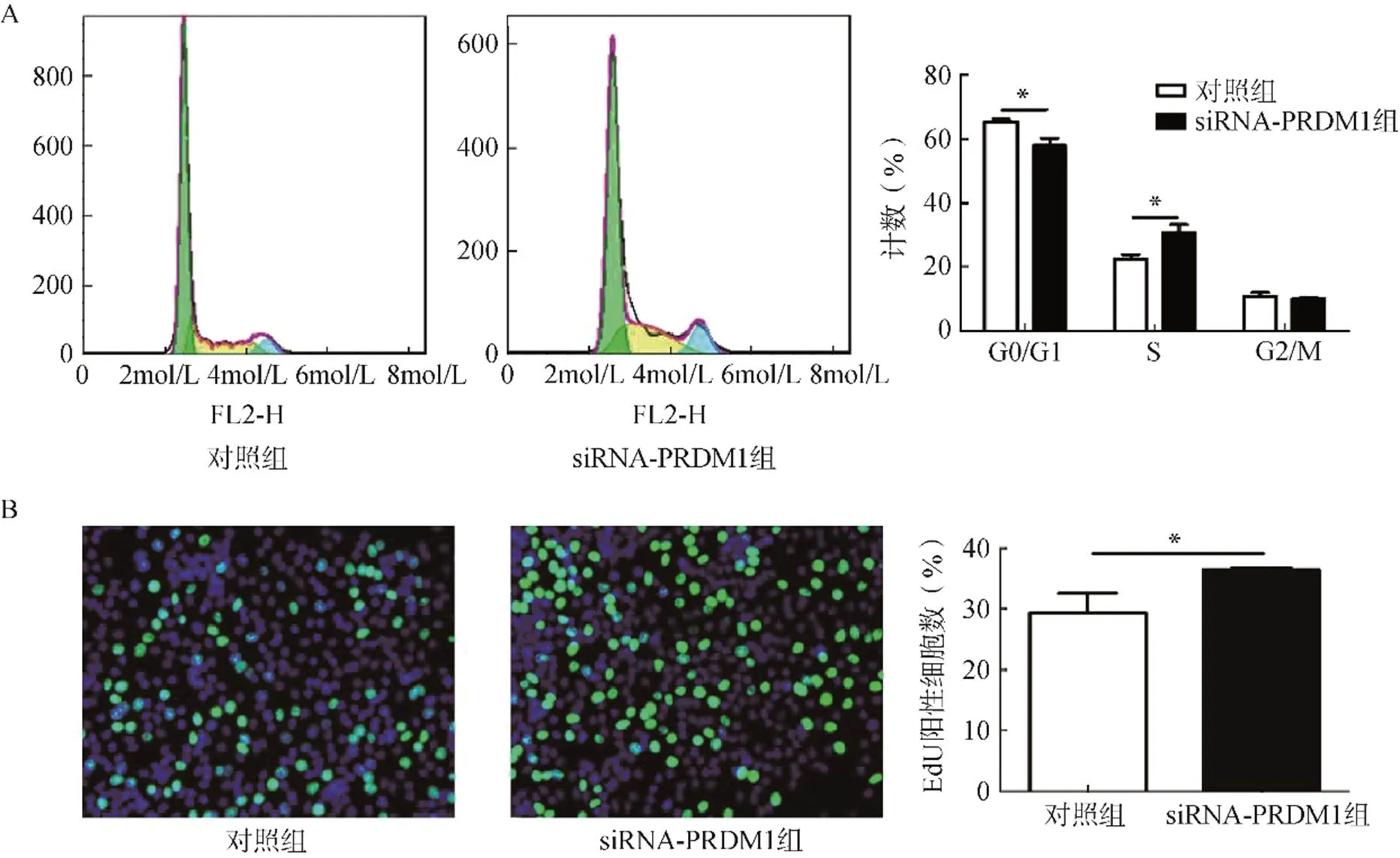
图1 敲低PRDM1的表达对黑色素瘤细胞增殖影响
A.流式细胞术检测黑色素瘤细胞周期;B.EdU检测黑色素瘤细胞增殖
注:与对照组比较,*<0.05

图2 实时荧光定量PCR检测细胞中PRDM1 mRNA相对表达水平
注:与对照组比较,*<0.05
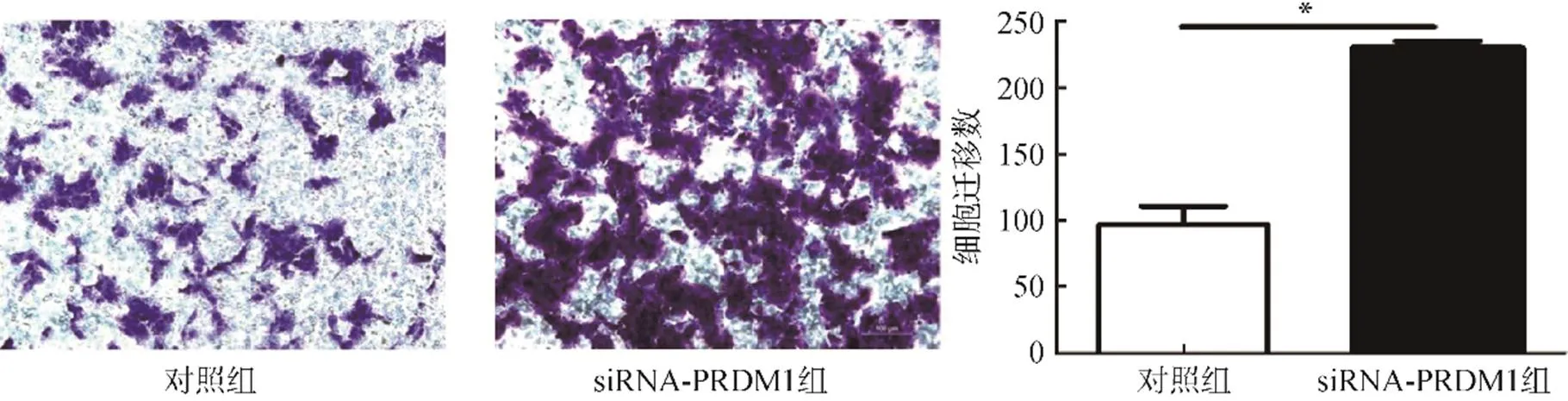
图3 敲低PRDM1的表达对黑色素瘤细胞迁移的影响(结晶紫染色,×100)
注:与对照组比较,*<0.05

图4 黑色素瘤细胞中PRDM1和MYC的关系
A.GEPIA数据库黑色素瘤中PRDM1与MYC的相关性;B.蛋白质免疫印迹法检测PRDM1对MYC的影响
注:与对照组比较,*<0.05
3 讨论
PRDM1作为一种支架蛋白能通过甲基化或者去乙酰化抑制基因转录,发挥沉默靶基因的效应[11]。已知PRDM1在部分肿瘤类型中具有肿瘤抑制因子的作用,特别是B、T和自然杀伤细胞淋巴瘤和肺癌[6,12]。而在黑色素瘤中,有文献报道PRDM1是神经嵴细胞分化为黑素细胞的重要调节因子,斑马鱼模型中缺失prdm1后早期黑色素干细胞标志物sox10表达上调,且促进了黑色素瘤的发生、发展[9],但PRDM1在黑色素瘤中是否具有抑癌基因的效果尚无未明确结论。
首先通过分析可视化公共数据库可知,与正常组织相比,PRDM1在黑色素瘤中低表达,同时黑色素瘤患者中PRDM1高表达水平者预后较低表达水平者高,生存时间延长,表明PRDM1表达水平的高低与黑色素瘤患者预后相关,且PRDM1具有作为黑色素瘤患者预后生物标记物的可能。既往有报道证实黑色素瘤免疫抑制治疗中,PRDM1缺失更容易发生免疫相关不良事件[13],可能是导致预后不良的因素之一,同时PRDM1的表达水平也可作为黑色素瘤患者开展免疫抑制治疗方案的筛选指标之一。此外,已知PRDM1在生发中心B细胞和浆细胞中高表达,与B淋巴细胞分化成熟密切相关,在维持T淋巴细胞稳态及分化中也发挥着重要作用[11,14]。在肿瘤微环境中,PRDM1可能通过促进B、T淋巴细胞分化成熟增强免疫细胞浸润,进而延长PRDM1高表达黑色素瘤患者的生存时间,这也是下一步的研究方向。
为了进一步证实PRDM1是黑色素瘤肿瘤抑制基因的一员。首先在A375细胞中成功转染PRDM1- siRNA,抑制细胞内PRDM1基因的表达。流式细胞术分析发现S期细胞显著增加,表明PRDM1阻碍黑色素瘤细胞细胞周期G1/S的转化,说明PRDM1抑制黑色素瘤细胞增殖,同样EdU实验也证实这一点;另外流式细胞术证明PRDM1表达下调后促进细胞凋亡;而迁移实验则表明PRDM1低表达后迁移能力增强。这些数据证实了PRDM1抑制黑色素瘤细胞生长发展。
MYC是已被普遍证实的一种原癌基因,参与多种生长促进相关信号通路的传导,在肿瘤的发生、发展中起重要作用[15,16]。MYC在多种类型肿瘤中处于高度扩增状态,短暂抑制MYC的表达可逆转体内肿瘤的发生[17]。此外有研究表明在弥漫性大B细胞淋巴瘤中PRDM1基因失活诱导MYC基因表达上调[18]。为探索黑色素瘤细胞中PRDM1是否通过MYC发挥肿瘤抑制基因的作用,进一步的在黑色素瘤细胞中成功转染siRNA-PRDM1后,蛋白质免疫印迹实验结果显示PRDM1表达下调,而MYC的蛋白表达水平则升高,可见PRDM1负向调控MYC,说明PRDM1可能是通过MYC调控黑色素瘤细胞的增殖、凋亡和迁移。
综上所述,在黑色素瘤患者中PRDM1高表达水平者相对生存期更长,且初步证明PRDM1可能是通过下调MYC抑制黑色素瘤细胞的增殖、凋亡和迁移。
[1] Rokhzan R, Meier K. Targeted therapy in melanoma[J]. N Engl J Med, 2022, 386(24): e66.
[2] Sabbatino F, Liguori L, Pepe S, et al. Immune checkpoint inhibitors for the treatment of melanoma[J]. Expert Opin Biol Ther, 2022, 22(5): 563-576.
[3] Mao L, Qi Z, Zhang L, et al. Immunotherapy in a cral and mucosal melanoma: Current status and future Directions[J]. Front Immunol, 2021, 12: 680407.
[4] Lugovic-Mihic L, Cesic D, Vukovic P, et al. Melanoma Development: Current knowledge on melanoma pathogenesis[J]. Acta Dermatovenerol Croat, 2019, 27(3): 163-168.
[5] Kalaora S, Nagler A, Wargo JA, et al. Mechanisms of immune activation and regulation: Lessons from melanoma[J]. Nat Rev Cancer, 2022, 22(4): 195-207.
[6] Zhu Z, Wang H, Wei Y, et al. Downregulation of PRDM1 promotes cellular invasion and lung cancer metastasis[J]. Tumour Biol, 2017, 39(4): 1010428317695929.
[7] Ma J, Nie K, Redmond D, et al. EBV-miR-BHRF1-2 targets PRDM1/Blimp1: Potential role in EBV lymphomagenesis[J]. Leukemia, 2016, 30(3): 594-604.
[8] Kucuk C, Iqbal J, Hu X, et al. PRDM1 is a tumor suppressor gene in natural killer cell malignancies[J]. Proc Natl Acad Sci USA, 2011, 108(50): 20119-20124.
[9] Iwanaga R, Truong BT, Hsu JY, et al. Loss of prdmla accelerates melanoma onset and progression[J]. Mol Carcinog, 2020, 59(9): 1052-1063.
[10] Tang Z, Li C, Kang B, et al. GEPIA: A web server for cancer and normal gene expression profiling and interactive analysis[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102.
[11] Boi M, Zucca E, Inghirami G, et al. PRDM1/BLIMP1: A tumor suppressor gene in B and T cell lymphomas[J]. Leuk Lymphoma, 2015, 56(5): 1223-1228.
[12] Boi M, Rinaldi A, Kwee I, et al. PRDM1/BLIMP1 is commonly inactivated in anaplastic large T-cell lymphoma[J]. Blood, 2013, 122(15): 2683-2693.
[13] Wolffer M, Battke F, Schulze M, et al. Biomarkers associated with immune-related adverse events under checkpoint inhibitors in metastatic melanoma[J]. Cancers (Basel), 2022, 14(2): 302.
[14] Xia Y, XuMonette ZY, Tzankov A, et al. Loss of PRDM1/BLIMP-1 function contributes to poor prognosis of activated B-cell-like diffuse large B-cell lymphoma[J]. Leukemia, 2017, 31(3): 625-636.
[15] Dhanasekaran R, Deutzmann A, Mahauad-Fernandez WD, et al. The MYC oncogene-the grand orchestrator of cancer growth and immune evasion[J]. Nat Rev Clin Oncol, 2022, 19(1): 23-36.
[16] Grieb BC, Eischen CM. MTBP and MYC: A dynamic duo in proliferation, cancer, and aging[J]. Biology (Basel), 2022, 11(6): 881.
[17] Dang CV. MYC on the path to cancer[J]. Cell, 2012, 149(1): 22-35.
[18] 张兴艳, 马志萍, 崔文丽, 等. PRDM1基因失活对C—MYC的调控在弥漫性大B细胞淋巴瘤中的作用[J]. 中华病理学杂志, 2018, 47(1): 25-31.
Effect of PRDM1 on melanoma cell proliferation, apoptosis and migration and its underlying mechanism
CHEN Ting SU Wenyang ZHU Xicong
1.Department of Dermatology, Taizhou Hospital of Zhejiang Province, Taizhou 317000, Zhejiang, China; 2.Department of Neurology, Taizhou Hospital of Zhejiang Province, Taizhou 317000, Zhejiang, China
To explore the relationship between the expression level of PR/SET domain (PRDM1) and the prognosis of melanoma patients, as well as the effect on proliferation, apoptosis and migration of melanoma cells.The expression level of PRDM1 in melanoma and normal tissues was analyzed by GEPIA database and GSCA database. The melanoma A375 cells were divided into two groups, then transfected with small interfering RNA PRDM1 (siRNA-PRDM1) and empty vector small interfering RNA negative control (siRNA-NC). The proliferation, anti-apoptosis and migration of A375 cells were detected by flow cytometer, transwell assay, respectively, at last use Western blot to detect the protein expression level of MYC.The expression level of PRDM1 in melanoma was significantly lower than that of normal tissue, and the highly expressed PRDM1 was related with the poor prognosis of melanoma patients. Compared with empty vector group, the proliferation and migration of the cells was increased, while the anti-apoptosis was decreased, and the protein expression level of MYC in the cells was significantly decreased after transfection of siRNA-PRDM1 (<0.05).The PRDM1 was under-expressed in melanoma tissues and correlated with poor prognosis of the melanoma patients. PRDM1 may inhibit the development of melanoma by increasing MYC to prevent the proliferation, migration and promote anti-apoptosis of melanoma cells.
Melanoma; PRDM1; MYC; Proliferation; Bioinformatics analysis
R739.5
A
1673-9701(2022)36-0018-05
台州恩泽医疗中心(集团)科研基金项目(19EZA2)
朱希聪,电子邮箱:zhuxc@enzemed.com
(2022–07–11)
(2022–09–12)

