结球甘蓝抽薹过程中抗氧化系统及蛋白质含量的变化
王神云,余方伟,张 伟,于 利,李建斌
(江苏省农业科学院 蔬菜研究所,南京 210014)
结球甘蓝(BrassicaoleraceaL var.capitata. L.,简称甘蓝)俗称包菜、圆白菜、茴子白等,是十字花科主要蔬菜作物之一,属绿体春化作物,即一定大小的植株通过一定的低温作用后,当温度和光照条件合适后诱导植株抽薹开花,完成世代[1-2]。春甘蓝生产中,经常会发生“未熟抽薹”现象,严重影响产品产量和质量;在甘蓝育种中,一些材料需促进抽薹,才能保证收到种子;在甘蓝F1代种子生产中,一些品种双亲需调节抽薹时间,保障两本花期相遇,增加种子产量和质量。因此,甘蓝抽薹过程的调控无论在生产中还是育种中都尤为重要。
植物抽薹是由系列内因和外因共同作用的过程,因此抽薹成花过程中不仅成花途径的相关分子因子,如FLC、CO、FT、miRNA156、miRNA159等会发生表达量或结构等的变化[3-4],而且也会发生复杂的生理生化反应,如系列抗氧化酶、糖、蛋白质、激素等物质的活性和含量的变化[5-7]。十字花科蔬菜白菜从营养生长到盛花抽薹过程中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)及可溶性蛋白(S-Pr)和丙二醛(MDA)含量的变化呈现一定的规律性,而且易抽薹和晚抽薹材料之间存在明显的差异,表明这些生理指标和白菜抽薹有一定的联系[6]。十字花科蔬菜萝卜从花芽未分化到薹高>5cm的抽薹过程中保护酶SOD、POD和CAT的活性与可溶性糖和S-Pr含量也发生趋势性变化,说明萝卜抽薹过程也需要一些生理生化物质的参与[8]。甘蓝抽薹必需经过一段低温春化,前人研究表明甘蓝通过低温春化阶段,可溶性糖、S-Pr、游离氨基酸含量积累,而淀粉和全氮含量却显著下降[9-10],抗氧化系统酶CAT、POD和SOD的活性随着低温的积累也降低[11];通过春化阶段后进入花芽分化阶段,花芽分化过程蛋白质和蔗糖含量表现为下降趋势[12];花芽分化后到现蕾蛋白质和蔗糖的含量又升高[12],因此,甘蓝抽薹过程中大量的代谢物质发生规律性变化趋势,与抽薹有一定联系。前期研究主要在甘蓝低温春化、花芽分化和现蕾这几个时期生理生化的分析,甘蓝现蕾到开花还有一个花薹伸长和分枝的生长过程,这个阶段的生理生化研究属于空白,本试验在前人研究的基础上,利用抽薹性差异明显表型稳定的两份甘蓝材料,研究分析甘蓝通过低温春化后到开花抽薹过程中抗氧化系统的几个酶活性、MDA和S-Pr含量变化进行研究,以期明确甘蓝抽薹发育后期抗氧化系统生理指标变化规律,进而为甘蓝类蔬菜阶段发育调控过程研究和人工调控提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为两份高代自交系甘蓝,耐抽薹甘蓝CF11-1-6-4(简称CF)和易抽薹甘蓝c179-1-4(简称c179),由江苏省农业科学院蔬菜研究所提供。两份供试材料第1批播种于9月20日,定植于10月28日;第2批播种10月10日,定植于11月21日,试验在江苏省农业科学院蔬菜研究所试验地进行,育苗和田间肥水管理同生产管理。
1.2 测定指标及方法
于2021年3月8日、3月15日、3月22日、3月29日、4月5日和4月12日(c179始花)每隔 7 d进行茎粗和抽薹率调查并采集样品。茎粗用直尺测定15个植株茎最粗部位的直径;调查已测量茎粗植株的抽薹性(薹高5 cm即为抽薹),抽薹 率=抽薹植株数/15×100%。
精确称取心叶数起第4片叶样品0.3 g,放入灭菌研钵,加入3 mL磷酸缓冲液(含0.2 mmol·L-1EDTA,pH 7.8)置于冰上研磨成匀浆, 11 000g4 ℃离心25 min,上清液用于测定MDA和S-Pr含量及各种酶的活性。SOD活性采用氮蓝四唑(NBT)法[13]测定。CAT活性参考Angela等的方法[14]测定。APX、G-POD活性参考朱祝军等的方法[15]测定。MDA含量参照Cakmak等的方法[16]测定。S-Pr含量采用考马斯亮蓝G-250染色法[17]测定。
1.3 数据处理
测定数据采用Excel 2016、SPSS 26.0软件进行方差分析(LSD多重比较)和作图。
2 结果与分析
2.1 不同定植时间甘蓝茎粗和抽薹情况
由表1可知,定植时间的早、晚影响甘蓝茎的生长量,两个材料定植早的茎均比定植晚的粗,而且易抽薹材料c179茎的生长速度快于耐抽薹材料CF(表1),c179于11月21日定植的茎的生长量也快于CF于10月28日定植。两个材料的耐抽薹性差异大,易抽薹材料c179,10月28日定植和11月21日定植,3月22日均发生现蕾现象,定植早比定植晚抽薹率高10%,3月29日抽薹率均达到100%;耐抽薹材料CF于10月28日定植后到第2年4月5日开始抽薹,比c179晚14 d,4月12日只有25%的植株发生抽薹,抽薹率低于c179材料75%,于11月21日定植没有发生抽薹现象,没有发生抽薹现象的均没有通过低温春化,表明耐抽薹材料CF通过绿体春化对植株生长量要求明显高于易抽薹材料c179。
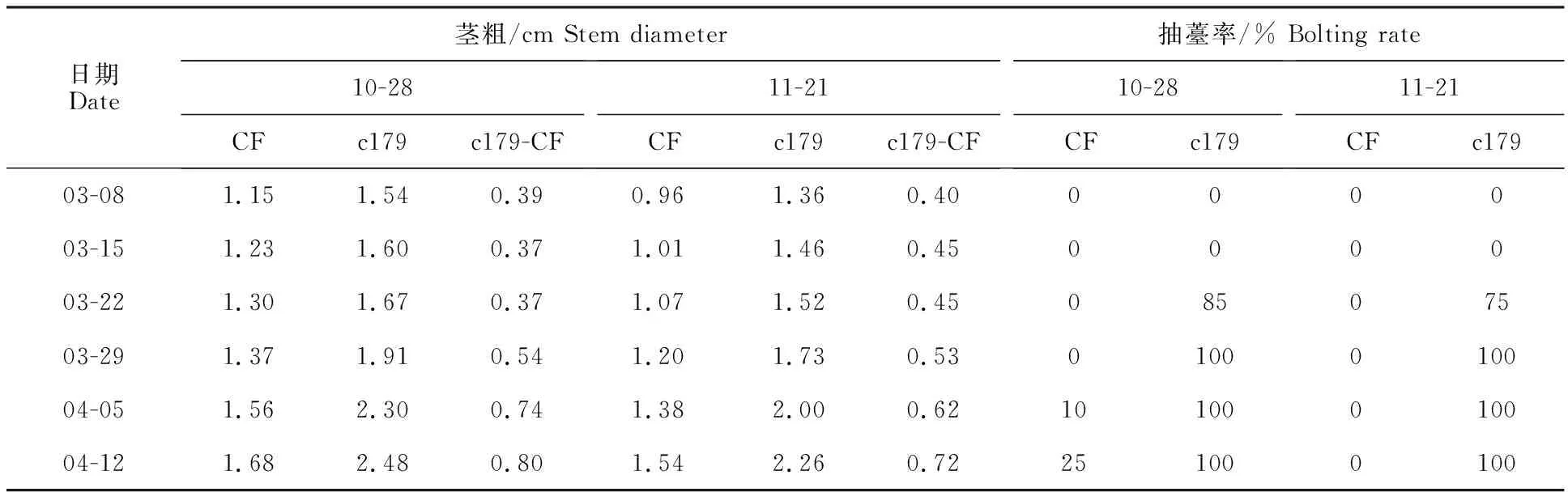
表1 两个甘蓝不同定植时间茎粗和抽薹率Table 1 The stem diameter and bolting rate of the two cabbage lines at different planting time
2.2 甘蓝抽薹过程CAT活性变化
耐抽薹CF和易抽薹c179,从3月8日-4月12日,定植早、晚6个时间点CAT活性变化趋势基本一致。两个材料定植早的CAT变化是3月15日稍微升高,3月22日迅速升高,3月29日活性又降低,4月5日到4月12日继续降低;两个材料定植晚的CAT活性变化3月15日稍降低,其他时间点变化趋势基本同于定植早的(图1)。3月22日c179发生现蕾现象而CF没有发生现蕾现象,但两个材料的CAT活性在这个时间点都迅速升高,而且它们定植早、晚没有同时表现显著差异,而且定植早的耐抽薹CF在4月5日部分发生现蕾现象,但其CAT活性同其他变化趋势一致,表现下降(表1,图1),4月12日c179(始花期)定植早、晚的CAT活性极显著低于CF。甘蓝通过低温春化后现蕾前两周到始花前的抽薹过程中CAT活性的变化规律表明其活性的变化与抽薹相关性不强,但可能与开花有关。
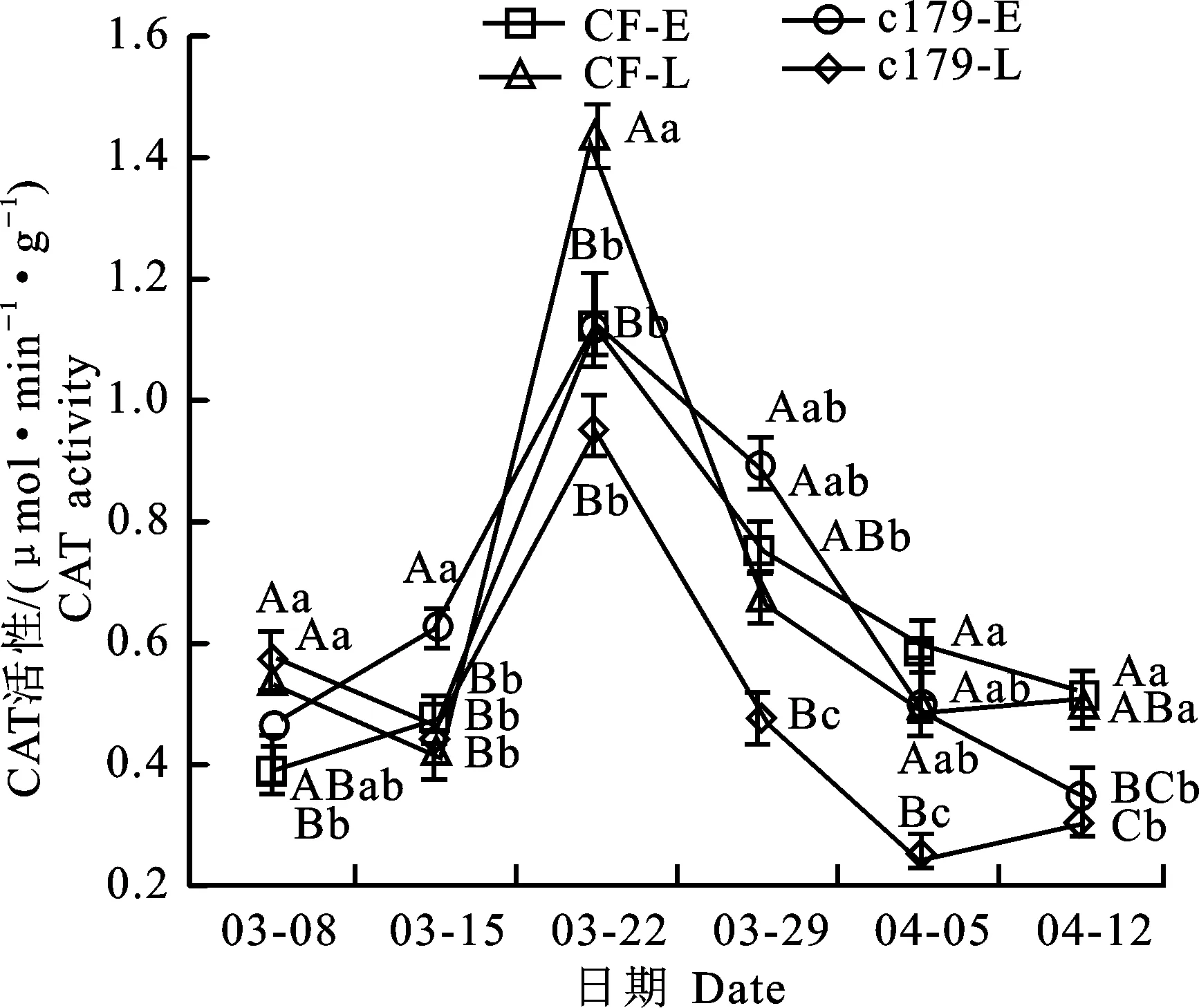
CF-E、CF-L、c179-E、c179-L表示定植早、晚的耐抽薹材料CF和易抽薹材料c179;大、小写字母表示同一日期两个材料定植早、晚间差异极显著水平(P<0.01)和显著水平(P<0.05)。 下同
2.3 甘蓝抽薹过程APX活性变化
耐抽薹CF和易抽薹c179的APX活性3月8日-4月12日变化规律不一致。易抽薹材料c179定植早、晚的APX活性变化规律稍有不同,定植早的APX活性3月8日到3月15日缓慢上升,3月22日下降到低于3月8日,3月29日又缓慢上升,随后开始下降,而定植晚的APX活性在3月29日稍有下降,但与定植早的不存在差异,但高于耐抽薹CF的活性,其他时间点活性变化趋势一致(图2);耐抽薹CF定植早的APX活性3月8日到3月22持续上升,3月29骤然下降,后期活性缓慢下降,定植晚的APX活性变化规律基本与定植早的趋势相似,3月8日和3月22日分别比定植早的强和弱(图2)。在抽薹过程中,易抽薹c179无论定植早、晚3月15日(现蕾前1周)和3月29日(现蕾后第1周)活性强于耐抽薹CF,现蕾前1周定植早的存在显著差异,定植晚的差异不显著,现蕾后1周定植早的存在极显著差异,定植晚的差异不显著;3月22日(现蕾)和4月12日(始花)弱于CF(表1,图2),现蕾期定植早的存在显著差异,定植晚的差异不显著,始花期存定植早、晚存在极显著差异。上述甘蓝抽薹过程APX活性变化规律,表明APX活性可能与现蕾前1周、现蕾后第1周及始花过程有关。

图2 甘蓝抽薹过程中APX活性Fig.2 APX activities during bolting process of cabbage
2.4 甘蓝抽薹过程G-POD活性变化
耐抽薹CF和易抽薹c179的G-POD活性3月8日-4月12日变化规律基本一致,3月15日先升高,3月22日除了定植早的CF的G-POD活性上升,其他均下降,3月29日除了定植早的CF的G-POD活性下降幅度大,其他均与3月22日活性相当,4月5日G-POD活性下降,4月12日CF的G-POD活性稍有上升,而c179的仍有下降(图3)。3月8日和3月15日(现蕾前2周)定植早、晚的易抽薹c179的G-POD活性极显著高于CF,4月12日(始花)极显著低于CF(表1,图3);3月22日定植早的耐抽薹材料CF的G-POD活性突然上升(部分材料现蕾前2周),极显著高于其他样品(表1,图3),3月29日也极显著高于定植晚的活性。3月8日、3月15日易抽薹材料c179和3月29日定植早的耐抽薹材料CF虽没有现蕾,但通过花芽分化的材料抽薹已启动,因此表明G-POD活性可能与甘蓝抽薹启动发育阶段和始花相关。
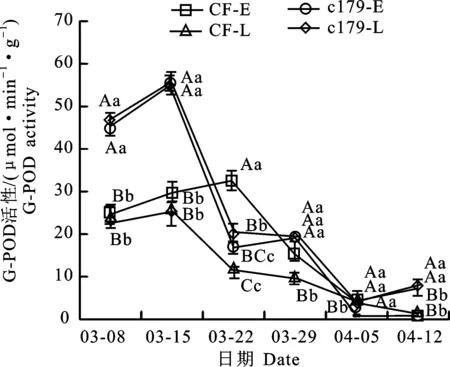
图3 甘蓝抽薹过程中G-POD活性Fig.3 G-POD activities during bolting process of cabbage
2.5 甘蓝抽薹过程SOD活性变化
耐抽薹CF和易抽薹c179的SOD活性3月8日-4月12日变化规律基本一致,3月15日基本不变,3月22日升高(除了定植早的CF),3月29日骤然下降,4月5日又升高,4月12日又略有下降(图4)。3月8日定植早的CF和c179的SOD活性比定植晚的强,3月15日定植早的CF和c179的SOD活性比定植晚的极显著高约100 U·min-1·g-1;3月22日定植早的CF的SOD活性骤然下降,c179变化不大,两个材料定植晚的SOD活性均上升;4月5日和4月12日两个材料定植早的SOD活性比定植晚的低,存在一定差异,但定植早的CF的SOD活性略有上升,可能与材料特性有关;从3月8日到4月12日CF和c179定植早的SOD活性基本都比定植晚的强(图4),除了3月22日定植早的CF的SOD活性,上述SOD活性变化规律,表明SOD活性的变化与甘蓝通过低温春化后的抽薹过程相关不强,可能与材料的特性、植株的大小和生长状态有关。

图4 甘蓝抽薹过程中SOD活性Fig.4 SOD activities during bolting process of cabbage
2.6 甘蓝抽薹过程丙二醛含量变化
耐抽薹CF和易抽薹c179的MDA含量3月8日-4月12日变化规律有差异,易抽薹c179,3月15日升高,3月22日下降,3月29日定植早的有上升现象而定植晚的持续下降,4月5日升高,4月12日定植早的急剧上升,而定植晚的略升高;耐抽薹材料CF于3月15日、4月5日和4月12日与c179变化趋势一致,3月15日定植早、晚的含量显著和极显著低于c179(现蕾前1周),3月22日定植早的CF(部分植株现蕾前1周)的MAD含量上升,与c179现蕾前1周变化趋势相同(图5),4月5日定植早的含量极显著低于c179(现蕾后第2周),定植晚的含量不存在显著差异,4月12日两个材料定植早的含量极显著高于定植晚的(图5)。上述丙二醛含量的变化规律,表明丙二醛含量在甘蓝通过低温春化后整个抽薹过程中在现蕾前1周、现蕾后第2周可能发挥一定的作用。

图5 甘蓝抽薹过程中MDA含量Fig.5 MDA contents during bolting process of cabbage
2.7 甘蓝抽薹过程可溶性蛋白含量变化
耐抽薹CF和易抽薹c179的S-Pr含量3月8日-4月12日变化规律基本一致,3月8日两个材料定植早的含量比定植晚的极显著偏低,3月15日两个材料定植早的S-Pr含量升高,定植晚的下降,c179(现蕾前1周)的S-Pr含量高于CF,而且定植晚的含量存在极显著差异,3月22日两材料定植早、晚的含量都升高,3月29日到4月5日持续下降,但3月29日和4月5日c179现蕾后第1、2周定植晚的S-Pr含量显著和极显著高于CF;定植早的含量不显著和极显著高于CF,4月12日两材料S-Pr含量均升高(表1,图6),定植早的CF含量最低,可能与部分植株进入现蕾第2周时期有关。上述S-Pr含量的变化规律,表明S-Pr含量在甘蓝通过低温春化后的抽薹过程中可能在现蕾前1周和现蕾后第1、2周存在一定的关系。

图6 甘蓝抽薹过程中S-Pr含量Fig.6 S-Pr contents during bolting process of cabbage
3 讨 论
甘蓝抽薹是通过低温春化顶端分生组织完成花芽分化后遇到合适的温度和光照花薹从叶丛中伸长生长,此阶段发育不仅受内部因素调控,而且受温度、光照等环境因素的影响,是典型的数量性状,受多个基因控制[18-20],还与多种代谢物质有关系,如蛋白质、糖及各类内源激素等[9-12]。甘蓝春化作用的效果是花发端,而花发端不是发生在春化过程中,却是发生在春化之后适合生长的条件下。甘蓝属于绿体春化,需要植株长到一定大小才能感受低温,本研究所利用的易抽薹材料c179在11月21日定植和10月28日定植均达到了春化要求,春化结束后茎粗达到1.3 cm以上,耐抽薹材料CF茎的生长量比c179小0.4 cm左右,10月28日定植后的植株部分通过低温春化,11月21日定植完全没有通过低温春化,说明不同基因型的甘蓝感受低温春化植株的大小要求不同,而且同一基因型植株营养体越大所需低温积累时间相对短,与王超等[21]建立甘蓝抽薹鉴定的方法研究结果一致,而且与吴国平等[2]研究结果也一致。在自然生长的条件下,就甘蓝春化、抽薹甚至开花发育的进程而言,耐抽薹和易抽薹材料是相似的,只是发育进程时间迟早有差别,因而,不同品种与抽薹有关的生理代谢活动可能相似,那么相关酶的活性和可溶性蛋白含量的变化也就应该具有相同的规律,只是变化的迟早可能因发育进程而存在差异。甘蓝通过低温春化过程抗氧化系列的保护酶,如SOD、CAT、POD等及蛋白质、蔗糖的含量会发生趋势变化,可作为甘蓝通过前期低温积累的生化标记[11-12]。本研究中易抽薹材料c179不同定植时间通过春化后到始花整个抽薹过程CAT、APX和G-POD活性、MDA和S-Pr含量可能发挥了一定的作用。甘蓝CAT虽然可以作为前期低温积累的生化指标[11],与萝卜相似[22],在抽薹过程中可能与抽薹没有直接关联,但本研究结果表明CAT可能有助于甘蓝开花;本研究APX活性在易抽薹c179和的耐抽薹CF中的变化规律和差异表明其在甘蓝现蕾前1周、现蕾后第1周和始花期发挥一定的作用;G-POD活性与甘蓝现蕾前两周和始花时期相关性强,在拟南芥和青花菜低温春化过程中POD活性是慢慢增强的[23-24],POD是细胞防御活性氧对细胞伤害的保护酶,而且POD也具有氧化分解IAA的作用,IAA在植物抽薹开花过程中发挥重要作用[22,25-26],本研究中G-POD可能在甘蓝抽薹过程中参与激素调控,变化趋势同十字花科芸薹属不结球白菜[6];MDA在现蕾后第2周可能发挥一定的作用,MDA是低温春化后的一个响应物质,在甘蓝、萝卜、洋葱中都会升高[11,22,27],本研究中甘蓝现蕾后第1周含量下降,第2周到初花稍有上升,变化规律同不结球小白菜抽薹过程[6],但现蕾第2周易抽薹和耐抽薹材料含量存在显著和极显著差异,可能在这个时期发挥一定作用; S-Pr在甘蓝现蕾后第1周和第2周发挥一定的作用,表明蛋白质可能作为物质基础促进甘蓝这2周薹长高的生长过程,与萝卜抽薹过程可溶性蛋白含量变化规律相反,可能与萝卜抽薹后营养物质向块根转移有关[22],白菜通过春化后到始花 S-Pr含量一直上升[6],而本研究中甘蓝现蕾后2周下降到始花又上升,可能不同的作物存在差异;两个材料的SOD活性的变化在抽薹过程中变化规律基本一致,它们可能与甘蓝现蕾前2周到始花过程关联不大。甘蓝抽薹是一个复杂的发育过程,生理生化物质的变化可以作为抽薹过程内因或外因调控的指示,有助于调控机理的解析而且可以为人工调控阶段发育提供理论依据。
4 结 论
甘蓝通过低温春化存在基因型差异,抗氧化系统酶CAT、APX、G-POD及MDA和S-Pr含量5个生理指标在现蕾前2周到始花整个过程在一些发育时段发挥重要作用,说明了甘蓝抽薹过程的复杂性,这些生理生化物质在甘蓝抽薹过程中所起作用以及如何起作用,需要从多方面深入细致的研究。

