暂养净化及无水保活中太平洋牡蛎活力品质与呈味物质分析
林恒宗,高加龙,梁志源,秦小明,范秀萍,林海生,曹文红,黄艳平
(广东海洋大学食品科技学院,国家贝类加工技术研发分中心(湛江),广东省水产品加工与安全重点实验室,水产品深加工广东普通高校重点实验室,广东 湛江 524088)
太平洋牡蛎(Crassostrea gigas)生长速度快,产量高,肉质鲜嫩,为我国北方沿海地区主要养殖品种。近年来,随着消费模式的改变,内陆地区对鲜活牡蛎的需求越来越高,许多消费者通过电商途径购买鲜活牡蛎。活体牡蛎商业流通链主要包括采捕、净化、运输、销售4 个环节[1],各流通环节牡蛎会受到干露、温度波动、缺氧、饥饿、振荡等逆境胁迫,机体脏器受到不同程度的损伤,存活质量受到显著影响[2]。但目前国内外针对活体牡蛎的研究主要集中在采捕后保活运输阶段,如:高加龙等[3]研究发现,香港牡蛎(Crassostrea hongkongensis)在4 ℃条件下流通,其存活率最高、营养成分损失相对较低;Hu Xiaopei等[4]采用电子鼻评价不同温度条件下运输的活体牡蛎新鲜度变化,发现4 ℃保活10 d仍保持良好的鲜活状态。在这些研究中大多以存活、质量损失、营养成分、微生物变化作为判断标准,难以全面反映牡蛎流通过程中活力及整体品质。
胁迫条件下,为维持体内环境的稳定,需要有一定的物质和能量消耗,因此能量代谢是鉴别贝类活力品质变化的关键途径。三磷酸腺苷(adenosine triphosphate,ATP)是一种高能磷酸化合物,可以为细胞各项生命活动提供能量,而核苷酸能荷(adenylate energy charge,AEC)值可准确反映贝类活力健康水平。大量研究已证实,当贝类AEC值为75%~90%时,处于最优生长、可繁殖阶段;低于50%时,处于不可逆、死亡阶段[5-6]。随着胁迫过程中能量物质被大量消耗,这必然会对牡蛎风味品质造成一定的影响,而牡蛎的风味品质取决于氨基酸、核苷酸、有机酸、有机碱、小分子肽、无机离子含量与组成。目前从物质能量代谢及风味变化途径解析长时低温无水保活流通对珍珠龙胆石斑鱼(Epinephelus fuscogutatus♀×Epinephelus lanceolatus♂)[7]、罗非鱼(Oreochromis niloticus)[8]、虾夷扇贝(Patinopecten yessoensis)[9]、菲律宾蛤仔(Ruditapes philippinarum)[10]的影响已有相关报道,而鲜见关于太平洋牡蛎商业流通过程中活力品质与呈味物质劣变规律的研究。因此,本研究模拟当前国内活体太平洋牡蛎流通模式,通过ATP等能量物质分析牡蛎在流通过程中活力品质变化,通过呈味化合物含量变化考察牡蛎在流通过程中风味品质变化,探明牡蛎在净化、降温预冷及无水保活中的内在联系,旨在为优化太平洋牡蛎商业流通过程中管理、提升其存活质量提供技术和理论参考。
1 材料与方法
1.1 材料与试剂
鲜活太平洋牡蛎,平均壳长(127.62±2.07)mm,壳宽(64.11±3.57)mm,壳高(31.98±2.47)mm,湿质量(129.51±2.81)g,于2021年10月购自山东威海灯塔水母海洋科技有限公司。牡蛎采捕后保留外壳污泥,每50 kg分装于铺有海水冰的泡沫箱中,经专用牡蛎冷链运输车运输48 h后运抵广东海洋大学水产品保活流通实验室。立即用灭菌人工海水清洗表面泥污并挑选富有活力,外壳完整的个体进行暂养净化,以缓解和消除捕捞和运输操作时应激胁迫。
海水晶 江西盐通科技有限公司;三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine-diphosphate,ADP)、单磷酸腺苷(adenosine 5’-monophosphate,AMP)、肌苷5’-单磷酸(inosine 5’-monophosphate,IMP)及24 种氨基酸标准品美国Sigma公司;浓盐酸、硼酸、氢氧化钠、二水合磷酸二氢钠、十二水合磷酸氢二钠、高氯酸溶、氢氧化钾(均为分析纯) 广州化学试剂厂。
1.2 仪器与设备
贝类暂养净化系统 广州创岭水产有限公司;1100液相色谱仪、ZORBAX SB-A色谱柱 美国Agilent公司;YC-800低温恒温层析柜 北京亚星仪科公司;SPX-250B生化培养箱 上海博迅实业有限公司;PR224ZH精密天平 美国OHAUS公司;5810R冷冻离心机 德国Eppendorf公司;OSE手持式匀浆机 北京天根生化科技有限公司;PB-10 pH计 德国Sartorius公司。
1.3 方法
1.3.1 暂养净化
净化流程参照SC/T 3013—2002《贝类净化技术规范》。按太平洋牡蛎养殖海域盐度(31±0.5)‰,在贝类净化系统中配制人工海水,开启增氧设备持续曝气24 h,以流速2.5 m3/h通过紫外灯管循环灭菌制冷至25 ℃,通臭氧至海水臭氧质量浓度0.15 mg/L,将清洗后的牡蛎分装于塑料筐(600 mm×420 mm×315 mm),置于预冷的人工海水中暂养净化24 h。
1.3.2 诱导休眠及无水保活
参照郝爽等[11]方法并加以改进,净化后的牡蛎采用聚氯乙烯热收缩膜逐个包裹,包装完成后将牡蛎分装于塑料周转筐(600 mm×420 mm×315 mm)中,置于恒温层析柜,采用梯度降温方式诱导休眠处理。处理方式为调节恒温层析柜,从(25±0.5)℃开始以5 ℃/h的速率降至生态冰温休眠温度0 ℃,温度每下降5 ℃停留90 min,避免温度急剧下降造成应激损伤。诱导休眠结束后,迅速将牡蛎分装于套有内膜袋的泡沫箱(450 mm×250 mm×200 mm)中,装箱前在箱底平铺一层无菌海水制备而成的冰袋,逐层覆盖浸足灭菌海水的海绵保湿处理,加盖后放置在温度设定为0 ℃的恒温层析柜中进行无水保活。
1.3.3 样品采集与制备
各实验组分别在净化前、净化后、休眠后、保活3 d、保活6 d、保活9 d取样,每组随机取牡蛎60 只,迅速开壳刨取肌肉组织,用预冷的0.86%生理盐水漂洗,吸水纸拭干表面水分,混合匀浆成肉糜状液氮速冻放于-80 ℃保存待测。
1.3.4 核苷酸及其关联物测定
参照Pei Fei等[12]的提取方法并加以改进,准确称取4.0 g牡蛎匀浆肉糜,加入20 mL预冷的10 %高氯酸溶液,均质,4 ℃、8000 r/min冷冻离心15 min;用5 mol/L氢氧化钾溶液调节pH值至6.8,沉淀物复提1 次,合并上清液;用超纯水定容至100 mL,静置30 min;取上清液用0.22 µm滤膜过滤后采用高效液相色谱仪测定。
色谱条件:ODS-BP-C18色谱柱(4.6 mm×250 mm,5 µm);流动相A:20 mmol/L柠檬酸和40 mmol/L三乙胺混合溶液,并用冰乙酸调节pH值至4.8;流动相B:纯甲醇溶液;柱温40 ℃;流速1.0 mL/min;样品进样量10 μL;检测波长254 nm;记录峰面积,根据标准品的保留时间定性外标法定量。AEC值按下式计算[6]:
1.3.5 游离氨基酸测定
参照GB 5009.124—2016《食品中氨基酸的测定》方法,牡蛎肌肉氨基酸水解处理:称取100.0 mg牡蛎肉糜于玻璃水解管中,加入浓度为6 mol/L的盐酸溶液10 mL,滴入3~4 滴苯酚;充氮气1 min并密封,110 ℃烘箱中水解22 h;水解完成后冷却至室温,加水稀释定容至50 mL;吸取1 mL水解液95 ℃氮吹挥干,准确加入浓度为0.01 mol/L盐酸溶液1 mL;过膜,滤液经柱前衍生后利用高效液相色谱仪测定。
色谱条件:ZORBAX Eclipse AAA色谱柱(4.6 mm×150 mm,3.5 µm);柱温40 ℃;流速1.0 mL/min;检测波长254 nm;流动相A:40 mol/L磷酸二氢钠(pH 7.8);流动相B为乙腈-甲醇-水(45∶45∶10,V/V)。
1.3.6 有机酸测定
参照GB 5009.157—2016《食品中有机酸含量测定》方法,准确称牡蛎匀浆肉糜5.000 g,加入25 mL超纯水均质,冷冻离心15 min(10000 r/min,4 ℃);取上清液用超纯水定容至50 mL,经0.22 μm滤膜过滤后采用高效液相色谱仪测定。
色谱条件:ZORBAXSB-AQ 色谱柱(4.6 mm×250 mm,5 μm);流动相A为0.1%磷酸溶液;流动相B为甲醇;检测波长210 nm;柱温40 ℃;流速1 mL/min;样品进样量10 μL。
1.3.7 无机离子测定
阳离子:K+、Na+、Ca2+、Mg2+,参照GB 5009.268—2016《食品中多元素的测定》采用火焰原子吸收光谱法测定;阴离子:Cl-,参照GB 5009.44—2016《食品中氯化物的测定》方法进行。
1.3.8 滋味物质的呈味强度评价
采用呈味强度值(taste activity value,TAV)评价单个呈味物质对整体的味觉特征贡献,参照Zhang Ninglong等[13]方法,计算太平洋牡蛎不同流通阶段呈味核苷酸、呈味氨基酸、有机酸、无机离子的TAV。
1.4 数据处理
实验结果均平行测定3 次,数据均采用SPSS 26.0对实验结果进行单因素方差分析(One-Way ANOVA)及组间差异采用Duncan多重比较,显著性水平α设为0.05,结果以表示。
2 结果与分析
2.1 活力品质变化
2.1.1 ATP及ADP测定
ATP提供维持正常生命活动所必需的能量,其含量变化能较好地反映贝类的生命状态[5]。活体牡蛎在不同流通阶段ATP含量呈先上升后下降趋势(图1a),牡蛎初始ATP含量较低,为0.944 μmol/g,这可能是离水运输过程中受到低温、饥饿、干露胁迫导致。经24 h暂养净化,ATP含量明显高于净化前水平(P<0.05),可见短期离水的活体牡蛎,在到达销售地通过复水暂养可使机体达到新的活力水平。诱导休眠过程中牡蛎处于逆境胁迫状态,迅速启动自身的应激反应机制调动能量物质以维持机体平衡,因此ATP含量较净化后明显降低(P<0.05),之后随保活时间的延长,ATP含量维持在一个稳定的较低水平(P>0.05)。主要原因是牡蛎处于休眠状态,以无氧呼吸为主,而ATP供能需氧气参与[14],因此在保活阶段ATP含量处于较低的稳定值。Liu Jinyang等[15]发现,虾夷扇贝在无水保活中ATP含量呈缓慢下降趋势,与本研究结果相似。由图1b可知,ADP变化趋势与ATP较为相似,在流通中呈下降趋势,这主要是因为磷酸精氨酸激酶可将ADP转化为ATP为机体供能,使机体在逆境胁迫下保持相对稳定的平衡状态[16]。保活9 d后牡蛎体内ADP含量仍维持在较高水平,可见牡蛎仍保持较高活力品质。
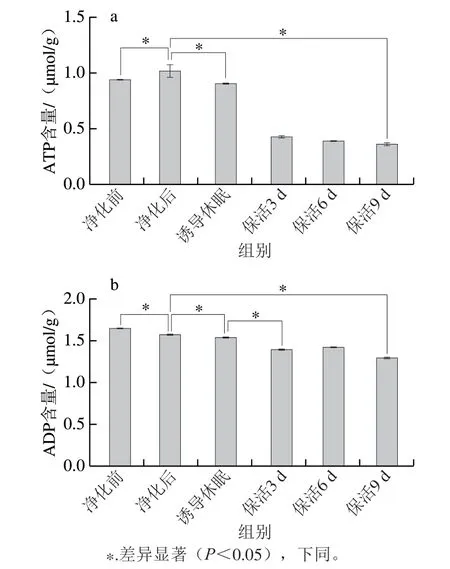
图1 太平洋牡蛎流通过程中ATP(a)、ADP(b)含量变化Fig.1 Changes in ATP (a),and ADP (b) contents in C.gigas during circulation
2.1.2 AEC值
AEC值被认为是描述细胞能量状态的关键指标,其变化能准确反映贝类活力变化[6]。图2显示,太平洋牡蛎暂养净化后AEC值显著高于暂养前水平(P<0.05),保活流通阶段处于稳定的较低值(P>0.05),这主要是由于ATP及ADP大量消耗所致,但在整个流通中牡蛎AEC值均大于50%,根据AEC值与动物生理状态的关系,处于应激胁迫但可恢复状态[5]。可见,牡蛎在长时冰温保活流通过程中仍保持较高的活力品质。在已有研究中,Jiménez-Ruiz等[17]发现长牡蛎在离水运输过程中AEC值呈下降趋势;刘慧慧等[18]研究表明,菲律宾蛤仔在干露胁迫过程中AEC值有所下降,复水处置后其活力明显提升,与本研究结果相似。
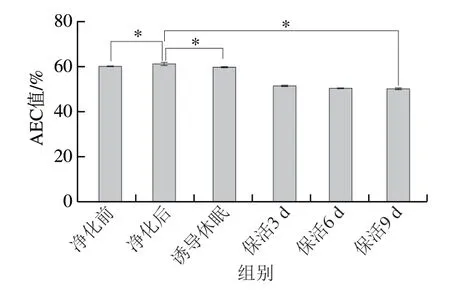
图2 太平洋牡蛎流通过程中AEC值变化Fig.2 Changes in AEC value in C.gigas during circulation
2.1.3 游离氨基酸组成与含量变化
③融资成本高。一般中小企业贷款利率高于市场平均利率水平。为弥补和防范贷款风险,很少选用信用贷款的方式。最常见的做法是把贷款利率在基准利率基础上上浮一定比例,用额外的利息收入去平衡无法收回的贷款。以及,在融资过程中,中间环节繁琐,费用过高,这些因素都增加了中小企业经营成本,影响了中小企业的利润。
游离氨基酸在贝类应对逆境胁迫的能量代谢响应中起关键作用[19],太平洋牡蛎不同流通阶段游离氨基酸含量变化见表1。活体牡蛎肌肉组织共检测出24 种游离氨基酸,其中含量最高的为Ala,其次是Trp、Glu、Arg、Asp、Gly。由图3可以看出,净化前与净化后的牡蛎在同一分类分支上,表明其氨基酸无显著差异;诱导休眠后至保活3、6、9 d分别在3 个不同分类分支上,表明牡蛎在流通阶段氨基酸含量差异明显。结合表1分析,暂养净化期间,牡蛎体内12 种氨基酸(Asp、Glu、Ser、Arg、Ala、Gly、Cit、Arg、Ala、Lys、Hyp、Pro)较净化前增加,提示牡蛎活力恢复,低温诱导休眠至保活终期,氨基酸含量随保活时间的延长缓慢下降,这一现象在菲律宾蛤仔[10]、虾夷扇贝[20]无水流通中也有报道,表明游离氨基酸可作为能源,以响应机体在无水保活流通中复杂的环境变化,如:温度波动、饥饿、缺氧等。
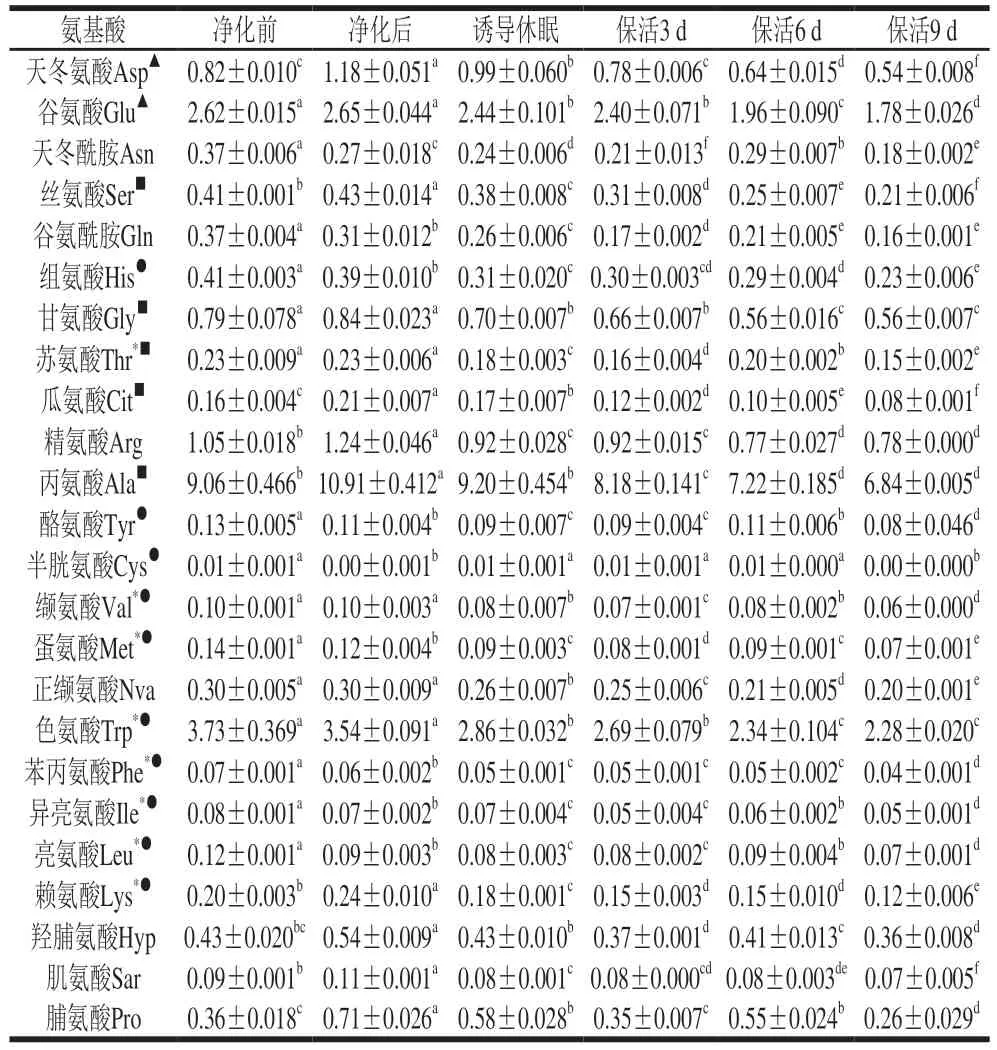
表1 太平洋牡蛎流通过程中游离氨基酸含量变化Table 1 Changes in free amino acid contents of C.gigas during circulation mg/g
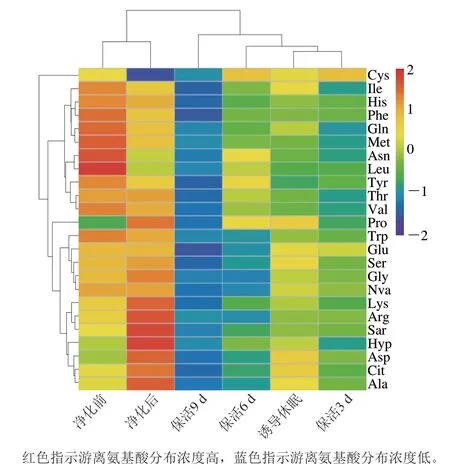
图3 太平洋牡蛎流通过程中游离氨基酸含量变化热图Fig.3 Heat map of changes in free amino acid contents of C.gigas during circulation
如图4所示,与净化前相比,牡蛎在净化后总游离氨基酸(total free amino acids,TFAA)、必需氨基酸(essential amino acids,EAA)、非必需氨基酸(nonessential amino acids,NEAA)均呈明显上升趋势,这可能是由于牡蛎离水后长时处于干露状态,需消耗大量能量物质以维持机体平衡,复水净化后,其胁迫解除,活力恢复,游离氨基酸总量明显提升;诱导休眠后其总量低于净化后水平,之后随着保活时间的延长,总含量变化与保活时间呈负相关,主要原因是牡蛎长时处于低温应激胁迫状态,能量代谢从而导致游离氨基酸总量进一步降低。对比TFAA、EAA、NEAA含量变化可知,NEAA在流通过程中变化趋势明显快于EAA,与Fan Xiuping等[19]对珍珠龙胆石斑鱼在冷胁迫过程中NEAA变化趋势相似,推测NEAA在活体牡蛎流通过程中能量消耗起着关键作用,而EAA则可能用于合成应激胁迫下所必需的化合物。
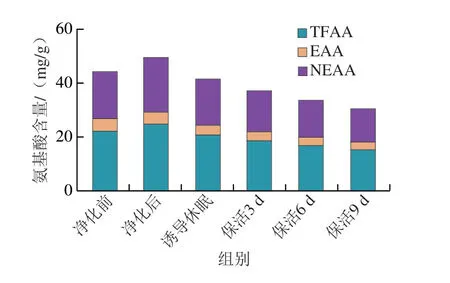
图4 太平洋牡蛎流通过程中TFAA、EAA、NEAA含量变化Fig.4 Changes in TFAA,EAA and NEAA contents in C.gigas during circulation
2.2 呈味物质含量变化
2.2.1 呈味氨基酸含量变化
将表1中游离氨基酸按呈味特性划分为鲜味氨基酸(delicious amino acid,DAA)、甜味氨基酸(sweet amino acid,SAA)和苦味氨基酸(bitter amino acid,BAA)。由图5可知,牡蛎在流通过程中SAA>DAA和BAA,SAA为活体牡蛎中主要呈味物质,含量占60%以上。结合图4氨基酸组成变化分析,DAA、SAA和BAA含量变化与TFAA变化基本一致,牡蛎通过暂养净化DAA(Asp、Glu)、SAA(Ser、Gly、Thr、Ala、Cit)愉悦性呈味物质明显提升,同时BAA(His、Tyr、Cys、Met、Trp、Phe、Ile、Leu、Lys)非愉悦性呈味物质显著降低。采捕后的牡蛎肠道中含有大量未排出的粪便、食物残渣、泥沙等物质,这些残留物通常被认为是牡蛎不良口感及土腥味的来源,可见通过暂养净化牡蛎鲜甜滋味得到明显改善[21-22]。保活流通阶段,牡蛎整体呈味氨基酸下降明显,表明在长时低温流通过程中对牡蛎风味造成了一定影响。步营等[7]在对珍珠龙胆石斑鱼在无水保活实验中发现,苦味氨基酸随着流通时间的延长而不断升高,这与本研究结果相反,可能是物种间差异、保活方式及流通时间不同有关。
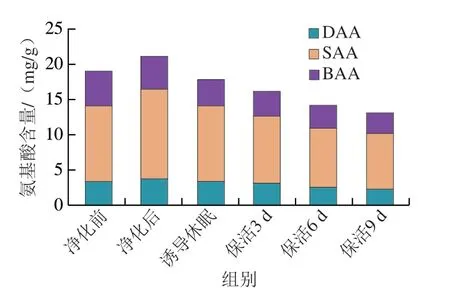
图5 太平洋牡蛎流通过程中DAA、SAA、BAA氨基酸含量变化Fig.5 Changes in DAA,SAA and BAA amino acid contents in C.gigas during circulation
2.2.2 呈味核苷酸含量变化
呈味核苷酸是评价贝类滋味的重要指标,牡蛎在低温胁迫下机体由耗氧呼吸转变成无氧呼吸,ATP迅速被分解为ADP→AMP→IMP→HxR→Hx,而这些分解产物影响牡蛎的口感和风味。其中IMP具有重要的呈鲜味作用,与天冬氨酸、谷氨酸之间存在协同效应,而AMP有抑制苦味的特性,与IMP在诱导鲜甜味方面存在协同作用,当IMP含量较低时,会赋予其鲜美味道并能增加甜味[23]。太平洋牡蛎在不同流通阶段AMP及IMP均能检出,且AMP、IMP随着流通时间的延长呈缓慢积累特征(图6a、b)。结合图1分析,这可能是长时饥饿及低温胁迫导致牡蛎机体代谢发生显著变化,ATP、ADP发生降解,最终导致AMP与IMP的积聚,从而提升牡蛎的鲜甜滋味。大量研究已证实,无水保活有利于机体鲜甜味核苷酸的积累,如:虾夷扇贝[20]在无水保活24 h后,肌肉中的IMP含量显著增加;大菱鲆(Scophthalmus maximus)[23]在无水保活18 h后,AMP与IMP仍维持在较高水平。
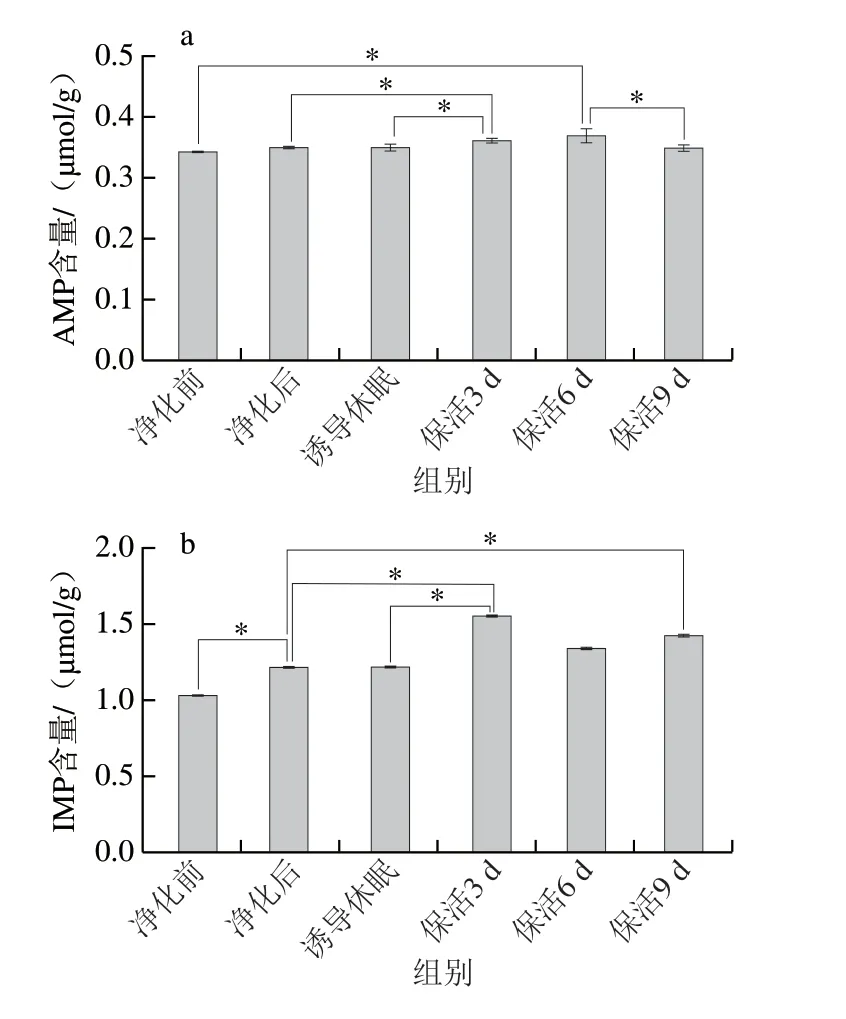
图6 太平洋牡蛎流通过程中AMP(a)、IMP(b)含量变化Fig.6 Changes in AMP (a) and IMP (b) contents in C.gigas during circulation
有机酸是水产贝类滋味的重要组成部分,其中乳酸、琥珀酸、苹果酸已被鉴定存在于活体牡蛎中[24],乳酸是反映机体能量代谢的关键指标,也对鲜味有增强作用;苹果酸呈略带果香的酸味,而琥珀酸是贝类中主要呈鲜味的有机酸,来源于贝体内丰富的糖原及氨基酸降解生成。由图7可知,太平洋牡蛎在不同流通阶段乳酸、琥珀酸及苹果酸均能检出;牡蛎在暂养净化后乳酸含量显著高于净化前水平(P<0.05),诱导休眠至保活终期呈下降趋势(P<0.05),推测原因是牡蛎复水后由无氧呼吸转为耗氧呼吸,糖分解代谢乳酸则增加,无水保活过程中低温条件下牡蛎呼吸及能量代谢减弱,导致乳酸的积聚减少。而苹果酸及琥珀酸在净化后降低(P<0.05),在保活流通阶段,随着保活时间的延长而缓慢增加(P<0.05),这可能是牡蛎在保活初期,呼吸代谢旺盛导致箱体内产生大量二氧化碳,随着时间的延长从而抑制了机体呼吸,最终导致牡蛎组织中酸鲜味明显增加。有机酸总量在整个流通阶段呈波动下降趋势,但始终维持在110 mg/100 g以上水平,整体而言,牡蛎在长时保活流通过程中滋味未发生明显变化,仍处于鲜活状态。
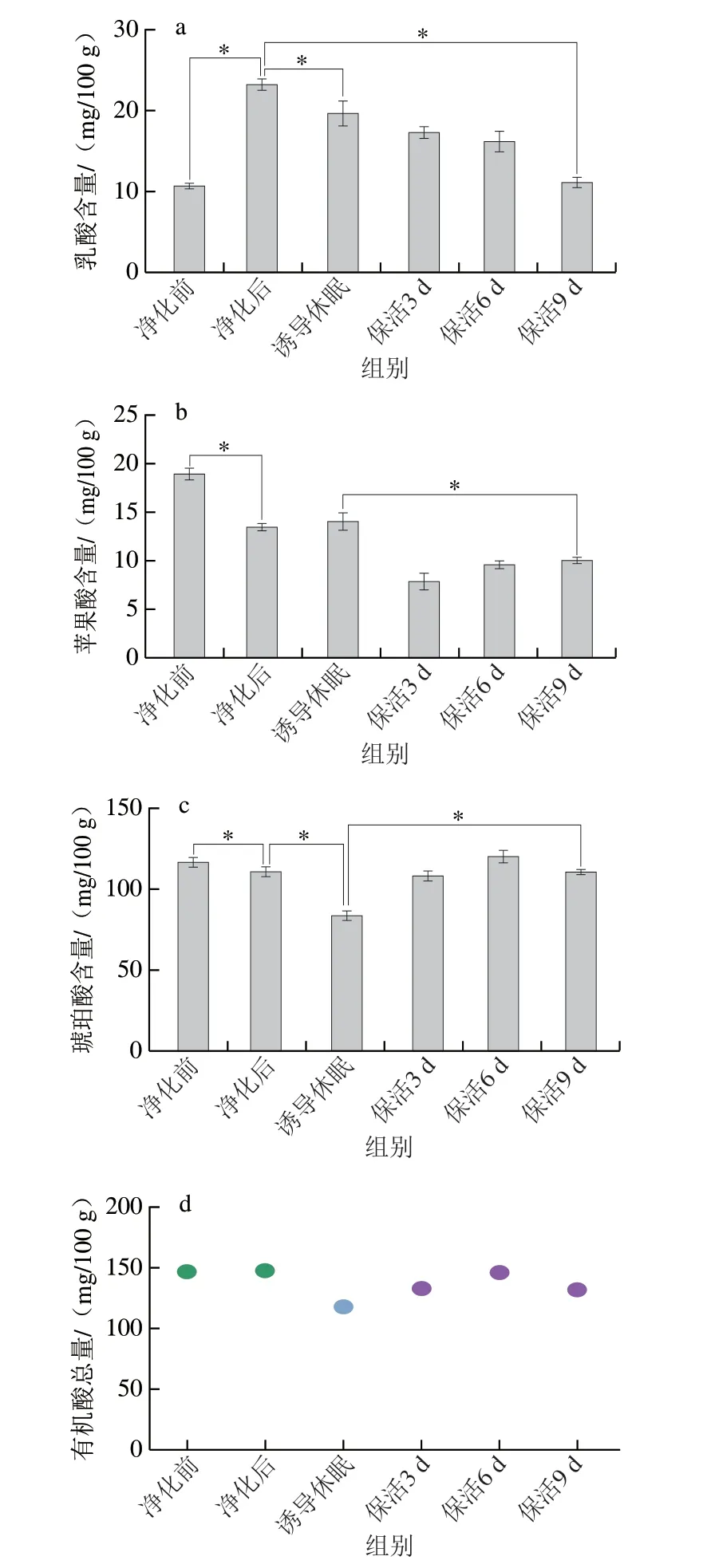
图7 太平洋牡蛎流通过程中乳酸(a)、苹果酸(b)、琥珀酸(c)、有机酸总量(d)变化Fig.7 Changes in amounts of lactic acid (a),malic acid (b),succinic acid (c),and total organic acids (d) in C.gigas during circulation
2.2.4 无机离子含量变化
无机离子是贝类中不可缺少的呈味辅助剂及鲜味增强剂,研究表明Na+、K+、Cl-、Mg2+等离子被确认为对牡蛎的呈味起关键作用[25]。如:Na+具有浓烈的咸味,对甜、咸、鲜味有增强作用;Cl-可抑制酸味并提高鲜甜味;而K+的缺失会降低贝类的总体风味[26]。如图8所示,活体牡蛎中共检测出Na+、K+、Cl-、Mg2+、Ca2+,其中Na+、K+含量最高,其次是Ca2+、Mg2+、Cl-离子。在整个流通阶段除Ca2+损失较大外,其他离子变化不大甚至高于初始水平,可见其在长时保活流通过程中整体风味未发生明显改变,仍处于鲜活状态。与本研究结果相似的是,罗非鱼[8]在无水保活中无机离子损失量低于有水保活;珍珠龙胆石斑鱼[27]在模拟运输过程中无机离子损耗较低;近江牡蛎(Crassostrea rivularis)[28]在生态冰温保活9 d后Ca2+损耗较大。
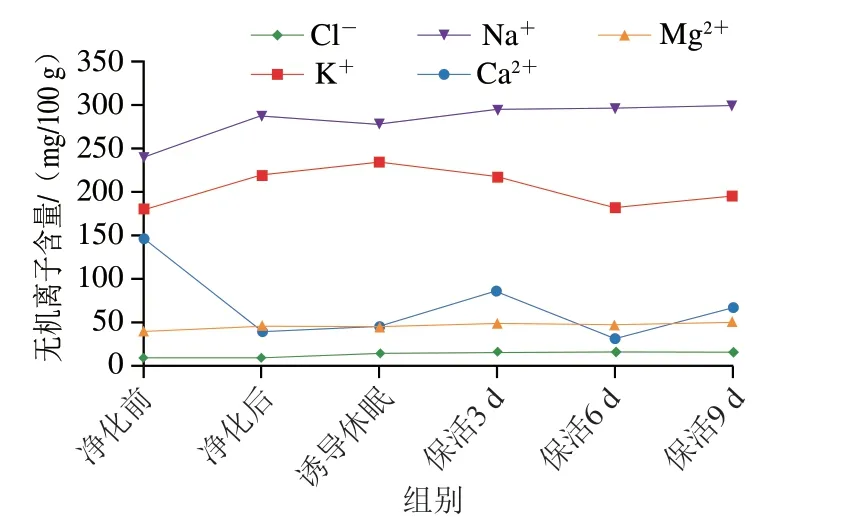
图8 太平洋牡蛎流通过程中无机离子含量变化Fig.8 Changes in mineral ion contents of C.gigas during circulation
2.2.5 滋味物质的呈味强度评价
太平洋牡蛎中呈味物质的组成、含量、阈值共同作用下使其表现出一定的滋味,而这些滋味物质的呈味强度通常以TAV评价,其中TAV大于1表明该物质对样品的呈味有较大贡献,反之则贡献较小[13]。牡蛎流通过程中滋味物质的呈味作用及TAV见表2。活体牡蛎在整个流通期内Asp、Glu、Arg、Ala、IMP、乳酸、琥珀酸、Na+、K+TAV大于1,可见这几种化合物对活体牡蛎的呈味有显著影响。虽然其他游离氨基酸、核苷酸、有机酸、无机离子的TAV均小于1,但它们之间具有协同增效作用,如,Glu、Asp与IMP协同作用下能增强贝类鲜味,也可以改善甜味及增加整体风味[23];此外,一些苦味氨基酸其含量低于阈值时,可以增强鲜味和甜味氨基酸的呈味强度[29]。
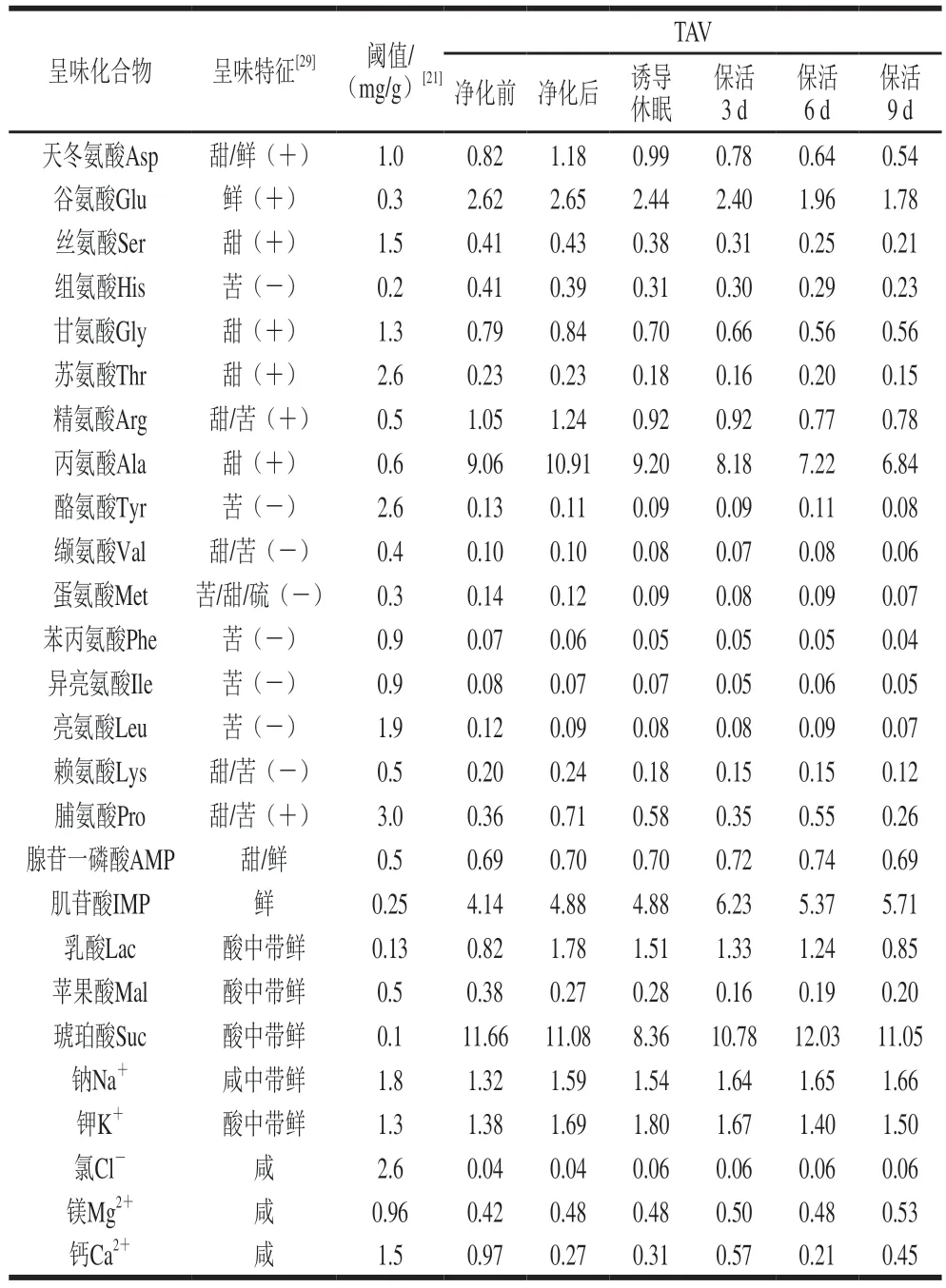
表2 太平洋牡蛎流通过程中滋味物质的呈味作用及TAVTable 2 Taste characteristics and TAV of taste substances in C.gigas during circulation
3 结论
太平洋牡蛎采捕后运输及环境胁迫对其活力品质、呈味物质均有显著影响,通过24 h暂养净化,机体活力及风味物质呈明显的恢复性,牡蛎鲜甜滋味得到明显改善;诱导休眠至保活流通终期,牡蛎遭受低温及缺氧胁迫,需调动更多能量物质以维持机体平衡,ATP、AEC值处于稳定的较低水平,游离氨基酸总量呈下降趋势;呈味化合物中AMP、IMP出现累积特征,有机酸、无机离子呈波动下降趋势,但呈味物质未发生整体性改变。由此得出结论,太平洋牡蛎采捕后在“暂养净化24 h-梯度降温诱导休眠-生态冰温保活9 d”模式下可维持较高的活力及风味品质。

