5 种食用菌水提物生物活性的比较
韩明月,李 俐,郝利民,王小龙,江庆伍,李 雪,刘可可,刘永奇,伊娟娟,*,鲁吉珂,*
(1.郑州大学生命科学学院,河南 郑州 450001;2.中国人民解放军军事科学院系统工程研究院,北京 100010;3.河南省银丰生物工程技术有限公司,河南 郑州 450001;4.安徽金寨乔康药业有限公司,安徽 六安 237300)
食用菌通称为蘑菇,是一类可供食用、子实体硕大的真菌[1]。食用菌营养物质丰富,含有多种对人体有益的活性成分,包括酚类化合物、萜类化合物、黄酮类化合物、多糖类化合物等,相应展现出多种生物学功能,如抗氧化、免疫调节及辐射防护等作用[2-3]。
在生物体内自由基的生成和清除通常处于动态平衡状态,自由基过剩将会对机体造成一定程度的氧化损伤,进而诱导衰老、癌症、肝损伤、心血管等疾病[4-5]。免疫系统是机体抵抗各种病原微生物,如细菌、病毒和寄生虫等的主要防御系统。机体在发挥免疫应答时不仅依赖于胸腺、脾脏等免疫器官,还依赖于淋巴细胞、巨噬细胞等免疫细胞进而发挥免疫调节作用[6]。随着核能技术的广泛应用,人类经常暴露于各种各样的电离辐射中。但电离辐射会对机体的免疫、造血、生殖等系统造成不同程度的氧化损伤[7],天然辐射防护剂的开发在来源、效用、成本及安全等方面具有特殊的优势,对人类健康具有十分重要的意义。
食用菌具有开发成天然抗氧化剂、免疫调节剂和辐射防护剂的潜力,本研究以草菇、灰树花、红菇、鸡腿菇、树舌5 种食用菌水提物为实验材料,通过生物活性对比研究筛选出活性较高的食用菌水提物,为天然抗氧化剂和辐射防护剂的开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
草菇水提物(water extracts ofVolvariellavolvacea,WEVV)、灰树花水提物(water extracts ofGrifolafrondosa,WEGF)、红菇水提物(water extracts ofRussulavinosa Lindblad,WERV)、鸡腿菇水提物(water extracts ofCoprinus comatus,WECC)和树舌水提物(water extracts ofGanoderma applanatum,WEGA)由安徽金寨乔康药业有限公司提供。
考马斯亮蓝G-250 北京鼎国昌盛生物技术有限责任公司;2,2’-联氨-双(3-乙基苯并噻唑-6-磺酸)(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、没食子酸、福林-酚 上海麦克林生化科技有限公司;芦丁 北京索莱宝科技有限公司;铁氰化钾、过硫酸钾 天津致远化学试剂有限公司;三氟乙酸 上海科丰实业有限公司;三氯化铁、硫酸亚铁 天津风船化学试剂科技有限公司;苯酚、抗坏血酸(ascorbic acid,VC)、水杨酸 天津恒兴化学试剂制造有限公司;30%过氧化氢 烟台市双双化工有限公司。以上试剂均为分析纯。
小鼠巨噬细胞系RAW264.7 中国科学院细胞库(上海);小鼠肝细胞系AML-12 南京三生生物技术有限公司;DMEM/F12培养基 美国HyClone公司;DMEM高糖培养基、双抗、地塞米松、胰蛋白酶消化液北京索莱宝科技有限公司;胎牛血清 杭州四季青生物有限公司;脂多糖(lipopolysaccharide,LPS) 中国上海碧云天生物技术有限公司;ITS液体培养基补充剂美国Sigma试剂公司;细胞计数试剂盒(cell counting kit-8,CCK-8) 上海陶术生物科技有限公司。
1.2 仪器与设备
HH-2SC型恒温水浴锅 常州普天仪器制造有限公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;JW-1016型低速离心机 安徽嘉文仪器装备有限公司;CMax Plus滤光片型光吸收酶标仪美谷分子仪器(上海)有限公司;60Co γ辐射装置(200万 Ci) 河南省科学院同位素研究所有限公司;3111型CO2恒温培养箱 美国Thermo公司;QL-902型旋涡混合器 海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 食用菌水提物中总糖质量分数的测定
采用苯酚硫酸法测定食用菌水提物中总糖质量分数[8]。以葡萄糖质量浓度为横坐标、490 nm波长处的吸光度为纵坐标,绘制标准曲线y=13.435x-0.023 7(R2=0.999 7)。
1.3.2 食用菌水提物中总蛋白质量分数的测定
采用考马斯亮蓝法测定食用菌水提物中总蛋白质量分数[9]。以牛血清白蛋白质量浓度为横坐标、样品反应液在595 nm波长处的吸光度为纵坐标,绘制标准曲线y=6.867 1x+0.002 7(R2=0.998 7)。
1.3.3 5 种食用菌水提物中粗多糖质量分数的测定
5 种食用菌水提物经醇沉过夜,4 000 r/min离心10 min获得粗多糖沉淀,将沉淀溶解定容,并参照出入境检验检疫行业标准SN/T 4260—2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》[8]测定样品溶液中的粗多糖质量分数。
1.3.4 食用菌水提物中总酚质量分数的测定
采用福林-酚法检测食用菌水提物中总酚质量分数[10]。以没食子酸为标准品,其质量浓度为横坐标、760 nm 波长处的吸光度为纵坐标,绘制标准曲线y=69.873x+0.002 3(R2=0.999 7)。
1.3.5 食用菌水提物中总黄酮质量分数的测定
采用NaNO2-AlCl3法测定食用菌水提物中总黄酮质量分数[11]。以芦丁作为标准品,其质量浓度为横坐标、510 nm波长处吸光度为纵坐标,绘制标准曲线y=7.577x-0.002 3(R2=0.999 8)。
1.3.6 食用菌水提物的体外抗氧化活性测定
1.3.6.1 ABTS阳离子自由基清除率的测定
采用刘宇琪等[12]的方法测定。7.4 mmol/L的ABTS和2.6 mmol/L的过硫酸钾溶液等体积混合,避光静置12~16 h,用pH 7.4的磷酸缓冲液稀释,使其在734 nm波长下的吸光度在0.70±0.02左右,制成ABTS工作液。取不同质量浓度的食用菌水提物溶液(0.2~1.0 mg/mL)以及VC溶液(0.001~0.005 mg/mL)各1 mL,加6 mL ABTS工作液,混匀并在室温下静置6 min,测定混合液在734 nm波长处的吸光度,以VC为阳性对照,按照公式(1)计算ABTS阳离子自由基清除率。
式中:A0为以等体积蒸馏水代替水提物样品溶液的吸光度;A1为1 mL水提物样品溶液与6 mL ABTS工作液混合的吸光度;A2为以等体积蒸馏水代替ABTS工作液的吸光度。
1.3.6.2 DPPH自由基清除率测定
采用Luan Xiaoxu等[13]方法评估DPPH自由基清除活性并稍作修改。分别将食用菌水提物配制成质量浓度为0.2~1.0 mg/mL的样品溶液,并分别取2 mL样品溶液与2 mL 0.1 mmol/L DPPH-乙醇溶液混匀,静置20 min后,在517 nm波长处测定混合液的吸光度。质量浓度0.2~1.0 mg/mL的VC溶液作为阳性对照组。以2 mL蒸馏水和2 mL无水乙醇混合液作为空白对照。根据公式(2)计算食用菌水提物清除DPPH自由基的能力。
式中:A0为2 mL DPPH溶液与2 mL蒸馏水混合的吸光度;A1为2 mL DPPH溶液与2 mL水提物样品溶液混合的吸光度;A2为2 mL无水乙醇溶液与2 mL水提物样品溶液混合的吸光度。
1.3.6.3 羟自由基清除率的测定
参照Zhang Tao等[14]方法并稍作改进。取不同质量浓度的食用菌水提物(1.0~5.0 mg/mL)及VC溶液(0.1~0.5 mg/mL)各1 mL,依次加入1 mL 5 mmol/L FeSO4溶液、1 mL蒸馏水、1 mL 5 mmol/L水杨酸-乙醇溶液及1 mL 5 mmol/L H2O2溶液,混合均匀,37 ℃下放置30 min,测定510 nm波长处的吸光度,以VC为阳性对照,按公式(3)计算羟自由基清除率。
式中:A0为等体积蒸馏水代替水提物样品溶液的吸光度;A1为水提物样品溶液的吸光度;A2为等体积蒸馏水代替H2O2溶液的吸光度。
1.3.6.4 总还原力测定
根据Zhang Jingjing等[15]的方法并稍作修改,进行总还原力测定。分别取2 mL不同质量浓度食用菌水提物溶液(0.2~1.0 mg/mL),依次加入2 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和2 mL质量分数1%铁氰化钾溶液,混合均匀,50 ℃下静置20 min,加入2 mL质量分数10%三氟乙酸终止反应,3 000 r/min离心10 min,取2 mL上清液与2 mL蒸馏水、0.4 mL质量分数0.1% FeCl3溶液混合均匀,50 ℃下静置10 min,检测混合液700 nm波长处的吸光度,以吸光度表征总还原力的强弱。以蒸馏水为空白对照。以质量浓度0.001~0.005 mg/mL的VC溶液为阳性对照。
1.3.7 食用菌水提物的体外免疫活性检测
采用CCK-8法检测RAW264.7细胞增殖活性[16]。取生长状态良好的RAW264.7细胞制备单细胞悬液,血球计数板计数,以1×104个/孔的细胞浓度接种于96 孔板中,过夜培养巨噬细胞使其充分贴壁。次日,5 种食用菌水提物(质量浓度10~200 μg/mL)分别作用于RAW264.7巨噬细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)组和LPS(质量浓度1 μg/mL)组分别作为阴性对照和阳性对照,每个实验组做5 个重复孔,于37 ℃、体积分数5% CO2的细胞培养箱中继续培养24 h。
24 h之后,弃去96 孔板中的细胞培养液,并避光配制含体积分数10%胎牛血清和10% CCK-8溶液的DMEM培养基,每孔避光加入110 μL,于37 ℃、体积分数5% CO2的细胞培养箱中孵育1~4 h。使用酶标仪测定450 nm波长处吸光度,并按公式(4)计算细胞存活率。
式中:A0为CCK-8溶液吸光度;A1为阴性对照孔的吸光度;A2为样品孔的吸光度。
1.3.8 食用菌水提物的体外抗辐射活性检测
将小鼠正常肝细胞AML-12在含有体积分数10%胎牛血清、1%青霉素-链霉素、1% ITS液体培养基补充剂和质量浓度40 ng/mL地塞米松的DMEM/F12培养基中培养。
1.3.8.1 AML-12细胞毒性实验
采用CCK-8方法检测5 种食用菌水提物对AML-12细胞活力的影响[17-18]。取生长状态良好的AML-12细胞制备细胞悬液,按照约5 000 个/孔加入96 孔板中,于体积分数5% CO2的细胞培养箱中培养12 h。加入10 μL不同质量浓度的样品,刺激AML-12细胞,PBS组作为阴性对照,每个实验组做5 个重复孔,继续培养36 h,弃去96 孔板中的细胞培养液,并避光配制含体积分数10%胎牛血清和10% CCK-8溶液的DMEM/F12培养基,每孔避光加入110 μL,于37 ℃、体积分数5% CO2的细胞培养箱中孵育1~4 h。使用酶标仪测定450 nm波长处吸光度,并按公式(5)计算细胞存活率。
式中:A0为CCK-8溶液吸光度;A1为阴性对照孔的吸光度;A2为样品孔的吸光度。
1.3.8.2 辐射防护实验
通过60Co γ照射建立肝细胞AML-12辐射损伤模型,并采用CCK-8方法检测5 种食用菌水提物对AML-12细胞的放射保护作用[17-18]。AML-12细胞培养步骤与1.3.8.1节相同。当样品作用于细胞后于体积分数5% CO2的细胞培养箱中培养12 h,然后对细胞进行60Co γ射线辐射处理,辐射剂量为6 Gy,剂量率为2 Gy/min。以辐照后的PBS组作为模型(model control,MC)组。培养24 h后,弃去96 孔板中的细胞培养液,并避光配制含体积分数10%胎牛血清和10% CCK-8溶液的DMEM/F12培养基,每孔避光加入110 μL,于37 ℃、体积分数5% CO2的细胞培养箱中孵育1~4 h。使用酶标仪测定450 nm波长处吸光度,并按公式(6)计算细胞存活率。
式中:A0为CCK-8溶液吸光度;A1为未辐照阴性对照孔的吸光度;A2为样品孔吸光度。
1.4 数据处理与分析
所有实验数据采用GraphPad Prism 8.0.2软件进行统计学分析,结果表示为平均值±标准差。采用单因素方差分析进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著,P<0.001表示差异高度显著。
2 结果与分析
2.1 5 种食用菌水提物中总糖、总蛋白、粗多糖、总酚及总黄酮的质量分数
为了探究5 种食用菌水提物的主要成分,对其总糖、总蛋白、粗多糖、总酚及总黄酮质量分数进行测定及对比,结果见表1。5 种食用菌水提物的总糖质量分数均超过50%以上,其中WECC和WEVV总糖质量分数最高,分别为(84.87±7.31)%和(80.90±1.20)%,表明糖类组分在5 种食用菌水提物中的占比较大。WEGA和WEGF总蛋白质量分数分别为(2.50±0.05)%和(1.06±0.03)%,其余水提物的总蛋白质量分数均较低。为了探究水提物中多糖的含量,将5 种食用菌水提物经醇沉得到的粗多糖进行测定,结果显示,5 种食用菌水提物中WEGF的粗多糖质量分数最高,其粗多糖质量分数为(61.28±2.95)%。值得注意的是,WEGA的总酚、总黄酮质量分数均高于其余食用菌水提物,分别为(2.62±0.01)%和(3.03±0.02)%。以上研究结果初步显示,5 种食用菌水提物均含有一定含量的活性成分,而糖类化合物是该5 种食用菌水提物的主要成分。已有报道表明,食用菌多糖具有抗氧化[19]、抗辐射[20]、降血糖[21]、降血脂[22]及增强免疫力[23]等多种生物活性。因而,有必要对这5 种食用菌水提物的生物活性进行进一步的探究。

表1 5 种食用菌水提物中总糖、总蛋白、粗多糖、总酚及总黄酮质量分数Table 1 Contents of total sugar,total proteins,crude polysaccharides,total phenols and total flavonoids in water extracts from five edible mushrooms
2.2 食用菌水提物的体外抗氧化活性
2.2.1 ABTS阳离子自由基清除能力测定结果
ABTS阳离子自由基是由ABTS与过硫酸钾发生氧化反应生成的,呈现蓝绿色,并在734 nm波长下有特征吸收峰。当向ABTS阳离子自由基中补充自由基清除剂后,蓝绿色变淡,其吸光度也会随着抗氧化剂的抗氧化能力的增加而降低。因而,ABTS阳离子自由基清除率可以作为评价样品抗氧化能力的重要指标[24]。如图1所示,阳性对照VC及5 种食用菌水提物对ABTS阳离子自由基均具有清除能力。在样品质量浓度为1 mg/mL时,WEGA、WEGF、WERV、WEVV、WECC对ABTS阳离子自由基的清除率分别为(99.78±0.10)%、(71.43±0.67)%、(65.54±0.92)%、(40.47±0.44)%和(38.58±0.42)%,其中WEGA对ABTS阳离子自由基清除能力最强。据Shi Min等[25]从豆腐渣发酵的灵芝中提取4 种多糖,灵芝多糖组分4(Ganoderma lucidumpolysaccharide-IV,GLP-IV)对ABTS阳离子自由基的清除活性最高,其质量浓度为5 mg/mL时清除率为98.68%。与GLP-IV相比,质量浓度1 mg/mL的WEGA对ABTS阳离子自由基的清除率高于质量浓度5 mg/mL的GLP-IV,表现出较高的抗氧化活性。综上所述,WEGA对ABTS阳离子自由基清除能力较高。

图1 5 种食用菌水提物对ABTS阳离子自由基的清除能力Fig.1 2,2’-Azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid (ABTS)cation radical scavenging capacity of water extracts from fvie edible mushrooms
2.2.2 DPPH自由基清除能力测定结果
DPPH自由基乙醇溶液呈紫色,当加入具有清除自由基能力的样品时,能够使得DPPH自由基的孤对电子被配对,原本紫色的DPPH自由基乙醇溶液颜色变浅,根据颜色变浅的程度可以判断样品抗氧化能力的大小[26]。如图2所示,阳性对照VC及5 种食用菌水提物的质量浓度与DPPH自由基的清除能力呈正相关。在0.2~1.0 mg/mL食用菌水提物质量浓度范围内,WEGA的DPPH自由基清除率均高于其他4 种食用菌水提物,但低于阳性对照VC的DPPH自由基清除率。在样品质量浓度为1.0 mg/mL时,5 种食用菌水提物的DPPH自由基清除率分别为WEGA(88.36±0.30)%、WEGF(85.37±0.41)%、WERV(62.81±0.39)%、WEVV(59.69±0.63)%、WECC(54.85±0.23)%。其中WEGA对DPPH自由基清除率最高,且高于真空技术提取的香菇多糖对DPPH自由基的清除率(低于50%)[27]。总的来说,5 种食用菌水提物中WEGA对DPPH自由基的清除能力最好。

图2 5 种食用菌水提物对DPPH自由基的清除能力Fig.2 1,1-Diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity of water extracts from five edible mushrooms
2.2.3 羟自由基清除能力测定结果
在已知的自由基中,羟自由基的氧化能力比较强,其氧化能力可以对几乎所有的生物大分子如核酸、蛋白质、糖类等造成氧化损伤,因而测定样品对羟自由基的清除能力具有十分重要的意义[28]。如图3所示,当VC质量浓度0.5 mg/mL时,其羟自由基清除率为(68.92±5.89)%,高于5 种食用菌水提物的羟自由基的清除能力。5 种食用菌水提物对羟自由基的清除能力均呈现浓度依赖性增加。但与DPPH自由基清除能力相比,5 种食用菌水提物对羟自由基的清除作用较弱。在1~5 mg/mL的质量浓度范围内,WEGA的羟自由基清除活性高于其他食用菌。在质量浓度为5 mg/mL时,WEGA羟自由基清除率达到最大,为(33.44±0.07)%,并高于从平菇子实体中分离出的两种多糖组分PSPO-1a和PSPO-4a对羟自由基的清除能力,PSPO-1a和PSPO-4a的清除率均低于25%[29]。结果表明WEGA是一种潜在的羟自由基清除剂。


图3 5 种食用菌水提物对羟自由基的清除能力Fig.3 Hydroxyl radical scavenging capacity of water extracts from five edible mushrooms
2.2.4 总还原力测定结果
抗氧化剂是通过自身的还原作用清除自由基,表现为还原能力越强,抗氧化能力越强,因此可以通过还原能力的大小判断其抗氧化水平的高低。如图4所示,每种食用菌水提物的总还原能力均随着样品质量浓度增加,呈现剂量依赖性增强。在0.2~1.0 mg/mL的质量浓度范围内,WEGA的总还原能力高于其他食用菌水提物。5 种食用菌水提物总还原能力的大小依次为WEGA>WERV>WEGF>WEVV>WECC。结果表明WEGA比其他4 种食用菌水提物具有更强的总还原能力。
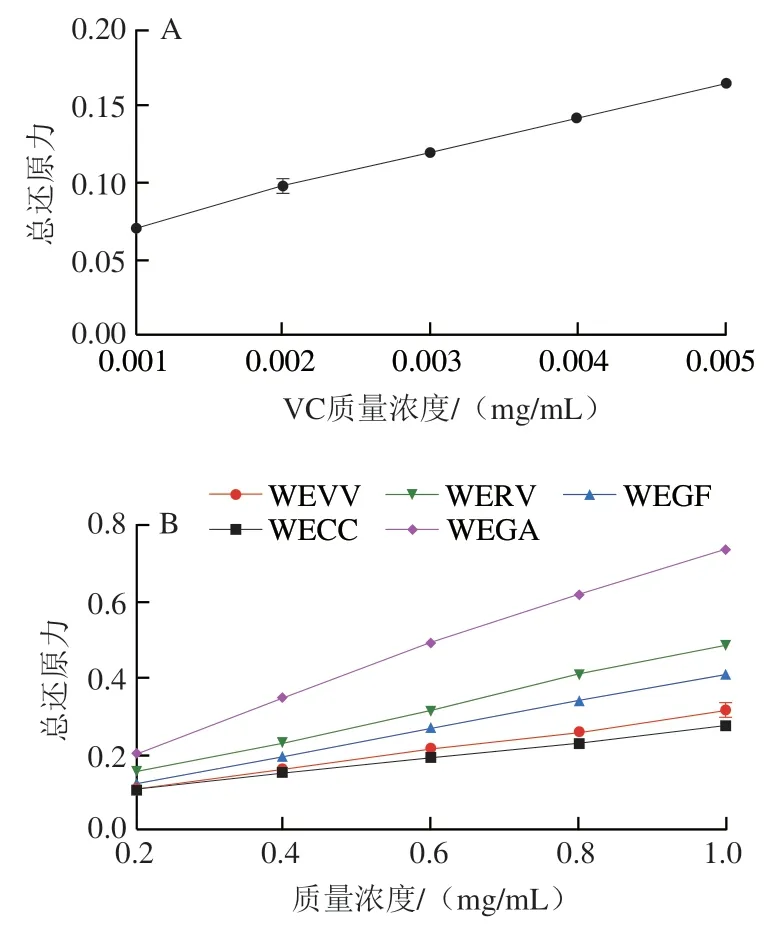
图4 5 种食用菌水提物的总还原力Fig.4 Total reducing power of water extracts from five edible mushrooms
2.3 食用菌水提物的体外免疫活性分析结果
巨噬细胞在机体免疫系统中占有非常重要的地位,其体外增殖能力可以作为评价生物活性化合物免疫调节作用的指标[30-31]。如图5所示,在实验质量浓度范围内,与阴性对照组相比,WECC和WEVV对巨噬细胞增殖具有较弱的促进作用。当样品质量浓度在40~200 μg/mL时,WERV对巨噬细胞增殖有剂量依赖性抑制作用。WEGF在10~160 μg/mL时对巨噬细胞的促增殖作用与质量浓度呈正相关,这一结果与Ma Xiaolei等[32]报道的灰树花多糖组分GFP-A对巨噬细胞的增殖活性的趋势一致。并且当WEGF质量浓度在80~200 μg/mL时,WEGF与其他4 种食用菌水提物相比,对巨噬细胞增殖促进能力最强。当质量浓度为10 μg/mL时,5 种食用菌水提物中WEGA对巨噬细胞增殖促进能力最强,并与阳性对照作用相当。综上所述,WEGA具有较好的免疫调节活性。已有报道表明树舌多糖具有免疫调节活性[33],与本研究结果相一致。

图5 5 种食用菌水提物对RAW264.7细胞活力的影响Fig.5 Effects of water extracts from five edible mushrooms on RAW264.7 cell viability
2.4 食用菌水提物的体外抗辐射活性
电离辐射是能引起一切物质电离的总称[34]。电离辐射会对机体造成直接和间接的伤害,严重危害人类身体健康[35]。肝脏是生物体的重要代谢器官,电离辐射也会对肝脏造成损伤[17,36]。因此,60Co γ辐射氧化损伤的小鼠肝细胞AML-12可以作为评价生物活性化合物的辐射防护作用的细胞模型。
如图6A所示,5 种食用菌水提物均能促进AML-12细胞的增殖,并对AML-12细胞无毒性作用。如图6B所示,60Co γ辐射后,与阴性对照组相比,MC组AML-12细胞存活率极显著下降(P<0.01)。WEGF在质量浓度80~200 μg/mL时,能够改善AML-12细胞存活率的下降,但改善作用较弱。与MC组相比,WECC和WERV在质量浓度10~200 μg/mL范围内均能改善辐射所致的肝细胞AML-12的损伤,但随质量浓度的增加WECC对AML-12细胞的辐射防护作用逐渐下降。在质量浓度10~200 μg/mL范围内,与其余4 种食用菌水提物相比,WEVV能够明显改善电离辐射导致的AML-12细胞存活率下降。WEGA在低质量浓度(10~40 μg/mL)时对肝细胞AML-12细胞存活率下降表现出显著的改善作用(P<0.05、P<0.01)。因而,WEGA、WEVV、WECC和WERV均可作为天然的辐射防护剂进行开发利用。此外,课题组前期采用AML-12细胞进行辐射防护作用研究时,发现布拉氏酵母发酵的山药多糖对60Co γ射线诱导的AML-12细胞损伤表现出较好的辐射防护作用[18]。而本研究水提物主要组分分析显示,糖类是5 种食用菌水提物的主要成分,由此推测多糖可能是食用菌水提物发挥辐射防护作用的主要因素,值得进一步探究。

图6 5 种食用菌水提物对AML-12细胞活力的影响Fig.6 Effects of water extracts from five edible mushrooms on AML-12 cell viability
3 讨论
近些年来,关于食用菌生物活性的研究备受科研工作者的关注,食用菌中的功能性成分已成为天然药物资源开发的领域之一[37]。目前,关于食用菌生物活性方面的研究,主要是针对单种食用菌的生物活性进行研究。本研究选用草菇、灰树花、红菇、鸡腿菇、树舌5 种食用菌水提物为研究对象,进行主要成分分析及生物活性比较,结果发现5 种食用菌水提物均具有一定的抗氧化活性、免疫活性和辐射防护作用,这可能与5 种食用菌水提物富含糖类化合物相关。WEGA的还原能力、DPPH自由基清除率、羟自由基清除率和ABTS阳离子自由基清除率均高于WEVV、WEGF、WERV、WECC,特别是当WEGA质量浓度为1 mg/mL时,WEGA对ABTS阳离子自由基清除率高达(99.78±0.10)%,表明其是天然抗氧化功能食品开发的良好原料来源。
同时,5 种食用菌水提物的体外免疫活性结果显示,低质量浓度(10 μg/mL)时,WEGA对巨噬细胞的促增殖能力强于其他食用菌水提物;在实验质量浓度范围内(10~160 μg/mL),WEGF对巨噬细胞表现出剂量依赖性的促增殖效果。此外,5 种食用菌水提物对60Co γ辐射下的肝细胞AML-12辐射防护结果显示,WEVV的辐射防护作用较强;WEGA的抗辐射活性结果与其体外免疫活性结果相似,在低质量浓度(10~40 μg/mL)时明显改善电离辐射导致的肝细胞AML-12的损伤。综合比较,WEGA具有较好的抗氧化、免疫及抗辐射活性,本实验结果可为WEGA相关功能产品的开发提供新的思路。

