纳米二氧化钛对小鼠亚慢性暴露的肠道微生物组和代谢组关联分析
赵化冰,杨 晨,常慧敏,史婷婷,张冰洁,谭有兰,李凤珠,王洪彬,路福平,*
(1.天津科技大学 工业发酵微生物教育部重点实验室,天津 300457;2.天津科技大学 天津市工业微生物重点实验室,天津 300457;3.天津科技大学生物工程学院,工业酶国家工程实验室,天津 300457)
二氧化钛(TiO2)因具有高折射率和自然白色,常被作为食品着色剂和风味增强剂添加至糖果、奶制品、酱料、干蔬菜、坚果、种子、汤、芥末、啤酒以及葡萄酒中[1]。我国对于食品中TiO2的最大使用量有着严格的规定(0.05%~1%)[2]。2012年,Weir等研究发现,糖果等含有较高剂量TiO2的食品中,其中约1/3的TiO2粒径属于纳米级别[3]。此外,纳米TiO2因其优良的抗菌活性也常被应用于食品包装领域[4]。随着纳米TiO2应用范围的扩大,人们越来越关注纳米TiO2对人体的潜在危害。
纳米TiO2经口摄入后直接接触肠道,对其造成的影响不容小觑。国内外研究均发现纳米TiO2对肠道微生物组成及多样性产生较大影响[5-7]。目前对于这种变化的机制尚不清楚,粪便代谢物可能是影响肠道微生物的关键因素[8]。基于此,本研究采用微生物组学-代谢组学技术,分析纳米TiO2干预后小鼠菌群结构和整体代谢变化规律,探讨纳米TiO2对小鼠肠道微生物影响的作用机制,为纳米材料的生物安全性评价提供参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级别C57BL/6J健康小鼠,雄性,3 周龄,生产许可证号:SCXK(京)2019-0010,由斯贝福(北京)生物技术有限公司提供。动物实验环境为天津杰柯逊生物技术开发有限公司提供的SPF级动物屏障系统。
纳米TiO2(纯度高于99%) 美国Sigma-Aldrich公司;酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 上海酶联生物科技有限公司;血脂相关测定试剂盒 南京建成生物工程公司研究所;4%多聚甲醛 北京索莱宝科技有限公司。
1.2 仪器与设备
超声波细胞破碎仪 宁波新芝生物科技股份有限公司;等离子电感耦合质谱仪 美国Thermo Scientific Forma公司;微波消解仪 奥地利安东帕公司;气相色谱-质谱联用仪、液相色谱-质谱联用仪 美国安捷伦科技有限公司;涡旋振荡器 美国Scientific Industries公司。
1.3 方法
1.3.1 动物模型的建立与分组
C57BL/6J小鼠在环境适应1 周后,被随机分为两组,每组7 只。适应性饲喂1 周后,对照组每天灌胃给予磷酸盐缓冲液(phosphate buffered saline,PBS),实验组按照100 mg/(kgmb·d)[9]剂量灌胃纳米TiO2,将纳米TiO2分散在20 mL PBS中,灌胃体积为0.2 mL,灌胃前用超声波细胞破碎仪超声处理20 min,使其均匀化。灌胃13 周后,以颈椎脱位的方式处死小鼠。
1.3.2 脏器指数的计算
处死小鼠后,取出完整心脏、肝脏、脾脏、肾脏等器官,将其用生理盐水漂洗后用滤纸擦干,称质量,并按下式计算脏器指数。
1.3.3 血清脂质的测定
甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇水平的测定均依照试剂盒说明书操作。
1.3.4 血清细胞因子的测定
白细胞介素6(interleukin-6,IL-6)、白细胞介素10(interleukin-10,IL-10)、活性氧(reactive oxygen species,ROS)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)水平均使用相应ELISA试剂盒检测。
1.3.5 小鼠粪便中Ti含量的测定
对小鼠处死前收集的粪便样品进行Ti含量的测定。称量100 mg上述粪便样品于特氟隆微波消化容器中,加入8 mL体积分数68% HNO3溶液和2 mL体积分数30%H2O2溶液,使用微波消解仪使之完全消解。冷却后,将消化液转移至试管中,稀释至50 mL用于后续含量检测。使用等离子电感耦合质谱测定样品中的Ti含量,以铟(20 ng/mL)作为内标元素。检测限为0.076 ng/mL。
1.3.6 小鼠肠道内容物的菌群分析
处死小鼠前,采用无菌EP管收集小鼠粪便,送至深圳华大基因有限公司进行基因扩增、肠道菌群16S rDNA高通量测序。
1.3.7 小鼠粪便代谢物的非靶向代谢分析
用电子天平称取40 mg小鼠粪便,加入0.5 mL冷却的体积分数80%甲醇溶液,其中含有0.6 μg/mL核糖醇作为内标。使用带有珠子的Precelly 24生物样品均质器,将粪便进行均质化(每20 s中断10 s),重复3 个循环。随后13 500 r/min、4 ℃离心15 min,取300 μL上清液在氮气下干燥。干燥后,将50 μL新鲜制备的盐酸甲氧基胺(含20 mg/mL吡啶)加入干燥的样品中,并于60 ℃孵育30 min。加入30 μLN-甲基-N-(三甲基甲硅烷基)三氟乙酰胺(含体积分数1%三甲基氯硅烷),60 ℃孵育30 min。样本制备好后进行上机分析。
气相色谱-质谱条件:色谱柱HP-5 MS(60 m×0.32 mm,0.25 μm);进样量:1 μL,不分流;进气温度:250 ℃;温度程序:50 ℃维持2 min,10 ℃/min升到250 ℃,维持15 min,再以10 ℃/min升到320 ℃,维持10 min;载气:氦气,1 mL/min恒流;传输线温度:280 ℃。离子源:电子轰击电离源;离子源温度:230 ℃;四极杆温度:150 ℃;扫描范围:50~700m/z。
采用MassHunter定量分析软件包(B.08)的未知物分析(Quant-My-Way)功能对气相色谱-质谱的原始数据进行分析和进一步鉴定。代谢物通过NIST17质谱库鉴定,后执行脚本AllBestHits.Unknows.script,导出cef格式文件进行下一步分析。代谢物差异分析采用Metaboanalyst 5.0数据库(https://www.metaboanalyst.ca/)进行分析,通过总和进行样本归一化,峰面积采用对数转换,为满足方差齐性条件,数据缩放方式优先采用帕累托比例法。
1.4 数据处理与分析
使用SPSS 26.0统计软件进行统计学分析。根据数据情况,采用不假定等方差的独立样本t检验进行两组间比较,数据表示为平均值±标准误。肠道代谢物和微生物区系之间的Spearman’s相关性和热图使用R语言(4.0.5版本)的psych软件包(https://CRAN.R-project.org/package=psych)进行计算和绘制。以P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 纳米TiO2对小鼠脏器指数的影响
机体各项功能运转正常时脏器指数较恒定。脏器指数增大,提示脏器可能发生充血、水肿或者增生等现象;脏器指数减小,则提示可能发生脏器萎缩或者其他病理学的改变。由表1可知,与对照组相比,实验组小鼠心、肝、脾、肺和肾的脏器指数之间差异不显著,表明在现有剂量下口服纳米TiO2颗粒13 周还不足以引起小鼠的器官损伤,但是不能排除器官功能的受损。之前相关的研究中同样发现了脏器指数未发生变化但器官功能受损的现象[10-11]。这可能是暴露方式、剂量不同以及材料本身等差异造成的。

表1 纳米TiO2对小鼠脏器指数的影响Table 1 Effect of nano-TiO2 on organ coefficients in mice
2.2 纳米TiO2对小鼠血脂和血糖水平的影响
纳米TiO2可引起大鼠孕期肠道菌群的改变,使孕鼠空腹血糖水平升高,可能增加孕期妇女患妊娠期糖尿病的风险[12]。如图1所示,摄入纳米TiO2的小鼠血糖浓度显著升高(P=0.032),但对小鼠血脂四项未见显著影响。血糖水平异常的原因一方面可能是纳米TiO2破坏了小肠绒毛结构,减少葡萄糖吸收表面积,从而增加了肝脏血糖摄取、利用和贮存水平;另一方面纳米TiO2引起了小鼠肝脏的内质网应激和ROS的生成量增加,致使胰岛素抵抗,从而导致血糖代谢紊乱[13-15]。
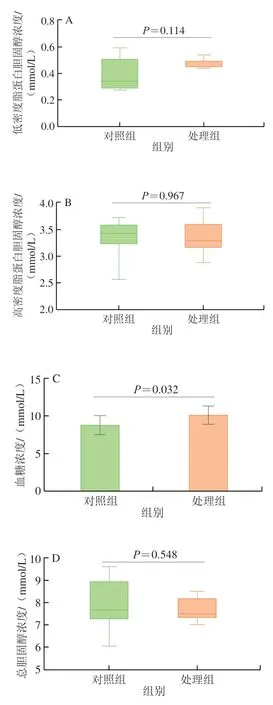

图1 纳米TiO2对小鼠血脂和血糖水平的影响Fig.1 Effect of nano-TiO2 on blood lipid and blood glucose levels
2.3 纳米TiO2对小鼠细胞因子等指标的影响
如图2 所示,与对照组相比,纳米Ti O2处理组的IL-6、IL-10、ROS、T-SOD水平并无显著性差异(P>0.05)。但处理组小鼠血清中促炎细胞因子IL-6和ROS水平有上升趋势,而抗炎细胞因子IL-10和T-SOD水平却呈下降趋势,均朝着对于机体不利的方向发展。纳米TiO2毒性较弱,本研究设置的暴露剂量和时间内并没有对机体造成显著损伤,但是仍然观察到了损伤的趋势。
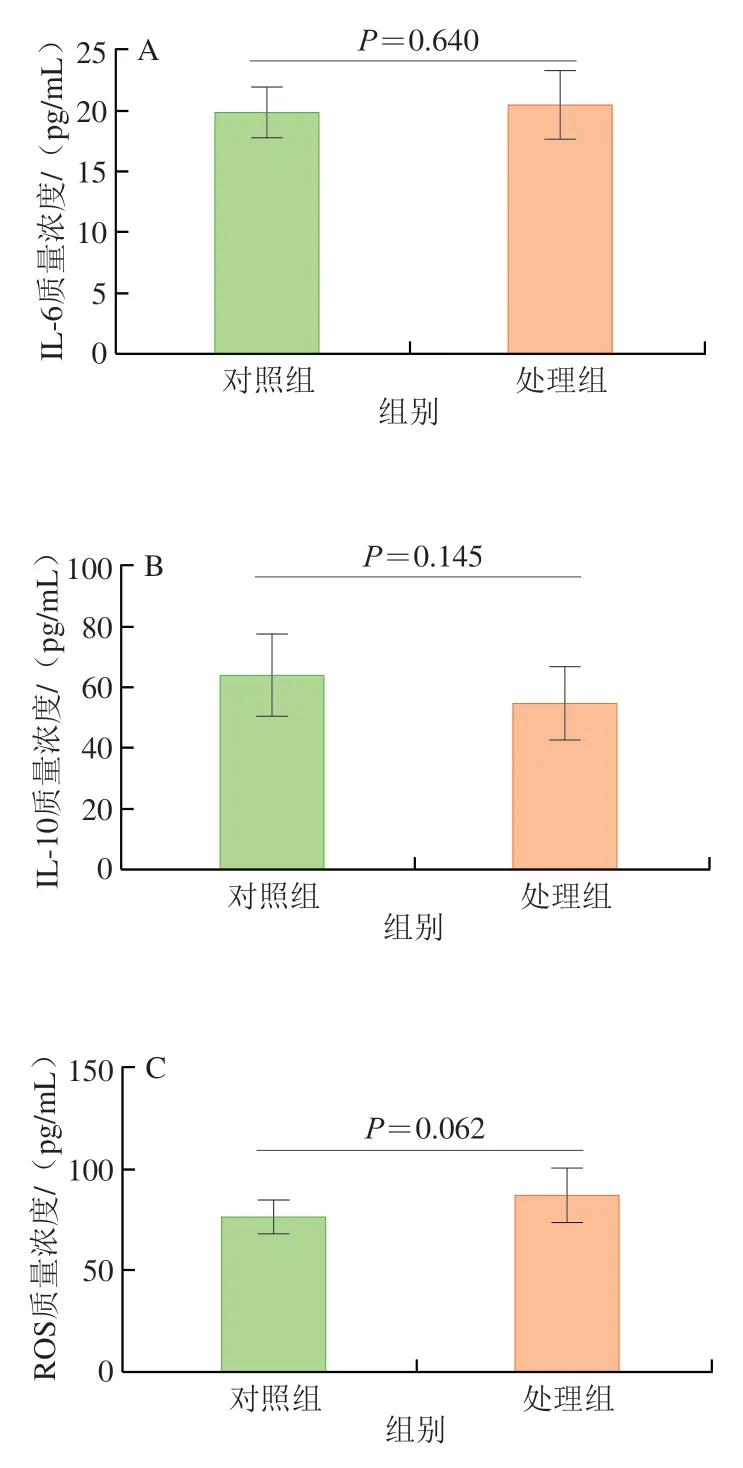

图2 纳米TiO2对小鼠细胞因子、ROS水平及T-SOD的影响Fig.2 Effect of nano-TiO2 on cytokine levels,reactive oxygen species level and total superoxide dismutase activity
2.4 纳米TiO2对小鼠肠道微生物的影响
粪便是纳米TiO2的重要排出途径之一,如图3所示,实验组小鼠粪便中Ti含量显著高于对照组(P=0.013)。说明纳米TiO2存在与肠道微生物和粪便代谢物之间发生互相作用的可能。
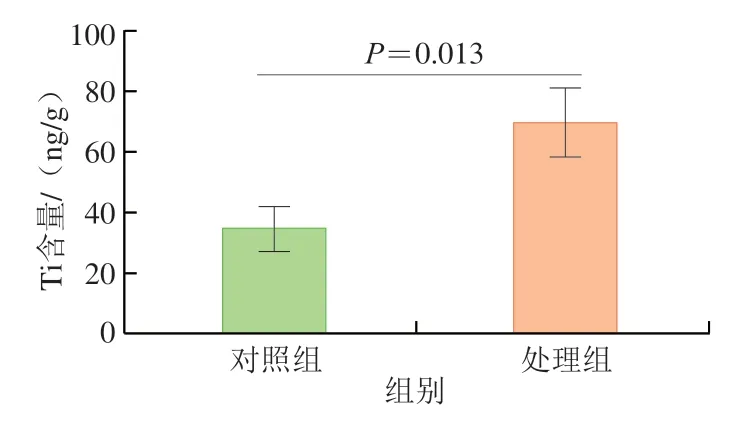
图3 纳米TiO2对小鼠粪便中Ti含量的影响Fig.3 Effect of nano-TiO2 on Ti content in feces of mice
2.5 纳米TiO2对小鼠肠道微生物的影响
如图4 A 所示,在门水平上,除拟杆菌门(Bacteroides)和厚壁菌门(Firmicutes)外,变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和TM7菌门也是小鼠肠道中的高丰度类群。纳米TiO2处理后,厚壁菌门在小鼠肠道中的占比与对照组相比显著增加了49.91%。先前的研究表明,厚壁菌门与拟杆菌门的比值(Firmicutes/Bacteroides,F/B)在一定程度上随着脂肪含量的增加而增加[16]。在本实验中由于厚壁菌门相对丰度的增加,F/B值也上升了75.4%,尽管该变化没有显著性(P=0.083),但也提示了纳米TiO2存在增加小鼠患代谢性疾病和肥胖的风险[17]。
如图4B所示,在属水平上,与对照组相比,别样棒菌属(Allobaculum)、乳杆菌属(Lactobacillus)、颤螺旋菌属(Oscillospira)在纳米TiO2干预后相对丰度显著增加(P<0.05)。Pinget等[18]同样发现了别样棒菌属丰度增加的现象,别样棒菌属先前已被证明是一种对宿主饮食变化敏感的微生物属,因此不难理解它在肠道中的波动现象。而肠道中乳杆菌属丰度的增加是纳米TiO2引起的普遍现象[19-20]。摄入纳米TiO2后乳杆菌属丰度的增加极有可能与一种革兰氏阳性细菌格氏乳杆菌(Lactobacillus_gasseri)有关,其可产生过量的过氧化氢,引起肠道炎症加重[21]。
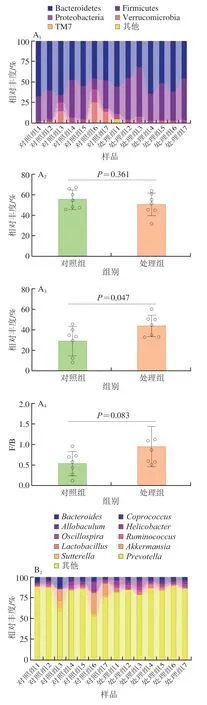
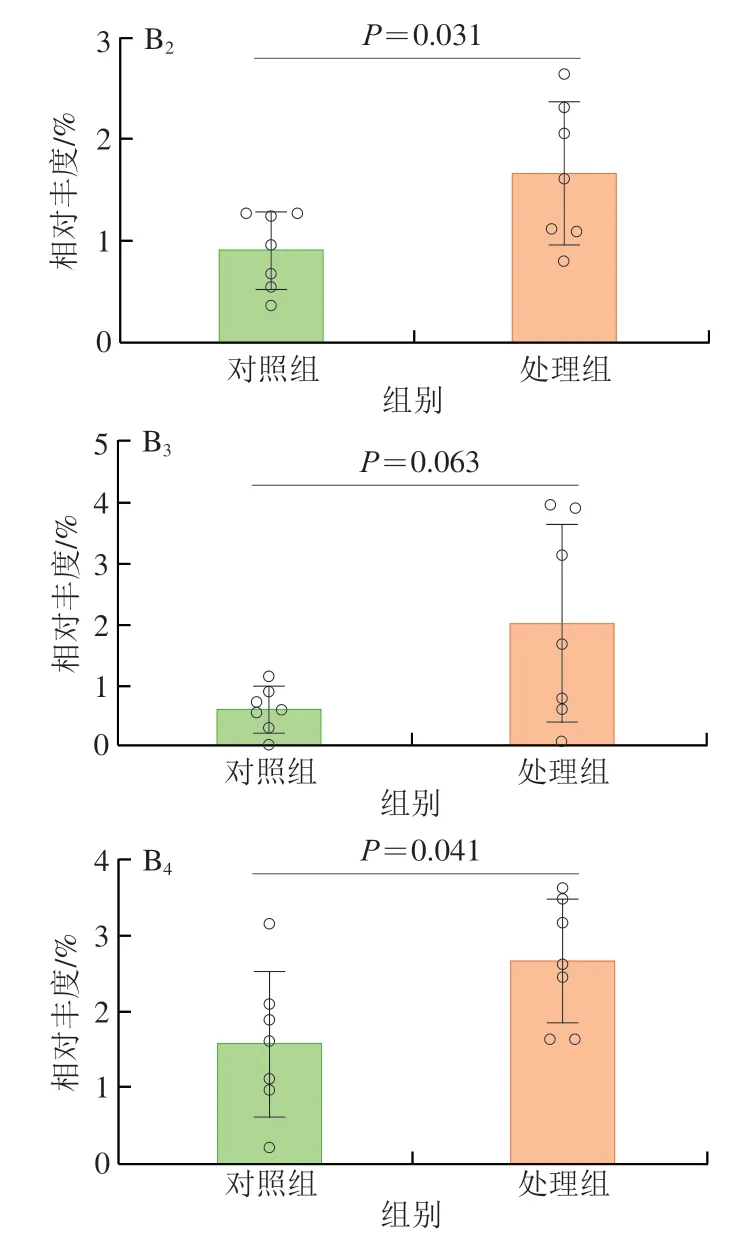
图4 纳米TiO2对小鼠肠道微生物在不同水平的影响Fig.4 Effect of nano-TiO2 on intestinal microorganisms at different levels
2.6 纳米TiO2对小鼠肠道代谢物的影响
2.6.1 对肠道非靶向代谢物的影响
通过气相色谱-质谱技术对粪便进行检测,获得了144 种代谢物。利用微阵列分析鉴定差异代谢物,如表2所示,与对照组相比,纳米TiO2干预引发了粪便代谢物的广泛变化,明显增强了甘油酯类代谢、半乳糖代谢、色氨酸代谢相关代谢途径的变化(图5A)。肠道细菌进行色氨酸代谢产生吲哚,随后在肝脏中被吸收和代谢为循环尿毒症毒素硫酸吲哚酚,对机体造成损伤[16]。此外,对小鼠影响最大的前25 种代谢物进行数据归一化处理(图5B),可以看出,纳米TiO2干预对粪便中的部分氨基酸和长链脂肪酸稳态造成了影响,部分氨基酸浓度和脂肪酸出现异常波动。

图5 纳米TiO2对小鼠粪便代谢物的影响Fig.5 Effect of nano-TiO2 on fecal metabolites in mice

表2 小鼠粪便差异代谢物详细信息Table 2 Detailed information of differential metabolites in mice feces
2.6.2 肠道微生物和粪便代谢物的关联性分析结果
微生物和代谢物之间的相关性可能是由于微生物对代谢物的分解或代谢物对微生物生长的刺激或抑制而产生。为了研究微生物组组成和粪便代谢之间的潜在依赖关系,本实验计算了代谢物和微生物组变量的Spearman相关系数。如图6所示,大多数改变的细菌与部分不同的代谢物有明显的相关性(r>±0.5,P<0.05)。这些细菌主要属于厚壁菌门(Ruminococcus(瘤胃球菌属)、Oscillospira、Lactobacillus、Coprococcus)、变形菌门(Sutterella)和拟杆菌门(Bacteroides)。显著相关的代谢物影响了脂质代谢(甘油)、氨基酸代谢(尸胺、色氨酸)、碳水化合物代谢(D-半乳糖、甘油酸)、叶酸的生物合成(氨苯甲酸)。有趣的是,属于厚壁菌门的细菌相对丰度都与代谢物水平呈负相关。例如,乳杆菌属相对丰度与氨苯甲酸以及色氨酸水平都具有负相关性。相比之下,其他门类下的细菌相对丰度与代谢物水平均呈正相关。可以看出,纳米TiO2造成的小鼠肠道微生物组和粪便代谢组紊乱是有规律可循的。

图6 小鼠属水平肠道微生物与显著变化的粪便代谢物相关性Fig.6 Correlation of gut microbes at the genus level with significantly differential fecal metabolites
3 讨论
本研究通过微生物组学和代谢组学两种组学技术对纳米TiO2进行了安全性评价,有利于进一步阐述纳米TiO2对小鼠肠道共代谢机制产生的影响。
长期高剂量地摄入纳米TiO2会引起部分组织内Ti的蓄积,从而导致组织损伤[22-24]。同时,许多文献报道纳米TiO2在生物体内引发毒性的主要原因是在体内产生了自由基,引起活性氧的积累[25]。然而,本研究中实验组的血清IL-6、IL-10、ROS和T-SOD等参数与对照组相比并无显著性差异,可能是在现有的暴露剂量和时间下,纳米TiO2没有对机体造成显著性损伤。
大多数的纳米TiO2经过消化道通过粪便排泄到体外,并直接与肠道微生物接触影响肠道微生物的区系结构[26]。本研究发现,纳米TiO2实验组和对照组之间部分肠道微生物丰度显著不同,粪便代谢组的整体轮廓存在较明显差异,区分度较高。通过微阵列分析鉴定出9 种差异代谢物,显著影响了甘油酯类代谢、半乳糖代谢、色氨酸代谢3 条代谢途径。进一步分析发现,9 种差异代谢物中尸胺和十五醇在实验组中上调,而丝氨酸、D-半乳糖、氨苯甲酸、甘油酸、甘油及色氨酸在实验组中下调。研究表明,粪便中较高的尸胺水平和较低的D-半乳糖、甘油、甘油酸水平与肠易激综合征、溃疡性结肠病及克罗恩病等肠道疾病发病率呈正相关[27-28]。而十五醇作为脂肪醇的一种,被胃肠道吸收后具有降低低密度脂蛋白胆固醇含量、提高高密度脂蛋白胆固醇含量的作用,结合之前血脂及血糖测定结果,推测该指标的上调可能是小鼠针对糖脂代谢异常的自身调节作用所致[29-30]。之前的研究发现,粪便代谢物中部分氨基酸如丝氨酸、色氨酸等含量改变会影响肠-脑轴,患有自闭症会导致上述氨基酸下调[31]。氨苯甲酸是某些细菌的必需营养素,能够刺激肠道细菌进一步合成叶酸[32]。肠道菌群合成是获取叶酸的重要途径,实验组中氨苯甲酸水平下调可能会导致小鼠叶酸缺乏,进一步增加其他疾病患病概率[33-34]。这些差异代谢物除了参与上述3 种途径,还参与脂质代谢、碳水化合物代谢和氨基酸代谢。此外,本实验发现了部分差异较大的粪便代谢物和肠道微生物的变化密切相关。肠道微生物对食物利用率的增加或减少是更复杂的宿主-微生物互相作用的结果。除了肝脏对过量葡萄糖摄取增加等原因外,粪便代谢物和肠道微生物的联合变化可能是引起小鼠空腹血糖异常的主要原因。
本研究剂量下的纳米TiO2能够影响小鼠的肠道微生物区系结构和粪便代谢表型,对脂质代谢、碳水化合物代谢和氨基酸代谢途径的粪便代谢物产生了显著影响,进一步可能导致小鼠空腹血糖、部分细胞因子及氧化应激指标水平的异常。本研究只观察了粪便的代谢组学特征,进一步应对血液、尿液以及各个脏器在不同周期的染毒样本进行联合分析,从而更准确得出纳米TiO2的毒性作用机制。

