食源性生物活性肽对2型糖尿病的干预作用及其机制研究进展
张 舒,王长远,张东杰,3,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.黑龙江省农产品加工与质量安全重点实验室,黑龙江 大庆 163319)
糖尿病是最常见的代谢性疾病之一,主要包括1型糖尿病、2型糖尿病(type 2 diabetes mellitus,T2DM)和妊娠糖尿病。21世纪以来糖尿病发病率持续上涨,预测在2045年患病人数将增至7亿,其中T2DM患者比例高达90%~95%,且发病人群逐渐“年轻化”。T2DM是由于胰岛素分泌不足、敏感度低或二者协同作用引起的机体营养代谢紊乱,并以持续高血糖为典型特征的退行性疾病[1],若未及时进行干预、调控,可能会诱发更为严重的糖尿病并发症,因此预防、干预、调控、治疗T2DM的行动与措施刻不容缓。
高糖高脂饮食诱发的“假性糖尿病”在初期可以通过改变生活方式干预,如通过运动行为提升、饮食调节来进行调控,但对于T2DM患者来说生活方式调节策略无法使血糖得到很好的控制,必须通过药物进行干预治疗。目前T2DM最有效的治疗途径为注射胰岛素和口服降糖药物,常见的降糖药物有双胍类、格列汀类、波糖类、X肽等[2],但通过基因重组技术和人工合成的非自然分子结构使它们大多数存在副作用、不良反应及耐药性。因此,需要将注意力集于预防和治疗T2DM的天然活性物质开发上。研究表明,日常食用的谷物、果蔬、鱼肉蛋奶等食品对血糖调节均有积极作用[3-5],但科研人员不再只满足于表面血糖值下降的现象性研究,而是试图鉴定食品中的抗糖成分及其作用机制,目前已知具有降糖功效的膳食组成包括可溶性纤维、多酚类化合物、多糖和多肽等[6]。其中分子质量低、生物利用度高、结构灵活的天然食源性生物活性肽能够在消化系统被吸收后进入血液循环,与体内的不同受体发生相互作用[7],多角度干预和调控T2DM,如基于解偶联调节能量代谢、促进葡萄糖代谢[8];介导磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKT)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等通路提高胰岛素敏感性[9];通过抑制T2DM疾病相关代谢酶进行靶向研究[10]。因此摄入活性肽等功能因子也被认为是糖尿病管理的补充方法和有效的疾病管理策略。
近年来,关于食源性生物活性肽的分离、鉴定、表征和活性的研究相对较多,主要是在分子水平上进行定量构效关系模型(quantitative structure-activity relationship,QSAR)拟合或通过分子对接等预测多肽的生物活性和理化性质[11],而其在细胞水平及动物体内的评估性研究相对较少。目前,开发更高生物活性、特异性或生物利用度的新型食源性生物活性肽用于防治T2DM等代谢相关疾病已成为新兴的研究课题。本文就T2DM的治疗现状,系统回顾了食源性降糖活性肽的制备、分离纯化和鉴定的方法,并从靶向调控关键性酶、激素和蛋白的角度综述了食源性活性肽在干预T2DM方面的现状,同时还讨论了其他重要因素在未来研究中的趋势和发展方向。
1 食源性生物活性肽的特性和来源
食源性生物活性肽是存在于蛋白质中可表达生物活性的氨基酸序列肽段,多数由2~20 个氨基酸残基组成,其被加密在原亲本蛋白的序列中,在其前体蛋白中并不活跃,需要蛋白质经过体外深加工,菌种发酵,内、外源性蛋白酶水解及体内消化吸收等方式特异性切割并释放,其相比于其他大分子物质更易被身体消化吸收,且肽段越小越易被肠上皮细胞肽酶水解[12],但底物蛋白质的分离过程可能受到多糖、脂质、蛋白酶、氧化酶和多酚的干扰[13],故直接从动植物中分离纯化生物活性肽是一项非常困难的任务,且成本高、产量低。而操作简单、成本低的制备方法更适用于实际应用,如化学水解法、酶解法和微生物发酵法,但化学水解法制备过程中副产物较多,易引起肽失活[14],并不是活性肽制备的优选方法。利用食品级蛋白酶进行酶解可维持氨基酸的结构和构型[15],此过程中没有毒害物质产生,安全性高、重复性好;而发酵法的酶解率高,过程中的代谢调控可合成和分泌小肽,代谢产物也能够修饰肽的功能基团提高活性[14],二者显然优于化学水解,故目前常用的生物活性肽制备方法为酶法及发酵法。
制备食源性降糖活性肽经常使用的蛋白酶有碱性蛋白酶、风味酶、胰蛋白酶、胃蛋白酶和木瓜蛋白酶[16-18],这些商业蛋白酶的裂解位点已经被证实,预测肽段裂解模式,选择合适的蛋白酶对活性肽的有效制备非常重要。内、外源性蛋白酶的作用位点及D-氨基酸多肽的累积程度均会使活性肽的降糖效果存在较大差异,蛋白的预处理及酶解条件如酶活力、水解时间、酶与底物比等也会影响最终的水解度,优化反应条件可降低肽裂解位点上氨基酸的异构化,防止D-氨基酸多肽累积,促进底物酶解,提升酶解效率[19]。此外,采用复合酶酶解增加裂解位点,促进水解范围,制备出高活性小肽的几率更大[20]。王婷婷[21]比较了6 种单一酶和复合酶对海参肽的水解度、分子质量分布和改善胰岛素抵抗活性的差异,结果表明复合酶酶解所获得的海参肽在软脂酸和高糖诱导的HepG2细胞胰岛素抵抗模型中表现出更优的活性。虽然酶解是从全食品蛋白中获得生物活性肽最常见的方法,但酶解工艺操作不当会使蛋白质水解过度,产生苦味氨基酸,影响其食味价值,也会导致水解物中具有降糖功效的活性肽含量下降[22]。有研究表明微生物发酵过程中产生的肽酶具有除苦肽的功效,可以改善食源性生物活性肽的风味[23],此外该方法制备的活性肽也更容易被人体消化吸收利用。李璇[24]对多种菌体进行筛选,发现乳杆菌MW1水解乳蛋白后的产物具有较高的双酶(α-葡萄糖苷酶、二肽基肽酶(dipeptidyl peptidase,DPP)-IV酶)抑制活性。但采用单独的发酵法也存在基质表面积受限[25]、底物蛋白质降解不充分和肽得率低的情况,液态发酵法虽可以较好解决上述问题,但同样有菌体代谢产物酶活低的缺陷[26]。
综合单一方法的优势及局限,近年通过微生物发酵联合酶解技术形成优势协同,提高蛋白质的水解度和转化率[27],生成高活性肽的研究较为广泛,该方法利用菌体胞外蛋白酶启动蛋白质水解,并通过肽转运激发胞内多肽酶,进而降解大分子寡肽[28-29],并在其他商业酶作用下进一步分解成具有一定的降糖活性的短肽或氨基酸,但廖斌[30]先通过酶解提高水解速率、再发酵降解寡肽的手段也获得了营养品质较高的生物活性肽。大量研究证实利用菌-酶联合的手段获得的食源性活性肽均有显著的抗氧化能力[31-33],虽目前利用该方法制备的多肽还鲜有降糖效果评估方面的报道,但Zhang Pengju等[34]证实了改善氧化应激和抗氧化疗法在治疗T2DM中的重要作用,这也间接提升菌-酶协同制备出高效价食源性降糖肽的可能性(上述方法的工艺流程如图1所示)。除上述将蛋白质水解成肽链的生化手段外,利用化学合成法将氨基酸连接同样可获得肽,虽然合成肽的操作复杂,经济损耗大,安全性有待考证,但此方法获得的肽纯度较高,可实现大规模生产,并能够对靶点进行针对性治疗,故目前合成肽已经逐渐成为药物研发的主要趋势,但在食品领域更倾向于从食物基质中分离获得目标活性肽,化学合成法更多被作为深入探究的一种手段。

图1 食源性生物活性肽的制备工艺流程[23-32]Fig.1 Flow charts for the preparation of food-derived bioactive peptides[23-32]
若想对食源性生物活性肽进行深入的体内外靶向研究,分离纯化和鉴定过程必不可少。活性肽的分离纯化需利用多步骤逐一获得越来越精细的小分子肽,并在每一步后进行活性跟踪。据文献报道,具有降糖活性的肽一般集中在分子质量较小的范围内,而超滤等膜分离技术为浓缩具有降糖作用的多肽提供了一种有效途径[35]。然后可通过凝胶过滤色谱、离子交换色谱、疏水性相互作用色谱、反相高效液相色谱、亲和层析色谱、电泳及双水相萃取等方法利用目标物的电荷性、极性、分子质量等逐级分离纯化出寡肽。离子交换色谱、凝胶过滤层析及反相高效液相色谱是制备食源性活性肽较为常用的纯化技术,但值得注意的是,利用凝胶过滤层析分离可能会使生物活性肽丢失降糖活性,且反相色谱以C18为固定相,有机溶剂为流动相时易使蛋白变性。但沈佳奇[36]利用Sephadex G-50葡聚糖凝胶纯化获得的麦芽根多肽仍对α-葡萄糖苷酶具有较好的抑制活性;江明珠[37]采用反相高效液相色谱以流动相A(含0.05%三氟乙酸的超纯水)与流动相B(含0.05%三氟乙酸的乙腈)体积比为90∶10的色谱条件进行纯化,也获得了Glu-Ala-Lys、Gly-Ser-Arg两种大豆降糖肽,因此在对食源性生物活性肽进行分离纯化时需要研究者明晰原材料的特点,并结合不同技术的优缺点,采用多种分离技术结合的模式,对降糖肽进行准确的分离(如超滤-离子交换色谱/凝胶过滤色谱/加压毛细管电色谱-反相液相色谱结合、毛细管等电聚焦-反相加压毛细管电色谱结合、超高效液相色谱-串联质谱、加压毛细管电色谱-反相液相色谱结合)。分离纯化活性肽可能需要几个月的工作,且无法保证100%的成功率,因此研究者会采用一种看似更理性的方法,通过在硅基中释放蛋白质水解物中可能的生物活性肽(计算机预测)和QSAR建模,并利用分子对接筛选,合成制备降糖肽[12,38];该方法虽然可以节省时间和成本,但仍存在活性肽生物利用度不高及副产物多等安全性问题。
2 食源性生物活性肽对T2DM的干预作用及其机制
2.1 促进胰高血糖素样肽-1分泌
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是由30 个氨基酸组成的位于胰高血糖素原基因第4号的外显子,其在胰岛α细胞剪接翻译后在空肠L细胞内合成并释放[39]。GLP-1作为肠促胰岛素中促胰岛素分泌作用最强的肽激素,是胰岛素信号通路的关键性一环,在T2DM的葡萄糖稳态中起着至关重要的作用,GLP-1不仅可以促进胰岛素合成分泌、改善胰岛β细胞功能,加速β细胞增殖并抑制其凋亡,还可以抑制餐后胰高血糖素分泌、持久控制血糖[40](图2)。GLP-1的分泌调节主要依靠食物摄取、神经信号、内分泌等,但其在体内的半衰期较短,分泌1~2 min后会被肝脏、肾脏、血液中的酶清除[41]。目前关于GLP-1受体激动剂或类似物的研究主要从修饰天然GLP-1、制备长效缓释制剂、植入式渗透泵以及人工合成(对酵母生产的GLP-1类似物进行基因重组)4 方面进行[40]。虽已有学者证实活性肽可通过激活钙敏感受体(calcium sensing receptor,CaSR)介导的钙/钙调蛋白依赖性蛋白激酶(calcium/calmodulin-dependent protein kinase,Ca2+/CaM/CaMK)通路促进CCK和GLP-1的分泌[42],但关于食源性的活性肽目前还只停留在水解物验证或通过组学筛选鉴定层面,如Jiang Pingzhe等[43]利用多肽组学技术筛选获得AGFAGDDAPR肽,对小鼠灌胃57 d后,发现小鼠血液中GLP-1水平与T2DM模型组相比显著上升,血液胰岛素水平上升4.3 倍;Domenger[44]和Komatsu[45]等也分别对食物源性“血啡素”及酪蛋白中潜在的GLP-1激动肽进行鉴定并人工合成,发现两种肽均可显著促进GLP-1的分泌;Heffernan等[46]证实鱼肌肉蛋白水解物在细胞水平上可提升GLP-1的分泌量,徐斐然[2]也通过体内实验验证了菜籽蛋白水解物可显著提升机体葡萄糖耐性、胰岛素水平、GLP-1分泌量。到目前为止,高度纯化和完整形式并证实具有提升GLP-1激素分泌效果的食源性肽段还鲜有报道,但鉴别具有潜在结构-功能关系的食物源是确定活性肽GLP-1激动作用机制的先决条件,同样不可或缺。由于其降糖作用可依赖于饮食,故食源性GLP-1受体激动剂或长效GLP-1类似物的开发意义重大。
2.2 抑制DPP-IV活力
DPP-IV是一种机体内普遍存在的代谢酶,最初被认为是一种T细胞分化的抗原,后来发现其可以表达于肠上皮细胞、血管内壁、胆囊管细管、肺泡细胞和皮肤纤维细胞等多种类型的细胞表面。DPP-IV酶能够裂解肠促胰岛素,导致其活性循环水平降低,而当该酶活力减弱时可延长肠促胰岛素激素的半衰期(图2),从而增强胰岛素和糖调节电位[47],故抑制DPP-IV水平和活力被认为是T2DM的新型调节剂。目前临床上使用的DPP-IV抑制剂类治疗药物主要为格列汀类,相比于双胍类、磺脲类、噻唑烷二酮类药物,DPP-IV抑制剂的副作用小,但同样存在不适用人群,因此食源性DPP-IV抑制肽作为血糖控制靶点的调节剂已展现出十分重要的前景。
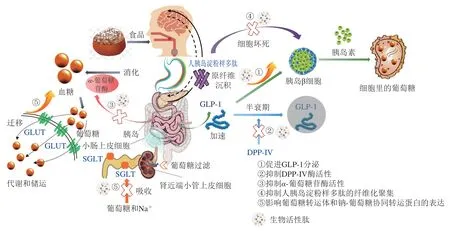
图2 食源性生物活性肽对2型糖尿病干预及调控机制Fig.2 Regulatory effects and mechanisms of food-derived bioactive peptides on T2DM
表1总结了近年来发现的具有DPP-IV酶抑制活性的食物源生物活性肽[48-62],研究表明其抑制活性被认为与肽链中氨基酸残基的序列的种类、疏水性及官能团有关[63];活性肽中疏水性氨基酸的含量越高或其存在于肽链的N端则具有DPP-IV酶抑制活性的可能性越大,肽活性越强;且当Pro、Arg存在或二者在氨基酸序列倒数第二位或Pro在C端时活性肽的抑制率更高[64]。Nongonierma等[11]从骆驼奶蛋白鉴定出的LPVP、MPVQA肽序列表现出更低的DPP-IV酶活力半抑制浓度(half maximal inhibitory concentration,IC50)值。此外,天然的食源性蛋白水解物对DPP-IV酶的IC50值数量级一般在mmol/L,利用超声、微波等辅助手段可增强蛋白质对商业蛋白酶的敏感度,使水解度在20%~40%范围内,可增强对DPP-IV酶的抑制活性,但过度水解同样不利于DPP-IV酶抑制肽的制备[65];通过合成或修饰后的衍生肽IC50值可达到μmol/L[48-49,56],少部分效果较为优异的活性肽IC50值在50~200 μmol/L[12]。Nongonierma等[66]研究发现合成的乳源性二肽对DPP-IV酶的IC50值水平在μg/mL,与天然酪蛋白、乳铁蛋白、乳球蛋白的水解物相差1.5~70.0 倍,但与临床药物的nmol/L范围仍相差甚远[52]。

表1 食源性蛋白质中鉴定的具有DPP-IV酶抑制效果的生物活性肽Table 1 Bioactive peptides with dipeptidyl peptidase-IV inhibitory effects derived from foodborne proteins
相比与GLP-1激动肽,许多DPP-IV抑制肽已从谷物、肉类、奶源中被分离、鉴定出。目前食源性DPP-IV抑制肽的鉴定方法主要是利用生化手段,该方法虽可以在短时间内筛选大量样本,但对于其活性表征并不充分,无法预期体内实验的结果或成功率,因此还要在细胞和分子水平进行深层次研究,搭建生物化学与体内研究的桥梁。如Lammi等[56]通过原位细胞的特异性检测技术,从细胞水平上对大豆DPP-IV抑制肽的抑制率进行验证;董宇婷[57]和徐斐然[2]也通过离体拟合技术对食物源抑制肽的活性表征进行深入探究。未来需开展更多类似的研究以填补区间空白。
2.3 抑制α-葡萄糖苷酶活力
消化酶抑制参与碳水化合物代谢也是其调节血糖的方法之一。食物中的碳水化合物在胃肠中无法直接被吸收,需要依靠小肠黏膜微绒毛表面的α-葡萄糖苷酶水解,释放游离葡萄糖,使游离的单糖进入血液循环,诱发餐后高血糖,因此抑制α-葡萄糖苷酶活力同样被认为是降低肠道内葡萄糖释放量的有效策略[67](图2)。α-葡萄糖苷酶抑制剂可以占据该酶在大分子碳水化合物上的催化位点,延缓多糖的转化和单糖的释放,改善餐后血糖水平使其处于平稳状态,达到调控T2DM的目的。研究表明,亮氨酸和异亮氨酸可快速分解转化葡萄糖,具有促进胰岛素分泌、控制血糖的功效[68],Salehi等[63]研究表明乳清蛋白中富含亮氨酸、异亮氨酸,且能够提高餐后胰岛素需求量,Lacroix等[69]也证实α-乳白蛋白水解物具有α-葡萄糖苷酶抑制作用;同样从螺旋藻肽(LRSELAAWSR)[70]和胡桃蛋白肽(LPLLR)[71]中也发现了大量的亮氨酸序列,二者均对α-葡萄糖苷酶存在较强的抑制活性。且当食源性生物活性肽具有以下结构特征时,同样可表现出优异的抑制活性:1)有3~6 个氨基酸残基;2)含—OH的氨基酸残基(丝氨酸、苏氨酸、酪氨酸)或N-末端为碱性氨基酸残基(赖氨酸、精氨酸);3)蛋氨酸和丙氨酸存在于C端或脯氨酸靠近C端;4)静电荷是0或1+[72-74]。此外,麦类杂粮如燕麦、藜麦、麦芽等也被认为是具有抑制α-葡萄糖苷酶活性肽的良好来源[36,54,57]。
2.4 抑制胰岛淀粉样多肽的纤维化聚集
胰岛淀粉样多肽(islet amyloid polypeptide,IAPP)又称Amylin,是一种与胰岛素共定位、共包装、共分泌的神经内分泌激素肽,二者共存于分泌颗粒中,并在人血糖升高时被释放,抑制胰高血糖素的分泌,促进葡萄糖代谢[75]。泛素-蛋白酶体系统和自噬体-溶酶体系统是调节IAPP周转的两大降解系统,在T2DM患者中,泛素-蛋白酶体系统活性显著下降,自噬小体的成熟速度超负荷,使蛋白酶体复合物溶解功能被破坏[76],IAPP降解速率降低[77],进而导致IAPP错误折叠聚集成为淀粉样纤维,并发生聚集沉积。此外还发现IAPP在聚集过程多伴随细胞毒性,使胰岛β细胞受损[78];由于过度补偿胰岛素分泌的减少,使得存活下来的β细胞压力增加导致功能丧失出现恶性循环,最终发生胰岛素抵抗[79],诱导慢性高血糖,这种细胞毒性是造成T2DM等疾病的主要因素之一(图2)。目前在T2DM患者体内发现了人胰岛淀粉样多肽的纤维化聚集[80],尽管在过去的几十年里,T2DM的治疗方法显著增多,但这些药物都不能阻止β细胞功能的逐渐衰退[81]。
有研究表明,短肽可抑制IAPP的聚集,在初期,研究者采用IAPP衍生肽截断附加修饰的手段进行纤颤抑制,Porat等[82]早在2004年就发现截取IAPP中的核心模块22~29残基NFGAILSS,并采用酪氨酸替代苯基丙氨酸获得NYGAILSS短肽,可以通过抑制芳香杂环的相互作用减少IAPP的聚集;近几年,发夹肽的使用也为短肽的纤颤抑制提供新思路,与本体自结合相比,β-发夹肽的芳香环更易于与其疏水位点相结合,从而抑制其聚集[83]。Shi Yue等[84]证实了FLPVF这种新型的五肽可以抑制淀粉样蛋白沉积,而根据BLAST搜索发现FLPNF存在于多种食物源性蛋白中,如大豆、鸽豌豆、豇豆和大米[85]。杨柳[86]也发现核桃多肽具有抗淀粉样蛋白聚集的活性,但食源性生物活性肽集中针对T2DM方面的研究还鲜有报道;而从胰岛的整体性出发,关注胰岛素分泌的同时,阻止β细胞受损的整合性调节才是稳定血糖的重要机制,对具有结合IAPP和抑制其纤颤的潜在食物蛋白基的全面挖掘或许将在T2DM的研究中取得重大突破。
2.5 影响葡萄糖转运体和钠-葡萄糖协同转运蛋白的表达
葡萄糖摄入所需的转运体存在于身体各个组织细胞中,它主要分为两类:一类是钠-葡萄糖协同转运蛋白(sodium-glucose cotransporter,SGLT),以主动方式逆浓度梯度转运葡萄糖[87];另一类为葡萄糖转运体(glucose transporter,GLUT),以易化扩散的方式顺浓度梯度转运葡萄糖[88]。目前,人体已发现6 种SGLT亚型和5 种GLUT亚型,具体亚型分类如图2所示。通过控制SGLT和GLUT蛋白表达量调节T2DM的作用机制与上述不同,其主要通过促进组织细胞中GLUT易位加速葡萄糖代谢和减少SGLT表达抑制葡萄糖再吸收的独特作用机制发挥降糖功效,而并非基于胰岛调控,与胰岛素分泌无关(图3)。

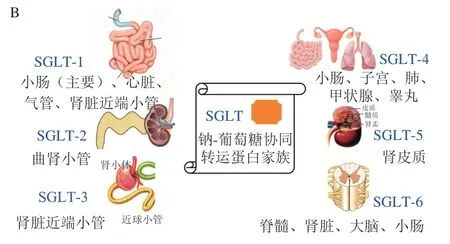
图3 两大转运体家族的主要类型[86,88]Fig.3 Main types of two transporter families[86,88]
SGLT-2抑制剂属于新一类降糖药物,其主要为化学合成类药物,如达格列净、恩格列净、Cefalo[89]等;天然产物中研究最为广泛的为根皮苷[90],北美芹素和葡萄素等天然活性物质也逐渐被开发[91],但目前对于活性肽抑制SGLT表达的报道仍甚少。而大量研究指出食源性活性肽具有促进GLUT型转运体易位的干预行为,如植物源性活性肽(大豆肽[92-93]、核桃肽[94-95]、黑豆肽[96]、黄酒肽[97]等),以及动物源性活性肽(海洋源肽[98]、鲑鱼肽[99]、乳源性三肽[100]、海参水解物[101-102]等),上述食源性活性肽主要改善了GLUT-4的易位障碍,提高其转移到细胞膜的数量,与传统药物相比毒副作用和免疫原性更低,优势更为明显,但大多数观察是在啮齿动物实验中进行的,在人类中尚未得到验证。
3 结语
食源性生物活性肽是具有食品属性的人体机能调节剂,此类功能性食品也是应对特定人群从“被动医疗”转向“主动健康”的前提。上述内容表明食源性生物活性肽具有干预T2DM的潜在应用,研究人员也力求从不同的食物源中开发新的活性肽,但目前将其作为治疗药物或功能性食品补充剂仍然具有挑战性。天然活性肽的分离纯化过程复杂且难度较高,易在制备过程中失活;即使有效分离出活性肽,商业转化的成本问题也需要考虑;若根据其肽序列进行合成,则需通过大量实验确保其合成肽的安全性。此外,活性肽的功效和生物利用度也是值得关注的问题,大量的文献通过体外实验评估了生物活性肽调节T2DM的功效,但缺乏体内有效数据的支撑,因活性肽可能会在肠道、血液和肝脏中发生分解、代谢和受损,也不排除与机体内的其他非靶向酶发生相互作用从而无法发挥功能甚至失活,且生物活性肽机体内降糖的作用机制尚未完全建立,对于其代谢组学、通路研究等机理研究较少,故无法保障体外的功效与体内的效果相同。因此,在进行人体临床研究之前,需要进行细胞、动物实验以及初步的药代动力学研究。
为增强口服食源性活性肽的有效性,还需要提高其溶解度和稳定性,目前探究通过提高活性肽稳定性和生物利用度使其达到缓释的目的,这类新型的技术如Pickering乳液、微胶囊、纳米颗粒、脂质体、纤维等已涌现,递送策略的优化可最大限度地发挥食物源肽的防治功效。但多数实验周期较短,缺乏中长期实验验证,长期服用对细胞毒性和机体的安全性等问题还有待商榷。通过对食源性生物活性肽调节T2DM功效的综述,有望为提前预防和辅助治疗T2DM、提升食源性生物活性肽的生物利用率、及其在功能食品的研发等方面提供新的思路,以期在未来充分利用多学科领域的知识来推广生物活性肽的使用,以改善人类健康。

