肠-肝轴介导的非酒精性脂肪性肝病及其营养干预研究进展
许 叶,胡彦周,徐 佳,黄香慧,黄昆仑,2,贺晓云,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种代谢功能障碍相关的肝脏疾病,在没有过量饮酒和其他刺激因素(如药物和病毒)的情况下,肝细胞中的脂肪堆积超过肝脏质量的5%[1],即定义为NAFLD。NAFLD可从脂肪变性发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、纤维化、肝硬化,最终发展为癌症[2]。据估计全世界39%的成年人超重,13%的人肥胖[3],而肥胖往往伴随着代谢并发症的发生,如2型糖尿病、代谢综合征和NAFLD,NAFLD已经成为最常见的慢性肝病和全球性健康问题,其全球患病率约为25%。目前,许多研究集中在阐明被称为“多重平行打击”的因素上,这些因素推动了从简单脂肪变性到更复杂更严重的NAFLD的病程进展[4],相关因素有肠道微生物失调[5]、膳食模式改变[6]、肠道通透性改变[7]、遗传基因改变[8]和内质网应激反应[9]等。其中,肠道微生物种群的改变被认为是NAFLD、肥胖和糖尿病最常见的危险因素[10]。
肠-肝轴是指肠道和肝脏通过胆道、门静脉和体循环的紧密双向连接进行交流,肝脏通过释放胆汁酸(bile acids,BAs)等生物活性介质进入胆道和全身体循环,从而与肠道相通;在肠道内,宿主和微生物代谢内源性(BAs和氨基酸)和外源性(来自饮食和环境暴露)底物,其产物通过门静脉转移到肝脏并影响肝脏功能[11]。研究表明,肠道微生物区系的失调会扰乱肝脏的碳水化合物和脂质代谢,影响肝脏促炎和抗炎效应之间的平衡,从而促使NAFLD向NASH的发展[12]。
然而,到目前为止,肠-肝轴与NAFLD的关系尚不清楚,许多新的机制仍有待发现,解决这些问题将是治疗NAFLD和其他肠道微生物相关的代谢综合征的重要突破口。肠-肝轴介导的NAFLD的发生发展已成为代谢性疾病研究的热点,对NAFLD的防治具有重要意义。本文综述了肠-肝轴在NAFLD发生发展中的已知作用机制,以及以肠-肝轴为靶点通过营养干预改善NAFLD的研究进展,旨在全面认识肠-肝轴在NAFLD发生发展中的作用,为NAFLD患者制定具体的营养干预措施,以期为预防和改善NAFLD寻找新的治疗策略奠定基础。
1 肠-肝轴在NAFLD发生发展中的作用机制
人类和动物的肠道定植着各种各样的微生物,这些微生物在维持肠道功能、调节宿主免疫反应和慢性疾病(如肥胖症、糖尿病和脂肪肝)以及代谢稳态方面发挥着关键作用。对肥胖相关代谢疾病的人类和啮齿动物研究表明,肠道微生物群在NAFLD发病机制中起着关键作用[13]。NAFLD患者在肠道菌群失调的同时,肠道屏障功能受损,细菌及细菌源性产物转运进入肝脏的量增加(图1)。因此,肠-肝轴在NAFLD的发生发展的过程中发挥着重要作用。以下将从肠道微生物组成、肠道屏障功能、肠道微生物成分、肠道微生物代谢物的角度阐述肠-肝轴介导NAFLD的作用机制。
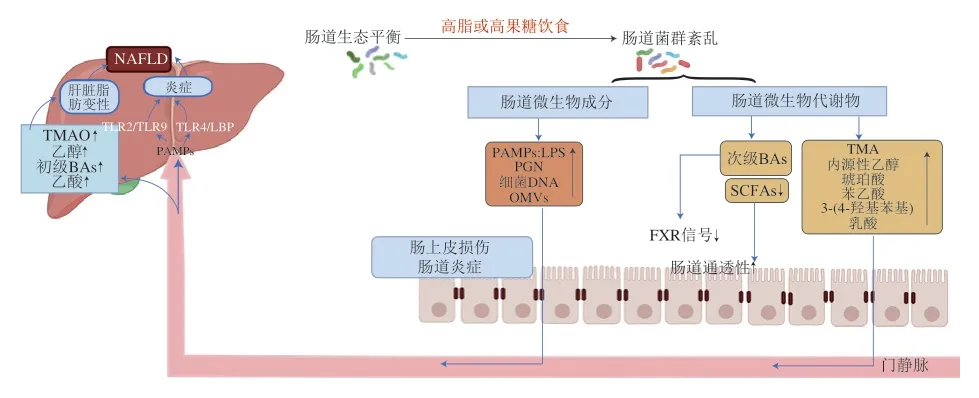
图1 肠-肝轴在NAFLD发生发展中的作用机制Fig.1 Mechanism of action of the gut-liver axis in the occurrence and development of NAFLD
1.1 肠道微生物组成
在人类肠道微生物组成中,拟杆菌和厚壁菌占90%以上,而其他菌门也有少量存在,包括变形杆菌、韦氏杆菌、放线菌、梭菌和蓝细菌[14]。NAFLD疾病进展的最典型特征包括微生物区系多样性下降、革兰氏阴性菌(主要是变形杆菌门)数量增加、革兰氏阳性菌(主要是厚壁菌门)数量减少[15]。Hrncir等[16]研究发现,与NAFLD相关的肠道微生物群特征是变形菌门、肠杆菌科、大肠杆菌、拟杆菌、多利亚菌和消化杆菌的丰度增加,以及理研菌科、瘤胃菌科、粪杆菌属、粪球菌属、厌氧杆菌属和真杆菌属丰度的减少;NAFLD患者与健康个体相比,或者轻度NAFLD患者与较重度NAFLD患者相比,肠道菌群组成中变形菌、肠杆菌、埃希氏菌以及Dorea变化一致,丰度均增加,而疣微菌、Anaerospacter、粪球菌、真杆菌、粪杆菌和普雷沃菌丰度均降低[13]。同时,高膳食胆固醇会导致小鼠脂肪变性,继而导致脂肪性肝炎、纤维化并最终引发肝癌,胆固醇诱导的NAFLD形成与肠道菌群失调有关,Mucispirillum、脱硫弧菌属、Anaerotruncus和脱硫弧菌科丰度依次增加;而双歧杆菌和拟杆菌在高脂高胆固醇喂养小鼠中上述微生物丰度均减少,这一发现在NAFLD患者中得到进一步证实[17]。综上所述,上述证据支持NAFLD的发生发展与肠道微生物组成失调密切相关,因为肠道微生物的失调往往伴随着肠道屏障功能障碍,促使肠道炎症,使肠道微生物成分以及肠道微生物产物通过肠黏膜屏障进入到门静脉转运至肝脏,导致肝脏炎症以及肝脏脂肪变性,促进NAFLD的发生(图1)。
1.2 肠道屏障功能
肠道屏障包括物理屏障、生化屏障和免疫系统屏障[18]。物理屏障主由黏液层、微生物和一层由紧密连接蛋白连接的肠上皮细胞支撑。生化屏障是由具有抗菌特性的分子如抗菌蛋白(包括α-防御素和β-防御素、c型凝集素、抗菌肽、溶菌酶和肠碱性磷酸酶)组成[19]。分泌型免疫球蛋白A和淋巴滤泡包含各种免疫细胞,包括B细胞、T细胞、树突状细胞和中性粒细胞,是免疫系统屏障的组成部分[18]。肠道屏障对细菌、肠腔抗原和炎症因子等有害物质的移位具有有效的防御作用,通常通过肠道通透性评估[20]。肠道菌群失调会导致肠道通透性增加,细菌移位到肝脏,导致炎症细胞因子从激活的库普弗细胞释放[21]。已有研究表明,NAFLD患者肠道菌群失调,肠道通透性受损[22];并且进一步的肠道微生物群紊乱引起的肠道屏障完整性受损是NASH发生的先决条件[7]。临床研究表明NAFLD患者出现结肠炎,肠上皮连接黏附分子1(junction adhesion molecule 1,JAM1)表达降低[23]。高脂肪和果糖饮食中JAM1基因缺陷的小鼠表现出肠通透性增加、内毒素血症和肝脏炎症,该研究强调了健康的肠上皮屏障在微生物菌群失调情况下阻止细菌产物进入门脉的重要作用[24]。其他实验研究也表明,高脂饮食喂养小鼠或者大鼠后,其组织病理学表现为肠道炎症细胞的浸润,异硫氰酸荧光素酯-葡聚糖测定结果表明高脂组肠道通透率升高,荧光免疫染色分析表现为紧密连接蛋白如ZO-1、Occludin、Claudin-1的表达量降低,而在肝脏病理表现为肝脏脂肪变性[25-27]。因此,寻找调控肠道屏障的干预措施可能有助于减轻或阻止NAFLD的进展。
1.3 肠道菌群代谢物-肝轴
NAFLD发生发展中的肠道菌群除了微生物组成的差异以及数量的直观改变以外,还有更重要的影响途径,即其代谢物对肝脏造成的影响。越来越多的证据表明,肠道微生物群及其衍生代谢物、免疫系统和肝脏之间的相互作用在NAFLD的发病机制中起着关键作用。在NAFLD中,以肠道通透性增加形式的肠道屏障功能障碍是促进PAMPs流入门静脉的因素,而PAMPs包括LPS、PGN、细菌DNA等肠道微生物成分,这些成分和肠道菌群衍生代谢物进入肝脏,引发促炎级联反应,导致肝脏炎症恶化(图1)。下文以连接肠道微生物与肝脏的“中间体”作为出发点,分别从肠道微生物组成成分与代谢物的角度阐述肠道微生物介导NAFLD的作用机制。
1.3.1 肠道微生物成分
1.3.1.1 脂多糖
LPS是革兰氏阴性菌的主要外膜成分,与宿主固有免疫系统的激活有关。研究证实NAFLD患者和动物的血清中LPS水平均升高[28],因此LPS引起的慢性低度炎症是NAFLD进展的关键因素。Toll4是LPS和多种游离脂肪酸的模式识别受体,广泛表达于各种类型的肝细胞,包括肝细胞、库普弗细胞和星状细胞[29]。LPS诱导的TLR4活化导致巨噬细胞分泌白细胞介素(interleukin,IL)-6和IL-1β等炎症细胞因子,导致肝损伤和NASH[30]。除TLR4外,LBP也参与LPS的识别。LBP是一种50 kDa的糖基化蛋白,在肝脏中合成后释放到血液中。一项临床研究发现,在NAFLD或NASH患者中LBP水平升高[31]。在高脂饮食诱导的NAFLD动物模型中观察到LBP基因敲除小鼠显示出改善脂质代谢和减轻NAFLD的多种病理特征[32],提示LBP是NAFLD发生发展的重要因素。肠道菌群产生的LPS参与NAFLD发生发展的机制,与肠道屏障功能障碍有关。一些证据表明,循环系统中LPS的增加会损害肠道屏障功能,并导致肠道通透性增加,是由TLR4/髓样分化因子(myeloid differentiation factor 88,MyD88)信号转导通路上调肌球蛋白轻链激酶(myosin light chain kinase,MLCK)介导的[33],进一步的研究发现TLR4/MyD88信号转导通路激活转化生长因子-β激活激酶1(transforming growth factor-β kinase activating 1,TAK-1)和核转录因子-κB(nuclear transcription factorκB,NF-κB)p65/p50进而激活MLCK,从而调节LPS诱导的肠上皮紧密连接通透性增加[34],而通过门静脉血进入肝脏的LPS通过TLR4激活库普弗细胞和肝星状细胞,从而分别促进肝脏炎症和纤维化。此外,LPS诱导的核苷酸结合寡聚域(nucleotide binding oligomerization domain,NOD)样受体热蛋白结构域相关蛋白3(NODlike receptor thermal protein domain associated protein 3,NLRP3)炎症小体的激活最近被证明与NASH的进展有关[35]。综上,LPS引起的NAFLD主要是通过TLR4、LBP和NLRP3直接作用于肝脏或者通过影响肠道屏障间接发挥促炎作用。
1.3.1.2 肽聚糖
PGN是革兰氏阴性和革兰氏阳性细菌细胞壁的重要组成部分,为细胞壁提供支撑和保护作用。与革兰氏阴性细菌中发现的薄层细胞壁不同,PGN与脂磷壁酸(lipoteichoic acid,LTA)结合,在革兰氏阳性细菌中形成更厚的细胞壁[36]。PGN激活宿主免疫细胞中的TLR2途径或NOD途径,从而促进炎症反应[37]。TLR2在NAFLD中的作用存在着一些争议,在高脂饮食诱导的肥胖小鼠中,TLR2基因敲除逆转了胰岛素抵抗和肝脏脂肪变性[38]。但是,当饲喂蛋氨酸和胆碱缺乏的饮食时,TLR2缺乏小鼠表现出更严重的脂肪性肝炎[39],不排除这种特殊饮食对代谢造成的影响可能与NAFLD不同。PGN通过NF-κB途径或丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径激活NOD1和NOD2,介导促炎因子的产生,为NAFLD的炎症和胰岛素抵抗奠定基础[40]。有研究表明,NOD1/2-/-双基因敲除小鼠可以抵抗肝脏脂质堆积和炎症浸润[41]。总之,PGN介导的肝组织炎症损伤主要与TLR2、NOD1和NOD2的信号通路有关。
1.3.1.3 细菌DNA
细菌DNA主要通过激活巨噬细胞、自然杀伤细胞和B细胞等免疫细胞,在NAFLD的发病过程中发挥重要作用。当细菌DNA通过内吞作用进入核内体后,核内体中的TLR9识别细菌DNA衍生的CpG寡核苷酸启动MAPK/NF-κB途径和分泌炎性因子,如肿瘤坏死因子-α(tumor necrosis factor,TNF-α)和IL-12[42-43]。TLR9还激活IkB激酶α(IkB kinase α,IKKα),IKKα募集微管相关蛋白1A/1B轻链3(light chain 3,LC3)干扰干扰素调节因子7(interferon regulatory factor 7,IRF7)的磷酸化,导致释放I型干扰素[44]。宿主细胞中炎症和免疫通路的激活表明细菌DNA在肝脏促炎和毒性中有一定的潜在作用。进一步的研究表明,在胆碱缺乏氨基酸限制饮食诱导的NASH小鼠中,TLR9-MyD88级联通路使库普弗细胞产生IL-1β,促进脂肪性肝炎、胰岛素抵抗和肝纤维化[45],而使用TLR9拮抗剂可以改善NASH小鼠的肝炎情况[46]。
1.3.1.4 细菌外膜囊泡
OMVs是由革兰氏阴性菌和一些革兰氏阳性菌产生的小球形双层囊泡(直径10~300 nm),这些革兰氏阴性菌有大肠杆菌、福氏志贺菌、伤寒沙门氏菌、铜绿假单胞菌和幽门螺杆菌等[47]。OMVs从细菌外膜释放到胞外环境中,并携带LPS、核酸、蛋白质、多糖和磷脂参与宿主与细菌间的相互作用,对宿主健康产生潜在的影响。Vanaja等[48]报道由细胞外细菌产生的OMVs可以作为载体,将LPS传递到宿主细胞的胞浆中,在体外和体内触发Caspase-11依赖性效应反应。OMVs在细菌定植、毒力因子传递和疾病发病中起着重要作用,如激活肠上皮细胞、巨噬细胞这些细胞表面及细胞内的受体,引起促炎反应[49]。因此,OMVs可能会影响NAFLD过程中宿主与细菌的关系,但具体机制还有待探究。
1.3.2 肠道微生物代谢物
1.3.2.1 胆汁酸
BAs是一种两亲性羟基类固醇,由肝脏中胆固醇的分解代谢合成,并以胆盐的形式从胆囊释放到小肠[50]。肠道微生物区系将人体远端小肠和结肠中的初级BAs如胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA)转化为次级BAs如脱氧胆酸(deoxycholic acid,DCA)、石胆酸(lithocholic acid,LCA)和熊去氧胆酸(ursodesoxycholic acid,UDCA);在小鼠体内,次级BAs如ω-鼠胆酸(ω-muricholic acid,ω-MCA)、猪胆酸(hyocholic acid,HCA)、鼠去氧胆酸(murideoxycholic acid,MDCA)和猪去氧胆酸(hyodeoxycholic acid,HDCA)通过肠道微生物异构化和脱羟基作用形成[51]。在回肠末端,约95%的BAs被顶端钠依赖性胆汁酸转运体(apical sodiumdependent bile acid transporter,ASBT)重吸收到肠细胞中,并通过门静脉转移到肝脏[52]。BAs对肝细胞损伤的研究表明,疏水BAs LCA、DCA和CDCA具有细胞毒性[53],而亲水BAs UDCA、TUDCA具有细胞保护作用[54-55]。FXR是BAs的一种受体,初级BAs CDCA激活FXR信号传导,而次级BAs DCA抑制这种活化并抵消CDCA的作用[56]。FXR是核激素受体家族中的一员,广泛存在于回肠和肝脏中,通过不同的机制调节糖脂代谢。Clifford等[57]通过全面的脂肪组学分析,发现FXR的激活在小鼠或人体中会降低肝脏中单不饱和脂肪酸和多不饱和脂肪酸的水平,并提示FXR通过减少BAs降低了对脂质的吸收,此外,用组织特异性FXR基因敲除小鼠证明肝脏FXR控制脂肪生成基因,而肠道FXR控制脂质吸收。BAs也可以与G蛋白偶联受体(G protein-coupled receptor,GPR)TGR5结合,在肝组织中TGR5在库普弗细胞和内皮细胞中表达,其功能是调节肝脏炎症和葡萄糖代谢。研究表明,TGR5信号可以减轻肝脏脂肪变性和炎症,并抑制NLRP3介导的NASH中巨噬细胞M1极化,促进巨噬细胞M2极化,为靶向TGR5/NLRP3信号通路治疗NASH提供了理论依据[58]。TGR5在控制肠道L细胞释放胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)从而维持葡萄糖的动态平衡方面起着关键作用。Zheng Xiaojiao等[59]报道了猪的主要BAs HCA与2型糖尿病患者的葡萄糖水平呈负相关,进一步研究发现,HCA通过激活TGR5和抑制FXR信号促进GLP-1的产生和分泌。激动剂激活TGR5被证明可以改善NAFLD小鼠的肝脏脂肪变性和胰岛素敏感性[60]。此外,TGR5还可控制BAs组成和胆囊功能,保护肝脏免受BAs超载的影响[61]。
1.3.2.2 胆碱及胆碱相关代谢物
胆碱被认为是一种基本营养素,可以影响肝脏的多种生理过程,如脂质和胆固醇新陈代谢。临床前研究表明,胆碱水平降低可通过减少极低密度脂蛋白(very low-density lipoprotein,VLDL)从肝细胞的外流而导致脂肪肝[62],并且胆碱缺乏的饮食一直被用来诱导啮齿类动物的脂肪性肝炎。TMA是胆碱经肠道微生物分解代谢的产物,通过门静脉到达肝脏,被含黄素的肝脏单加氧酶氧化形成TMAO,而TMAO被认为是早期代谢综合征的新生物标志物[63]。已有研究表明TMAO通过调节BAs代谢和抑制NAFLD的FXR信号而加重肝脏脂肪变性[64]。一项采用肝组织病理确诊的病例对照研究结果表明,研究对象TMAO水平与胆碱水平呈正相关,NAFLD组TMAO水平显著高于对照组,随着血清TMAO水平增加,NAFLD发病风险增加[65]。但TMAO与NAFLD发生的具体作用机制还有待进一步研究。
1.3.2.3 短链脂肪酸
SCFAs是最重要的肠道菌群代谢物,是在肠道(盲肠和结肠)中通过发酵无法消化的碳水化合物而产生的,以醋酸、丙酸和丁酸为主。SCFAs可被肠道高效地吸收(90%~95%),而没有被肠道细胞吸收的SCFAs通过门静脉输送到肝脏,在肝脏中丙酸可以用于糖异生,醋酸或丁酸盐可以作为脂肪生成的底物[66]。由此可见,肠道微生物来源的SCFAs对肝脏代谢具有调节作用。SCFAs还可以作为GPR的配体,如GPR41和GPR43,调节分子信号转导[67]。研究表明,口服醋酸、丙酸和丁酸的混合物可以降低脂肪生成相关基因的表达,增加脂肪酸氧化相关蛋白基因的表达,降低肝脏中的总脂肪含量[68]。den Besten等[69]在小鼠饮食中添加SCFAs,结果表明SCFAs可通过降低过氧化物酶体增殖物激活受体γ(peroxisomal proliferator-activated receptor γ,PPARγ)的表达和活性预防和逆转高脂肪饮食诱导的代谢异常。但最近的一项研究报道了摄取果糖后肝脏脂质合成的另一种机制,即结肠微生物利用果糖产生的乙酸盐在酰基辅酶A合成酶短链家族成员2的作用下转化为乙酰辅酶A,有助于小鼠肝脏的新生脂肪生成[70]。此外,SCFAs对肝脏的影响可能继发于肠道屏障功能的改善,SCFAs可保护肝脏免受门静脉LPS的影响。研究表明,丁酸盐可以调节肠道菌群,改善肠道完整性,进而减少小鼠体内LPS浓度及其引起的炎症,从而预防饮食诱导的脂肪性肝炎[71]。总之,肠道微生物代谢产的SCFAs可能通过调节肝脏代谢和炎症反应对NAFLD的发展具有一定的有益作用。为了充分了解肠-肝轴在NAFLD中的作用,有必要确定每种微生物代谢产生的SCFAs在NAFLD患者中的实际作用。
1.3.2.4 内源性乙醇
研究表明,NAFLD患者的内源性乙醇含量明显高于健康人[72]。肠道完整性受损部分与内源性乙醇的产生有关,来自NAFLD患者的特定肠道菌株(肺炎克雷伯菌)具有产高水平内源性乙醇的能力,从而加剧了肠屏障功能受损和肝脂肪变性[73]。内源性乙醇可以抑制三羧酸循环,增加乙酸水平,从而促进甘油三酯在肝细胞中的积累[74]。由内源性乙醇产生的乙醛对肝细胞有一定毒性,具有氧化依赖性代谢和细胞毒作用,可进一步加重肝损伤[75]。总之,内源性乙醇可能通过增加肠道通透性、乙酸水平和乙醛的形成来导致肝损伤,从而参与NAFLD的发病。
1.3.2.5 琥珀酸、苯乙酸和3-(4-羟基苯基)乳酸
琥珀酸是一种细胞外信号分子,也是柠檬酸循环的中间产物,在NAFLD患者的粪便、血清和肝脏样本中丰度均有所增加,可能是通过导致α-平滑肌肌动蛋白(纤维化反应的生物标志物)的产生促进非酒精性脂肪肝的发生发展[76]。同时,它也是一种重要的代谢物,由哺乳动物细胞和肠道微生物(如拟杆菌科和普氏菌属)产生[77],而这些微生物在NASH患者的粪便样本中有所增加[78]。最近的一项研究表明,血浆苯乙酸与人类肝脏脂肪变性和NAFLD活性评分相关[79],它是蚂蚁后胸膜腺分泌物的产物,也是人体苯乙胺的氧化产物。肠道细菌也能产生苯乙酸,苯乙酸通过诱导人原代肝细胞甘油三酯积累和促进相关脂质代谢基因的表达促进NAFLD的发生[79]。NAFLD患者血清样本中3-(4-羟基苯基)乳酸水平也高于对照组,3-(4-羟基苯基)乳酸是由细菌酶如D-氢化酶和苯乳酸辅酶A转移酶合成的,可由肠道微生物产生,并且与肝脏脂肪变性和纤维化有共同的基因效应[80]。琥珀酸、苯乙酸和3-(4-羟基苯基)乳酸是促进NAFLD发生的肠道微生物代谢产物,可作为NAFLD的诊断标志物,应提出减少微生物生产琥珀酸、苯乙酸和3-(4-羟基苯基)乳酸的策略,从而抑制NAFLD的发展。
2 以肠-肝轴为靶点通过营养干预改善NAFLD的研究进展
饮食模式是NAFLD的主要诱因,长期摄入过多的热量,特别是富含精制碳水化合物、饱和脂肪或果糖的饮食,与NAFLD的发病密切相关。这种饮食模式可能导致胰岛素抵抗和脂质代谢紊乱,导致肝脂肪变性、炎症和纤维化。有研究表明,长期摄入过量的能量可能会导致肠道微生物群失衡,并对NAFLD的发展产生深远的影响[81]。目前已发现能够维持和调节肠道菌群的膳食补充剂,包括益生菌、功能性低聚糖、膳食纤维、ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFA)、多酚等,已证明这些膳食补充剂可通过肠-肝轴保护和改善NAFLD,涉及维持肠道微生物群平衡、维持BAs稳态、加强肠道屏障功能、减少细菌易位以及减少肠道细菌产生的有害成分和代谢物(表1)。因此,以肠-肝轴为靶点,制定具体的营养干预措施,可能是提高NAFLD患者健康状况的重要策略。

表1 改善NAFLD的营养干预及其作用机制Table 1 Nutritional interventions to improve NAFLD and their mechanisms of action
2.1 益生菌
益生菌是指为宿主带来健康益处或改善病理条件的足够数量的活微生物菌株[98]。最新的一项临床试验表明益生菌可保护NAFLD患者免受肠道通透性增加,并且稳定黏膜免疫功能[99]。动物实验也表明,给予高脂高胆固醇饮食的小鼠青春双歧杆菌和鼠李糖乳杆菌后,发现这些益生菌可通过调节肠道微生物,增加肠道SCFAs的浓度抑制NAFLD的发展[82]。口服益生菌预处理小鼠还可降低LPS水平,增强肠细胞的肠道通透性,减少肝脏损伤和细菌易位,进而改善西方饮食引起的NAFLD[83]。益生菌也可通过影响BAs途径来缓解NAFLD,例如口服干酪乳杆菌YRL577后,NAFLD小鼠体内的脂质代谢、氧化应激和促炎细胞因子水平下降,并且口服干酪乳杆菌YRL577上调了FXR和成纤维细胞生长因子15的mRNA水平,下调了ASBTmRNA水平[84],这些结果说明干酪乳杆菌YRL577对肠道胆汁途径中基因的影响可能有助于NAFLD的减轻。总的来说,不同的益生菌菌株可以从不同方面改善NAFLD,可考虑作为NAFLD膳食补充策略,但是仍需要进行进一步的临床研究。
2.2 功能性低聚糖
功能性低聚糖近年来已成为改善NAFLD的研究热点。功能性低聚糖是一种益生元,研究已经证明其可促进肠道有益菌的增殖,抑制病原菌,可参与控制糖脂代谢、免疫和氧化损伤[100]。低聚木糖可通过改善肝脏氧化代谢和影响肠道微生物来改善Wistar大鼠的NAFLD[85],此外,经谷氨酸钠注射后用常规饮食诱导的肥胖小鼠,灌胃果聚糖后,改善了脂肪性肝炎,逆转了内脏脂肪含量的增加,并且增加了丁酸的水平[86]。壳聚糖对饮食型肥胖小鼠的肝脏有一定保护作用,明显减轻肝脂肪变性,调节脂质相关通路,尤其是抑制脂肪酸合成相关基因和炎症相关基因的表达,更重要的是,壳聚糖还降低了肠道菌群中Mucispirillum的丰度,增加了粪球菌属的丰度,并通过上调紧密连接相关基因的表达来保护肠道屏障[87]。张廷婷等[88]用黑木耳及其多糖干预大鼠的饮食,结果发现均显著增加了盲肠内SCFAs的含量,推测可能通过上调副拟杆菌属和拟杆菌属等产SCFAs菌群丰度来产生对机体有益的SCFAs以促进血脂代谢,二者还显著提高了大鼠粪便菌群中紫红球菌科或非消化糖杆菌属丰度,显著下调了促炎菌普雷沃菌属丰度,缓解高脂饮食摄入造成的肝炎。上述动物研究结果表明,在食物中加入低聚糖是一种有益于肝脏健康的干预方式,未来有望通过临床试验来评估寡糖对NAFLD患者的疗效。
2.3 膳食纤维
膳食纤维是一种不可消化的碳水化合物,含有3 个或3 个以上的单体单元,包括在谷物、豆类、水果和蔬菜等植物性饮食中[101]。研究表明,膳食纤维的摄入可阻止NAFLD的发展[102],增加营养膳食纤维的摄入可降低NAFLD患者血清Zonulin(肠道通透性标志物)水平,降低肝脏酶活力,改善肝脏脂肪变性,这可能是通过改变肠通透性引起的[89]。菊粉是一种在草本植物中发现的不可消化的膳食纤维,菊粉通过增加NAFLD小鼠肠道微生物群落的丰度(如阿克曼氏菌和双歧杆菌)以及降低Blautia丰度,提高了乙酸、丙酸和丁酸的含量,并抑制LPS TLR4-Mψ-NF-κB-NLRP3炎症途径而阻止NAFLD的发生[90-91]。此外,食用来自大豆壳的不溶性膳食纤维引起粪便微生物组成的改变,增加了有益菌如乳酸菌和双歧杆菌的丰度[103]。因此,膳食纤维的摄入从某种程度上来说对NAFLD具有一定的改善作用。
2.4 ω-3 PUFA
ω-3 PUFA的来源包括植物油中的α-亚麻酸和鱼油中的EPA和DHA,其中EPA和DHA具有抗脂肪和抗氧化作用,可以预防或改善炎症或NAFLD[92]。ω-3 PUFA有可能成为预防和治疗NAFLD的一种支持性选择。ω-3 PUFA通过3 种主要途径影响肠道微生物群:1)调节肠道微生物的种类和数量;2)改变LPS和IL-17等促炎症介质的水平;3)调节SCFA或SCFA盐的含量[93],进而改善NAFLD。此外,细胞水平的研究进一步揭示了ω-3 PUFA对人体细胞模型BAs稳态的影响,ω-3 PUFA降低了BAs合成相关基因的表达,产生毒性较小的BAs池,并且所产生健康的BAs谱已被确认为FXR配体,从而有助于维持肝脏健康和抑制肝脏炎症[94]。综上,ω-3 PUFA有可能成为预防和治疗NAFLD的一种支持性选择。
2.5 多酚
多酚属于植物中自然存在的高度多样化的一类化合物,各种多酚已被证明通过减轻胰岛素抵抗、氧化损伤和炎症以及加速脂肪酸β氧化,对NAFLD具有保护作用[104-105]。此外,多酚还具有调节肠道屏障功能完整性的功能。一项研究表明姜黄素对NAFLD大鼠肠屏障完整性有促进作用,免疫组化和Western Blot分析显示,NAFLD大鼠回肠远端组织ZO-1蛋白表达水平降低,但经灌胃姜黄素(200 mg/kg)4 周后得到恢复,此项研究强调了姜黄素通过改善体内肠屏障完整性,可能在NAFLD治疗中发挥作用[95]。也有研究报道了野生蓝莓多酚提取物对高脂高糖饮食肥胖小鼠肠道微生物的调节作用,并且对结肠上皮黏液层有一定的恢复作用,为黏膜相关共生菌提供合适的生态位,进而改善局部或者全身的健康状态[96]。苹果多酚提取物能够调节高脂饮食小鼠肠道微生物组成的多样性,增加阿克曼氏菌的丰度,同时通过抑制BAs的合成共同减轻NAFLD小鼠的肝脏脂肪变性[97]。因此,通过靶向肠-肝轴这些途径可说明多酚对肝脏健康有一定保护作用。
3 结语
肠道微生物组成与NAFLD密切相关,通过其自身成分或代谢产物介导NAFLD的发生发展。细菌内毒素、PGN、细菌DNA和OMVs诱导的炎症可能加速NAFLD的发展和NASH的发生。NAFLD患者出现肠道生物失调和肠屏障功能受损,进而加重肝组织对细菌成分的摄取,从而加剧免疫反应。肠道微生物产生的关键代谢物包括次级BAs、TMA及其氮氧化物、SCFAs、内源性乙醇以及近年来新发现的代谢物如琥珀酸盐、苯乙酸和3-(4-羟基苯基)乳酸,在宿主代谢、免疫细胞系统和氧化还原稳态中发挥调节作用,从而从根本上改变NAFLD的进展。尽管有关肠道微生物与肝病相互作用的研究取得了一些进展,但其潜在的机制尚未完全阐明。关于肠道微生物衍生因子对NAFLD的作用机制,需要对其细胞受体和宿主上潜在的信号通路进行全面的描述,因此需要更广泛的实验和临床研究。通过营养干预以肠道微生物群衍生因子和相关宿主细胞信号通路为目标,将为干预NAFLD提供一种新策略。膳食营养补充剂参与NAFLD的改善作用,有助于维持肠道微生物的稳态,从而改善肠屏障功能,维持有益代谢产物的稳态,并减少细菌和有害因子向肝脏的迁移。需要更进一步研究特定营养素对肠-肝轴有益作用的机制,从而为预防和改善NAFLD提供依据。

