河流网箱养殖与池塘养殖鲤鱼营养及品质评价
梁释介 丁 宁 冯淳淞 闫有利 罗永康*
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.辽宁省淡水水产科学研究院,辽宁 辽阳 111000)
鲤鱼(Cypinuscarpio)属鲤科,是我国重要的淡水鱼。鲤鱼富含优质蛋白质,营养价值高,尤其在夏季体型肥硕结实、味道鲜美,广受消费者喜爱[1],2020年我国鲤鱼产量达289.6万t[2]。鲤鱼品质受到多种因素的影响,如养殖环境、饵料、年龄和季节等[3]。随着社会经济的发展,消费者对鲤鱼的营养品质提出了更高的要求。
淡水鱼的养殖方式有池塘养殖、集装箱式养殖、稻田养殖、网箱养殖等[4-5]。关于不同养殖模式对鱼肉营养品质的影响研究已有报道。叶香尘等[6]分析了稻田和池塘养殖模式下金边鲤和建鲤肌肉营养成分、理化特性和质构特性,并进行营养价值评价,发现稻田金边鲤肌肉比建鲤和池塘金边鲤肌肉更富有嚼劲,其肌肉中必需氨基酸、不饱和脂肪酸及高度不饱和脂肪酸含量更高,且组成比例更符合人体需求。池塘养殖的匙吻鲟肌肉粗脂肪总量、n-3多不饱和脂肪酸/n-6多不饱和脂肪酸的比值、二十碳五烯酸和二十二碳六烯酸总量均显著低于网箱养殖的匙吻鲟,网箱养殖的匙吻鲟具有较好的食用价值和保健作用[7]。微流水养殖的齐口裂腹鱼肌肉中氨基酸总量、必需氨基酸总量、鲜味氨基酸总量、n-3多不饱和脂肪酸/n-6多不饱和脂肪酸的比值均显著高于网箱养殖的齐口裂腹鱼,微流水养殖的齐口裂腹鱼拥有更加鲜美的味道和更好的口感,且营养价值更高[8]。以上研究结果均表明不同养殖方式、不同饲喂条件均能造成鱼肌肉营养成分和品质出现差异。网箱养殖一般位于环境优良的湖泊和河流,通过投喂天然饵料,模拟鱼类野生生活环境,从而获得品质优良的养殖鱼。目前鲤鱼的养殖方式以传统池塘养殖为主,研究证明不同养殖模式因其环境的水质状况及养殖用料都对鱼类的生长特性、肉质风味等有重要影响[9-14],而关于河流网箱养殖与池塘养殖模式下鲤鱼鱼肉品质差异对比的报道较少。
本研究拟采用感官评价得分、色泽、肌苷酸含量评价2种养殖方式的鲤鱼肉的感官品质,采用营养成分(粗蛋白、粗脂肪、水分、灰分)、氨基酸组成、蛋白质体外模拟消化率、模拟消化后相对分子质量分布以及蒸煮得率等指标评价2种养殖方式鲤鱼肉的营养品质,旨在全面了解新养殖模式下鲤鱼鱼肉的营养品质,为推动绿色养殖渔业的高效发展提供理论依据。
1 材料与方法
1.1 试验材料
本试验于2022年在中国农业大学食品科学与营养工程学院进行。河流网箱养殖鲤鱼与池塘养殖鲤鱼由盘锦辽河绿水湾休闲娱乐有限公司提供。河流网箱养殖鲤鱼先在池塘中培育至1 kg,之后转移至辽河入海口的网箱中养殖20天,整个养殖期间定期投喂天然沙蚕。池塘养殖鲤鱼投喂普通饲料,不投喂天然沙蚕。本试验所用河流网箱养殖鲤鱼平均体长(52.50±0.50) cm,平均体重(1.87±0.03) kg;所用池塘养殖鲤鱼平均体长(51.33±0.47) cm,平均体重(1.72±0.03) kg。
胰蛋白酶、胃蛋白酶、氨基酸标品及肌苷酸标品购自美国Sigma-Aldrich公司;异硫氰酸苯酯、高氯酸、浓硫酸、盐酸、氨水、氢氧化钠、氯化钠、三乙胺均为分析纯,购自国药集团化学试剂有限公司;甲醇、乙醇、乙腈为色谱纯,购自美国Fisher Scientific公司。
1.2 仪器及设备
FE-20 pH计,上海梅特勒托利多科技有限公司;LC-16高效液相色谱仪,日本Shimadzu公司;TGL16A冷冻离心机,长沙平凡仪器仪表有限公司;NR110手持色差仪,深圳3nh科技有限公司;SM-28-10马弗炉,天津市华北实验电炉厂;KDY-9820凯氏定氮仪,北京通润源机电仪器设备公司。
1.3 试验方法
1.3.1 样品前处理
选取大小均一、形态相近的2种养殖方式鲤鱼,均用塑料袋充氧密封运输至实验室,击晕后迅速进行去鳞、去头、去内脏处理,沿脊椎取背部白肉后立即测定各项指标。
1.3.2 感官评价
感官评价参考刘月月等[15]的方法。由11名(5男6女)训练有素的实验室成员进行感官评价。每位评价人员分别对生鲜和蒸煮过的鲤鱼肉进行感官评价,生鲜鱼肉的评价指标包括质地、色泽、清香味、土腥味、鱼腥味、总体可接受度;蒸煮后鱼肉的评价指标包括质地、口感、色泽、清香味、土腥味、熟鱼味、汤汁浑浊度、总体可接受度。以1~5分对以上指标进行评价,分数越高表示指标越好或气味越强烈。
1.3.3 色泽测定
采用NR110手持色差仪对鲤鱼背部肉的特定3个部位进行肉色测定,结果以L*(亮度值),a*(红绿值),b*(黄蓝值)和白度值表示。每个部位测量3次,取平均值。
1.3.4 肌苷酸(IMP)质量摩尔浓度测定
取1 g绞碎的鱼肉于离心管中,加入10%高氯酸2 mL,5 000 r/min离心3 min,取上清于50 mL离心管中;向沉淀中加入2 mL 5%冷高氯酸,涡旋振荡1 min,5 000 r/min离心3 min,洗涤2次,合并上清液。用10 mol/L氢氧化钾、1 mol/L氢氧化钾、5%高氯酸调节上清液pH至6.4±0.05,5 000 r/min离心3 min,重复清洗沉淀1次,合并上清液。然后用中和冷高氯酸定溶于预冷后的10 mL容量瓶中,反复颠倒摇匀15次以上,取7~8 mL,用高效液相色谱测定IMP质量摩尔浓度,结果以μmol/g计。采用COSMOSIL 5C18-PAQ 反相色谱柱(4.6 I.D.×300 mm);流速:1.0 mL/min;柱温:35 ℃;检测波长:254 nm;进样量:20 μL[16]。
1.3.5 基本营养成分测定
粗蛋白测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[17];水分测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18];灰分测定参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》[19];粗脂肪测定采用Bligh等[20]的方法。
1.3.6 氨基酸组成及质量分数测定
称取60 mg样品于水解管中,加入6 mL 6 mol/L HCl并在110 ℃下水解22 h。取冷却后的水解液1 mL于称量皿中,在42 ℃烘箱内干燥至盐酸完全挥发,加入0.1 mol/L HCl复溶。取复溶后的样品200与离心管中,与1 000.1 mol/L异硫氰酸苯酯和100 三乙胺混合均匀。在室温黑暗条件下放置1 h后加入400 正己烷,充分震荡1 min后静置。分层后,取下层溶液,用高效液相色谱测定其氨基酸组成与质量分数。采用Agilent ZORBAX SB-C18 液相色谱柱(4.6 I.D×250 mm);检测波长:254 nm;进样量:5;流动相A:10 mmol/L 的磷酸缓冲液(pH 6.9);流动相B:乙腈。
1.3.7 蛋白体外消化率的测定
参照Gao[11]的方法,精确称取10 g绞碎的鱼肉样品,加入100 mL去离子水,加入鱼肉质量1%的胃蛋白酶,用6 mol/L HCl调pH至2.0,37 ℃酶解1 h。再用2 mol/L NaOH将pH调至8.0后加入鱼肉质量1%的胰蛋白酶,37 ℃酶解1 h后消化结束,立即95 ℃水浴灭酶10 min。将消化液离心(10 000 r/min,5 min),分离上清液和沉淀,冻干。取上清液的冻干粉测定其相对分子质量分布,取沉淀的冻干粉测定其蛋白消化率。采用凯氏定氮法测定消化前鱼肉和消化后沉淀的蛋白质质量,蛋白消化率计算公式为:
式中:DT表示蛋白消化率,%;M0表示消化前鱼肉的蛋白质质量,g;M1表示消化后沉淀的蛋白质质量,g。
1.3.8 模拟消化后相对分子质量分布
参照Wang等[22]的方法将待测样品溶解在缓冲液(含0.1%三氟乙酸的45%乙腈水溶液)中配置成2 mg/mL的样品,并且用孔径为0.22 μm的滤膜过滤,用高效液相色谱测定其相对分子质量。色谱柱型号为TSK gel G2000 SWXL凝胶柱(7.8 I.D.×300 mm),流动相为含0.1%三氟乙酸和45%乙腈水溶液,设定每次进样25 μL,洗脱流速为0.5 mL/min,检测紫外光波长设定为220 nm。用低聚肽校正曲线标准品建立保留时间和相对分子质量对数之间的校准曲线。
1.3.9 蒸煮得率
取背部肉切成1.5 cm×1.5 cm×1.0 cm大小的鱼块,用电子天平精确称重(W0),于85 ℃水浴锅中加热15 min。取出后待鱼块冷却至室温,吸去表面水分后再精确称重(W1)并记录,计算公式如下:
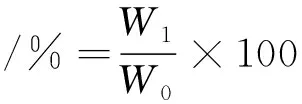
1.4 数据处理
试验结果采用SPSS 17.0软件进行统计分析,显著性检验采用Duncan检验,在P<0.05水平上差异为显著。使用Excel 2021绘图。每组试验平行测定3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 感官评价
河流网箱养殖鲤鱼生肉的质地、色泽和清香味平均分数略高于池塘养殖鲤鱼生肉,河流网箱养殖鲤鱼生肉的鱼腥味和土腥味平均分数低于池塘养殖鲤鱼生肉(图1(a))。河流网箱养殖鲤鱼熟肉的质地和口感平均分数高于池塘养殖鲤鱼生肉,河流网箱养殖鲤鱼熟肉的色泽和汤汁浑浊度略低于池塘养殖鲤鱼生肉(图1(b))。从总体可接受度来看,河流网箱养殖鲤鱼更受感官评价人员青睐。
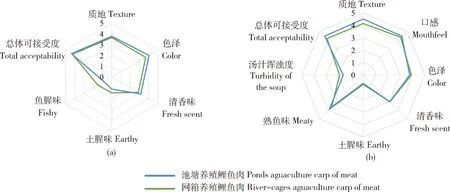
图1 池塘与河流网箱养殖生(a)、熟(b)鲤鱼肉感官评价雷达图Fig.1 Sensory evaluation radar chart of raw (a) and cooked (b) carp cultured in ponds and river-cages
2.2 色泽
池塘养殖鲤鱼肉的亮度值L*和白度值显著(P<0.05)低于河流网箱养殖鲤鱼肉,红绿值a*和黄蓝值b*无显著性差异(表1)。
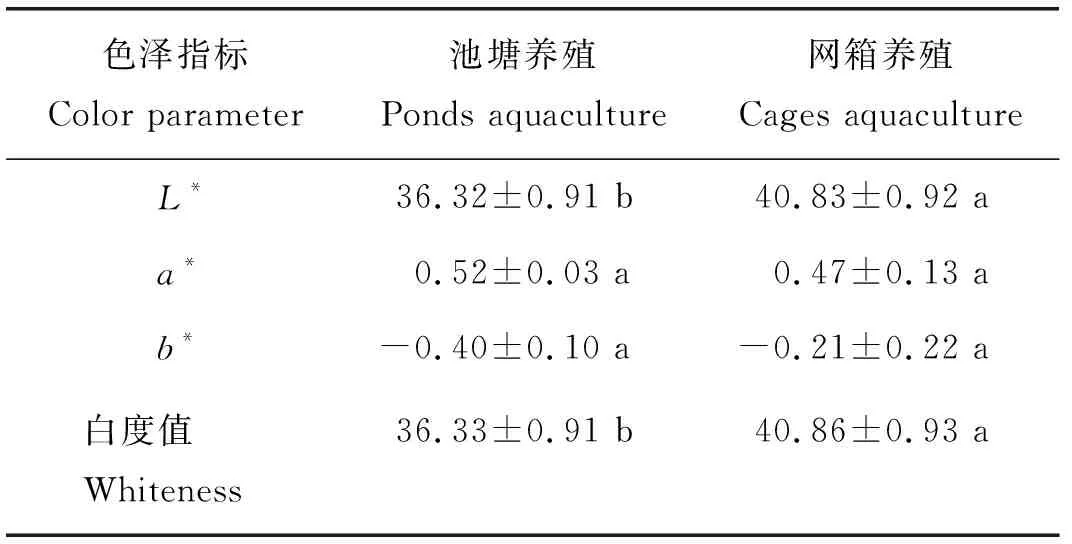
表1 池塘与河流网箱养殖鲤鱼肉色泽比较Table 1 Color comparison between ponds and river-cages cultured carp meat
2.3 肌苷酸(IMP)质量摩尔浓度
池塘养殖和河流网箱养殖鲤鱼肉IMP的质量摩尔浓度分别为2.95和5.85 μmol/g。池塘养殖鲤鱼肉的IMP的质量摩尔浓度显著(P<0.05)低于河流网箱养殖鲤鱼肉。
2.4 营养组分
池塘养殖鲤鱼肉的粗蛋白和粗脂肪含量显著(P<0.05)低于河流网箱养殖鲤鱼肉,水分含量与灰分含量没有显著差异(表2)。
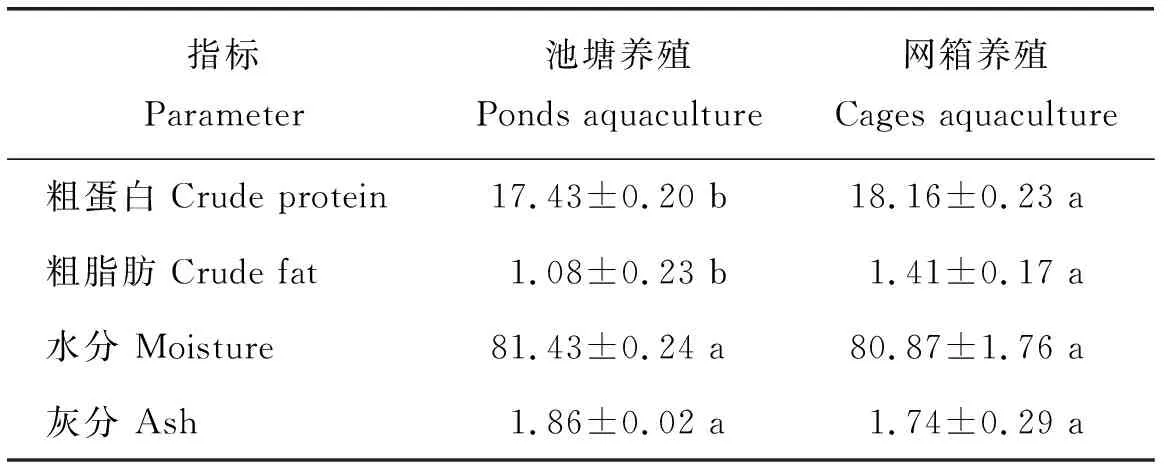
表2 池塘与河流网箱养殖鲤鱼肉营养组分的质量分数Table 2 Mass fraction of nutrient components of ponds andriver-cages cultured carp meat %
2.5 氨基酸组成及含量
为了更好地比较2种鱼肉的营养价值,本试验测定了新鲜鱼肉的氨基酸组成与含量,结果见表3。河流网箱养殖鲤鱼肉中天冬氨酸、谷氨酸、丝氨酸、甘氨酸、苏氨酸、丙氨酸、缬氨酸、半胱氨酸、异亮氨酸、赖氨酸的质量分数显著(P<0.05)高于池塘养殖鲤鱼肉。2种养殖方式鲤鱼肉中质量分数最高的氨基酸均为谷氨酸,质量分数最低的氨基酸均为半胱氨酸。池塘养殖鲤鱼肉总氨基酸(TAA)的质量分数、总必需氨基酸(TEAA)的质量分数、总非必需氨基酸(TNEAA)的质量分数、总鲜味氨基酸(TDAA)的质量分数均显著(P<0.05)低于河流网箱养殖鲤鱼肉。
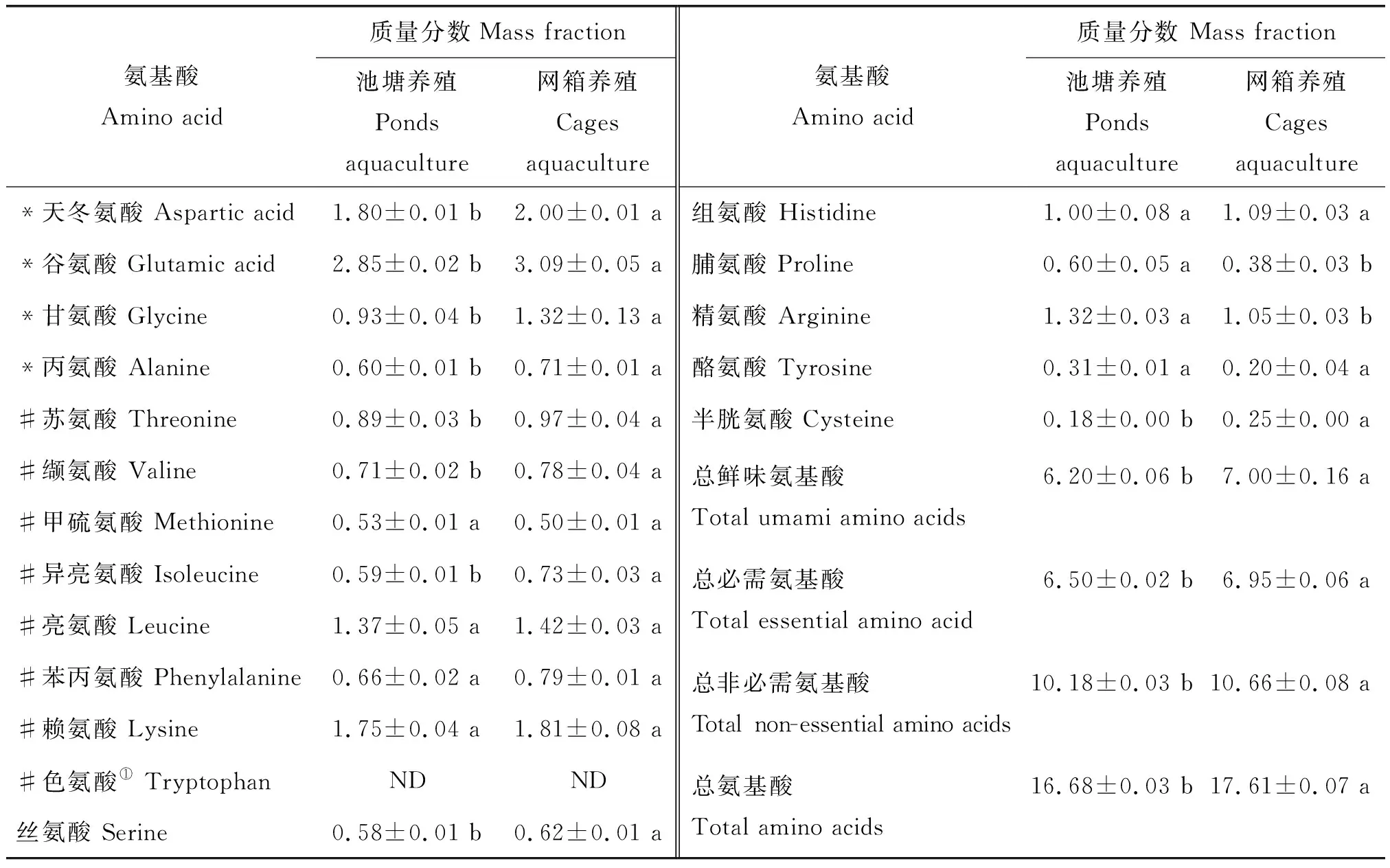
表3 池塘与河流网箱养殖鲤鱼肉中氨基酸组成与质量分数Table 3 Amino acid composition and content of ponds and river-cages cultured carp meat g/100 g
2.6 蛋白质体外模拟消化率
池塘养殖和河流网箱养殖鲤鱼肉的蛋白质体外模拟消化率分别为55.86%和67.13%,池塘养殖鲤鱼肉的蛋白体质外模拟消化率显著(P<0.05)低于河流网箱养殖鲤鱼肉。
2.7 模拟消化后相对分子质量分布
池塘养殖与河流网箱养殖鲤鱼肉经体外胃肠模拟消化后产物中相对分子质量小于500的肽分别占17.52%和17.39%,相对分子质量小于1 000的肽分别占38.75%和39.85%,相对分子质量小于2 000的肽分别占63.58%和64.92%,均没有显著差异。
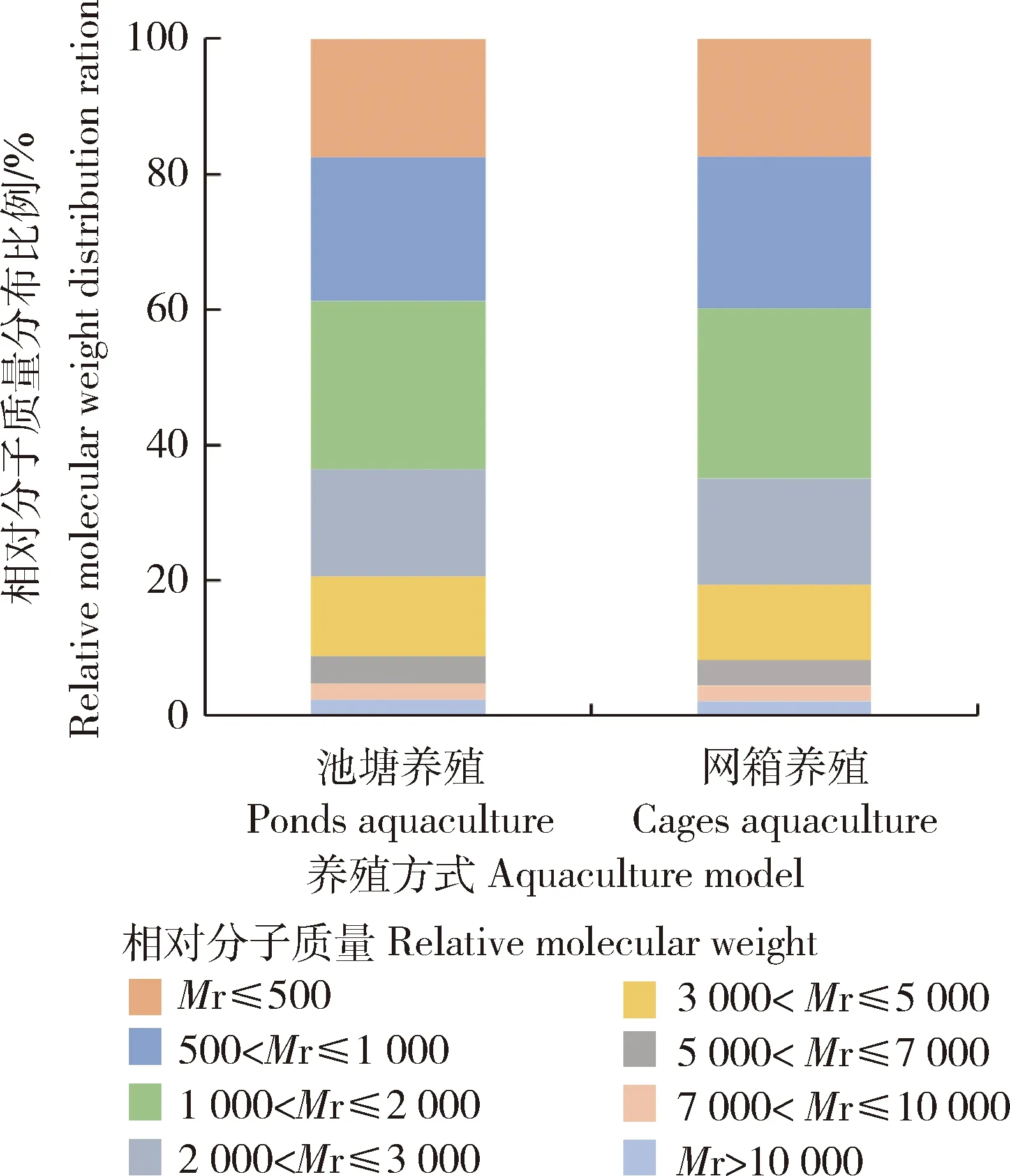
图2 池塘与河流网箱养殖鲤鱼肉经体外 模拟消化后相对分子质量分布Fig.2 Relative molecular weight distribution of carp meat cultured in ponds and river-cages after simulated digestion in vitro
2.8 蒸煮得率
池塘养殖与河流网箱养殖鲤鱼肉的蒸煮得率分别为78.91%和83.11%。池塘养殖鲤鱼的蒸煮得率显著(P<0.05)低于河流网箱养殖鲤鱼。
3 讨 论
3.1 2种养殖方式鲤鱼肉感官品质比较分析
养殖鲤鱼生肉具有更好的质地和色泽,且清香味更强、鱼腥味和土腥味更淡;河流网箱养殖鲤鱼熟肉的质地和口感更佳;河流网箱养殖鲤鱼生、熟肉总体可接受度更佳。这可能是由于网箱布置于辽河入海口,养殖区宽阔、水质优良、水流更新速度较快,水体不易富集有害物质;而池塘养殖空间范围有限,水体容易受到污染,富集有害物质,鱼体更易受到污染,产生不良气味,进而影响鱼肉品质。鱼肉的色泽受到脂肪含量、色素细胞以及肌原纤维结构的影响[23]。河流网箱养殖鲤鱼肉亮度值L*和白度值更大说明其肌原纤维结构更紧实。这可能与河流网箱养殖鲤鱼游动更充分、捕食行动更为活跃有关。
肌苷酸(IMP)又称次黄嘌呤核苷酸,是鱼体内ATP代谢过程的中间产物,广泛的分布于体内,具有一定的生物活性,参与生物能量代谢的调节[24-25],并且IMP是鱼肉主要呈味物质,含量越高鱼肉越新鲜,味道越鲜美[26-27]。IMP的生成和降解主要在鱼体尸僵时发生。鱼类在死后几个小时内ATP迅速降解,导致肌苷酸逐渐累积,随后逐渐降解,并产生苦味的次黄嘌呤(Hx)。IMP的生成主要由来自于鱼肉本身的内源酶催化,与鱼体所带的微生物无关,IMP的降解则由鱼肉内源酶和微生物的酸性磷酸酶共同催化[28]。河流网箱养殖鲤鱼肉IMP含量显著(P<0.05)高于池塘养殖鱼肉,说明河流网箱养殖鲤鱼肉味道更鲜美,这可能是因为池塘养殖鱼肉中降解ATP的相关内源酶活性较弱,鱼体所带微生物较多,能产生大量降解IMP的酶。此外,河流网箱养殖鲤鱼肉的蒸煮得率显著(P<0.05)高于池塘养殖鱼肉,鱼肉在蒸煮过程中的高温作用会导致鱼肉肌原纤维蛋白变性,蛋白质空间结构发生变化,导致部分水分流失[29],河流网箱养殖鲤鱼肉的蒸煮得率更高表明其肌原纤维蛋白在蒸煮过程中热变性程度更小,持水能力更强,蒸煮后鱼肉更加细嫩,这与感官评价结果“河流网箱养殖鲤鱼熟肉的质地和口感更佳”一致。
3.2 2种养殖方式鲤鱼肉营养品质比较分析
河流网箱养殖鲤鱼肉的粗蛋白和粗脂肪含量较高,而河流网箱养殖鲤鱼在整个养殖期间饲喂天然沙蚕这种高蛋白质、高脂肪食物[30]可能是主要原因。
蛋白质的氨基酸组成及含量是评价鱼肉蛋白质营养价值的重要指标[31]。根据FAO/WHO的氨基酸标准模式,高质量蛋白质需要满足的条件为氨基酸组成高质量蛋白质需要满足的条件为,氨基酸组成中,总必需氨基酸质量分数(wTEAA)与总氨基酸质量分数(wTAA)的比值>40%,总必需氨基酸质量分数(wTEAA)与总非必需氨基酸质量分数(wTNEAA)的比值>60%[32]。池塘与河流网箱养殖鲤鱼肉wTEAA与wTAA的比值分别为37.96%和39.49%,池塘与河流网箱养殖鲤鱼肉wTEAA与wTNEAA的比值分别为63.83%和65.25%,说明池塘与河流网箱养殖鲤鱼肉氨基酸平衡较好,都属于优质蛋白质。而河流网箱养殖鲤鱼肉wTEAA与wTAA的比值显著(P<0.05)高于池塘养殖鲤鱼肉,表明河流网箱养殖鲤鱼肉的蛋白质品质优于池塘养殖鲤鱼。鱼肉中鲜味氨基酸的组成和含量与鱼肉的鲜美程度有关[33],其中天冬氨酸和谷氨酸是呈鲜味的特征氨基酸,甘氨酸和丙氨酸是呈甘味的特征氨基酸[34]。河流网箱养殖鲤鱼的鲜味氨基酸和IMP含量均显著(P<0.05)高于池塘养殖鲤鱼肉,说明河流网箱养殖鲤鱼肉味道更鲜美,风味更佳。
为更好地比较2种养殖方式鲤鱼肉的蛋白质营养价值,本试验通过体外模拟消化测定了鱼肉的蛋白质体外模拟消化率。鱼肉中蛋白质在消化道内被蛋白酶酶解成大小不一的肽段,蛋白质的消化率越高,表示其越容易被机体的消化吸收[35]。河流网箱养殖鲤鱼肉的蛋白体外模拟消化率更高,表明其更容易被人体消化吸收。
4 结 论
本研究采用感官评价得分、色泽、肌苷酸含量评价河流网箱养殖与池塘养殖鲤鱼的感官品质,采用营养成分(粗蛋白、粗脂肪、水分、灰分)、氨基酸组成、蛋白质体外模拟消化率、模拟消化后相对分子质量分布以及蒸煮得率等指标评价营养品质。河流网箱养殖鲤鱼肉鲜味物质(IMP)含量较池塘养殖鲤鱼肉高,感官评价结果显示其具有更好的口感和风味。河流网箱养殖鲤鱼肉肌纤维结构更紧实,呈现出更好的色泽,并且蛋白质和脂肪含量、体外模拟消化率、总氨基酸含量、总必需氨基酸含量、总非必需氨基酸含量、总鲜味氨基酸含量、总必需氨基酸含量与总氨基酸含量的比值、总必需氨基酸含量与总非必需氨基酸含量的比值均显著高于池塘养殖鲤鱼肉,表明河流网箱养殖鲤鱼肉氨基酸组成更均匀、含量更高、营养价值更高,是优秀的蛋白质来源。

