地方小麦品种贵协3号赤霉病抗性QTL的定位与效应鉴定
郑首航,何员江 ,陶 军 ,张 华,吴 舸,邹凤亮 ,杜小英,欧俊梅,雷加容 ,闫海生,贾海燕,任 勇
(1.绵阳市农业科学研究院,四川绵阳,621000; 2.南京农业大学农学院,江苏南京,210095)
由镰刀菌引起的赤霉病对小麦生产危害严重,可导致小麦产量和品质下降[1]。近年来,由于全球气候变暖、免耕技术的推广以及秸秆还田等原因,国内外小麦赤霉病的发生和流行程度日趋严重,引起国际广泛关注[2]。该病在中国常年发生面积在267万~333万hm2,且有逐渐扩大的趋势[3],流行区域由传统的长江中下游、黄淮麦区向华北麦区蔓延。由于赤霉病抗性受环境影响大以及抗病机制复杂,致使小麦抗赤霉病育种进展缓慢,目前大面积推广的品种赤霉病抗性普遍较差[4]。在已发现的赤霉病抗源中,仅有中国地方品种望水白和苏麦3号表现较为突出[5]。挖掘抗病基因,解析分子机制以及培育抗赤霉病小麦品种,是小麦抗赤霉病育种工作的重中之重。
小麦在受到赤霉病病原菌侵染后,会产生一系列复杂的信号途径激活应答反应,诱导抗病相关基因的表达,进而引起蛋白以及代谢水平的变化,抵御病原菌的侵袭。小麦对赤霉病的抗性包括抗侵入(Type Ⅰ)、抗扩展(Type Ⅱ)、抗毒素积累(Type Ⅲ)、降低病粒率(Type Ⅳ)和耐病性(Type Ⅴ)五种类型[6],是受多基因控制的数量性状。随着小麦基因组学的发展,借助DNA分子标记和遗传图谱,已定位到400多个抗赤霉病基因/QTLs[7],分布在小麦21条染色体上,这些基因/QTLs主要来自苏麦3号及其衍生系和望水白[7-8],其中Fhb1~Fhb7已被精细定位[9-16]。前人在CM82036[17]、DH181[18]、W14[19]、周麦27[20]等品种中均鉴定到Fhb5基因,是目前抗性最强、最稳定的抗侵入相关基因[21]。
贵协3号是贵州省农业科学院旱粮研究所2008年用以色列野生二粒小麦(Triticumdicoccoides)为母本,用光稃野燕麦 (AvenafatuaL.var.glabratapat)为父本进行远缘杂交,获得的F1代与贵农22回交获得的普通小麦材料。2013年,经国家小麦产业技术体系在江苏海安、南京和湖北武汉三地的赤霉病抗性鉴定中,贵协3号表现为中抗至抗病,2014年在海安试验点也表现出较好的抗性,病情指数低于抗病对照品种苏麦3号[22],但目前尚未有贵协3号抗赤霉病QTL的定位报道。本研究以感赤霉病品种绵麦96-5和贵协3号构建的含有196个株系的DH群体为材料,结合两年两个地区的赤霉病严重度数据,挖掘与赤霉病抗性相关的QTL,并分析其聚合效应,以期了解贵协3号抗赤霉病的遗传基础,为小麦抗赤霉病育种提供帮助。
1 材料与方法
1.1 供试材料及田间种植
试验材料为贵协3号和绵麦96-5及其杂交F1代通过花药培养、染色体加倍获得的含有196个株系的DH群体。贵协3号由贵州省农业科学院旱粮研究所提供,绵阳96-5为四川省绵阳市农业科学研究所自育品系。
于2018和2019年将DH群体及其亲本分别种植在南京农业大学试验基地和四川省绵阳市农业科学研究院试验田(分别用2018NJ、2019MY表示),进行赤霉病抗侵入表型鉴定,以贵协3号和绵麦96-5分别作为抗、感病对照。四种强致病菌种F15、F301、F7136以及GFP标记过的菌株WT-GFP由南京农业大学应用基因组实验室提供。
采用随机区组试验设计,每三行设置一空行,每个株系2个重复,行宽1.5 m,行距0.3 m,每行播种25粒。
1.2 田间接种及抗性鉴定
将小麦籽粒在清水中浸泡过夜,在沸水中煮30 min,晾干表面水分后分装至500 mL组培瓶中,121 ℃灭菌30 min后,于烘箱中烘干3~5 min,即为麦粒培养基。将四种强致病菌种F15、F301、F7136以及GFP标记过的菌株WT-GFP接种在麦粒培养基中,室温培养10 d左右,待培养基表面布满白色菌丝后,于开花前4 d在田间进行撒播,撒播小麦病麦粒后,尽量保持湿润,于开花后10 d进行抗性表型鉴定,调查病小穗数和总小穗数,每个株系调查20个穗,严重度计算采用下面公式:严重度(%)=病小穗数/总小穗×100%[21],取平均值记为株系的严重度。3次重复。鉴定圃周围试验田未进行其他菌株和其他病原菌接种。
1.3 统计分析
根据赤霉病严重度,将DH群体的196个株系分为三种不同的表型:抗病亲本类型(严重度在10%以下)、感病亲本类型(严重度在10%~50%之间)和不同于亲本的其他类型(严重度在50%以上)[23]。
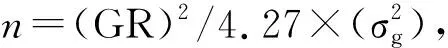
1.4 基因型分型、连锁图谱的构建和QTL分析
采用SPSS Statistics 17.0对表型数据进行t检验、相关性分析等。用CTAB法[24]提取DH群体及亲本的DNA,用澳大利亚基因芯片公司的55K DArT标记基因芯片杂交技术平台对196个DH株系及亲本进行全基因组扫描,利用QTL IciMapping V4.1软件的BIN功能对冗余标记进行删除,筛选出两亲本间存在多态性的标记,并进行连锁图谱的构建,利用完备区间作图法(ICIM)对QTL进行定位分析;通过软件的1000 permutation功能计算LOD阈值,P值设定为0.05,检测QTL的显著性。与中国春最新参考基因组(IWGSC RefSeq v1.0)进行比对,获得标记的物理位置。
2 结果与分析
2.1 DH群体的赤霉病严重度鉴定结果
感病亲本绵麦96-5在2018年江苏南京和2019年四川绵阳试验基地的赤霉病平均严重度为36%和53%,而抗病亲本贵协3号的平均严重度为13%和20%,DH群体的平均严重度为5%~93%,该群体后代株系的严重度均呈现连续性变异(图1),分布频率基本符合正态分布,表明该群体的赤霉病严重度属于数量性状,由多个基因控制。根据孟德尔遗传分析法和数量性状分析法,估算该群体至少含有2~4个抗侵入基因/QTLs(表1和表2)。
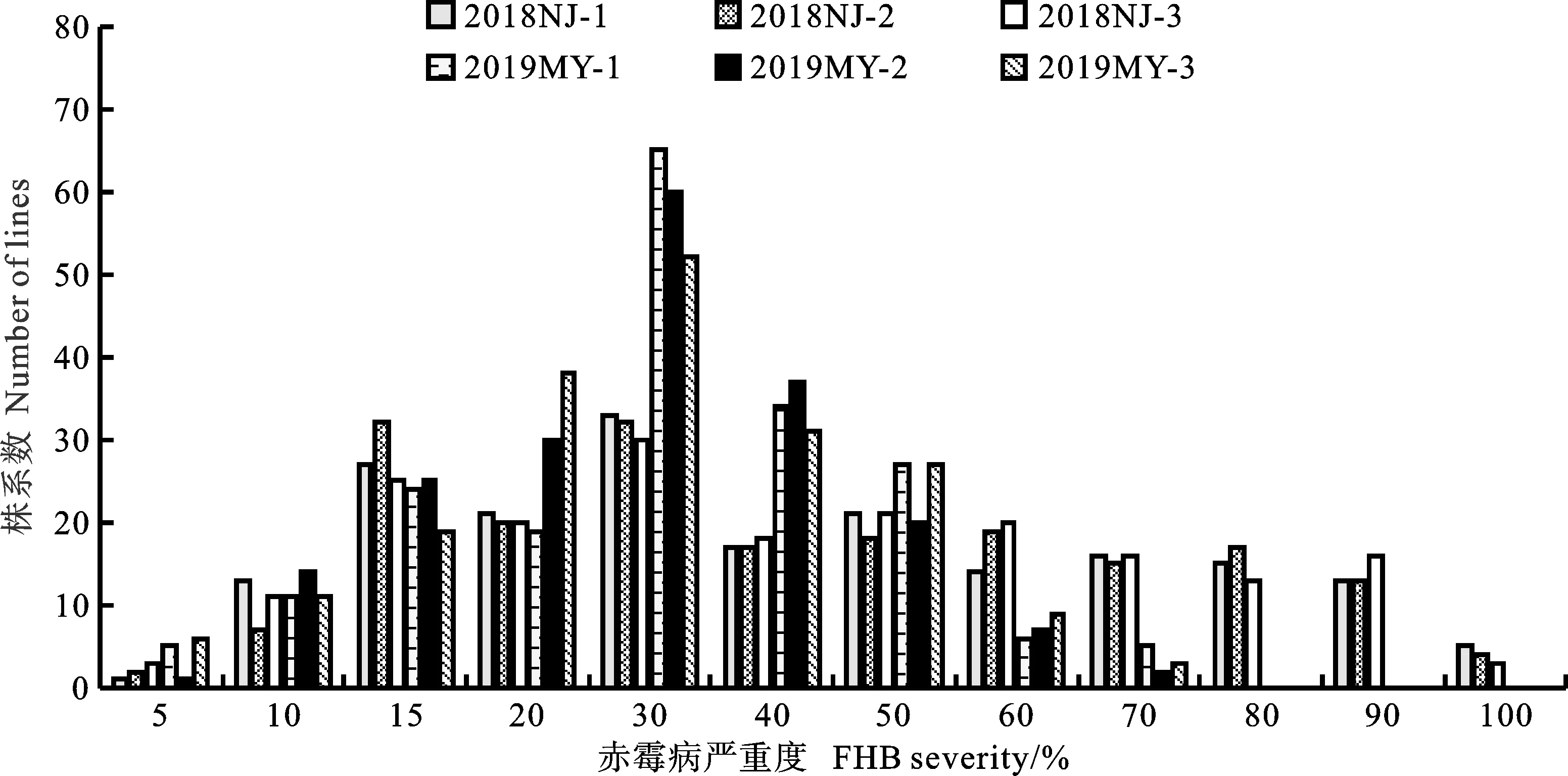
2018NJ:2018年南京;2019MY:2019年绵阳。表1~3同。1、2和3为3个重复。表1同。2018NJ:Naijing of 2018; 2019MY:Mianyang of 2019. The same in tables 1~3. 1,2 and 3 were three replicates. The same in table 1.图1 DH群体赤霉病严重度的频率分布Fig.1 Frequency distribution of FHB severity in DH population
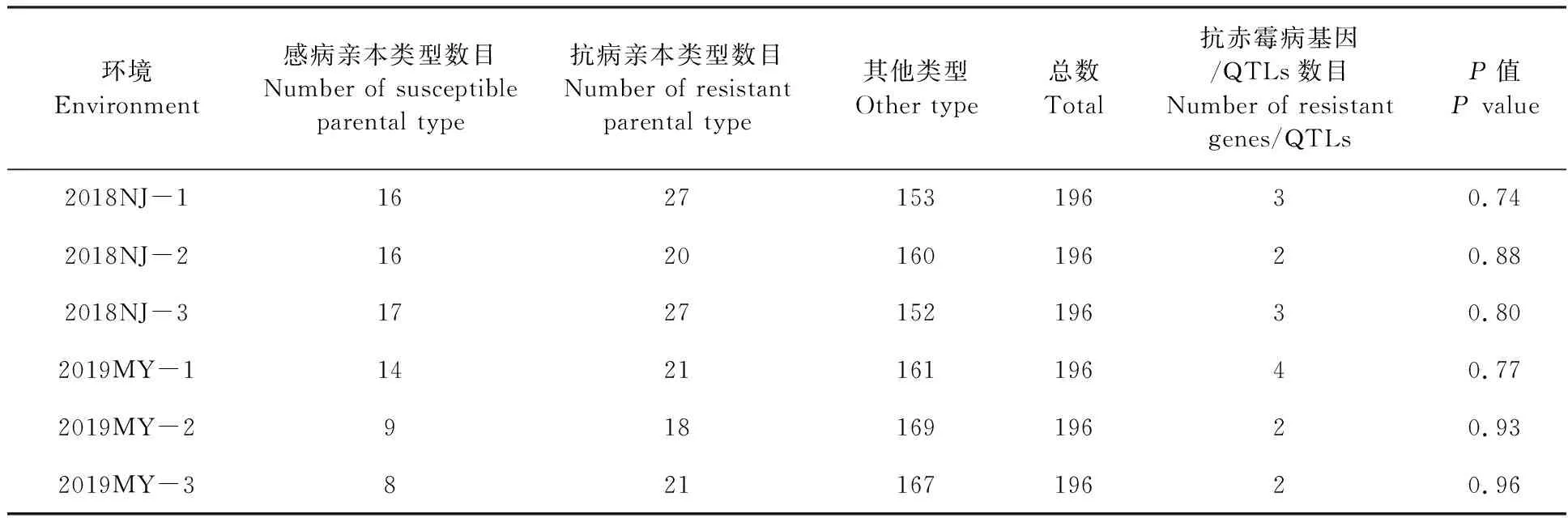
表1 孟德尔遗传分析法估算DH群体中含有的抗赤霉病基因数目Table 1 Number of FHB resistant genes in DH population evaluated by Mendelian genetic analysis method

表2 数量性状分析法估算DH群体中含有的抗赤霉病基因数目Table 2 Number of FHB resistance genes in DH population by quantitative genetic analysis method
2.2 遗传连锁图谱的构建
利用覆盖小麦21条染色体的大约373 60个标记的DArT-Seq芯片对亲本及196个株系进行基因分型,结果发现有13 472个DArT-Seq标记位点(占标记总数的36%)在亲本间具有多态性。利用QTL IciMapping V4.1软件的BIN功能,对冗余标记进行删除,最终获得1 432个DArT-Seq标记。这些标记构成的遗传连锁图谱覆盖小麦全基因组,图谱全长为15 195.8 cM,平均图距为10.6 cM。
2.3 抗赤霉病QTL的定位结果
共检测到3个抗赤霉病QTLs,其中QTL-FHB.GX-2B在2B染色体上,与AX-111081804标记紧密连锁;QTL-FHB.GX-5B在5B染色体上,与AX-111012188标记紧密连锁;QTL-FHB.GX-7A在7A染色体上,位于标记AX-110915586 ~AX-108934756之间,区间长度为16 cM (图2)。这3个QTLs的抗性等位基因均来自于抗病亲本贵协3号,LOD值分别为12.7、8.5和10.6,分别可解释1.5%、1.2%和1.3%的表型变异;这3个抗赤雷病QTLs在2018南京和2019绵阳两个环境下均能检测到,抗性表现较为稳定。
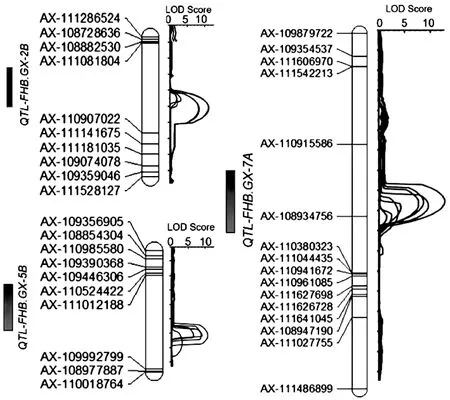
图2 抗赤霉病QTL在染色体上的分布Fig. 2 Distribution of QTLs for resistance to FHB on chromosomes of wheat
2.4 QTL的加性互作效应
利用与3个QTL紧密连锁的分子标记的基因型数据,分析其累加效应,结果在196个株系中共发现8种抗赤霉病单倍型(表3)。其中,32个株系含有3个抗赤霉病QTL,2018南京和2019绵阳两个环境的平均严重度分别为24%和30% (表3);72个株系含有2个抗赤霉病QTL,2018南京和2019绵阳两个环境的平均严重度分别为26%~31% 和36%~41%;68个株系只含有1个QTL,2018南京和2019绵阳两个环境的平均严重度分别为27%~32%和39%~46%;24个株系不含有检测到的抗赤霉病QTL,2018南京和2019绵阳两个环境的年平均严重度分别为33%和50%。这说明含有多个抗赤霉病QTL株系的赤霉病严重度明显低于含有单个和不含抗赤霉病QTL的株系。
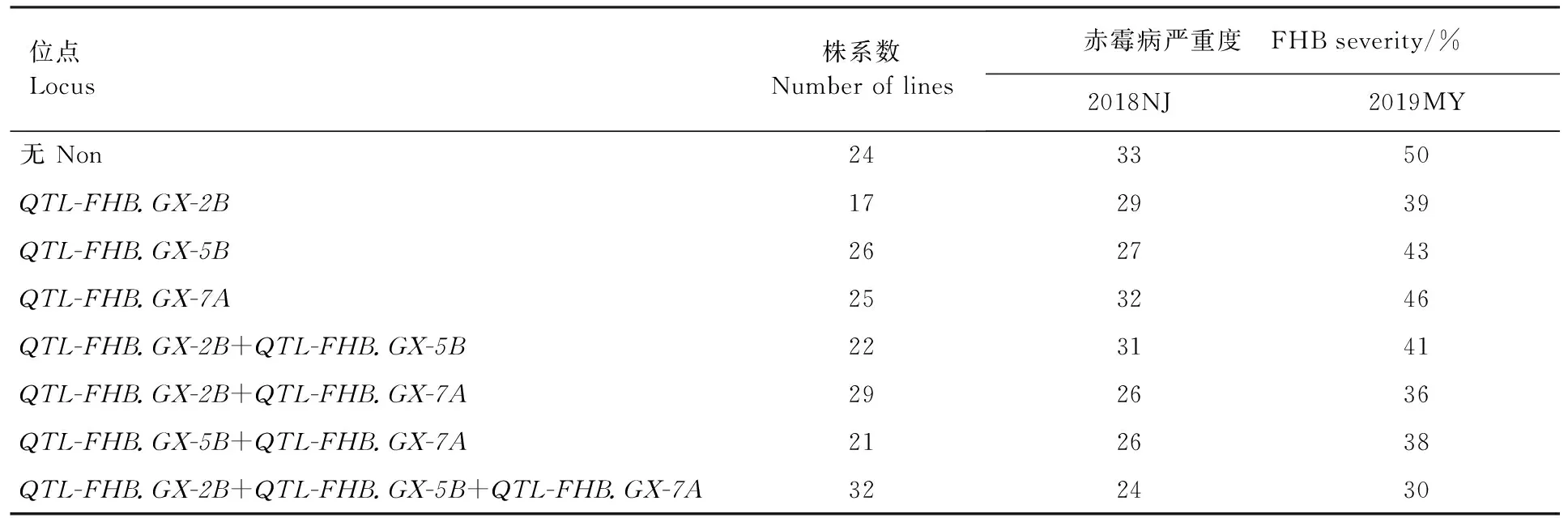
表3 QTL组合对赤霉病严重度的影响Table 3 Effect of QTL combinations to FHB severity
3 讨论
本研究利用数量性状分析法以及孟德尔遗传分析法,预测到 DH群体(贵协3号×绵麦96-5)的抗赤霉病性状受3~4个加性基因控制,进一步利用QTL IciMappingV4.1软件共定位到3个抗赤霉病QTL,与数量性状分析法估算群体中的基因数目基本一致。本研究在7A染色体上定位到的QTL-FHB.GX-7A(物理区间为15 681 840~91 358 341 bp),与Zhang等[25]在7A染色体上定位到的QTL(区间为21 763 191~33 614 065 bp)区间存在部分重叠,但尚不能确定是否为同一个基因。本研究定位到的3个QTL的抗性等位基因均来自于抗病亲本贵协3号,表型变异解释率为1.2%~1.5%,推测贵协3号的赤霉病抗性是多个微效基因的累加效应,后续将会采取相关试验进行进一步的验证。本研究同时也进一步证明,以色列野生二粒小麦与光稃野燕麦远缘杂交获得的贵协3号,对小麦赤霉病具有良好的抗性。在目前我国赤霉病危害不断蔓延的情况下,贵协3号可作为抗病资源在小麦抗病育种中加以利用。
在小麦抗赤霉病研究中,经国内外科学家的不懈努力,已经取得了长足的进展。如抗赤霉病基因Fhb1在美国、日本以及我国江苏等地区均已得到成功应用;抗性资源苏麦3号和望水白抗赤霉病位点的有利等位变异,也已进行了分子标记辅助选择聚合育种[26]。近几年我国不断加强对赤霉病的防控工作,已经培育出一批达到抗或中抗赤霉病的小麦新品种。但由于全球气温变暖和种植制度的不断改变,小麦赤霉病在我国已经从长江中下游、黄淮麦区扩展到全国各大麦区,加强小麦抗赤霉病的研究以及抗赤霉病新品种的选育任重而道远。

