小麦TaMAPK1基因的克隆及其功能研究
张潇予,吴保为,张思雨,马 猛,刘香利,赵惠贤
(西北农林科技大学生命科学学院,陕西杨凌 712100)
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是真核生物中普遍存在的一类保守丝氨酸/苏氨酸类蛋白激酶。其与MAPK激酶MAPKK(MKK/MEK)和MAPKK激酶MAPKKK(MKKK/MEKK)组成MAPK信号级联通路,在真核细胞的信号转导过程中起着至关重要的作用[1]。研究表明,MAPK信号级联通路参与植物生长发育以及多种生物、非生物胁迫响应过程[2]。在拟南芥中,共鉴定出20个MAPK基因(MAPK1~MAPK20),10个MAPKK基因(MAPKK1~MAPKK10),69个MAPKKK基因[3],在杨树和水稻中也发现了MAPK、MAPKK、MAPKKK基因库[4]。
小麦MAPK家族的研究较为滞后。已有研究发现,TaMKP3在小麦受到禾生球腔菌(Mycosphaerellagraminicola)侵染时上调表达[5];TaMAPK4可增强小麦对条锈病的抗性[6]。但这些报道主要集中在小麦MAPK参与抵抗生物与非生物胁迫的过程中,而对调控小麦生长发育的研究尚未见报道。
本课题组前期构建了小麦不同生长发育时期的microRNA库,并从中鉴定出一个小麦特异小RNA-miR5048(登录号:MI0030413)[7]。利用psRNA Target软件(http://plantgrn.noble.org/psRNATarget/)预测并结合试验发现,小麦miR5048的靶基因为MAPK基因(在IWGSC Ref. v1.0数据库中MAPK基因三个部分同源基因的ID分别为TraesCS6A01G118100、TraesCS6B01G146300和TraesCS6D01G108100,未发表),但其生物学功能目前尚不清楚。本研究对小麦6A、6B和6D染色体上三个MAPK基因编码的蛋白氨基酸序列、结构、基本性质、系统进化进行分析,并检测MAPK基因在小麦不同发育时期的时空表达谱;进一步创制转TaMAPK1基因拟南芥,了解该基因对转基因拟南芥表型和产量性状的影响,以期为后续研究MAPK基因在小麦生长发育过程中的生物学功能提供依据。
1 材料与方法
1.1 试验材料
供试小麦材料为中国春,由本实验室保存。选取颗粒饱满的小麦种子用纯净水浸泡,待吸胀后置于湿润的滤纸上萌发,培养条件为22 ℃、16 h光照/8 h黑暗,相对湿度为75%,培养至两叶期时取样,用液氮速冻后置于-80 ℃保存。
供试拟南芥材料为哥伦比亚(Columbia)生态型,简写为Col-0,拟南芥缺失突变体mapk1(SALK_063847C)购买于拟南芥信息资源库TAIR(https://www.arabidopsis.org/),培养条件为22 ℃,16 h光照/8 h黑暗,相对湿度为60%。
1.2 基因组DNA和总RNA的提取以及cDNA第一链的合成
用CTAB法提取拟南芥和小麦基因组DNA,用艾科瑞生物工程有限公司的植物RNA提取试剂盒(SteadyPure Plant RNA Extraction Kit)提取样品总RNA,提取后的DNA和RNA冻存于-80℃。用反转录试剂盒PrimeScriptTMII 1st Strand cDNA Synthesis Kit(Takara, 日本)合成cDNA第一链,于-20℃冻存。
1.3 TaMAPK1基因的克隆及载体构建
根据小麦基因组测序联盟IWGSC(International Wheat Genome Sequencing Consortium,http://www.wheatgenome.org/)公布的中国春MAPK基因(TraesCS6A01G118100)的CDS序列,设计特异性引物TaMAPK1-F/R(表1),以中国春叶片cDNA为模板,使用高保真酶KOD FX(TOYOBO,日本)进行PCR扩增。反应体系为50 μL,包括模板cDNA 0.5 μL,TaMAPK1-F/R引物各1.5 μL,高保真酶KOD FX 1 μL,2× Buffer 25 μL,dNTPs(各2 mmol·L-1)10 μL,ddH2O 10.5 μL。PCR反应程序:94 ℃2 min;98 ℃10 s,58 ℃30 s,68 ℃1 min,35个循环。用1%的琼脂糖凝胶电泳检测扩增产物,将目的片段进行胶回收纯化后,加poly-A连接到pMD19-T载体上,得到重组载体pMD19-T-TaMAPK1,将重组载体转化至大肠杆菌DH5α感受态细胞中,置于37 ℃培养箱过夜培养,挑取单克隆进行阳性鉴定,摇菌培养后提取质粒,送北京擎科生物科技有限公司进行测序。
利用带酶切位点的引物TaMAPK1-XbalI-F和TaMAPK1-BglII-R(表1)从测序正确的重组载体扩增得到目的基因TaMAPK1,将目的片段连接至植物双元表达载体pCAMBIA1304(含35S启动子)上得到表达载体p35S::TaMAPK1,然后将其转入大肠杆菌DH5α感受态细胞中,对重组载体进行测序以确保TaMAPK1的读码框正确。将构建成功的p35S::TaMAPK1重组载体转化至农杆菌EHA105感受态细胞中,置于28 ℃培养箱培养,挑取单克隆进行菌落PCR鉴定,将阳性单菌落摇菌并保存。
1.4 生物信息学分析
用DNAMAN进行TaMAPK1蛋白的氨基酸序列比对,用ExPASy(https://web.expasy.org/protparam/)对TaMAPK1蛋白的分子量、等电点、亲水性等理化性质进行分析,用SMART(http://smart.embl-heidelberg.de/)对TaMAPK1蛋白的保守结构域进行分析,用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对TaMAPK1基因启动子区的顺式作用元件进行分析。用MEGA 11(https://www.megasoftware.net/)对TaMAPK1蛋白进行系统进化分析,用Neighbor-joining法构建进化树,Bootstrap设置为1 000,用Evolview(http://evolgenius.info/)对进化树进行可视化。
1.5 拟南芥突变体的纯合鉴定
以mapk1突变体基因组DNA为模板,以Atmapk1-1-LP/RP/LBa1(表1)为引物,利用三引物法进行PCR扩增,在DNA水平上对突变体进行纯合鉴定。以mapk1突变体RNA反转录得到的cDNA为模板,以mapk1-F/R、AtACTIN-qPCR-F/R(表1)为引物,以AtActin为内参基因,采用半定量RT-PCR的方法在RNA水平上对突变体进行纯合鉴定。PCR反应体系均为20 μL,包括基因组DNA或模板cDNA 0.5~3 μL,上、下游引物各0.8 μL,2×Rapid Taq Master Mix(诺唯赞,南京) 10 μL,用ddH2O补足至20 μL;PCR反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共30个循环。PCR和半定量RT-PCR的产物均用1%的琼脂糖凝胶电泳进行鉴定,用JY04S-3C型凝胶成像仪观察并拍照记录。
1.6 转基因拟南芥的创制
待野生型拟南芥Col-0和mapk1突变体开花后,去掉顶端花序,约一周后剪掉已长成的果荚。用农杆菌介导的花器浸蘸方法[8]进行拟南芥遗传转化。侵染完成后,用保鲜膜覆盖侵染后的整株拟南芥,避光24 h后采用常规条件培养,直至种子收获。将收获的拟南芥种子用土培法进行培养,在独立转基因事件的每一代幼苗叶面喷施100 mg·L-1Basta,对阳性植株进行筛选,移栽阳性单株进行自交加代繁殖,直至转基因株系后代纯合。
1.7 目标基因的表达水平分析
为了解TaMAPK1基因在小麦不同组织中的时空表达模式,基于本课题组前期建立的小偃6号不同组织样品的RNA-Seq数据[9],用归一化处理FPKM值来分析TaMAPK1在小麦不同生长发育阶段和不同组织/器官的表达谱。为进一步了解TaMAPK1基因在转基因拟南芥中的表达水平,以转基因拟南芥叶片cDNA为模板,以TaMAPK1-qPCR-F/R(表1)为引物,以拟南芥AtACTIN(AT3G18780)作为内参基因,在CFX96 Real-Time PCR Detection System(Bio-Rad,美国)进行半定量RT-PCR,检测转基因拟南芥中TaMAPK1基因的表达量。每个样品进行3次生物学重复。PCR反应体系为20 μL,包括2× TB Green Premix Ex Taq II(Tli RNaseH Plus)(TaKaRa,日本)10 μL,上、下游引物各0.8 μL, 模板cDNA 2 μL,ddH2O 8.4 μL。反应程序:95 ℃30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环;溶解曲线设置为65~95 ℃,每0.5 s升高1 ℃,每0.05 s读取一次荧光强度。按照2-△△Ct法计算基因的相对表达量。
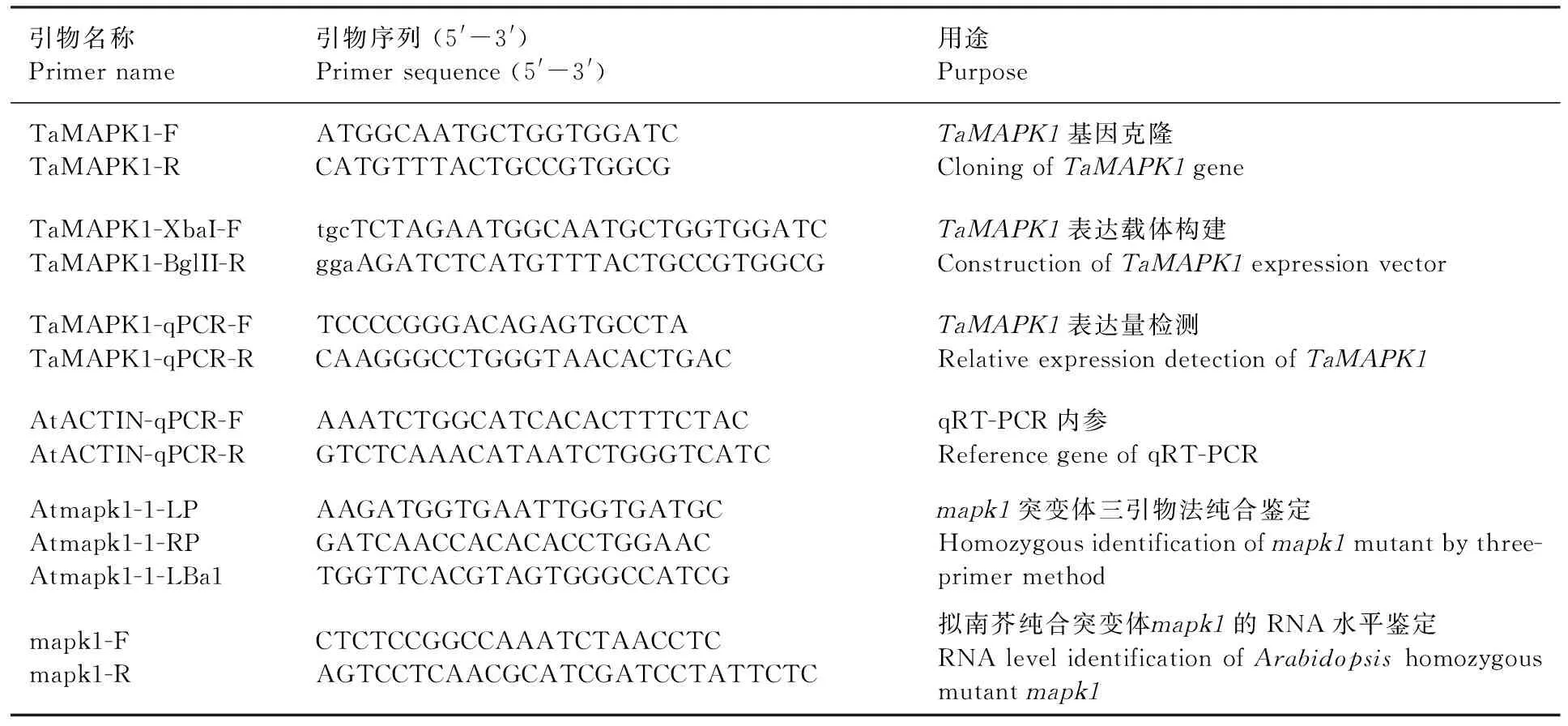
表1 本研究所用的引物Table 1 Primers used in this study
1.8 转基因拟南芥的表型调查
对野生型拟南芥Col-0、mapk1突变体、Col-0背景下转p35S::TaMAPK1的T2代纯合株系(TaMAPK1-OE)以及mapk1突变体遗传背景下转p35S::TaMAPK1的回补株系(TaMAPK1-com)进行全生育期观察。将拟南芥花序生长至1 cm时视为抽薹。待拟南芥抽薹后一周统计莲座叶数目;待拟南芥成熟后调查分支数目,然后将整个植株地上部分烘干至恒重后,调查单株生物量、单株种子重量;用体视显微镜(SMZ25,Nikon)对种子拍照,再用ImageJ软件(https://imagej.nih.gov/ij/)统计种子大小(投影面积)。以上表型统计均调查10~20株植株。
1.9 数据处理
用SPSS Statistics 26(https://www.ibm.com/products/spss-statistics)软件的one-way Anova进行显著性分析。
2 结果与分析
2.1 小麦MAPK基因编码蛋白的序列特征和系统进化分析
为了探究小麦miR5048靶基因MAPK的功能,对IWGSC Ref. v1.0数据库中TraesCS6A01G118100.1、TraesCS6B01G146300.1和TraesCS6D01G108100.1三个基因编码蛋白的氨基酸序列进行比对,结果(图1)表明,这三个蛋白的氨基酸序列长度分别为380、369和382 aa,序列一致性为96.70%。推测这三个MAPK基因为部分同源基因。
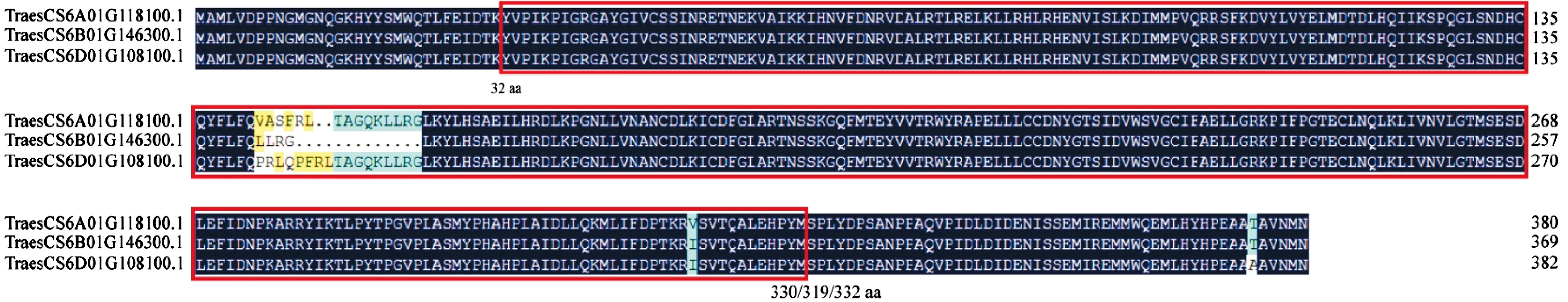
图中红色方框部分为小麦MAPK蛋白的激酶结构域。Red boxes are the kinase domain of wheat MAPK proteins.图1 小麦三个MAPK蛋白的氨基酸序列比对Fig.1 Amino acid sequence alignment of the three wheat MAPK proteins
用ExPASy在线分析这三个MAPK基因编码蛋白的理化性质,发现它们的的理论分子量分别为43.5、42.3和43.8 kDa,等电点分别为7.2、6.7和7.6,平均亲水性分别为-0.181、-0.187和-0.205,表明这三个蛋白均为亲水性蛋白。利用SMART软件对保守结构域进行预测,发现这三个蛋白均含有一个保守的丝氨酸/苏氨酸磷酸化的激酶结构域,分别位于32~330、32~319和32~332 aa处(图1),表明这三个蛋白均为丝氨酸/苏氨酸蛋白激酶。
为明确三个小麦MAPK基因的系统进化关系,用MEGA 11构建小麦MAPK蛋白与拟南芥MAPK蛋白(AtMAPK1~AtMAPK20)、水稻MAPK蛋白(OsMAPK3和OsMAPK6)的系统进化树,结果如图2所示。25个MAPK蛋白被分成A、B、C和D四个组,其中三个小麦MAPK蛋白与拟南芥AtMAPK1、AtMAPK2、AtMAPK7和AtMAPK14蛋白被聚为C组,且与AtMAPK1的同源关系最近(一致性为92.71%),说明这三个小麦MAPK基因是拟南芥AtMAPK1的直系同源基因,故将其命名为TaMAPK1,三个同源基因分别命名为TaMAPK1-6A/6B/6D。推测小麦TaMAPK1和拟南芥AtMAPK1的功能相似。
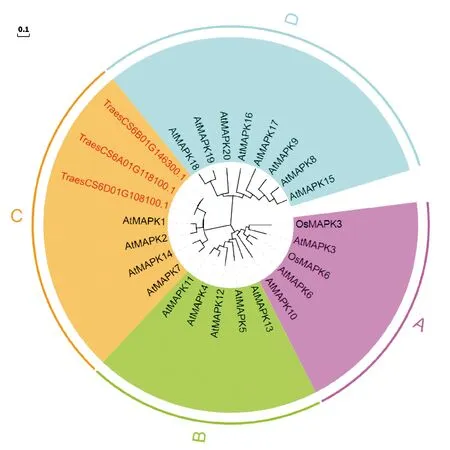
进化分支长度表示进化距离。Evolutionary branch length represents evolutionary distance.图2 小麦、拟南芥和水稻MAPK蛋白的系统发育分析Fig.2 Phylogenetic tree of MAPK proteins in wheat, Arabidopsis and rice
2.2 TaMAPK1基因的时空表达谱和顺式作用元件分析
从图3可以看出,TaMAPK1-6A/6B/6D三个基因在小麦各生育期及不同组织中均有不同程度的表达,且TaMAPK1-6A基因的表达量均为最高。推测TaMAPK1-6A在小麦生长发育过程中的作用最大。后续研究以TaMAPK1-6A(下文简写为TaMAPK1)为对象进行分析。
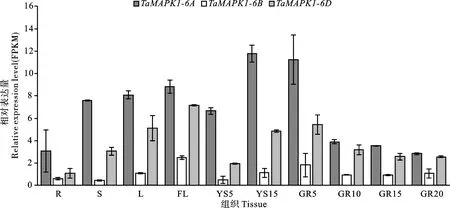
R:根;S:茎;L:叶片;FL:孕穗期的旗叶;YS5:孕穗期5 mm宽的幼穗;YS15:抽穗期15 mm宽的麦穗;GR5:扬花后5 d的籽粒;GR10:扬花后10 d的籽粒;GR15:扬花后15 d的籽粒;GR20:扬花后20 d的籽粒。R: Root; S: Stem; L: Leaf; FL: Flag leaf at booting stage; YS5: 5 mm wide young spike at booting stage; YS15: 15 mm wide spike at heading stage; GR5: Grains at 5 d after anthesis; GR10: Grains at 10 d after anthesis; GR15: Grains at 15 d after anthesis; GR20: Grains at 20 d after anthesis.图3 TaMAPK1基因在小麦不同组织中的时空表达谱Fig.3 Spatio-temporal expression patterns of TaMAPK1 genes in different tissues of wheat
在IWGSC Ref. v1.0 数据库中选取TaMAPK1基因5′ UTR上游2 000 bp的启动子序列,利用PlantCARE预测该基因启动子区的顺式作用元件。结果(表2)表明,TaMAPK1基因的启动子区含有多个与生长发育相关的顺式作用元件,如赤霉素响应元件P-box、生长素响应元件TGA-element以及参与胚乳表达的顺式作用元件GCN4_motif等。
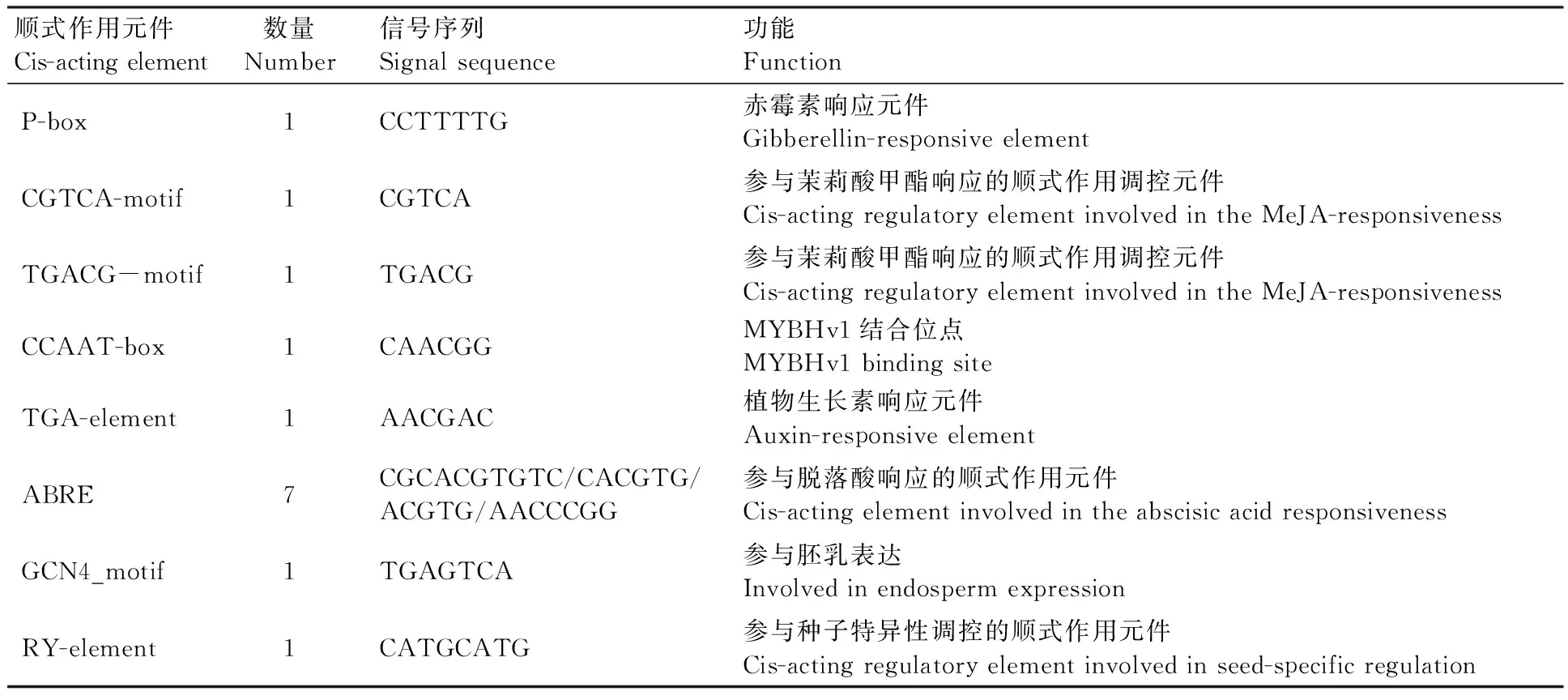
表2 TaMAPK1基因启动子的顺式作用元件Table 2 Cis-acting elements in promoter regions of TaMAPK1 gene
2.3 拟南芥mapk1突变体的鉴定及转TaMAPK1基因拟南芥的创制结果
突变体mapk1的T-DNA插入位点在AtMAPK1基因第一个外显子处(图4A)。用三引物法(Atmapk1-1-LP/RP/LBa1)进行鉴定,结果在野生型Col-0中可以扩增出符合预期大小的1 071 bp片段,而在突变体mapk1中仅扩增到大小为750 bp左右的片段(图4B),表明mapk1为纯合突变体。进一步用锚定在AtMAPK1基因5′ UTR区和CDS区的一对特异引物(mapk1-F/R)对野生型Col-0和突变体mapk1的AtMAPK1基因mRNA进行半定量检测,结果显示,在野生型拟南芥Col-0中可以检测到AtMAPK1基因mRNA,而在突变体mapk1中未检测到(图4C),表明拟南芥mapk1突变体中AtMAPK1基因功能缺失。
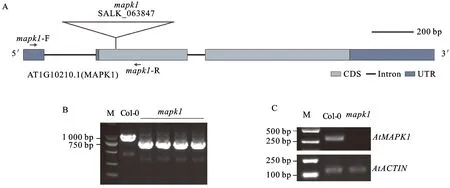
A: mapk1突变体T-DNA插入位点示意图。B: mapk1突变体的DNA水平鉴定,M: DL2000。C: mapk1突变体的RNA水平鉴定。M:250 bp DNA ladder marker; Col-0: 拟南芥野生型; mapk1: 拟南芥突变体。A: Schematic diagram of the insertion site of T-DNA for mapk1 mutant. B: Identification of mapk1 mutant at DNA level; M: DL2000. C: Identification of mapk1 mutant at RNA level, M: 250 bp DNA ladder marker; Col-0: Wild type of Arabidopsis; mapk1: Mutant of Arabidopsis.图4 拟南芥mapk1突变体的鉴定Fig.4 Identification of Arabidopsis mutant mapk1
将过表达载体p35S::TaMAPK1转化野生型拟南芥Col-0和突变体mapk1,分别获得5个转基因纯合株系。对这些转基因拟南芥中TaMAPK1基因的表达水平进行测定,结果(表3)显示,过表达转基因株系TaMAPK1-OE9和回补转基因株系TaMAPK1-com6、TaMAPK1-com7中TaMAPK1基因的表达水平显著高于野生型Col-0;TaMAPK1-OE2和TaMAPK1-OE19中TaMAPK1基因的表达水平高于Col-0,但差异不显著。
2.4 TaMAPK1转基因拟南芥的表型和产量
对拟南芥野生型(Col-0)、突变体(mapk1)、过表达株系(TaMAPK1-OE)和回补株系(TaMAPK1-com)进行全生育期表型观察,结果发现,mapk1的抽薹时间比Col-0提前2.8 d;除TaMAPK1-OE2株系外,其他转基因株系的抽薹时间与Col-0无显著差异(表4),表明AtMAPK1基因负调控拟南芥抽薹开花时间。此外,mapk1的莲座叶数目显著低于Col-0,而TaMAPK1-com和TaMAPK1-OE的莲座叶数目与Col-0均无显著差异(表4),推测这与各株系由营养生长向生殖生长的转换时间有关,mapk1抽薹时间提前导致营养生长时间缩短,使其莲座叶数目显著减少。对不同株系的株高进行测量,发现mapk1的株高显著高于Col-0,TaMAPK1-OE的株高均显著低于Col-0,而TaMAPK1-com的株高与Col-0之间均无显著差异(表4),这表明AtMAPK1和TaMAPK1基因功能相同,均负调控拟南芥株高。
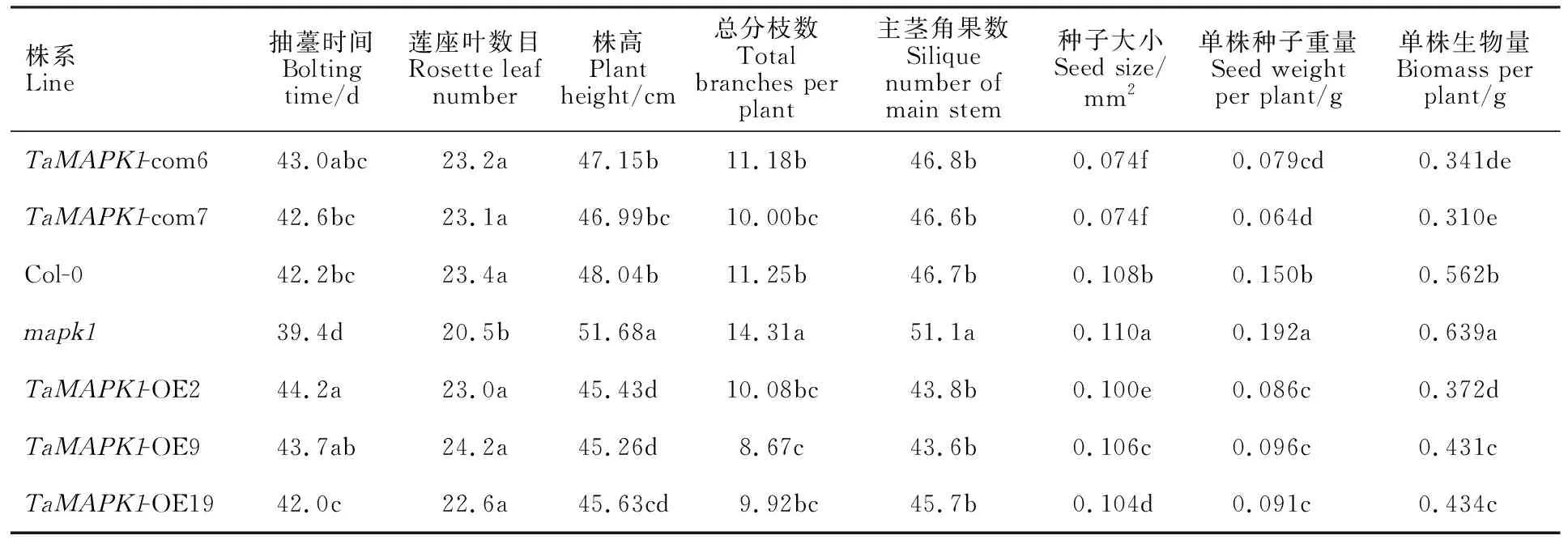
表4 TaMAPK1转基因拟南芥表型调查Table 4 Phenotypic variations of TaMAPK1 transgenic Arabidopsis
进一步对不同株系的籽粒产量相关性状(总分枝数、主茎角果数、单株生物量、种子大小和单株种子重量)进行统计,发现mapk1的总分枝数显著高于Col-0,除过表达株系TaMAPK1-OE9外,其他转基因株系的总分枝数与Col-0均无显著差异。此外,mapk1的主茎果荚数、种子大小、单株种子重量和单株生物量均显著高于Col-0;除TaMAPK1-com和TaMAPK1-OE的主茎角果数与Col-0无显著差异外,其余性状均显著低于Col-0(表4)。这说明拟南芥AtMAPK1基因负调控单株生物量、单株种子重量和种子大小,小麦TaMAPK1基因能恢复mapk1突变体的上述性状。
3 讨论
3.1 MAPK1在小麦和拟南芥中的表达模式
本研究发现,小麦TaMAPK1作为拟南芥AtMAPK1的直系同源基因,与拟南芥AtMAPK1、AtMAPK2、AtMAPK7、AtMAPK14均属于MAPK家族C组成员。迄今为止,包括拟南芥在内的所有植物中,MAPK家族C组成员的功能研究未见报道。因此,本研究对小麦MAPK1基因的功能研究,有助于了解MAPK家族C组成员的功能。TaMAPK1包含三个同源基因TaMAPK1-6A/6B/6D,三者在小麦不同生长发育阶段和组织中均有表达,且TaMAPK1-6A的表达量均为最高,推测该基因在三个等位基因中发挥的生物学功能贡献最大。
3.2 MAPK1负调控拟南芥的抽薹时间和产量相关性状
本研究发现,小麦TaMAPK1和拟南芥AtMAPK1基因均负调控拟南芥的抽薹时间,影响其从营养生长向生殖生长的转换。而这种转换受成花转换蛋白FCA(Flowering Locus CA)磷酸化状态的影响[10],由于TaMAPK1和AtMAPK1都是蛋白激酶,推测它们通过调控这些成花转换相关蛋白的磷酸化状态来调节开花时间。理想的株型有利于植物充分利用阳光。本研究发现,TaMAPK1和AtMAPK1基因均负调控拟南芥株高、总分枝数和主茎果荚数。但TaMAPK1基因是否参与调控小麦株型需要进一步研究。籽粒大小是作物产量的重要组成部分,在小麦中已报道的影响籽粒大小的基因有TaSDIR-4A[11]、TaCYP78A3/5[12-13]等。其中,TaSDIR-4A基因负调控籽粒大小,且响应ABA和盐胁迫处理,在平衡产量和胁迫响应方面具有重要作用[11]。本研究发现,TaMAPK1和AtMAPK1均负调控种子大小和单株种子重量。值得一提的是,TaMAPK1-OE株系(除TaMAPK1-OE9外)和Col-0中TaMAPK1基因的相对表达量无显著差异,而回补株系TaMAPK1-com中TaMAPK1基因的相对表达量显著高于TaMAPK1-OE2,原因可能是拟南芥内源基因AtMAPK1抑制转基因表达所致。
总之,小麦TaMAPK1和拟南芥AtMAPK1基因均负调控拟南芥的抽薹时间、株高、总分枝数、主茎果荚数、种子大小、单株种子重量和单株生物量。说明MAPK1在不同植物中功能较为保守,这为进一步揭示该基因在小麦生长发育中的生物学功能提供重要参考。

