兔糖尿病周围神经病变模型的建立及超声表现
黄建波,何 英,王 红,向 茜,杨汐静,张静漪△
(四川大学华西医院:1.超声医学科;2.动物实验中心,成都 610041)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病病程相关的最常见并发症[1]。DPN可能会影响运动神经、感觉神经、自主神经,导致触觉、痛觉、温度觉的减退、消失,或产生其他异常感觉如自发疼痛、烧灼感、针刺感等[2]。DPN感觉异常及血管功能障碍常造成下肢皮肤溃烂、糖尿病足的发生,甚至出现截肢的风险,严重影响患者的生活质量。DPN的早期诊断治疗是降低患者病残程度、提高生活质量的关键。
目前DPN主要依靠临床病史、病变症状的体征表现和神经电生理检测来确诊,但其中病变症状的体征表现主要是基于主观估计,确诊的重复性较差,而神经电生理检测仅能评估25%的神经功能[3]。神经穿刺活检作为DPN诊断的“金标准”,虽然可以准确量化无髓纤维损伤,但也是一种侵入性和高度专业化的手术,且早期 DPN 患者的有髓神经纤维形态仍然正常,导致其在临床应用中有一定局限性。因此需要有一种能够直接评估DPN中神经纤维损伤的非侵入性技术。超声作为一种非侵入性技术,已广泛应用于周围神经病变,如遗传性疾病、卡压综合征、创伤和肿瘤的诊断[4]。据报道,超声也可用于糖尿病患者周围神经的研究,超声诊断相比于神经电生理检测,不仅在诊断DPN方面具有更高的价值和效率,而且有助于医生根据形态和结构变化区分神经病变的类型,在DPN的治疗和监测中发挥了重要作用[5]。
为了更好地研究DPN的发病机制,探索DPN早期诊断更快捷的影像学检查方法,建立理想的DPN动物模型非常必要。DPN动物模型包括诱导型、自发型、转基因型等,以药物诱导型多见。国内外建立DPN动物模型以鼠类多见[6],而兔DPN模型较少见。鼠类的周围神经纤细,对于影像学检查仪器的分辨率要求较高,而兔体型稍大,其周围神经较鼠类粗,更利于影像学显影,且神经电生理学对细小纤维的敏感性较低,漏诊率较高,在神经电生理信号改变之前可用超声监测形态学改变。超声影像技术应用于兔DPN模型中坐骨神经病变的研究少见于报道。本研究旨在探讨用较低剂量四氧嘧啶(Alloxan,ALX)破坏兔胰岛细胞诱导兔坐骨神经DPN模型的建立方法,并利用超声影像检测神经横截面面积(cross-sectional area,CSA)和回声等图像变化,模拟显示DPN患者周围神经形态学变化的特征,以分析坐骨神经病变情况,从而为糖尿病神经病变的临床诊疗提供参考依据。
1 材料与方法
1.1 实验材料
取健康新西兰大白兔30只,雄性,体重约2.5~2.8 kg,8周龄,购于四川省实验动物专委会养殖场,检疫合格后由四川大学华西医院动物实验中心适应性饲养至少1周,检疫合格后造模。动物单笼饲养,笼舍每日定时清洗,饲养间的温度维持在20~26 ℃,相对湿度为40%~70%。每日2次定时饲喂标准普通兔饲料,更换清洁饮水。本研究所有操作程序都经过四川大学华西临床医学院实验动物管理与使用委员会批准。
1.2 实验方法
30只兔随机分为正常对照组(N组,n=6)和造模组(n=24)。造模组采取一次性注射给药的方式,注射给药前动物禁食12 h,自由饮水,按65 mg/kg体重耳缘静脉注射新鲜配制的5% ALX,正常对照组注射等量的生理盐水。分别于注射后第2、4、6天取少量耳缘静脉血,用罗氏血糖测量仪进行血糖测量,血糖浓度>16.0 mmol/L并维持1周以上,认为兔糖尿病模型建模成功。再将ALX诱导糖尿病模型建模成功的兔随机分为糖尿病病程1月组(A组)、2月组(B组)、3月组(C组)。
A、B、C组分别于1、2、3个月后进行坐骨神经超声检查和神经电生理检测。超声检查采用Philips IU22彩色超声诊断仪,线阵探头(L12-5),频率5~12 Mhz,选用浅表肌骨模式。研究对象取侧卧位的相对固定位置,仪器参数条件保持一致,比如增益、深度等。二维超声观察各组双侧坐骨神经的内部回声情况,并测定坐骨神经CSA。全部研究对象均由具有多年经验的同一位超声医师完成超声诊断。超声检查完成后,对双侧坐骨神经行电生理检测,测量神经传导的动作电位传导速度。N组也于1、2、3个月后各取2只进行上述检查。所有测量数据重复3次,取平均值。双侧坐骨神经电生理检查完成后,分批取材,对坐骨神经做HE染色及快蓝染色观察其病理改变。
1.3 统计学处理

2 结 果
2.1 体重、血糖情况
造模组兔在静脉注射ALX 24 h后陆续进入低血糖期。当兔血糖浓度小于2.0 mmol/L时,出现嗜睡、不进水进食,甚至出现惊厥、尖叫等现象,此时给予静脉注射少量10%葡萄糖。24 h内造模组中2只兔死于低血糖;至给药72 h,有1只血糖低于16 mmol/L,从造模组中剔除。最终共21只兔血糖大于16.0 mmol/L且在饲养过程中无死亡及血糖下降,造模成功(87.5%)。
糖尿病模型建立后兔的饮水量、摄食量及尿量均明显增加,尿膻味重,体毛逐渐失去光泽,出现脱毛现象、活动减少等一系列糖尿病及DPN的相关症状。N组兔体重为(2.52±0.15)kg,A组为(2.64±0.32)kg,B组为(2.73±0.21)kg,C组为(2.85±0.20)kg。A组、B组与N组体重比较,差异均无统计学意义(P>0.05);而C组与N组比较,差异有统计学意义(P<0.05);C组与A、B组进行比较,差异有统计学意义(P<0.05);A组与B组比较,差异无统计学意义(P>0.05)。
N组兔血糖为(5.30±0.26)mmol/L。A、B、C组兔血糖值控制在16.0~30.0 mmol/L。A组血糖为(26.94±0.35)mmol/L,B组血糖为(28.83±0.18)mmol/L,C组血糖为(27.26±0.21)mmol/L。A、B、C组血糖与N组比较,差异有统计学意义(P<0.05)。A、B、C组组间比较,血糖值差异无统计学意义(P>0.05)。
2.2 兔糖尿病坐骨神经病变的超声表现
正常兔坐骨神经的超声纵截面表现为中间为低回声、上下高回声的神经外膜结构,而横截面超声表现为内部呈低回声、周围有高回声的神经外膜(图1)。用超声测量各组CSA数值统计分析结果中可见,随糖尿病病程时间延长,CSA逐渐增加,其中A、B、C组组间CSA两两比较,差异均有统计学意义(P<0.05);A组CSA与N组比较,差异无统计学意义(P>0.05);B、C组与N组之间CSA比较,差异均有统计学意义(P<0.05),见表1。
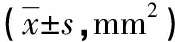
表1 各组间兔坐骨CSA比较
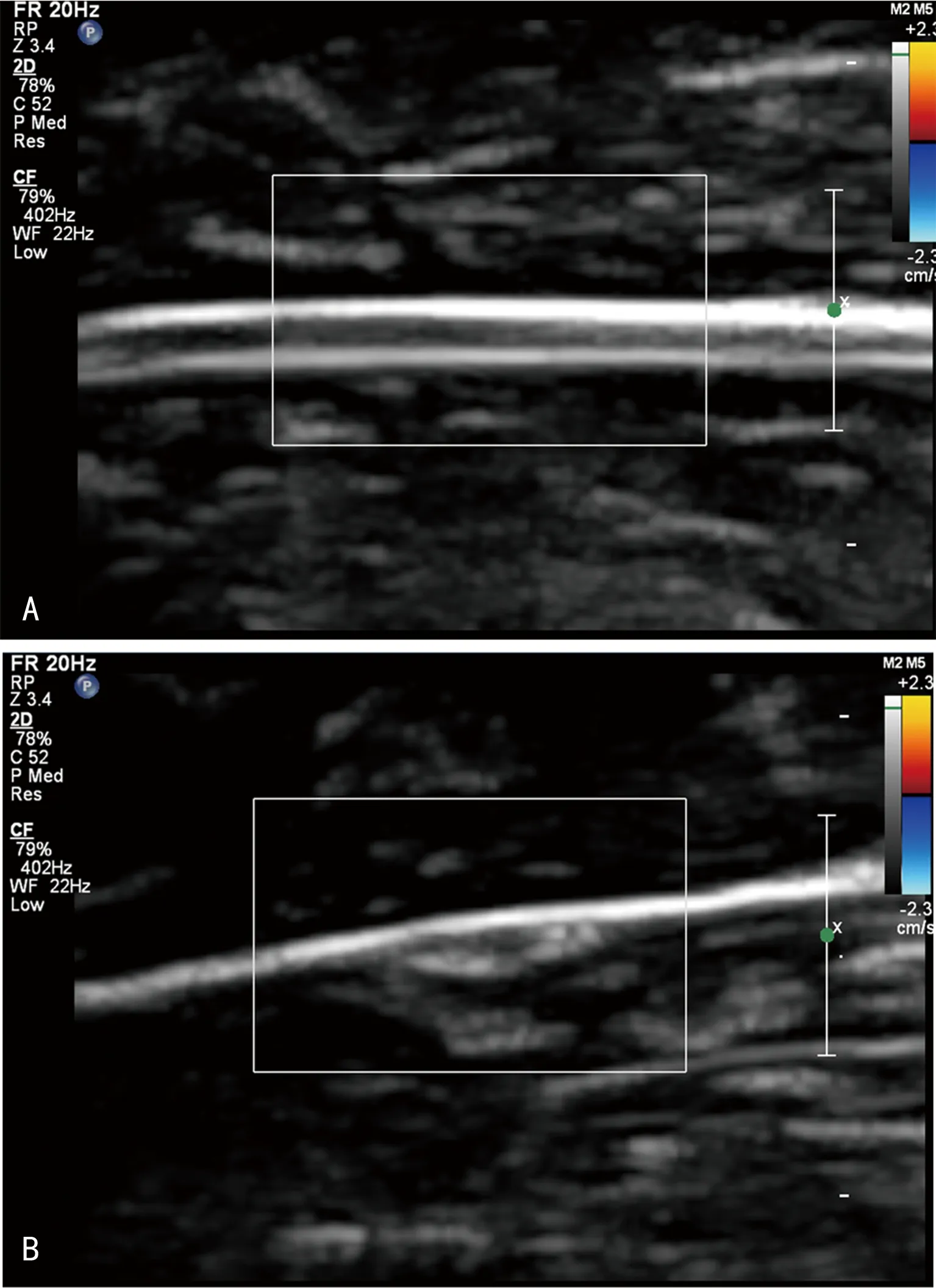
A:坐骨神经纵截面的超声成像;B:坐骨神经横截面的超声成像。
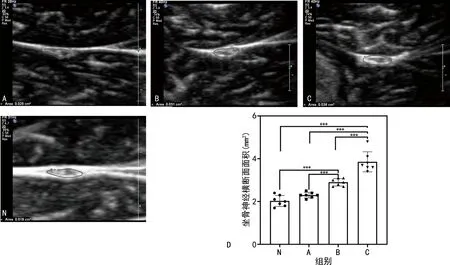
虚线区域为兔坐骨神经横截面,A、B、C、N分别为A、B、C及N组;图D为各组的CSA统计图;***:P<0.05。
2.3 兔坐骨神经动作电位传导速度改变
兔坐骨神经传导速度结果如表2所示。A、B组与N组比较,以及A组与B组比较,坐骨神经传导速度差异均无统计学意义(P>0.05);而C组与N组比较,两组坐骨神经传导速度差异有统计学意义(P<0.05);C组与A、B组比较,坐骨神经传导速度差异有统计学意义(P<0.05),见表2。
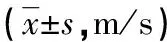
表2 各组间兔神经动作电位传导速度比较
2.4 兔坐骨神经病理结果
HE染色结果显示,N组、A组和B组的神经纤维排列均较规则、紧密,染色均匀;C组神经纤维发生水肿,神经纤维髓鞘发生脱髓鞘,部分区域出现淡染区(图3)。与N组比较, A、B组兔坐骨神经神经纤维之间排列比较规则,快蓝染色神经纤维髓排列紧密、规则,C组兔坐骨神经纤维之间的排列变的较疏松,快蓝染色显示部分神经纤维髓鞘出现轻度“空泡化”(图4)。
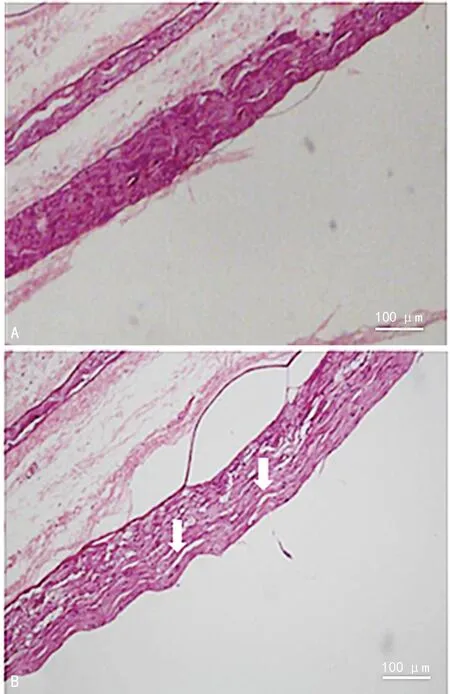
A:N组兔坐骨神经,神经纤维排列紧密,染色均匀;B: C组兔坐骨神经神经纤维出现水肿,部分区域出现淡染区(白色箭头)。
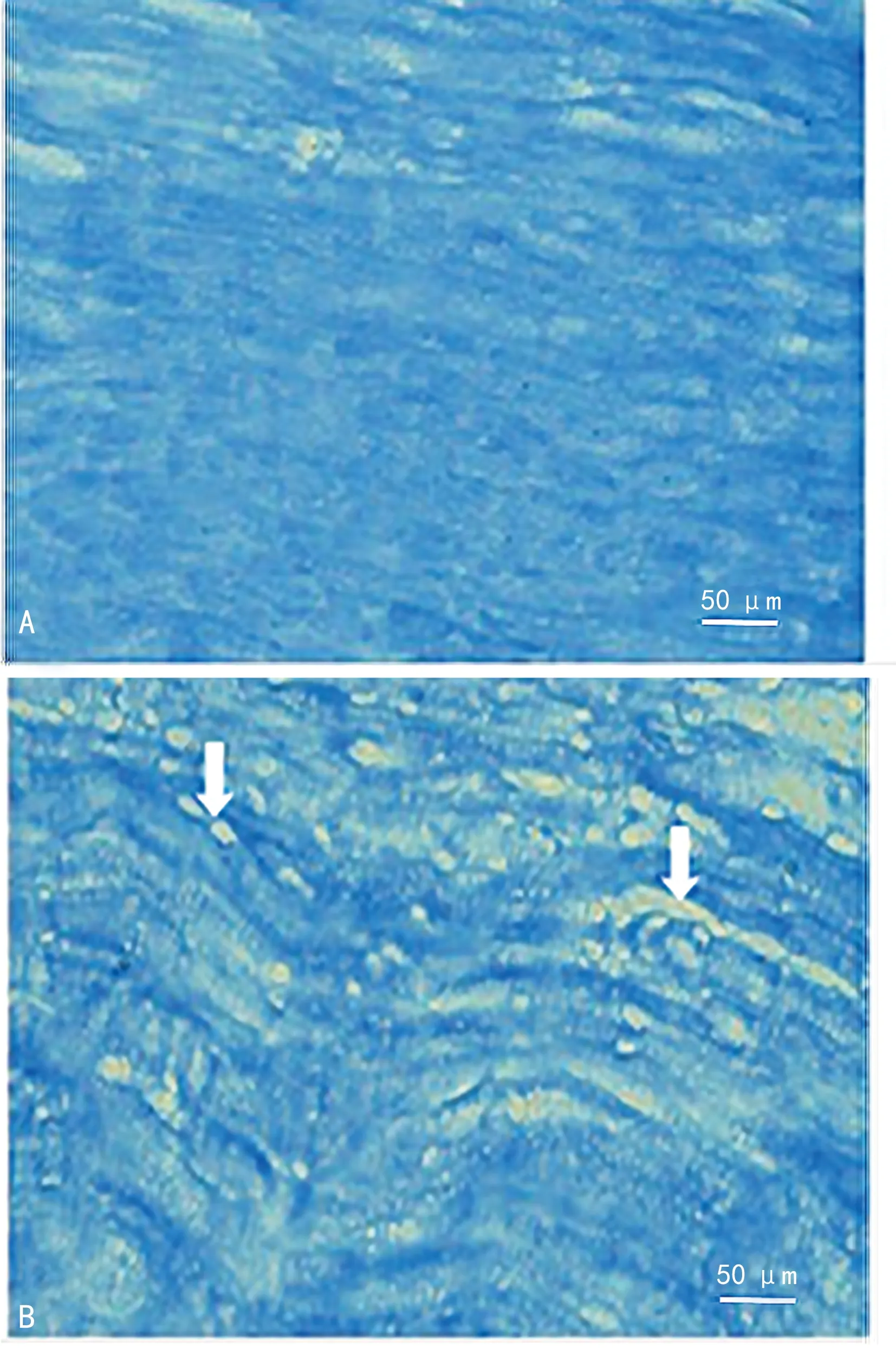
A: N组兔坐骨神经,神经纤维髓排列规则,染色均匀;B: C组兔坐骨神经髓鞘出现脱髓鞘病变,部分区域出现“空泡化”(白色箭头)。
3 讨 论
DPN模型可分为诱发型、自发型及转基因或基因敲除型等[7]。其中诱发型常用化学药物、高脂高糖饮食或者手术等诱导,由于具有操作简便、稳定性好、短期内可诱导出大量模型等优点,所以较为常用。化学药物ALX在诱导DPN模型时,通过自由基破坏胰岛B细胞,导致胰岛素缺乏,进而诱发糖尿病。但ALX给药剂量在各文献中存在较大差异,大鼠模型单一注射的剂量为40~70 mg/kg,兔的给药剂量为100~200 mg/kg[8]。本研究采用一次性耳缘静脉注射65 mg/kg 5% ALX溶液的方式,避免了大剂量给药出现药物集中释放对胰腺造成较大破坏,同时降低肝脏及肾脏毒性,减少造模过程中动物死亡率。一次性给药操作简单方便,相比于多次给药,缩短了造模时间。另外,ALX溶于水易分解,新鲜配置好后立即使用,在注射时推注速度越快越容易诱发动物糖尿病的发生,通常情况下应在30 s内将ALX溶液注入动物体内。严格的禁食对于ALX诱发糖尿病也十分关键。
目前,化学药物诱导的糖尿病及其并发症模型大部分采用鼠类[9],研究报道的糖尿病并发症兔动物模型大部分关注点在糖尿病肾脏病变等方面,而糖尿病兔周围神经病变的模型较少见。本研究考虑到鼠类神经纤细,对影像仪器的分辨率要求较高,显影较困难;兔的体型较鼠类大,神经也较鼠类粗,更利于观察影像表现,因此选择雄性新西兰大白兔作为造模对象。造模组动物相比于健康对照组,毛色逐渐失去光泽,甚至发生脱毛现象,并出现精神较萎靡,饮水量、尿量明显增加,尿膻味加重,活动减少等一系列的相关症状,在高血糖的持续状态下,逐渐出现糖尿病周围神经病变等并发症。糖尿病周围神经病变模型建立成功的判断依据为坐骨神经传导速度减慢、机械性痛阈减低、痛觉传导时间延长、平均步行周期延长和甩尾潜伏期和热缩足潜伏期缩短等,通常在药物诱导的4~12周出现糖尿病周围神经病变。本实验采用65 mg/kg ALX于耳缘静脉注射建立糖尿病新西兰兔模型,给药剂量明显低于文献中的剂量[10],3天后血糖升高,分别于1、2、3个月后进行坐骨神经的神经电生理检测,实验发现,造模组在1个月和2个月后,与正常对照组比较,神经传导速度差异无统计学意义,3个月后行神经电生理检测出现动作电位传导速度减低,为(51.14±0.45)m/s,较N组(54.79±0.52)m/s减慢,且其他行为学方面也符合造模成功特征,因此本研究认为在ALX诱导3个月后DPN模型建立成功。与部分鼠模型中最早4周出现神经传导速度减慢比较,本研究模型建立时间较长,可能与动物的种类不同,以及诱导糖尿病的药物、给药方法、给药剂量等因素有关。
近年来,超声由于具有无创、实时、简便等优点,广泛应用于各种疾病的诊断治疗。超声可以显示周围神经的形态,在周围神经病变中具有较高的诊断和评估价值[11],也作为DPN的评价工具受到关注[12]。CSA可反映周围神经病变的严重程度,将CSA作为超声在周围神经病变研究中的测量指标[13]。有研究发现,超声显示DPN患者腓深神经中间支内神经束回声模糊,神经外膜不平整、回声欠清晰,且神经内回声不均匀,神经内径较正常组增大[14]。本研究中A组相比N组,CSA有所增加,但差异并无统计学意义,可能是因为神经纤维变性的同时也存在再生[15]。C组兔CSA大于A、B组,且差异具有统计学意义,与病理结果较为一致,髓鞘的空泡化比较明显。实验中造模组神经内神经束的回声欠均匀,可能与DPN神经纤维退变、神经纤维间基质增生有关[16],也有研究报道轴索变性的神经痛患者的腓肠及腓浅神经CSA增大[17]。但是无法通过超声直接区分周围神经内的轴索变性及髓鞘退变。目前对于CSA变化和轴索及髓鞘的关系在临床上还没有统一结论,而且DPN的病理机制尚未完全明确,其超声改变与病理学改变之间的关系尚不清楚,因此没有建立DPN的完整超声评价体系。
本研究以ALX诱导成功建立与人类DPN相似的兔糖尿病模型,通过超声分析坐骨神经在病变前后的图像变化,将CSA作为超声在周围神经病变研究中的测量指标来反映周围神经病变的严重程度,再结合神经电生理检测及组织病理学检查评价超声在定量评估DPN中的价值,为临床开展超声定量评估DPN可行性提供了实验依据。本研究也存在一定的局限性,比如超声检查对操作者的依赖性较大;未将神经病变的其他影像学检查方法进行对比分析,如弹性成像、超声造影成像等。
综上所述,本研究采用ALX诱导新西兰大白兔糖尿病模型,3月后出现坐骨神经神经传导速度减低,采用较低的给药剂量一次耳缘静脉注射,造模成功率较高,不失为一种经济、便捷的兔坐骨神经DPN模型建模方法。超声对兔坐骨神经的显示率为100%,且操作简单、图像清晰,能够分析CSA的变化,可用于兔DPN模型中神经病变的评估。

