电针对胰岛素抵抗大鼠肝脏组织自噬相关蛋白表达的影响
易璇,陈丽,王静芝,王雅媛,郑紫桐,梁凤霞
(湖北中医药大学,武汉 430065)
胰岛素抵抗(insulin resistance, IR)是指由多种因素引起的机体对胰岛素敏感性降低的一种病理状态[1]。国内外研究表明,电针能够有效改善IR,其机制包括减轻炎症、调控脂质代谢、调节胰岛素信号通路等环节[2-4]。肝脏是胰岛素的重要靶器官之一,肝脏的脂肪浸润程度越高,胰岛素敏感性越差,降低肝脏脂肪含量能够提高机体胰岛素敏感性,改善IR[5]。且自噬是脂肪降解和储存的重要环节[6],自噬可以维持肝脏脂质代谢稳态,并提高肝脏胰岛素敏感性;而抑制肝细胞自噬,则会降低肝脏胰岛素敏感性[7-9]。因此,自噬可能是调控胰岛素敏感性的突破口。
有研究表明,电针具有调控自噬相关蛋白的作用[10-11],但在不同的疾病与组织中,电针对自噬的调控效应并不相同。为进一步明确电针对IR 状态下肝脏自噬的调控作用,本研究建立IR 大鼠模型,通过电针中脘、关元、足三里和丰隆观察胰岛素敏感性与肝脏自噬水平的变化,进一步研究电针治疗IR 的潜在机制。
1 材料与方法
1.1 实验动物
40 只7 周龄Wistar 雄性大鼠,体质量(220±20)g。购于湖北省实验动物研究中心,许可证号为SCXK(鄂)2020-0018。所有大鼠以普通饲料适应性饲养1 周。饲养于湖北中医药大学SPF 级动物房,大鼠自由饮食与饮水,12 h 明暗交替。实验严格遵守《关于善待实验动物的指导性意见》中的各项规定。
1.2 主要试剂与仪器
RIPA 裂解液(AS1004,ASPEN)、BCA 蛋白质浓度测定试剂盒(AS1086,ASPEN)、ECL 化学发光检测试剂盒(AS1059,ASPEN)、磷酸化蛋白酶抑制剂(AS1008,ASPEN),β-Actin 抗 体 (TDY051, 天 德 悦 ),p62(sequestosome 1, p62)一抗(ab109012,abcam),微管相关蛋白1 轻链3B (microtubule-associated protein 1 light chain 3B,LC3B)一抗(43566,CST)、胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)一抗(2382,CST)、磷酸化胰岛素受体底物 -1(phosphorylated-IRS-1, p-IRS-1) 一 抗(2385,CST)、蛋白激酶B(protein kinase B, AKT)一抗(9272,CST)、磷酸化蛋白激酶B(phosphorylated-AKT, p-AKT)一抗(4060,CST),HRP-Goat anti Rabbit二抗(AS1107,ASPEN)。电针治疗仪(HANS LH202H,北京华运安特科技有限责任公司),冷冻离心机(TGL-16,湖南湘仪实验室仪器开发有限公司),电泳仪(DYY-6C,北京市六一仪器厂),扫描仪(LiDE110, Canon),生物显微镜(BX53,奥林巴斯)。
1.3 模型制备及评价
适应性饲养1 周后,随机选取10 只以普通饲料喂养,8 周后随机选取其中8 只作为正常组,剩余30 只以高脂饲料[12]喂养8 周,制备IR 大鼠模型。将高于正常组体质量平均值20%的28 只大鼠随机取3 只检测其葡萄糖输注率(glucose infusion rate, GIR),若所测大鼠的GIR 小于正常组20%则认定为造模成功。将造模成功的28只大鼠随机进行编号,并挑选16只随机分入模型组与电针组,每组8 只。
高胰岛素-正葡萄糖钳夹术(hyperinsulinemiceuglycemic-clamp, HEC)检测GIR,钳夹术前大鼠禁食8 h,在大鼠尾根部注射局麻,行尾动静脉插管。将胰岛素注射液和30%葡萄糖注射液分别连接在尾静脉的小三通管上,两者均以双数字式微量注射泵泵入。取尾动脉血 0.5 m L 测基础血糖。接着以恒定速度[0.25 μ/(kg·h)]输入胰岛素,每5 min 测1 次血糖并调整GIR。血糖须保持在基础血糖±0.5 mmol/L 范围内。共采血24 次,计算60~120 min 的GIR 的平均值。
1.4 干预方法
选取中脘、关元、足三里及丰隆穴进行电针干预,取穴参考《实验针灸学》[13]。针具选择0.30 mm×13 mm不锈钢毫针。足三里和丰隆均直刺入3~5 mm,关元和中脘斜刺3~5 mm。频率2 Hz,强度1 mA,连续波。同侧足三里和丰隆连接同一输出的两个电极,关元和中脘连接另一输出的两个电极。隔日干预,每周干预3次,每次10 min,共干预8 周。
1.5 标本采集
干预结束后, 采用 2% 戊巴比妥钠溶液(0.25 mL/100 g)腹腔注射麻醉。取肝脏组织并迅速放入液氮中。之后转入-80 ℃冰箱,冻存备检。
1.6 指标检测
1.6.1 餐后血糖(postprandial blood glucose, PBG)及腹腔糖耐量实验(intraperitoneal glucose tolerance test, IPGTT)血糖
干预前及干预8 周后,对各组大鼠进行尾尖取血,用快速血糖仪测定大鼠PBG。干预6 周后,行IPGTT 检测,操作前尾尖取血测空腹血糖(0 min),根据大鼠体质量行50%葡萄糖腹腔注射,注射后30 min、60 min、90 min、120 min 尾尖取血,检测血糖值。
1.6.2 GIR 检测
干预8 周后,每组大鼠各取3 只行HEC 检测GIR,测定全身胰岛素敏感性。
1.6.3 大鼠肝脏组织中LC3B-Ⅱ、p62、IRS-1、p-IRS-1、AKT、p-AKT 蛋白表达检测
取出冻存的待检组织50 mg,提取总蛋白,测定其浓度,进行SDS-PAGE 电泳,之后进行转膜、封闭。孵育一抗[β-actin(1:10 000),LC3B(1:1 000),p62(1:2 000),IRS-1(1:500),p-IRS-1(1:500),AKT(1:2 000),p-AKT(1:1 000)]过夜,孵育二抗1 h,暗室中曝光。以β-actin 为内参蛋白,分析目的蛋白相对表达水平。
1.6.4 GFP-LC3 荧光检测
大鼠于处死前给予高压尾静脉注射GFP-LC3 腺病毒0.166 mL,给药后饲养5 d,进行取材。取部分组织进行OCT 包埋、冰冻切片、荧光显微镜观察并拍照,利用Image-Pro Plus 分析平均光密度值。
1.7 统计学方法
使用SPSS22.0 统计软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差表示,方差齐则采用单因素方差分析进行组间比较,并采用LSD法进行两两比较。以P<0.05 表示差异有统计学意义。
2 结果
2.1 模型评价
与正常组比较,造模后高脂组大鼠GIR 显著下降(P<0.05),说明IR 大鼠模型制备成功。详见图1。

图1 造模后正常组与高脂组大鼠GIR 的比较(±s, n=3)
2.2 3 组大鼠PBG、IPGTT、GIR 比较
与正常组比较,模型组PBG 显著上升(P<0.01),GIR 显著下降(P<0.01);与模型组比较,电针组PBG 显著下降(P<0.05),GIR 显著上升(P<0.01)。在IPGTT实验中,各组大鼠腹腔注射葡萄糖30 min后,血糖水平迅速升高达到峰值,然后逐渐降低。模型组大鼠IPGTT血糖水平明显高于正常组(P<0.01,P<0.05);电针组IPGTT 血糖水平明显低于模型组(P<0.05)。详见图2-图4。
2.3 3 组大鼠肝脏组织IRS-1、p-IRS-1、AKT、p-AKT蛋白表达比较
与正常组比较,模型组肝脏组织IRS-1、p-IRS-1、p-AKT 蛋白表达显著降低(P<0.01);与模型组比较,电针组肝脏组织 p-IRS-1 蛋白表达显著上升(P<0.05)。IRS-1、AKT、p-AKT 蛋白表达有上升趋势,但差异无统计学意义(P>0.05)。详见图5。
2.4 3 组大鼠肝脏组织p62、LC3B-Ⅱ蛋白表达比较
与正常组比较,模型组肝脏组织p62 蛋白表达显著上升(P<0.01),LC3B-Ⅱ蛋白表达显著降低(P<0.01);与模型组比较,电针组肝脏组织p62 蛋白表达显著降低(P<0.01),LC3B-Ⅱ蛋白表达显著上升(P<0.01)。详见图6。
2.5 3 组大鼠GFP-LC3 荧光比较
与正常组比较,模型组GFP-LC3 绿色荧光蛋白荧光密度显著降低(P<0.01);与模型组比较,电针组GFP-LC3 绿色荧光蛋白荧光密度显著上升(P<0.01)。详见图7。

图2 3 组大鼠PBG 的比较(±s, n=8)
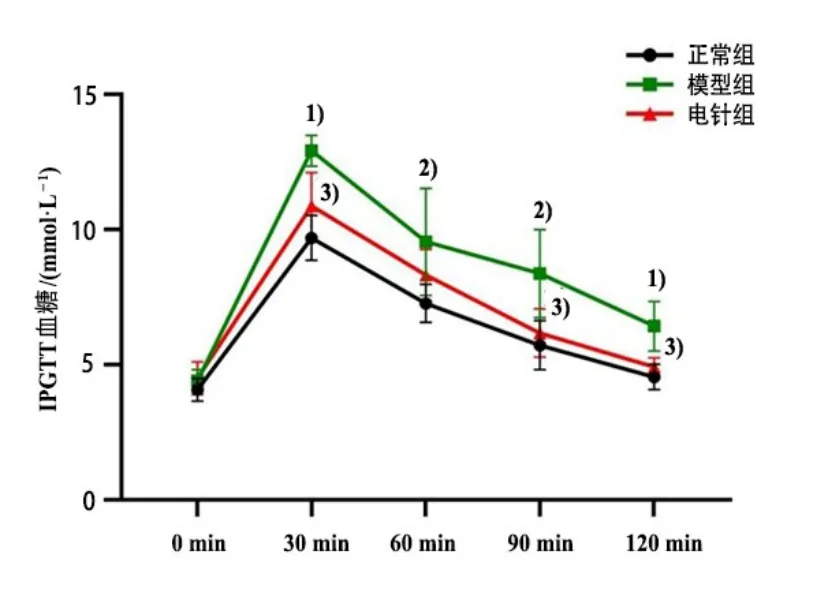
图3 3 组大鼠IPGTT 血糖比较(±s, n=8)
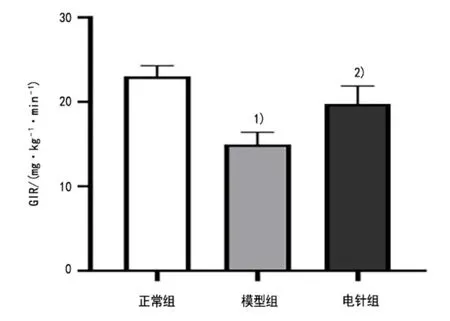
图4 3 组大鼠GIR 的比较(±s, n=3)

图5 各组大鼠肝脏IRS-1、p-IRS-1、AKT、p-AKT 蛋白表达比较(±s, n=8)

图6 3 组大鼠肝脏组织p62、LC3B-Ⅱ蛋白表达比较(±s, n=8)

图7 各组大鼠GFP-LC3 荧光的比较(±s, n=8)
3 讨论
大量的临床及动物研究[14-17]证实,电针能有效治疗IR 相关疾病,并且有环保安全、无不良反应等优势。中医学认为IR 与痰浊内阻、脾肾亏损等密切相关[18],故可从化痰祛湿、补益脾肾着手进行治疗。中脘、关元、足三里和丰隆为针刺治疗IR 研究的常用穴[19],关元和足三里固护先天肾气之本和后天脾胃之本,提升机体正气,避免向糖尿病和多囊卵巢综合征等IR 相关性疾病转化;配伍中脘和丰隆理气化痰祛湿,祛除病邪。有研究表明,高脂饮食能促进大鼠的肥胖与IR,并且Wistar 大鼠经过高脂饮食饲料喂养建模能较好地模拟IR 的临床自然过程[20-21]。IRS-1 与Akt 是关键的肝脏胰岛素信号调控因子[22],IRS-1 磷酸化后,Akt 发生磷酸化,使葡萄糖转移至细胞内,从而改善IR[23]。若胰岛素代谢分泌异常,将造成上述功能障碍。因此,本研究采用高脂饮食饲喂法,制备IR 大鼠模型,并选取中脘、关元、足三里和丰隆进行电针治疗。检测大鼠肝脏组织中IRS-1、p-IRS-1、AKT、p-AKT 蛋白表达,以观察肝脏胰岛素敏感性的变化;检测大鼠GIR,以观察全身胰岛素敏感性的变化。结果显示,与正常组相比,模型组PBG显著上升,GIR显著降低,IPGTT血糖水平明显上升,肝脏组织IRS-1、p-AKT、p-IRS-1 蛋白表达显著降低;与模型组相比,电针组PBG 显著降低,GIR 显著上升,IPGTT 血糖水平明显降低,肝脏组织p-IRS-1 蛋白表达显著上升。提示高脂饮食会引起胰岛素敏感性降低,导致IR,而电针治疗能够提高胰岛素敏感性,从而改善IR。这与现有研究[24-25]较为一致。研究表明,自噬水平的变化与IR 呈负相关[26-27],IR 状态下,肝脏自噬相关基因表达显著降低,提示IR 与肝脏自噬水平下降密切相关,且肝脏自噬受损可导致IR 的发生发展[28]。故此,自噬成为IR 机制研究的热点。目前关于IR 的研究多为电针对脂质生成和水平的影响,自噬虽是脂肪降解和储存的重要环节,但对自噬的相关报道甚少,导致其深入的机制未揭示。因此,本研究从自噬角度入手,研究电针改善IR 效应与肝脏自噬水平的关系,结果显示电针可以通过激活肝脏自噬改善全身与肝脏胰岛素敏感性,明确了自噬在治疗中的作用,对既往研究结果进行了补充。
微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3, LC3)和p62 是自噬相关的重要标志物[29],LC3 是检测自噬发生的标志性蛋白。当自噬作用发生的时候,Ⅰ型经泛素样反应与磷脂酰乙醇胺结合,并直接形成Ⅱ型,此时,LC3 含量与自噬泡数成正比例关系[30-31]。LC3-Ⅱ可反映自噬活性水平,其值越大,自噬越强,反之则越弱。LC3 蛋白共分为多种亚型,其中LC3B 起到自噬调控作用,与自噬的关系最密切,通过结合脂质形成LC3B-Ⅱ发挥自噬功能[32]。p62 是泛素化蛋白,可以和底物蛋白及LC3-Ⅱ特定结构域结合,有利于底物进入自噬体被降解,p62 越高表示自噬越弱,反之则越强[33]。通过荧光显微镜观察肝细胞GFP-LC3 荧光斑可很好地监测细胞自噬,当发生细胞自噬时,细胞自噬强度与GFP 荧光强度成正比,自噬强度越强,荧光强度越强。本研究结果显示电针干预后IR 大鼠LC3B-Ⅱ蛋白表达显著上升,p62 蛋白表达均显著下降,电针组GFP-LC3 荧光密度显著上升,由此可推论电针激活了大鼠肝脏细胞自噬。
研究证实电针对细胞自噬具有调节作用。田洪昭等[34]发现,电针可增加自噬相关蛋白LC3-Ⅱ表达,降低p62 的表达,促进自噬流修复损伤脊髓。黄小珍等[35]通过研究后发现,电针可降低脊髓及神经组织p62 的蛋白含量,对神经根型颈椎病大鼠具有显著镇痛作用,可通过调节大鼠脊髓及神经组织神经细胞的自噬保护神经细胞。有研究发现,电针治疗可降低LC3 的表达,上调p62 的表达,有效抑制肥胖大鼠白色脂肪组织的自噬水平[36]。本研究结果显示,电针可以上调LC3B-Ⅱ表达,下调p62 表达,提示电针能激活肝脏自噬,与以上众多研究报道相符。
综合上述内容,电针疗法可提高IR 大鼠全身及肝脏胰岛素敏感性,有效改善IR,其作用机制可能与调节LC3B-Ⅱ和p62 的表达,从而激活肝脏自噬有关。

