7 种新型冠状病毒核酸检测弱阳性质控品的性能比较*
赵冉,夷峥,陈颖玮,黄中强,储呈祥,王雪亮,(上海市临床检验中心.质控品研发实验室,.临床细胞分子遗传学研究室/分子病理研究室,上海 200126)
随着分子生物学技术的快速发展,核酸检测已成为辅助诊断多种感染性疾病的有效手段,如新型冠状病毒(新冠病毒)核酸检测结果可作为疾病确诊的依据[1]。核酸检测包括样本采集、运输、保存、检测和结果分析等多个环节,其中任一环节均会影响检测质量。为保证检测结果准确可靠,使用室内质控品是实验室质量管理的重要措施之一[2-4]。历次版本的《新型冠状病毒肺炎防控方案》均明确要求实验室使用弱阳性质控品同批参与检测过程。此外,质控品还用于实验室检测系统性能验证、仪器校准、测量程序评估等[4-5],核酸检测质控品应能够监测样本核酸提取和扩增等检验全过程质量。
目前可供选用的商品化新冠病毒核酸检测质控品种类多样,不同类型质控品性能及适用场景可能存在较大差异[3-5],选择性能可靠且适用的质控品是保证检测质量的前提。然而,目前尚无对第三方弱阳性质控品性能比较评价的相关研究。为此,本研究选取多种常见的商品化新冠病毒核酸检测弱阳性质控品进行评价,以期为实验室合理选用质控品提供参考借鉴。
1 材料与方法
1.1 质控品样本 7 种商品化的新冠病毒核酸检测弱阳性质控品分别来自:郑州标源生物科技有限公司、广州邦德盛生物科技有限公司、上海之江生物科技股份有限公司、睿丰康生物医药科技(浙江)有限公司、英维谱(浙江)生物科技有限公司、北京康彻思坦生物技术有限公司、广东和信健康科技有限公司,随机编号为品牌A(1×103copies/mL)、品牌B(1.12×103copies/mL)、品牌C(1.03×103copies/mL)、品牌D(1×103copies/mL)、品牌E(1.83×103copies/mL)、品牌F(1×103copies/mL)和品牌G(1×103copies/mL)。
1.2 核酸检测方法 使用NP968-C 核酸提取仪(西安天隆科技有限公司)及配套试剂耗材(批号22081010T324),根据说明书及操作规程进行核酸提取。使用ABI 7500 实时荧光定量PCR 仪(美国赛默飞世尔公司)进行核酸扩增。为减少配制试剂等操作引入的误差,除适用性评价外,均使用武汉明德生物科技股份有限公司生产的新冠病毒核酸检测试剂盒(明德,批号220809)进行核酸扩增。
1.3 评价方法
1.3.1 适用性评价 各质控品分别随机选取5 管,提取核酸后使用20 种不同品牌的经国家药品监督管理局(National Medical Products Administration,NMPA)批准的新冠病毒核酸检测试剂分别进行检测,分析其靶基因扩增Ct 值是否符合阳性结果判断要求。
适用性评价试剂生产商包括:明德(批号220809)、郑州安图生物工程股份有限公司(安图,批号20220516)、上海伯杰医疗科技股份有限公司(伯杰,批号20220516G)、广州达安基因股份有限公司[达安(快速法),批号2022536 及达安(普通法),批号20220086],浙江东方基因生物制品有限公司(东方基因,批号AA220707)、复星诊断科技(上海)有限公司(复星,批号C20220430)、华大生物科技(武汉)有限公司(华大,批号60202010065)、上海捷诺生物科技有限公司(捷诺,批号COV20221006)、杭州迪安生物技术有限公司(金迪安,批号2208086)、卡尤迪生物科技宜兴有限公司(卡尤迪,批号202209072)、潮州凯普生物化学有限公司(凯普,批号20220919A)、迈克生物股份有限公司(迈克,批号1020531)、北京纳捷诊断试剂有限公司(纳捷,批号DJ202201)、圣湘生物科技股份有限公司(圣湘,批号2022191-1)、江苏硕世生物科技股份有限公司(硕世,批号20220705)、上海思路迪生物医学科技有限公司(思路迪,批号QP07220724)、上海之江生物科技股份有限公司(之江,批号P20220140)、中元汇吉生物技术股份有限公司(中元,批号5207039)及北京卓诚惠生生物科技有限公司(卓诚惠生,批号C20220430)。
1.3.2 稳定性评价 对品牌A~G 质控品的短期稳定性、长期稳定性、反复冻融后稳定性分别进行评价,步骤:(1)短期稳定性:包括37 ℃储存2 h、4 h,25 ℃储存2 h、4 h、6 h、8 h、1 d,4 ℃储存4 h、8 h、1 d、2 d、3 d,-20 ℃储存2 d。(2)长期稳定性:包括-20 ℃储存2 周、1 个月、3 个月及6 个月。(3)反复冻融测试:将-80 ℃冻存的各品牌质控品样本取出后25 ℃静置1 h 至完全融化,再置于-80 ℃冻存12 h 以上为1 次冻融,分别进行冻融1 次、2 次、3 次。经相应条件处理后的样本分别提取核酸并进行检测,与-80 ℃保存的样本检测Ct 值进行比较。
1.3.3 量值准确性评价 使用新型冠状病毒核糖核酸基因组标准物质[中国计量科学研究院,编号GBW(E)091099]作为标准品分别进行10-1、10-2、10-3倍稀释后检测并绘制标准曲线,对各品牌质控品进行定量。根据Ct 值计算各质控品中ORF1ab基因、N 基因浓度,与各质控品产品说明书中所标示浓度进行比较。
1.3.4 核酸残留检测 各品牌质控品分别随机选取3 管,以不提取核酸的样本直接作为模板进行检测,并与提取核酸后检测结果进行比较。
1.4 统计学分析 除适用性评价外,其他每次试验为3 个重复样本,计算Ct 值的均数±标准差()。采用GraphPad Prism 5 软件对数据进行统计分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 适用性验证 7 种品牌弱阳性质控品适用性评估结果见表1。在不考虑内参基因的情况下,仅品牌A 质控品使用迈克试剂不能有效检出ORF1ab基因,其余各质控品均适用于各检测试剂。因此,7种品牌质控品均可满足多种检测试剂对阳性质控品的需求。
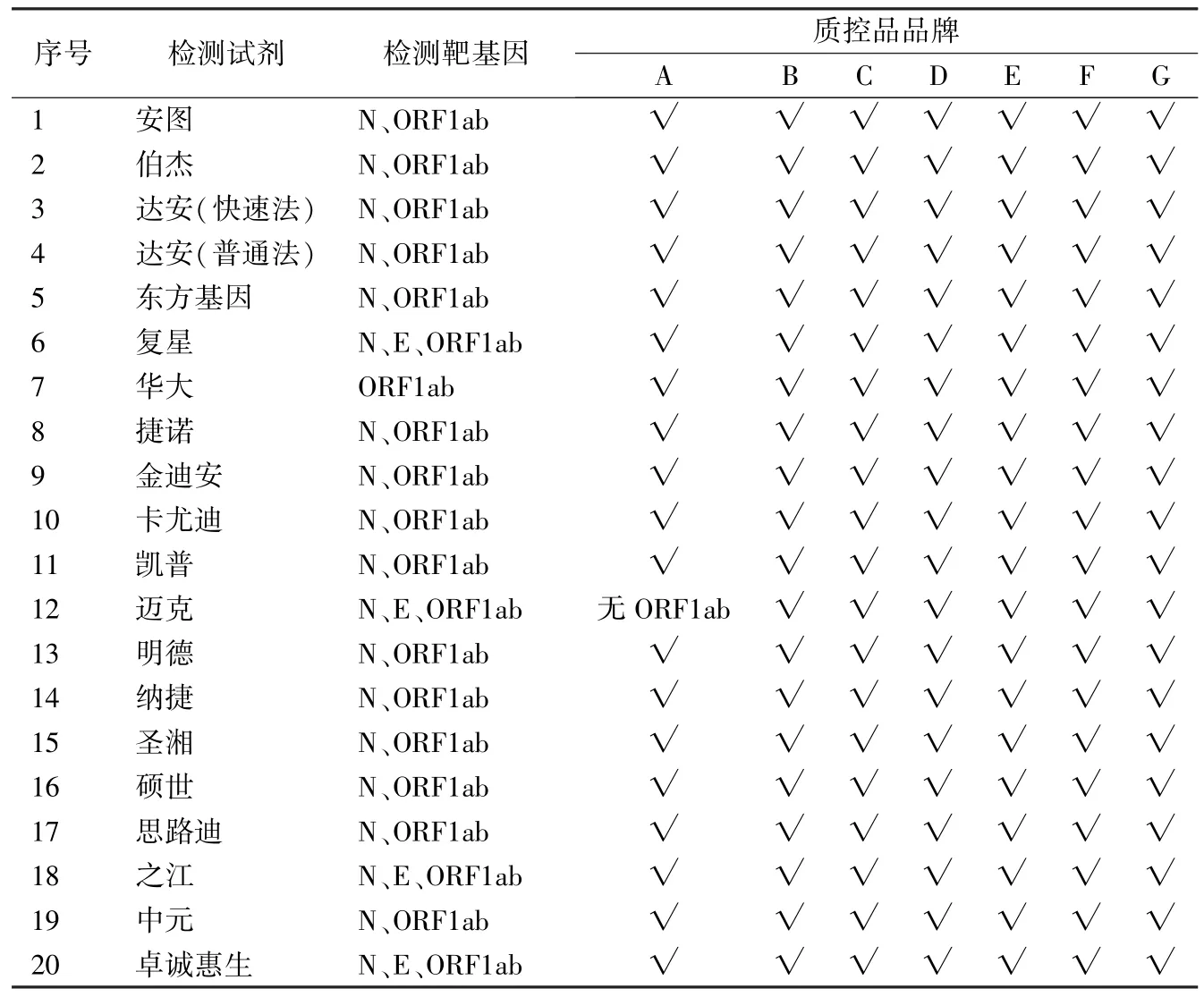
表1 品牌A~G 质控品对不同检测试剂的适用性
2.2 稳定性评价 不同保存条件(-20 ℃,2~8 ℃或室温)下的各质控品稳定性结果以ORF1ab 基因为例进行分析,结果见图1。与-80 ℃相比,7 种质控品在37 ℃保存4 h、25 ℃保存1 d、4 ℃保存3 d、-20 ℃保存6 个月时其Ct 值均无明显变化。N 基因检测结果与ORF1ab 基因检测结果类似。表明7种质控品稳定性良好,临床实验室在实际应用中将质控品暂存于2~8 ℃或室温条件下不会显著影响其检测效果。
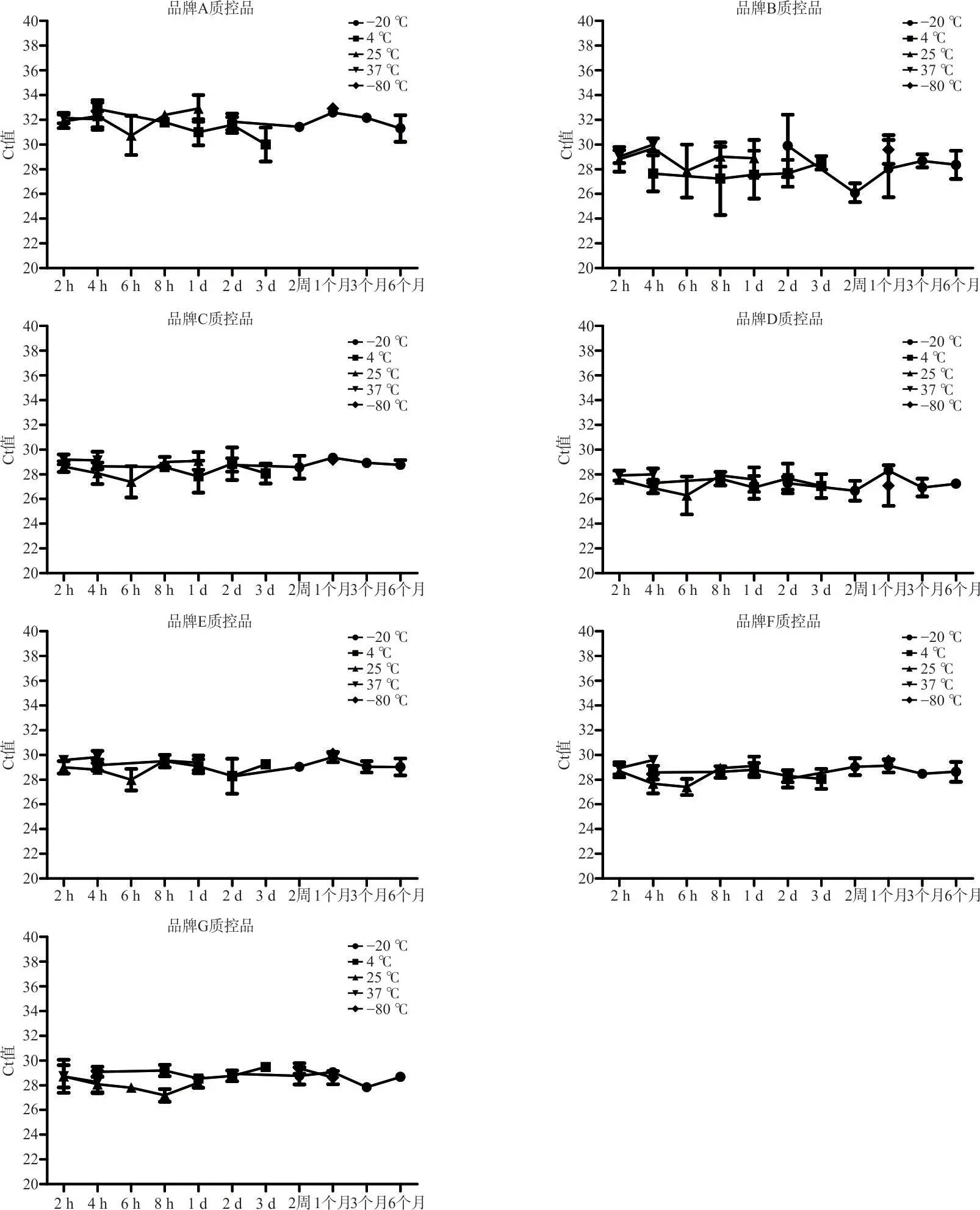
图1 品牌A~G 质控品ORF1ab 基因在不同条件下的稳定性
此外,7 种质控品反复冻融后与冻融前(0 次)检测结果进行比较,显示ORF1ab 和N 基因检测Ct值差异均无统计学意义(图2),表明反复冻融3 次后不影响其稳定性,在实际使用中质控品开瓶后多次使用不影响其检测效果。
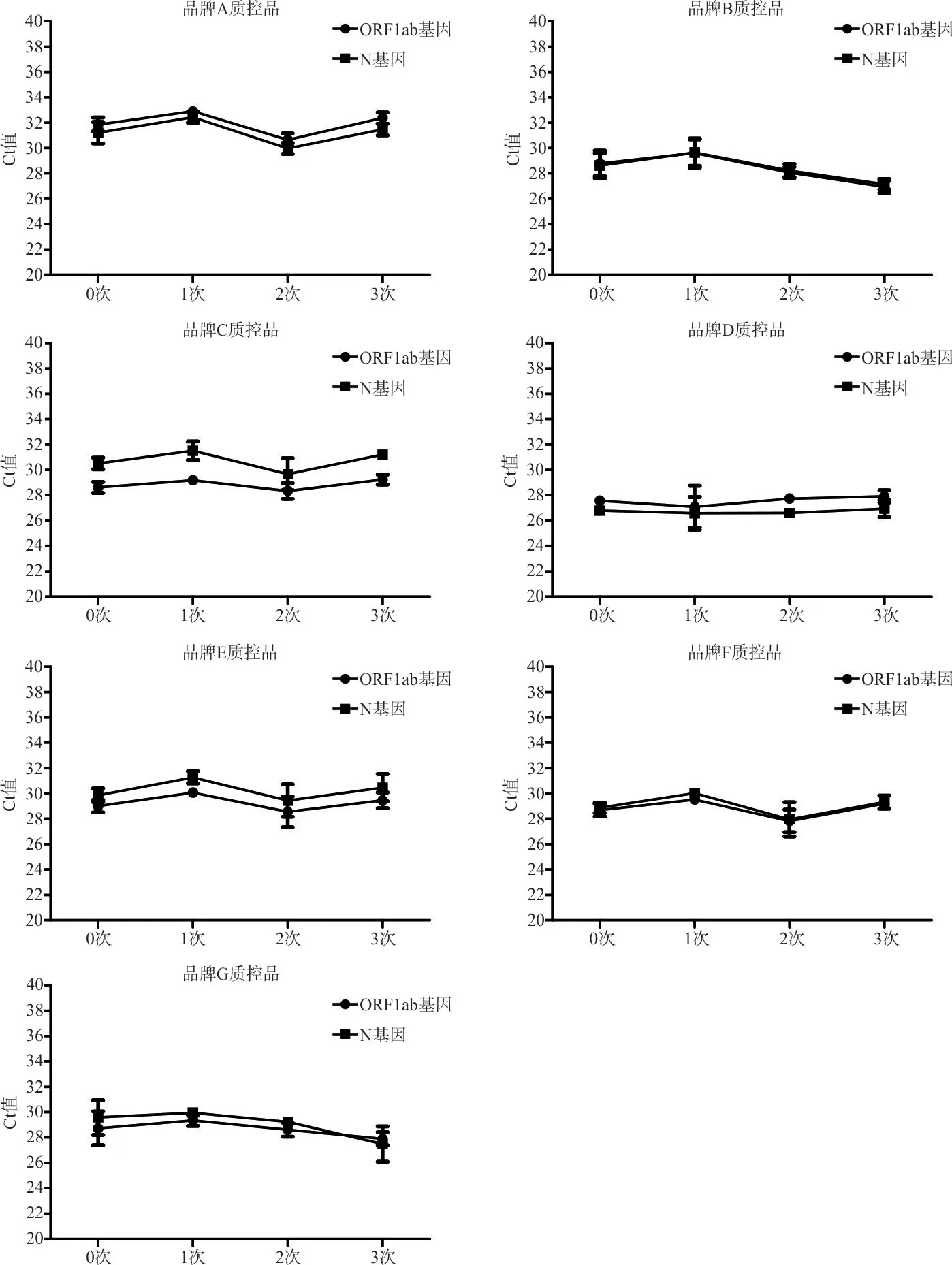
图2 品牌A~G 质控品反复冻融不同次数后检测Ct 值比较
2.3 量值准确性评价 7 种不同品牌质控品定量结果及其与产品说明书中的标示浓度比较结果见表2。除1 种弱阳性质控品定量结果与其标示浓度值接近以外,其余6 种弱阳性质控品的实际定量结果与标示浓度值均存在较大差距,个别品牌的浓度差异高达220 倍,明显不符合相关法规文件中对新冠病毒弱阳性质控品浓度要求。
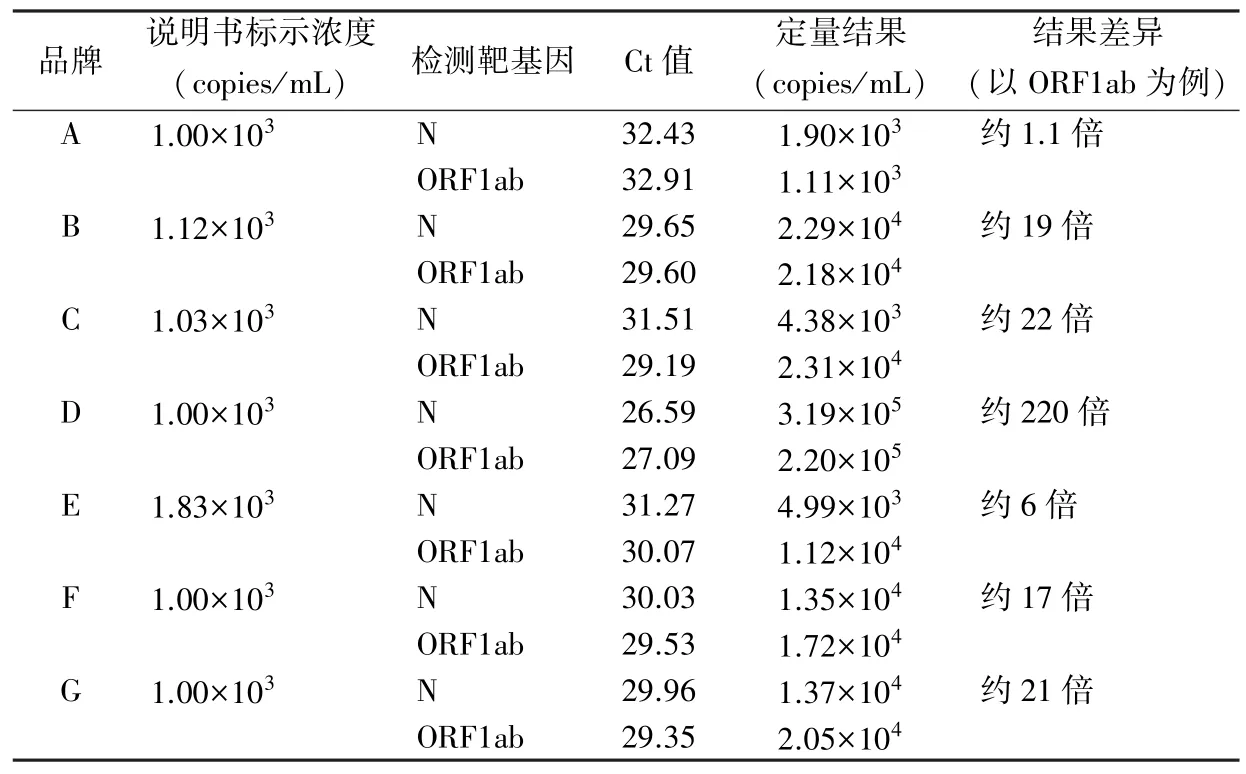
表2 品牌A~G 质控品使用标准物质定量结果
2.4 核酸残留检测 7 种品牌质控品进行核酸提取后检测或不提取直接检测Ct 值结果见表3。部分质控品核酸残留处理较好,在不提取核酸情况下完全无核酸扩增反应,如品牌B、E 和F。但部分品牌质控品仍存在残留核酸,不提取核酸直接扩增即可产生阳性结果。如品牌A 质控品仅对ORF1ab基因靶标进行了处理,其N 基因在提取核酸后扩增Ct 值与未提取核酸直接扩增Ct 值仅相差1 左右;品牌C 质控品不提取核酸与提取核酸后检测其检测靶基因Ct 值仅相差2 左右,证明该产品中仍有大量的核酸残留。而品牌G 和品牌D 质控品虽然在未提取核酸情况下也有部分扩增,但与提取后扩增的Ct 值差异较大,说明该质控品虽然进行了处理,但仍有少量核酸残留。
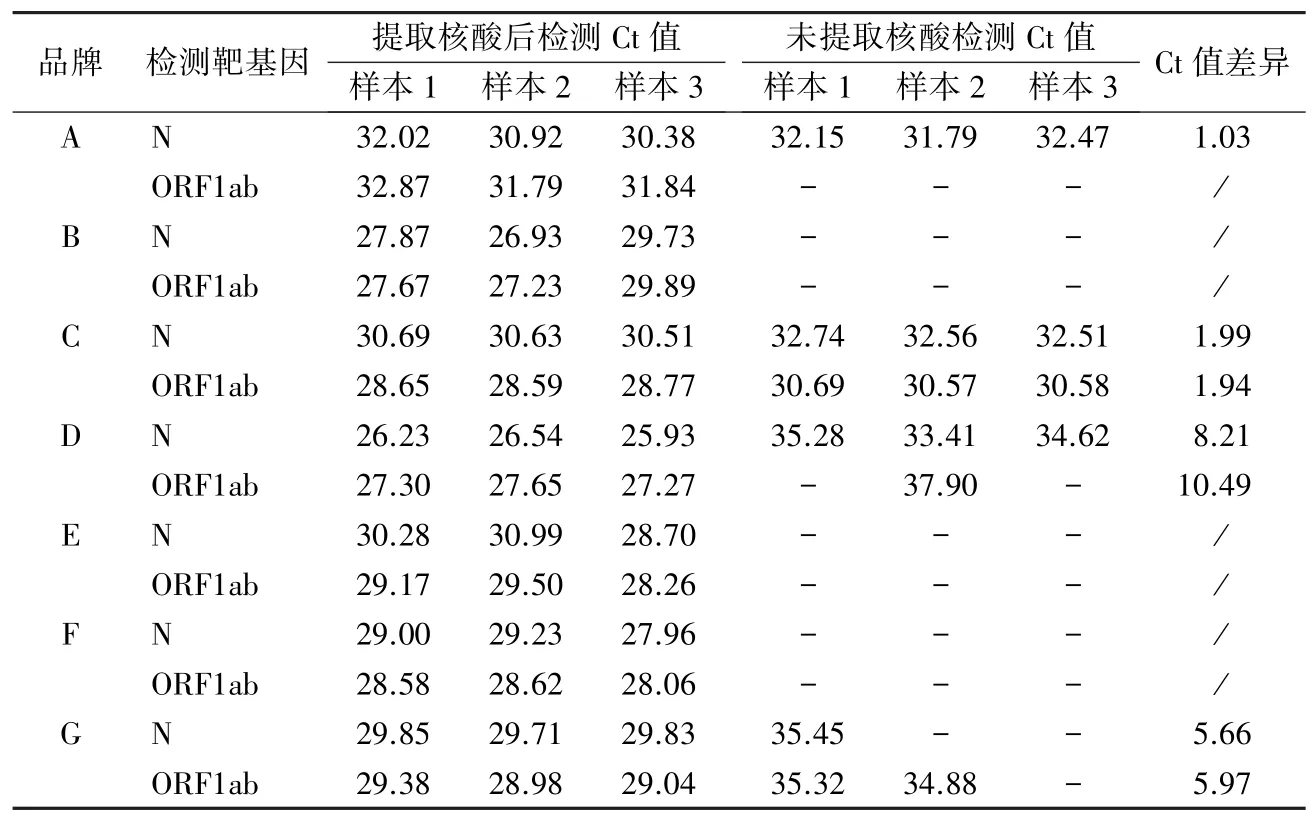
表3 不同品牌质控品核酸残留检测结果
3 讨论
合理设置质控品是保障核酸检测结果准确可靠的重要手段[4]。目前新冠病毒核酸检测可供选择的质控品有多种类型,例如假病毒颗粒和灭活病毒等,其在生物安全风险、保存运输条件等方面特性不同[4-7]。选择合适的质控品是保障检验项目质量的前提,但目前缺少对相应质控品性能的比较评价研究。为此,本实验对7 种品牌质控品进行性能评估,以期为临床实验室合理选用质控品提供参考。
新冠病毒核酸检测质控品通常存放于-20 ℃,使用时于2~8 ℃或室温解冻,且常需要开瓶后多次使用。本研究结果显示7 种质控品在不同保存条件下或反复冻融后稳定性良好,均能满足实验室日常使用要求。适用性评价结果表明绝大多数质控品均可满足不同检测试剂需求,但仍有少数质控品未能覆盖个别检测试剂靶基因。因部分检测试剂为外源性内标,此次评价中未考虑质控品中内参基因检出情况。但笔者也发现部分质控品用于个别检测试剂时确实存在不能有效检出内参基因的问题。因此,如何确保核酸检测质控品覆盖所有检测试剂靶基因,且能包括各类内参基因,是未来质控品进一步优化提升的方向。
为降低检测假阴性结果风险[8],新冠病毒核酸检测建议使用弱阳性质控品。然而,多数实验室在使用弱阳性质控品时仅关注其扩增曲线,未对质控品实际浓度进行有效验证。本研究发现大多数品牌弱阳性质控品实际浓度远高于产品说明书中的标示浓度值,这并不符合弱阳性质控品的浓度要求,可能会无法有效监测实验室检测假阴性结果。此外,高浓度阳性质控品在使用过程中还存在引发实验室污染的风险[9]。因此,建议临床实验室在选用弱阳性质控品时除关注扩增曲线外,还需关注所用质控品的实际浓度。
此外,为更好地监测RNA 病毒核酸提取及反转录效率,质控品应完全去除生产过程中的核酸残留。目前商品化质控品制备较多采用RNA 体外转录、噬菌体病毒样颗粒、慢病毒颗粒等技术,其生产过程均涉及质粒DNA 的使用,易导致质粒DNA 残留[9]。本研究结果表明部分质控品不提取核酸完全不能进行扩增,说明其质控品核酸残留处理较好。当然,也不能排除部分产品有添加核酸扩增抑制剂的情况。残留的质粒DNA 会导致其无法有效模拟真实病毒的核酸提取和逆转录过程。此外,本研究还发现部分质控品未能完全去除核酸残留,这说明其生产工艺尚存在问题,不能有效监控检测全过程质量。因此,临床实验室在选用核酸检测质控品时应评价其产品中的核酸残留情况,以确保能够监测检验全过程质量。
综上所述,本研究所评价的7 种质控品基本能满足各检测试剂的适用性需求,且稳定性良好。但部分质控品量值准确性和核酸残留方面尚存在一定问题。虽然目前新冠病毒核酸检测已大大减少,但类似问题也很可能出现在其他RNA 病毒核酸检测质控品中,如多重呼吸道病毒检测。因此,质控品生产商应持续优化提升相关产品质量,实验室也应合理选用并规范设置质控品,以有效保证相关病原体检测结果的准确可靠,从而更好地服务于临床。

