脓毒症患者肠道短链脂肪酸的变化及临床意义分析
范彬,张立,汪逸,胡秀平,徐良
脓毒症患者肠道短链脂肪酸的变化及临床意义分析
范彬,张立,汪逸,胡秀平,徐良
浙江省人民医院(杭州医学院附属人民医院)急诊重症中心重症医学科,浙江杭州 310014
探讨脓毒症肠道短链脂肪酸(short-chain fatty acid,SCFA)的变化及临床意义。采用观察性研究方法,选择2019年1月至2022年6月浙江省人民医院ICU收治的脓毒症患者 50例,根据28d后转归情况分为存活组和死亡组,记录入科时患者的急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)和序贯器官衰竭评分(sequential organ failure assessment,SOFA),测定患者入科时超敏C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)及第1次粪便样品的乙酸、丙酸、丁酸含量,比较存活组和死亡组患者的APACHE Ⅱ、SOFA、CRP、PCT、乙酸、丙酸、丁酸的差异。死亡组患者的APACHE Ⅱ、SOFA、PCT均高于存活组,差异有统计学意义(<0.05),CRP差异无统计学意义(>0.05);死亡组患者的乙酸、丙酸、丁酸含量较存活组明显降低,差异有统计学意义(<0.05)。Logistic回归分析提示,APACHE Ⅱ评分、乙酸、丙酸、丁酸是脓毒症患者28d死亡的独立危险因素(<0.05)。脓毒症患者肠道的乙酸、丙酸、丁酸含量明显降低,提示肠道功能失衡,可作为评估预后的指标。
脓毒症;肠道;短链脂肪酸
脓毒症是指由感染所致的一种全身性炎症反应综合征,是宿主对感染的反应失调而导致危及生命的器官功能障碍[1]。脓毒症休克是指脓毒症患者经充分的液体复苏仍存在持续的低血压,需要使用升压药物维持血压,同时血乳酸检测结果在2mmol/L以上,脓毒症休克的病死率高达40%~70%,特别是高龄人口的增加,发病率呈不断上升趋势[2]。
脓毒症在临床上的表现常缺乏特异性,而感染的病原菌培养通常需数天后才能得出结果,且检出率相对较低,一定程度上延误诊疗时机。早期正确及时有效地诊断脓毒症病情和感染程度在临床上尤为重要。目前常用的疾病严重程度评价指标有急性生理与慢性健康评分(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)和序贯器官衰竭评分(sequential organ failure assessment,SOFA)等。肠道菌群结构失衡,如脓毒症患者肠道α-多样性的降低、宿主免疫反应的改变、肠道微生物的代谢产物短链脂肪酸(short-chain fatty acid,SCFA)产生的减少等,在脓毒症发病过程中起作用[3-4]。特定的肠道菌群特征可预测脓毒症的发展方向,也能监测脓毒症的治疗效果、早期诊断及评估预后等[5]。在临床实践中,需要有敏感的非侵入性且易于测量的早期肠道损伤生物标志物以指导早期药理干预,预防或恢复肠道损伤,并改善结局[6]。
目前脓毒症患者粪便中SCFA的含量未见有研究报道,特别是SCFA和脓毒症患者的预后关系也没有报道。SCFA是肠道菌群的代谢产物,在维持肠道黏膜健康方面发挥非常重要的生理作用[7]。本研究旨在检测脓毒症肠道菌群的SCFA含量,并分析其临床意义。
1 资料与方法
1.1 一般资料
收集2019年1月至2022年6月浙江省人民医院ICU收治的脓毒症患者的住院资料。入选标准:年龄≥18岁,诊断符合2016年《脓毒症和脓毒症休克国际共识定义》[8]诊断标准,不符合上述入选标准的予以排除,最终纳入患者共50例,本研究仅对样本数据进行分析。本研究经浙江省人民医院医学伦理委员会审批通过[伦理审批号:浙人医伦审2022研第(015)号]。
1.2 数据收集
收集入选病例的年龄、性别等资料,记录入科后即刻的APACHE Ⅱ评分和SOFA评分,由两名评分者在互不干扰的情况下分别评分,取平均值。
1.3 检测方法
留取入科后的第1次粪便样品,采用气相色谱法进行SCFA检测,包括乙酸、丙酸、丁酸等。留取入科后24h内抽取的血样品进行检测,记录超敏C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)等资料。其中CRP采用免疫比浊法;血清PCT采用罗氏电化学发光法检测。
1.4 研究终点
记录患者第28天的转归情况,分为存活组及死亡组。
1.5 统计学方法
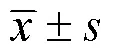
2 结果
2.1 两组患者的一般资料比较
根据患者住院28d的结局,将入组病例分为存活组(=20)和死亡组(=30)。两组患者的年龄、性别等一般资料比较,差异无统计学意义(>0.05),见表1。
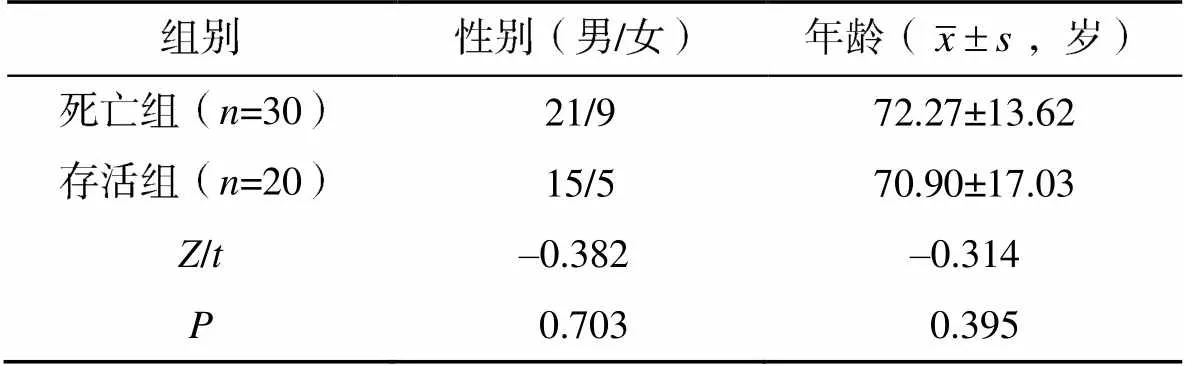
表1 两组患者的一般资料比较
2.2 两组患者入科时的实验室指标比较
死亡组患者入科时的APACHE Ⅱ、SOFA评分及PCT均高于存活组,差异有统计学意义(<0.05);CRP差异无统计学意义(>0.05),见表2。
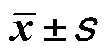
表2 两组患者入科时的实验室指标比较()
2.3 两组患者入科时的SCFA含量比较
存活组患者粪便样品中的SCFA(包括乙酸、丙酸、丁酸)含量均高于死亡组,差异有统计学意义(<0.05),见表3。
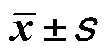
表3 两组患者入科时粪便样品的SCFA含量比较(,μmol/g)
2.4 脓毒症死亡危险因素的Logistics回归分析
将转归作为因变量,APACHE Ⅱ评分、乙酸、丙酸、丁酸作为自变量,Logistics回归分析显示,APACHE Ⅱ评分、乙酸、丙酸、丁酸均是患者28d死亡的独立危险因素(<0.05),见表4。
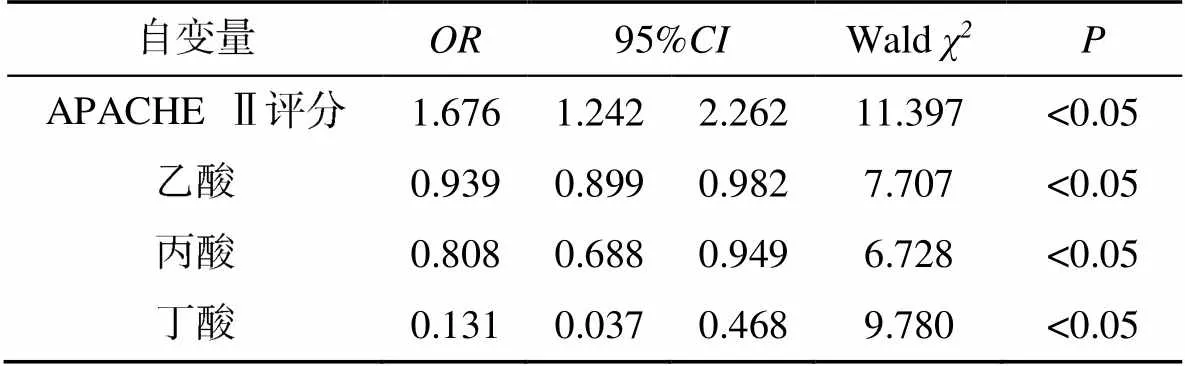
表4 脓毒症死亡危险因素的Logistics回归分析
3 讨论
脓毒症的发病机制包含炎症、免疫、凝血等方面[9]。感染是脓毒症发生的必需条件,细菌的内毒素在脓毒症的发病机制中具有促进作用[10]。近年来研究发现,肠功能障碍及菌群紊乱在脓毒症的发生及发展过程中起十分重要的作用[11]。肠道菌群与宿主之间存在稳态关系,肠道菌群除保护肠上皮免受损伤外,还参与肠道免疫防御,通过产生抗生素等代谢产物,或通过竞争管腔营养物和附着位点,抵御肠道病原体的侵袭[12]。肠道功能及肠道菌群的变化不仅影响个体的生理变化,而且会通过改变免疫应答影响宿主对感染的易感性[13]。营养和饮食在肠道菌群的组成和宿主的免疫状态中起重要作用。重症患者受肠内营养、抑酸药物、抗生素、机械通气等多种因素影响,肠道菌群多样性显著降低,肠道微生态紊乱与不良预后相关[14]。
CRP对炎症反应的敏感性很高,但缺乏特异性,非感染引起的全身炎症反应综合征CRP 水平也明显升高,同时CRP 受外界因素的干扰比较大[15]。PCT相比CRP更能反映感染的严重性及预后[16]。Anaraki等[17]研究得出,与重症成年患者使用常规抗生素治疗相比,使用PCT指导的抗生素治疗可有效缩短重症患者的治疗时间。本研究纳入的患者年龄为66~80岁,与年龄相仿的正常人群相比,脓毒症存活组患者粪便中的SCFA含量明显降低[18]。SCFA是肠道菌群的代谢产物,一方面为结肠上皮细胞提供能量,加强肠道屏障作用;另一方面依赖G 蛋白偶联受体(G protein-coupled receptors,GPCR)43/41,通过丝裂原活化蛋白激酶信号通路发挥免疫调节作用,通过核因子κB(nuclear factor-κB,NF-κB)途径发挥抗炎作用[7]。此外,丁酸可通过增强组蛋白H3在Foxp3 启动子中的乙酰化作用,增强调节T细胞的分化,发挥抗炎作用[19]。年龄是影响粪便中SCFA含量的因素之一,随着年龄的增长,粪便中的SCFA含量呈降低趋势[18]。膳食纤维是一种多糖,既不能被胃肠道消化吸收,也不能产生能量,一度被认为是一种无营养的物质。随着研究进一步发现,膳食纤维可在肠道有益菌作用下产生SCFA,并发挥重要的生理作用,因而膳食纤维被认为是“第七营养素”[20]。乙酸、丙酸、丁酸含量的减低提示肠道功能失衡,且这种失衡在病情较重的患者中表现更为明显,通过添加膳食纤维,可增加肠道SCFA含量[21]。早期实验室指标推断预后,符合重症医学的“早期目标导向治疗”,临床上常用的脓毒症生物标记物有APACHE Ⅱ、SOFA、PCT、CRP等。对患者进行脓毒症的症状、体征和实验室检查筛查,有助于早期发现和干预,因此可将脓毒症患者肠道的乙酸、丙酸、丁酸含量纳入筛查的范围,作为评估预后的指标之一[22]。
综上所述,脓毒症患者肠道的乙酸、丙酸、丁酸含量明显降低,存在肠道菌群失衡和功能下降,在代谢水平上反映脓毒症肠道存在变化,提示脓毒症的严重程度及预后,也表明可使用一些干预手段来改善肠道的功能,从而可能发现针对性治疗脓毒症的新靶点,为临床新药开发提供新的思路。本研究存在一定的局限性:①为单中心研究,样本量偏小;②仅在代谢水平上分析,未进一步在更深层次上揭示具体的代谢通路及发生机制。未来需要多中心、前瞻性、大样本临床随机对照实验研究不断验证和完善。
[1] 万有栋, 朱瑞雪, 潘新亭, 等. 脓毒性休克患者肠道微生态变化临床研究[J]. 中华急诊医学杂志, 2019, 28(3): 350–355.
[2] DELLINGER R P, LEVY M M, RHODES A, et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165–228.
[3] GRASPEUNTNER S, WASCHINA S, KÜNZEL S, et al. Gut dysbiosis with bacilli dominance and accumulation of fermentation products precedes late-onset sepsis in preterm infants[J]. Clin Infect Dis, 2019, 69(2): 268–277.
[4] RUPPÉ É, LISBOA T, BARBIER F. The gut microbiota of critically ill patients: First steps in an unexplored world[J]. Intensive Care Med, 2018, 44(9): 1561–1564.
[5] AGUDELO-OCHOA G M, VALDÉS-DUQUE B E, GIRALDO-GIRALDO N A, et al. Gut microbiota profiles in critically ill patients, potential biomarkers and risk variables for sepsis[J]. Gut Microbed, 2020, 12(1): 1707610.
[6] SHIMIZU K, YAMADA T, OGURA H, et al. Synbiotics modulate gut microbiota and reduce enteritis and ventilator-associated pneumonia in patients with sepsis: A randomized controlled trial[J]. Critical Care, 2018, 22(1): 239.
[7] MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016, 7(3): 189–200.
[8] SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock(Sepsis-3)[J]. JAMA, 2016, 315(8): 801–810.
[9] VINCENT J L, MARSHALL J C, NAMENDYS- SILVA S A, et al. Assessment of the worldwide burden of critical illness: The intensive care over nations(ICON) audit[J]. Lancet, 2014, 2(5): 380–386.
[10] HENRIKSEN D P, LAURSEN C B, JENSEN T G, et al. Incidence rate of community-acquired sepsis among hospitalized acute medical patients-A population-based survey[J]. Crit Care Med, 2015, 43(1): 13–21.
[11] 王慧芳, 王方岩, 常平, 等. 肠道微生态与脓毒症[J]. 中华危重症医学杂志(电子版), 2018, 11(6): 415–419.
[12] JACOBS M C, HAAK B W, HUGENHOLTZ F, et al. Gut microbiota and host defense in critical illness[J]. Curr Opin Crit Care, 2017, 23(4): 257–263.
[13] ADELMAN M W, WOODWORTH M H, LANGELIER C, et al. The gut microbiome’s role in the development, maintenance, and outcomes of sepsis[J]. Critical Care, 2020, 24(1): 278.
[14] 李雅琳, 李东风. 脓毒症患者的肠屏障功能损伤变化情况探究[J]. 中国现代医生, 2021, 59(9): 122–124, 133.
[15] 王胜云, 陈德昌. 降钙素原和C-反应蛋白与脓毒症患者病情严重程度评分的相关性研究及其对预后的评估价值[J]. 中华危重病急救医学, 2015, 27(2): 97–101.
[16] 麻微微, 蒋永泼. 降钙素原对危重症患者合并脓毒症早期诊断及预后预测的意义[J]. 中国现代医生, 2019, 57(7): 133–136.
[17] ANARAKI R M, NOURI-VASKEH M, OSKOUIE A S. Effectiveness of procalcitonin-guided antibiotic therapy to shorten treatment duration in critically-ill patients with bloodstream infections: A systematic review and Meta-analysis[J]. Infez Med, 2020, 28(1): 37–46.
[18] SALAZAR N, ARBOLEYA S, FERNÁNDEZ-NAVARRO T, et al. Age-associated changes in gut microbiota and dietary components related with the immune system in adulthood and old age: A cross-sectional study[J]. Nutrients, 2019: 11(8): 1765.
[19] MANCO M, PUTIGNANI L, BOTTAZZO G F. Gut microbiota, lipopolysaccharides, and innate immunity in the pathogenesis of obesity and cardiovascular risk[J]. Endocr Rev, 2010, 31(6): 817–844.
[20] HOLSCHER H D. Dietary fiber and prebiotics and the gastrointestinal microbiota[J]. Gut Microbes, 2017, 8(2): 172–184.
[21] CUERVO A, VALDÉS L, SALAZAR N, et al. Pilot study of diet and microbiota: Interactive associations of fibers and polyphenols with human intestinal bacteria[J]. J Agric Food Chem, 2014, 62(23): 5330–5336.
[22] EVANS L, RHODES A, ALHAZZANI W, et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181–1247.
Changes and clinical significance of intestinal short-chain fatty acid in patients with sepsis
Emergency and Critical Care Center, Intensive Care Unit, Zhejiang Provincial People’s Hospital (Affiliated People’s Hospital of Hangzhou Medical College), Hangzhou 310014, Zhejiang, China
To investigate the changes of short-chain fatty acid (SCFA) in intestinal tract of sepsis and its clinical significance.Fifty patients with sepsis that admitted to ICU of Zhejiang Provincial People’s Hospital from January 2019 to June 2022 were selected, and they were divided into survival group and death group according to the outcome after 28 days. Acute physiology and chronic health evaluation Ⅱ (APACHE Ⅱ) and sequential organ failure assessment(SOFA) were recorded at admission. The contents of hypersensitive C-reactive protein (CRP), procalcitonin (PCT) and acetic acid, propionic acid and butyric acid in the first fecal sample were determined. The differences of APACHE Ⅱ, SOFA, CRP, PCT, acetic acid, propionic acid and butyric acid between survival group and death group were compared.APACHE Ⅱ, SOFA and PCT in death group were higher than those in survival group, the difference was statistically significant (<0.05), CRP was not statistically significant (>0.05), and the contents of acetic acid, propionic acid and butyric acid in death group were significantly lower than those in survival group, the difference was statistically significant (<0.05). Logistic regression analysis indicated that APACHE Ⅱ score, acetic acid, propionic acid and butyric acid were independent risk factors for sepsis death at 28 days (<0.05).The contents of acetic acid, propionic acid and butyric acid in the intestinal tract of sepsis patients were significantly reduced, suggesting that intestinal function was unbalanced and could be used as a prognostic indicator.
Sepsis; Intestinal tract; Short-chain fatty acid
R574
A
10.3969/j.issn.1673-9701.2023.27.005
浙江省卫生健康科技计划项目(2021KY521)
范彬,电子信箱:fanbinxmu@163.com
(2022–12–13)
(2023–09–04)

