工厂化循环水养殖的不同规格大西洋鲑脂类组成分析❋
杨小刚, 顾靖媛, 董 暄, 王 鹏, 黄 铭, 王 杰, 高勤峰,3, 董云伟,3, 周演根❋❋
(1. 海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003; 2. 中国海洋大学食品科学与工程学院, 山东 青岛 266003;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
大西洋鲑(Salmosalar)是一种优质的鲑科鱼类养殖品种,根据世界粮农组织(FAO)数据显示,其全球年产量已超过200万t[1]。大西洋鲑营养丰富、质优味美,具有丰富的长链多不饱和脂肪酸(LC-PUFA)[2],其中n-3和n-6等LC-PUFA具有很高的营养价值和保健效应[3]。
脂类是鱼体新陈代谢所必需的营养物质[4],其组成不但会影响鱼类的口感和品质,且对人体健康至关重要[5-6],如二十二碳六烯酸(Decosahexaenoic acid,DHA)和二十碳五烯酸(Eicosapentaenoic acid,EPA)等优质脂类对人体极为有益。但是,其他脂类如胆固醇和甘油三酯等,摄入过多则会对机体产生不利影响。因此,了解养殖大西洋鲑脂类组成对鱼类营养和人体健康意义重大。
不同规格鱼类的脂类组成和含量会有显著差异,如军曹鱼(RachycentroncanadumL.)[7]、鲈鱼(Moronechrysops♀×Moronesaxatilis♂)[8]和鲱鱼(Sprattussprattusbalticus)[9]。此外,鱼类不同组织的脂类组成也会因其功能不同而有所差异。鱼类肝脏和肌肉是脂类代谢和储存的主要器官[10]。肾脏是鱼类重要的渗透调节器官,在海水环境中,肾脏主要以脂类物质作为能量来源[11]。因此,了解上述三种组织的脂类组成与鱼类规格的关系,可以更好地揭示不同生长阶段大西洋鲑对脂类的生理需求。
脂类作为必需营养成分,在鱼类的整个生命周期发挥着重要作用[12],但是,脂类种类较多,含量不一,易受到多种环境因素的综合影响[13-16],导致其在不同环境中会有所差异。循环水养殖是一种高成本、高产出、节水和节地的养殖模式,其室内养殖环境稳定可控,可有效避免食物来源多样、环境多变对鱼体脂类的影响[17]。本研究选取4个规格的循环水养殖大西洋鲑(0.89、1.96、4.41和5.75 kg)作为研究对象,以期了解不同生长阶段大西洋鲑的肝脏、肾脏和肌肉(背肌、腹肌和尾肌)的脂类组成特征,为改进鲑科鱼类规模化养殖的生产技术和水产品消费提供理论参考。
1 材料与方法
1.1 实验设计及样品采集
大西洋鲑取自山东烟台国信东方循环水养殖科技有限公司,孵化自挪威进口二倍体鱼卵。循环水养殖池为四方形,使用4个规格为6 m×6 m×3 m(有效水体90 m3)的循环水养殖池,分别饲养不同规格的鱼类,养殖密度为25 kg/m3,系统水循环量为25次/d。生物滤池体积占总水体的1/3~1/2。循环水系统由固液分离装置、生物过滤装置、消毒增氧装置、有机物去除装置、控温装置和养殖池等组成。其工艺流程如下:养殖池排出水→过滤机(去除粪便、残饵及其他固体杂质)→蛋白分离器(去除胶状物、微小颗粒)→Ⅰ级生物滤池→Ⅱ级生物滤池→Ⅲ级生物滤池→紫外灯消毒装置→氧水混合器(补充溶解氧)→养殖池(最终回流)。
养殖用水为天然地下井水,盐度常年稳定在28~30 g/L,经循环水系统处理,控制养殖期间水温范围为13.5~16.0 ℃,pH为7.2~7.5,溶氧>12 mg/L,氨氮<0.2 mg/L,流速为0.13~0.16 m/s。
饲料在整个养殖期间保持不变,其基本营养成分为:蛋白质45.5%、总脂20.2%、粗灰分8.7%、水分8.5%。饲料脂肪酸组成如表1所示。每天用自动喂食器投喂4次,日投饵量约为鱼体质量的1.5%。
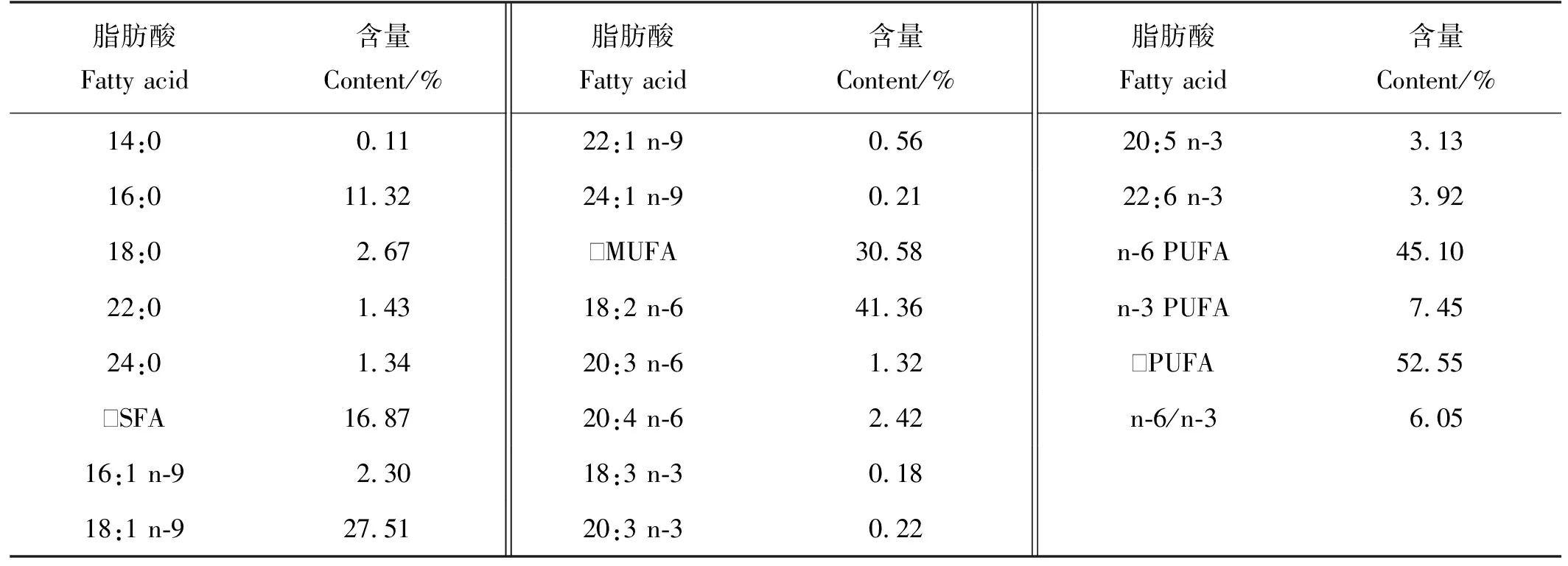
表1 循环水养殖大西洋鲑的饲料脂肪酸组成含量
本研究选取4组不同规格的大西洋鲑,实验样品组编号分别为S1、S2、S3、S4,取样时对应的平均质量分别为(0.89±0.07)、(1.96±0.18)、(4.41±0.40)和(5.75±0.24) kg,每种规格从相应养殖池随机选取10尾,置于200 mg/L的MS-222中进行快速麻醉,随后称量鱼体质量,取其肝脏、肌肉和肾脏置于液氮中速冻,并置于-80 ℃冰箱保存,以待后续检测。
1.2 总脂测定
参照GB 5009.6—2016《食品中脂肪的测定》,采用索氏-抽提法测定粗脂肪。
总脂含量百分比计算参考王蒙等[18]的公式:
P=n/m×100%,
(1)
式中:P代表总脂百分比;n代表粗脂肪总量;m代表样品干质量。
1.3 胆固醇和甘油三酯测定
根据试剂盒(A111-1-1,南京建成)使用说明分别提取肝脏、肌肉的胆固醇和甘油三酯,并测定组织样本匀浆蛋白浓度,计算组织中胆固醇和甘油三酯含量。计算公式如下:
胆固醇含量(mmol/g)=((A样本孔-A空白孔)/
(A标准孔-A空白孔))×C标准/Cpr。
(2)
式中:A为测试样本量;C标准为标准品浓度,值为5.17 mmol/L;Cpr为待测组织样本匀浆蛋白浓度(g/L)。
甘油三酯含量(mmol/g)=((A样本孔-A空白孔)/
(A标准孔-A空白孔))×C标准/Cpr。
(3)
式中:A为测试样本量;C标准为标准品浓度,值为2.26 mmol/L;Cpr为待测组织样本匀浆蛋白浓度(g/L)。
1.4 脂肪酸提取及含量测定
分别选取4种规格大西洋鲑各组织样品0.1 g,用氯仿/甲醇(2∶1, v/v)混合液低温(4 ℃)匀浆,将匀浆液过滤,加入0.4mL 0.73%NaCl溶液,并进行离心处理(15 min,30g)使溶液分层,抽走上层液体,下层液体用石油醚定容至10 mL用于提取样品中的脂质。将脂质与混合物用氮气吹干至恒质量,随即加入2 mL甲酯化试剂(HCl-甲醇溶液),充入氮气,封口膜密封,同时90 ℃水浴2 h。水浴结束之后,将1 mL色谱级正己烷加入其中,并混合均匀,静置分层并取上层溶液至色谱进样瓶中,氮气吹干,再次用色谱级正己烷复溶至50 μL待测。
使用气相色谱仪(日本岛津,GC-2010 plus)进行脂肪酸甲酯的检测,单次进样1 μL,检测器和气相色谱柱分别为火焰电离化检测器和RTX-WAX石英毛细管柱(柱长30 m,内径0.25 mm,膜厚0.25 μm)。升温采用如下方法:先以60 ℃维持1.0 min,随即以10 ℃/min升温速率升至190 ℃,最后以2.0 ℃/min的升温速率至260 ℃,并持续0.6 min。通过脂肪酸标品出峰时间来确定本研究中脂肪酸的类型。使用面积归一法对本实验脂肪酸进行定量分析,每种脂肪酸的含量表示为相对浓度(%),即试样中某个脂肪酸峰面积占所有脂肪酸成分峰面积总和的百分比。
脂肪酸的命名方法采用X:Y n-z形式,其中X表示链长,Y代表双键的数量,n-z表示第一个双键的位置(从脂肪链甲基端开始计算)。
1.5 数据处理与分析
在数据分析之前,首先剔除低含量(低于0.1%)的脂肪酸,并从不同样品中选择一致的脂肪酸来统一脂肪酸种类。具体选择方法如下:根据气相色谱仪的检测范围,并参考Dalsgaard等[19]描述的方法来界定脂肪酸类别。在分析前,剩余脂肪酸亚群被标准化为1。
具体数据分析如下:
(1)采用SAS 9.4(Cary,North Carolina,USA)对数据进行统计分析。通过Kolmogorov-Smirnov test对数据进行正态性检验,如果数据不符合正态分布,则使用非参数检验。对符合正态分布的数据采用ANOVA单因素方差分析。如果差异显著,采用Tukey(方差齐)或Tamhane’s T2(方差不齐)进行组间两两比较,以P<0.05作为差异显著性水平。
(2)采用Origin进行主成分分析,首先标准化原始脂类含量,并进一步提取所需的主成分,用于评估大西洋鲑不同规格和不同组织脂类之间的潜在差异。
(3)使用距离系数D比较不同规格间3种组织脂类的差异,该参数描述了规格之间脂类的紧密程度,该参数计算如下:

(4)
式中:Djh代表两个规格之间的脂类差异程度;Pij代表j规格的i脂类的含量;Pih代表h规格的i脂类的含量。
(4)通过在线软件(https://www.omicshare.com/tools/Home/Soft/getsoft)进行正交偏最小二乘判别分析。
(5)采用独立样本t检验分析组织n-3 PUFA和饲料n-3 PUFA的差异,以P<0.05作为差异显著性水平。
2 结果
2.1 总脂、胆固醇和甘油三酯组成
循环水养殖不同规格大西洋鲑的肝脏、肾脏和肌肉(包含背肌、腹肌和尾肌)的总脂组成含量如表2所示。S1组背肌、腹肌和尾肌总脂含量显著高于其他规格,不同部位肌肉总脂含量随规格增大而降低。S1和S3组肝脏总脂含量显著高于S2和S4组(P<0.05)。肾脏总脂含量随规格增大而升高,且S4组含量显著高于其他规格(P<0.05)。
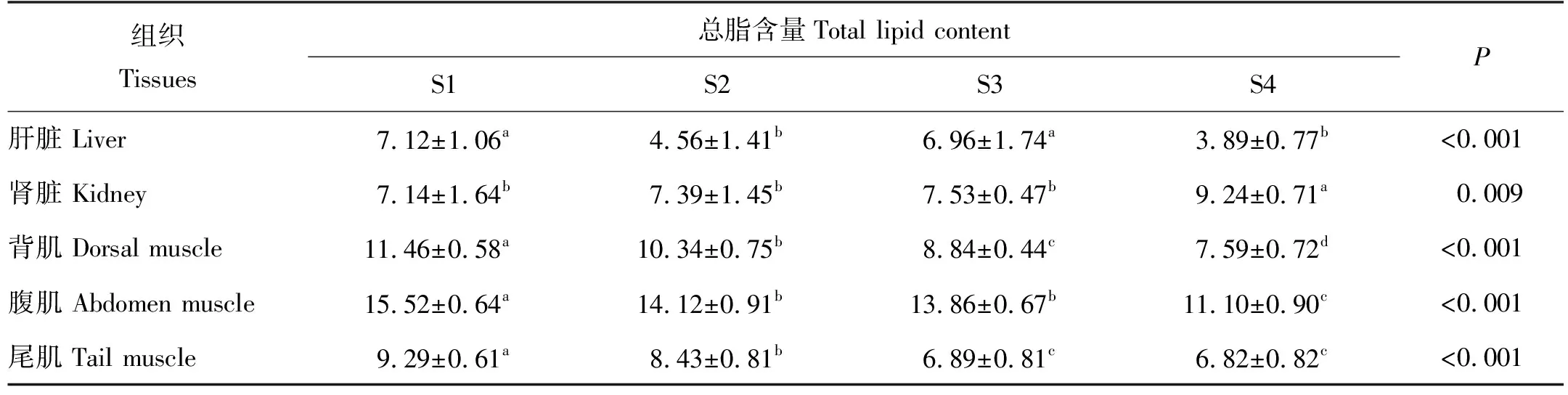
表2 循环水养殖不同规格大西洋鲑不同组织的总脂含量
循环水养殖不同规格大西洋鲑不同组织或部位的胆固醇含量如图1所示。S4组腹肌胆固醇含量显著高于其他规格(P<0.05),S4组肝脏胆固醇含量显著高于S2和S3组(P<0.05),S4组肾脏胆固醇含量显著高于S2组(P<0.05)。背肌和尾肌胆固醇含量在各规格间无显著差异(P>0.05)。
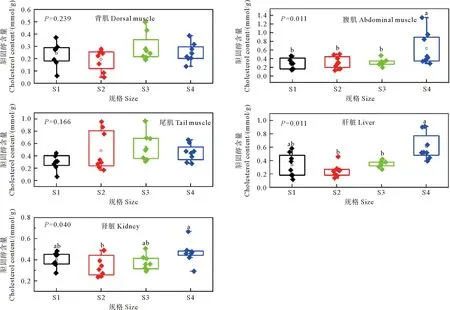
(柱状图上不同字母表示不同规格大西洋鲑间差异显著(P<0.05),S1—S4分别代表4个规格大西洋鲑。Different letters in the bar chart indicated significant differences among different specifications of Atlantic salmon (P<0.05), S1—S4 represent four sizes of Atlantic salmon.)
循环水养殖不同规格大西洋鲑不同组织或部位的甘油三酯含量如图2所示。S4组腹肌甘油三酯含量显著高于其他规格(P<0.05),S4组肝脏甘油三酯含量显著高于S2组(P<0.05)。其余部位甘油三酯含量在各规格间无显著差异(P>0.05)。

(柱状图上不同字母表示不同规格大西洋鲑间差异显著(P<0.05),S1—S4分别代表4个规格大西洋鲑。Different letters in the bar chart indicated significant differences among different specifications of Atlantic salmon (P<0.05), S1—S4 represent four sizes of Atlantic salmon.)
2.2 脂肪酸组成
循环水养殖不同规格大西洋鲑三种组织的16种脂肪酸组成含量如表3、4、5所示,包括5种饱和脂肪酸(SFA)、4种单不饱和脂肪酸(MUFA)和7种多不饱和脂肪酸(PUFA)。总体来说,不同规格大西洋鲑组织脂肪酸含量存在显著差异。
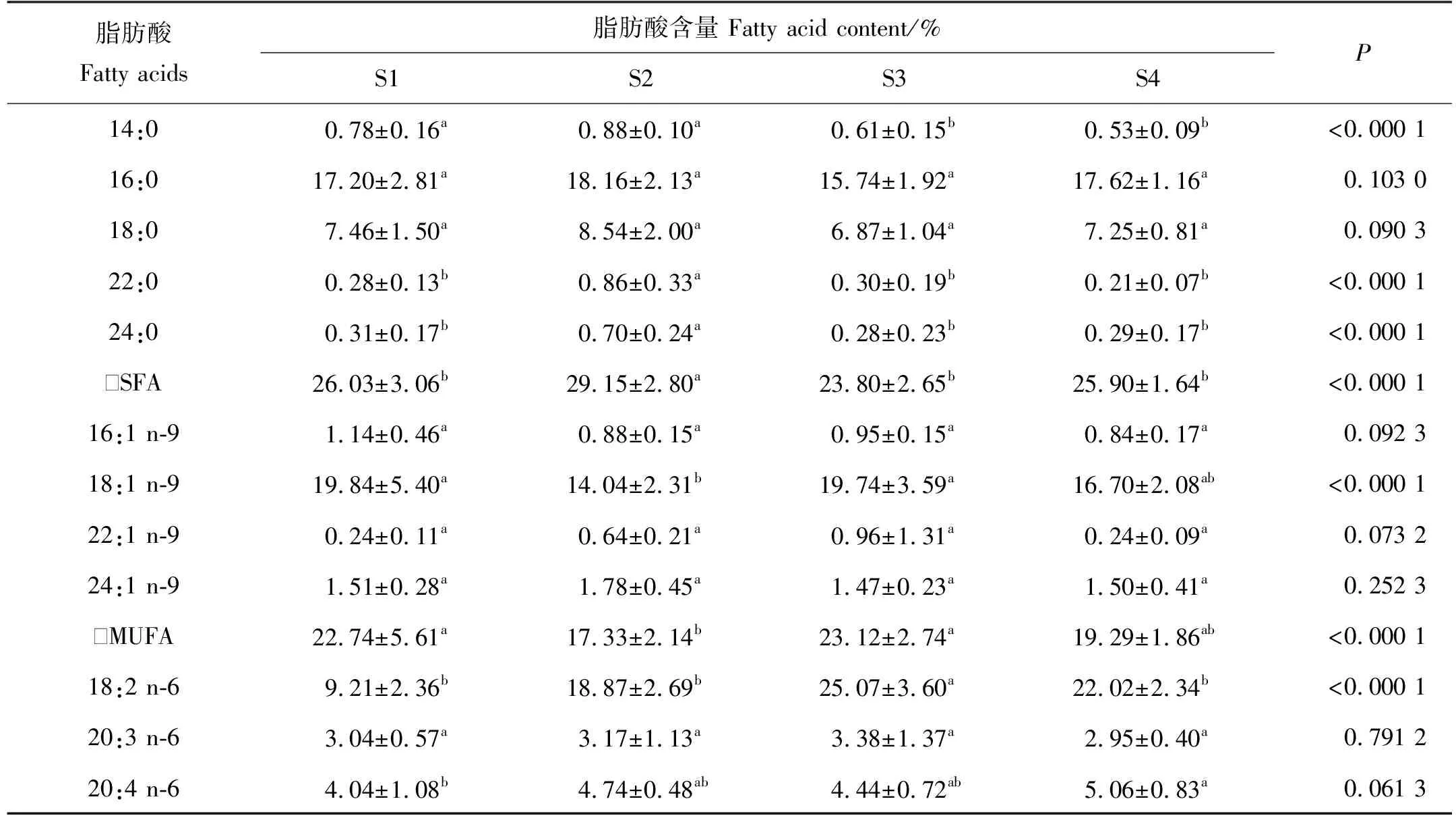
表3 循环水养殖不同规格大西洋鲑肝脏的脂肪酸组成及含量
循环水养殖不同规格大西洋鲑肝脏脂肪酸组成含量如表3所示,其中有8种脂肪酸存在显著差异(P<0.05)。肝脏SFA随着规格增大先显著升高后显著降低,最后无显著差异。n-6 PUFA在S3组显著升高,后在S4组显著降低。MUFA先显著降低后显著升高,最后无显著差异。肝脏的主要SFA、MUFA和PUFA分别为16:0、18:1 n-9和18:2 n-6,其总和超过50%。
循环水养殖不同规格大西洋鲑肾脏脂肪酸组成如表4所示,其中有13种脂肪酸存在显著差异(P<0.05)。肾脏MUFA和n-6 PUFA含量会随规格变大而显著降低,且在S2组显著降低后趋于平稳。与肝脏类似,肾脏的主要SFA、MUFA和PUFA为16:0、18:1 n-9和18:2 n-6,其总和均超过50%。
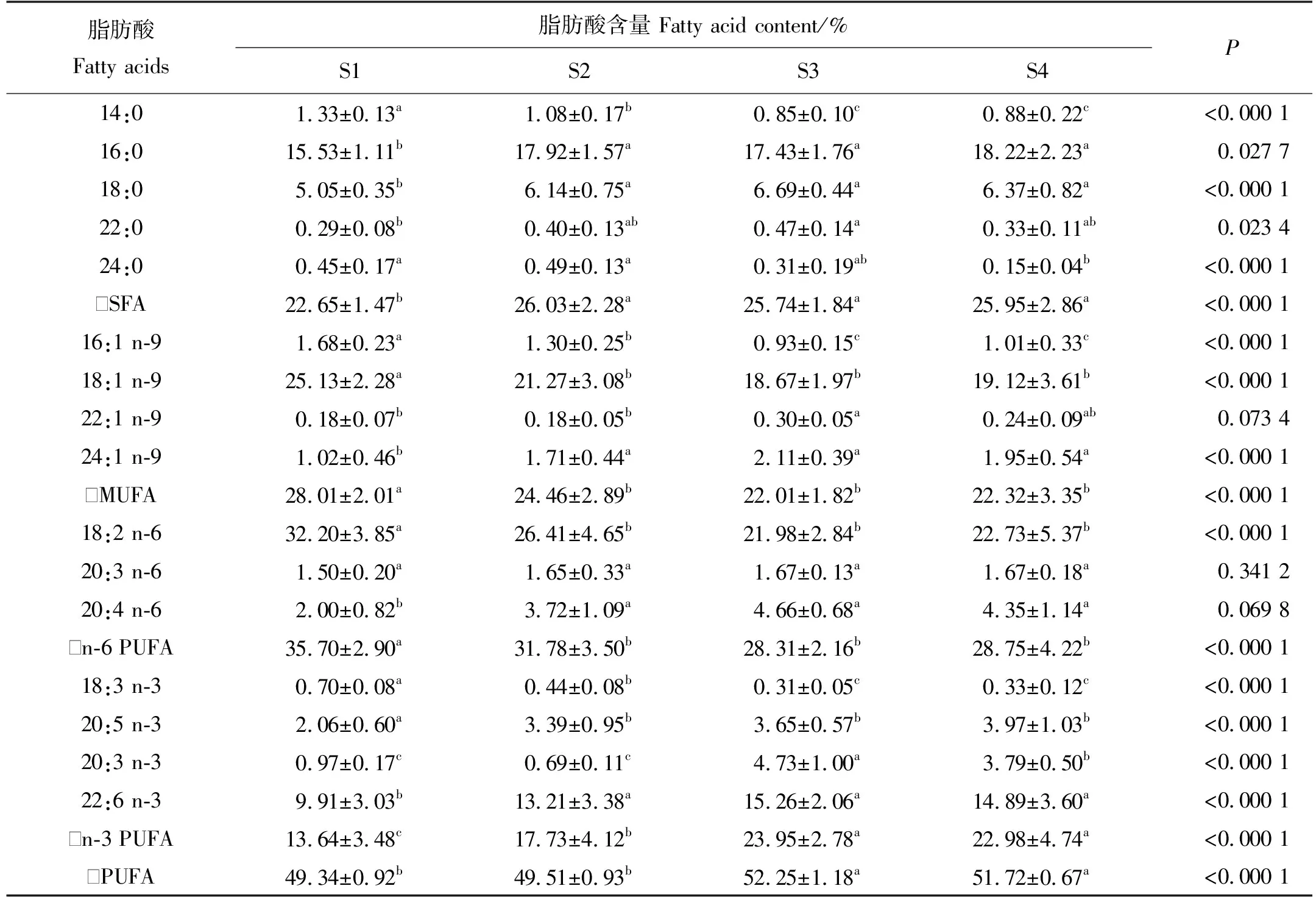
表4 循环水养殖不同规格大西洋鲑肾脏的脂肪酸组成及含量
循环水养殖不同规格大西洋鲑背肌、腹肌和尾肌脂肪酸组成含量如表5所示。4个规格肌肉SFA、MUFA和PUFA主要的脂肪酸为16:0、18:1 n-9和18:2 n-6,其总和均超过50%。4个规格大西洋鲑肌肉n-6 PUFA含量丰富,均占总体脂肪酸含量32%以上,三个不同部位肌肉n-6/n-3值在1.55~3.58之间。S1组背肌、腹肌和尾肌EPA+DHA含量高于其他规格。
2.3 主成分分析(PCA)
本研究对循环水养殖不同规格大西洋鲑肝脏、肾脏和肌肉的总脂、胆固醇、甘油三酯和脂肪酸进行了主成分分析(见图3)。由图3可知,PC1×PC2总共描述了总数据变量的59.8%(PC1为45.5%,PC2为14.3%)。大西洋鲑背肌、腹肌和尾肌样本明显聚合在一起。肝脏样本落在图的右侧,肾脏样本与其他组织区分不明显。
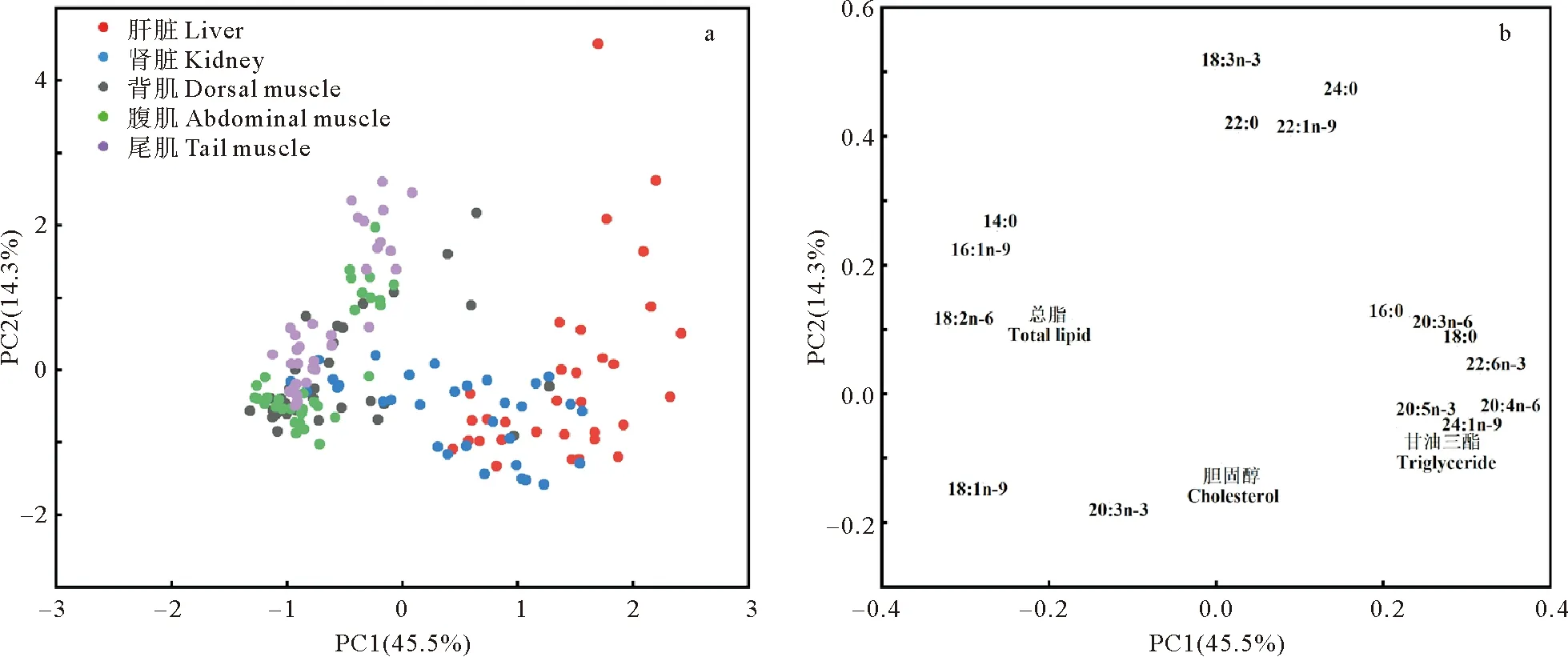
(a为主成分得分图,b为主成分载荷图。a is PCA score plot, b is PCA loading plot.)
在第一主成分中,18:2 n-6、20:4 n-6和DHA对样本分布贡献较大,其中20:4 n-6和DHA对样本分布有正贡献,18:2 n-6对样本分布有负贡献。在第二主成分中,18:3 n-3和24:0对样本分布贡献较大,两者对样本分布均有正贡献。
2.4 脂类的几何距离解析
从脂类D值雷达分布图(见图4)来看,循环水养殖不同规格大西洋鲑的肝脏、肾脏、背肌、腹肌和尾肌D值范围分别在4.79~10.56、1.67~13.36、4.03~11.64、3.98~9.79和5.37~10.75之间,其均值分别为6.79、8.42、8.34、8.28和7.84。大西洋鲑各组织D值波动范围按降序排列为:肾脏>腹肌>背肌>尾肌>肝脏。

(1、2、3和4分别代表大西洋鲑的4个规格,DS与数字组合代表两个不同规格之间脂类的定量距离。1, 2, 3 and 4 represent four sizes of Atlantic salmon respectively, DS and number combination represent the quantitative distance of lipid profiles between sizes of Atlantic salmon.)
2.5 正交偏最小二乘法判别分析
本研究使用正交偏最小二乘法判别分析(OPLS-DA)来确定不同规格大西洋鲑肌肉关键脂类(见图5和表6)。两个不同规格的大西洋鲑样本区分显著。18:2 n-6、20:3 n-3的模型变量投影重要度(Variable importance in the projection, VIP)在不同组间比较中均大于1,16:0是区分S1与S3(1.71)、S2和S3(1.42)的关键脂肪酸,18:1 n-9是区分S1与S2(1.95)、S1和S3(1.61)、S2和S3(1.61)、S2和S4(2.03)、S3和S4(2.43)的关键脂肪酸,DHA是区分S1与S2(2.33)、S1和S3(1.67)、S2和S3(1.87)、S2和S4(1.26)的关键脂肪酸,EPA和22:0是区分S2和S3的关键脂肪酸,总脂是区分S1与S3(1.56)、S1与S4(1.53)的关键指标。模型R2和Q2值均大于0.7。
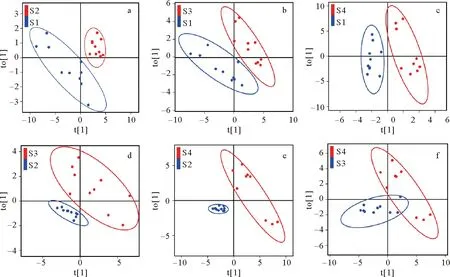
(S1、S2、S3和S4分别代表4个规格大西洋鲑。t[1]表示预测成分得分值,to[1]表示正交成分得分值。a为S1和S2的OPLS-DA分析,b为S1和S3的OPLS-DA分析,c为S1和S4的OPLS-DA分析,d为S2和S3的OPLS-DA分析,e为S2和S4的OPLS-DA分析,f为S3和S4的OPLS-DA分析。 S1, S2, S3 and S4 represents the four sizes of Atlantic salmon respectively. t[1] represents the predictive component score value, to[1] represents the orthogonal component score value. a is OPLS-DA between S1 and S2, b is OPLS-DA between S1 and S3, c is OPLS-DA between S1 and S4, d is OPLS-DA between S2 and S3; e is OPLS-DA between S2 and S4; f is OPLS-DA between S3 and S4.)
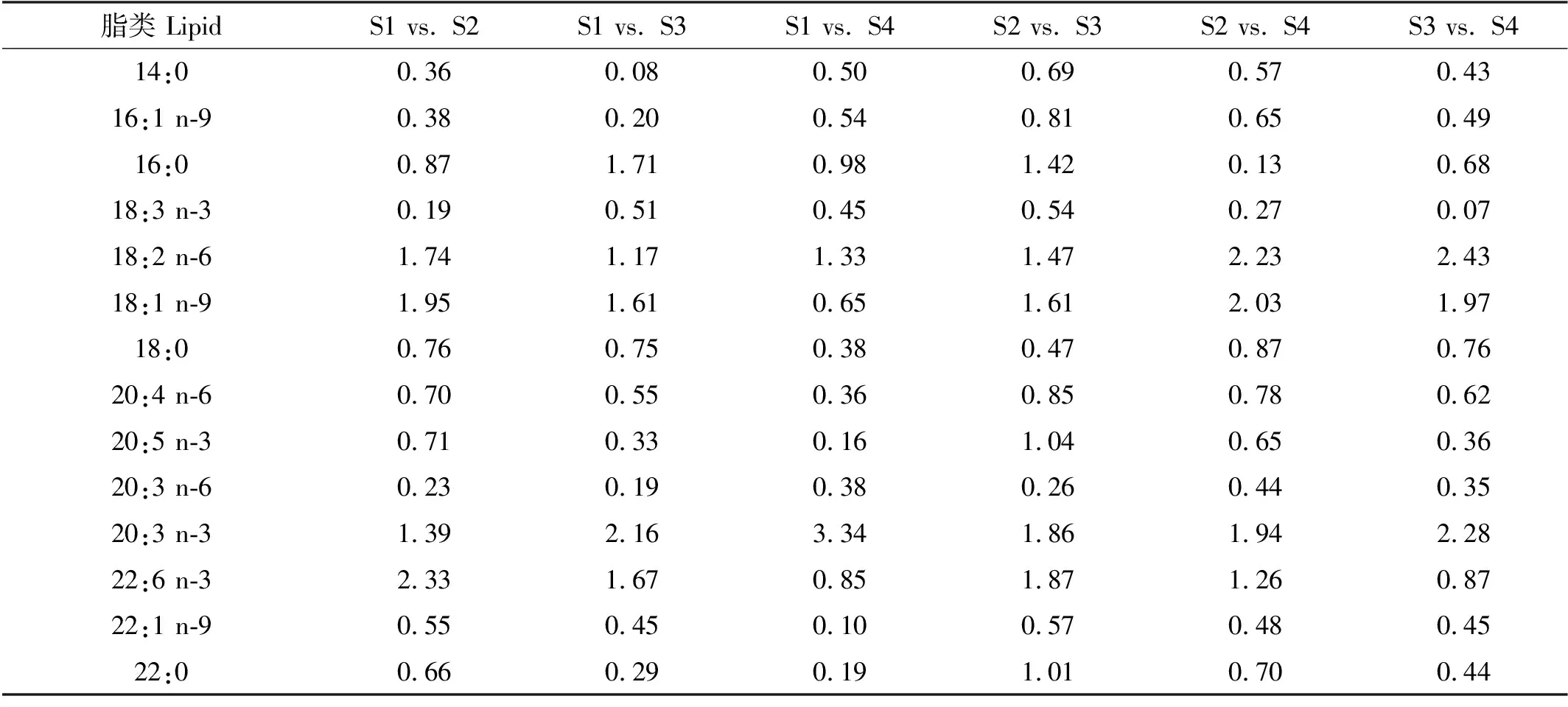
表6 不同规格大西洋鲑脂肪酸变量投影重要度
2.6 组织和饲料的n-3 PUFA组成
本研究对循环水养殖大西洋鲑组织n-3 PUFA和饲料n-3 PUFA进行了比较分析(见图6)。如图6所示,4个规格大西洋鲑的肝脏、肾脏和肌肉(背肌、腹肌和尾肌)的n-3 PUFA均显著高于饲料n-3PUFA(P<0.05)。
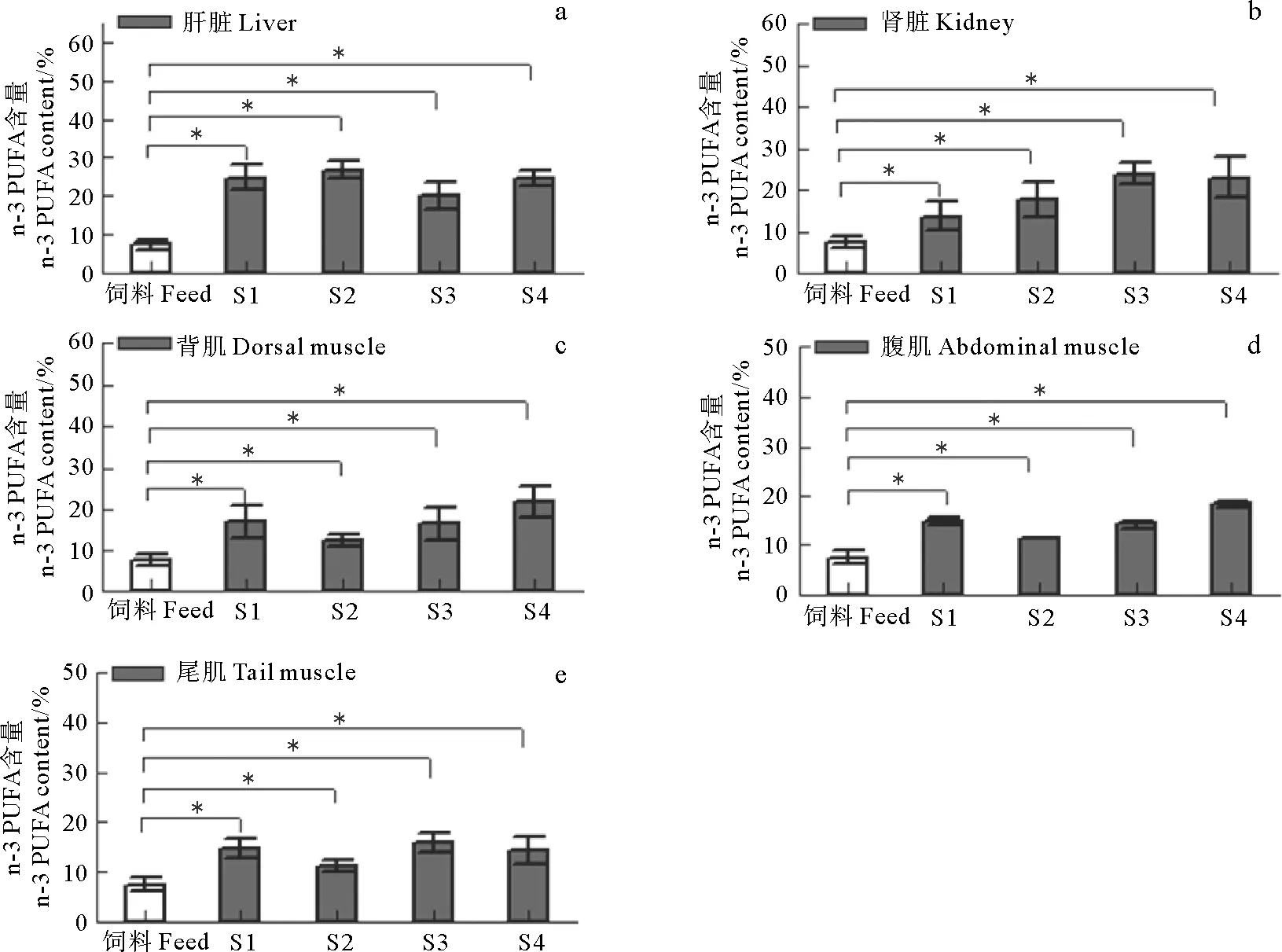
(*代表两组之间差异显著(P<0.05)。The asterisk represents significant difference (P<0.05) between the two groups.)
3 讨论
3.1 大西洋鲑肌肉、肝脏和肾脏组织脂类组成
本研究发现,大西洋鲑肝脏、腹肌和肾脏胆固醇含量均随规格增大而升高,表明大规格鱼体内胆固醇沉积现象更明显。胆固醇是鱼体胆汁酸、类固醇激素和维生素D等物质的底物[20]。随着规格增大,鱼体部分代谢器官对胆固醇的需求量可能也会增加。此外,本研究还发现4个规格大西洋鲑背肌和尾肌胆固醇含量差异不显著,说明胆固醇可以在上述两个部位保持较好的一贯性,不会因规格增大而发生较大变化。
甘油三酯是鱼体新陈代谢能量的重要来源[21]。本研究发现大西洋鲑腹肌和肝脏甘油三酯含量会随规格增大而升高,表明随着规格增大,上述两种组织对能量的需求更高。本研究中大西洋鲑腹肌、肝脏胆固醇和甘油三酯的变化趋势基本一致,均随规格增大而升高。类似地,周梦馨等[22]发现,吉富罗非鱼(Oreochromisniloticus)体内甘油三酯的升降通常会伴随着胆固醇的升降,表明鱼体胆固醇和甘油三酯的变化趋势具有相似性。
本研究中,不同规格大西洋鲑组织的脂肪酸含量存在显著差异,且肌肉、肝脏和肾脏中16:0、18:0、18:1 n-9、18:2 n-6和DHA这5种脂肪酸含量占有很高比例(>80%)。类似地,Duan等[23]发现,上述5种脂肪酸在刘家峡水库网箱养殖虹鳟(Oncorhynchusmykiss)中同样占比较高,表明大西洋鲑在不同生长阶段对上述脂肪酸的需求较高。一般来说,养殖大西洋鲑的商品饲料中会添加高比例的18:1 n-9和18:2 n-6来满足其生理需求[24],此种添加方式可能导致了大西洋鲑体内18:1 n-9和18:2 n-6含量的升高。而16:0、18:0和DHA占比较高的原因可能是由于体内脂肪酸生物合成导致的。值得注意的是,本研究发现大西洋鲑不同组织n-3 PUFA含量显著高于饲料中n-3 PUFA的含量,表明循环水养殖的大西洋鲑摄食饲料后,体内会对饲料中的n-3 PUFA选择性保留,且呈净增长趋势。
从大西洋鲑脂类的主成分分析图谱可以看出,大多数肝脏样本落在图的右侧,而大多数肌肉(背肌、腹肌和尾肌)样本位于图的左侧,均表现出良好的聚合。类似地,Barrado等[25]利用养殖虹鳟的脂肪酸组成特征成功区分了其肌肉和肝脏。因此,利用脂类组成可对鲑科鱼类肝脏和肌肉进行有效区分。值得注意的是,本研究中大西洋鲑肾脏样本与肝脏、肌肉样本分离不明显,这表明肾脏脂类组成不具有组织特异性。主成分分析中高贡献率的指标对样本分类贡献最大[26]。本研究中,脂肪酸18:2 n-6、20:4 n-6、18:3 n-3、24:0和DHA是主要贡献指标。因此,这5种脂肪酸可作为区分大西洋鲑组织的特征指标,其中18:2 n-6、18:3 n-3和24:0可作为鉴定肌肉的特征指标,而20:4 n-6和DHA可作为鉴定肝脏的特征指标。综合而言,通过分析脂类组成可鉴定鱼类组织。
距离系数D可用于描述不同样本脂肪酸的差异程度[27]。本研究以D值来描述大西洋鲑同一组织脂类在不同规格间的差异,结果发现肝脏D值波动明显低于肌肉和肾脏,这可能与肝脏特定的生理作用有关。肝脏是鱼类脂类合成、代谢及储存的主要场所,具有较强的脂质摄取能力[28],对多数脂类具有很强的选择性保护作用,该特性可能是导致大西洋鲑肝脏脂类稳定性强于其他组织的主要原因。
3.2 大西洋鲑肌肉脂类营养价值
脂类组成和含量是评估鱼肉品质的重要指标之一[29],其中n-6/n-3值是衡量食品安全性的指标,其值若高于英国卫生部建议的日常膳食最大值4.0,将可能引起消费者心血管等方面的疾病[30]。本研究发现大西洋鲑3个不同部位肌肉n-6/n-3值范围为1.55~3.58,均低于4.0,表明循环水养殖的大西洋鲑肌肉符合安全标准。DHA和EPA对人体健康极为有益[31-32]。本研究发现,S1组EPA+DHA含量最高,表明小规格大西洋鲑更善于储存DHA和EPA。类似地,Duan等[23]发现,刘家峡水库4个规格虹鳟(0.25~2.89 kg)的EPA+DHA含量会随规格增大而减少。因此,从补充EPA和DHA摄入的角度来说,S1组价值更高。
鱼体肌肉脂肪含量可增加肉质的柔嫩感和风味的浓郁感,当鱼肉脂肪含量在5%~8%时,其口感会变得细腻柔嫩[33]。本研究中,S3、S4组背肌以及S2、S3、S4组尾肌的脂肪含量在上述范围之内,表明其肉质口感较好。然而,不同规格腹肌脂肪含量均超过10%,此种现象可能与腹肌具有存储脂肪的特性有关[34],可能会在一定程度上影响到肉质口感。
目前市场上主要售卖4 kg以上的大西洋鲑,但存在以小规格鱼肉冒充大规格鱼肉的现象,两种规格的肉色相似,肉眼很难辨别不同。因此,本研究结合肌肉脂类组成和OPLS-DA区分不同规格的大西洋鲑,从而为区分不同规格鱼肉提供新的见解。模型变量投影重要度可用于衡量两组分组的贡献程度,若某指标的变量投影重要度大于1,则代表其对模型的贡献度较大[35]。本研究中,不同规格大西洋鲑两两分组明显,表明可通过脂类组成来区分不同规格大西洋鲑。16:0、18:1 n-9、18:2 n-6、20:3 n-3、22:0、DHA、EPA和总脂在变量投影重要度中占有重要贡献(大于1),表明其可作为区分不同规格大西洋鲑的关键脂类。
4 结语
循环水养殖大西洋鲑肝脏、肾脏和肌肉(背肌、腹肌、尾肌)的脂类组成会随规格变化而发生显著变化。肝脏、肾脏、腹肌胆固醇含量和腹肌、肝脏甘油三酯含量均随规格增大而升高,而EPA+DHA含量却随着规格增大而减少。肝脏脂类D值波动性低于肌肉和肾脏。PCA发现肝脏和肌肉脂类组成具有组织特异性,而肾脏不具备此种特性。通过结合大西洋鲑脂类组成和多元统计分析,可有效区分循环水养殖大西洋鲑的不同规格和不同组织。

