亚洲沙尘中铁、铜对黄海近海表层优势浮游细菌丰度影响的模拟研究❋
丁雅楠, 那 红, 祁建华❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100;2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237)
海洋浮游细菌是海洋生物群落的重要组成部分,它们可以适应高温、高压、低压、低氧等复杂多变的海洋环境,能够参与碳、氮、磷、硫等生源要素的生物地球化学循环,在海洋食物链中起着重要作用,也是海洋微生物食物环的重要环节[1-3]。细菌的丰度和群落结构决定了它们的生态功能,而环境条件的变化,如沙尘沉降等,能够影响细菌的生物活动、群落结构和生态功能[4-6]。
近海营养盐及微量金属的浓度均高于远洋,与贫营养开阔海洋相比,近海富营养化水域的浮游细菌生长效率更高[7-8],并且近海生物在富营养环境中对必需金属等元素的需求可能非常高[9],也有些海洋细菌对高浓度重金属具有耐受性[10-11]。沙尘沉降为近海输入大量的营养盐及微量金属元素,同样会影响近海浮游细菌的生长和生理作用。其中,铁对海洋的初级生产和次级生产具有限制作用,同时铁也是许多代谢过程(有氧呼吸、光合作用、硝化作用和固氮等)必不可少的辅助因子[12]。铜是海洋生物呼吸蛋白质和氧化酶的组成部分[13],对海洋浮游细菌至关重要;但海洋中铜浓度较高时,可能会对浮游植物具有毒性作用[14],进而影响海洋浮游细菌的生长。目前有研究发现,在高营养低叶绿素(HNLC)海区(如佛罗里达群岛),撒哈拉沙尘中的铁可以缓解该海区铁的限制,从而刺激弧菌生长[15];而在北大西洋百慕大群岛附近进行的沙尘添加实验表明,无机铁并不是刺激海洋弧菌生长的主要因素,沙尘中的磷以及其他微量金属元素(Zn、Cu、Mn等)可能是刺激弧菌生长的主要因素[16]。也有在HNLC地区(如亚北极太平洋地区)和印度洋极地地区的研究发现,单独添加铁并不能促进该地区细菌的生产和生长能力[17-18]。目前,微量金属对海洋浮游细菌生长的研究主要集中于铁对海洋浮游细菌生长的影响,铜对海洋浮游细菌作用的研究较少。关于海洋浮游细菌对沙尘沉降响应的研究多集中于贫营养海域,而富营养近海受沙尘传输沉降的影响更为频繁,因此研究沙尘对近海海洋细菌的影响具有重要意义。
随着近海生态系统富营养化程度逐渐加重,沿海水域中浮游细菌的产量、生物量和生长速率也会增加[19-20]。黄海处于亚洲沙尘源区和华北城市群的下风带,受亚洲沙尘影响的概率较大[21]。目前有关沙尘沉降对黄海浮游细菌影响的研究多集中于远洋[6,22],因此,本研究在去除摄食压力的条件下,通过室内培养实验来研究亚洲沙尘中铁、铜对黄海近海表层优势浮游细菌丰度的影响,为深入揭示沙尘沉降对海洋浮游细菌的影响及其作用机制提供科学参考。
1 材料与方法
1.1 培养实验设置
本研究分别于2021年6和8月,在实验室内进行了铁、铜和沙尘添加培养实验,各组物质添加浓度见表1,每组设置3个平行样。所有用于海水取样和培养实验的器皿均在10%的盐酸中浸泡24 h后用超纯水清洗干净,去除金属污染物。海水采样点为周围无显著人为污染源的黄海近岸海域(36°05′N,120°27′E),采集表层海水后,记录采样时间和海水温度。将采集的海水带回实验室,依次用酸洗过并高温高压灭菌的63 μm尼龙筛绢、5 μm混合纤维滤膜和2 μm聚碳酸酯膜过滤,滤去浮游动物和浮游植物,进行高温高压灭菌后,分装于1 L无菌聚碳酸酯瓶中。将优势细菌菌悬液(1∶100)接种至600 mL的培养体系中,分别添加不同浓度(见表1)的铁、铜和沙尘溶液混合均匀,将培养瓶置于恒温振荡培养箱中25 ℃、150 r·min-1避光培养168 h。

表1 各室内培养组添加物质浓度Table 1 Treatment applied to indoor culture experimental bottles
本研究中所用沙尘气溶胶样品是在2021年1月12日青岛发生沙尘天时采集,采用KC-1000型大流量采样器(青岛崂山电子有限公司)以1.05 m3·min-1的流量连续采样12 h,将大气颗粒物收集在Whatman 41#纤维滤膜上。采样结束后对样品进行称重,于-20 ℃冷冻保存。在进行培养实验之前,将一定量的沙尘气溶胶样品置于15 mL超纯水(18.2 MΩ·cm)中,在0 ℃下超声萃取30 min,制备沙尘萃取液,浓度为0.67和2 mg·L-1。
1.2 样品测定
1.2.1 优势浮游细菌丰度 室内培养周期为168 h,分别于培养的第0、3、6、12、24和36小时取样,之后每24小时取样一次。每次取100 μL样品,将其涂布于平板上,置于恒温培养箱中25 ℃避光培养72 h后,进行平板计数,计算其丰度。
1.2.2 各营养物质浓度分析 分别于培养的第0、1、3、5、7天取样,取30 mL水样于酸洗过的洁净HDPE瓶中,水样经0.45 μm滤膜过滤后,滤液于-20 ℃冷冻保存,用于营养盐和金属分析。同时,分别取20 mL水样置于高温灼烧过的棕色玻璃瓶中,经0.7 μm的GF/F滤膜过滤后,加入1滴饱和HgCl2溶液,将滤液于-20 ℃冷冻保存,用于溶解态有机碳(Dissolved Organic Carbon,DOC)分析。
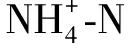
1.3 数据处理与分析方法
1.3.1 细菌丰度比(Tn/T0) 通过比较添加营养物质后各组第n时取样的细菌丰度(CFU·mL-1)与实验开始时的比值,将黄海近海表层优势浮游细菌的生长进行归一化处理[15]。
1.3.2 细菌丰度的相对变化 细菌丰度相对变化的计算方法为(A-C)/C,其中A和C分别为第n时取样的各营养物质添加组和对照组中黄海近海表层优势浮游细菌丰度的平均值[23]。
1.3.3 黄海表层近海优势浮游细菌对各营养盐的吸收(释放)速率 单个菌落对营养盐的吸收速率Isp[24-25](μmol·CFU-1·h-1),计算公式如下所示:
Isp=(Cn-C0)/B(tn-t0)。
(1)
式中:C0、Cn分别为培养实验开始和取样时的营养盐浓度(μmol·L-1);t0、tn分别为培养实验开始和取样时间;B为培养期间细菌的平均含量(CFU·mL-1),细菌在此期间以指数形式增长,则B用下式进行计算:
B=(Bn-B0)/(lnBn-lnB0)。
(2)
式中B0、Bn分别为培养开始和取样时的细菌含量(CFU·mL-1)。
2 结果与讨论
2.1 初始海水营养物质浓度

2.2 FeCl3添加对黄海表层近海优势浮游细菌丰度的影响
于2020年9月采集黄海近岸表层水,在实验室进行培养、筛选、纯化,最终得到黄海表层近海优势浮游细菌。经鉴定该细菌为Rhodobacteraceaebacterium(α-变形菌纲)。生理上高度多样化的Rhodobacteraceae是沿海海洋细菌的主要群体之一,可以迅速对环境变化做出反应[23,32]。Hou等[22]在黄海进行沙尘添加实验时发现,在培养后期,Rhodobacteraceae会取代一些γ-变形菌,在海洋浮游细菌群落结构中占据优势。因此,本研究以Rhodobacteraceaebacterium作为优势菌代表,研究沙尘沉降对海洋表层浮游细菌的影响。
不同浓度铁的添加对黄海表层近海优势浮游细菌丰度均有促进作用,但影响效应有所不同(见图1)。与对照组相比,低浓度的铁能促进该优势浮游细菌丰度增长,但无显著差异(P>0.05),这与Obernosterer等[33]在克尔盖伦群岛进行的单一铁添加(添加浓度为1 nM)的结果相似。低铁组在培养初期,优势浮游细菌处于对新环境的适应期,细菌丰度逐渐增加,至第12小时,低铁组细菌丰度是对照组的3.39倍(见图2)。在培养24 h之后,进入指数生长期,并且在第48小时细菌丰度达到最大值,低铁添加组是对照组的1.68倍。培养中期细菌丰度开始降低,在培养的第120小时,低铁组优势浮游细菌丰度降至最低值,但依然高于对照组,是对照组的1.38倍。在培养后期,低铁组优势浮游细菌丰度再次缓慢增加,细菌丰度略高于对照组,相对增加了9%~15%。高浓度的铁促进优势浮游细菌丰度,但变化趋势与对照组基本一致,没有显著差异(P>0.05)。高铁组在培养初期,优势浮游细菌增长相对较快,在培养的第12小时,高铁添加组细菌丰度已是对照组的6.58倍,显著促进细菌生长(P<0.05)。在培养的第72小时,优势浮游细菌丰度达到最大值,是对照组的1.33倍。与对照组相同,高铁组细菌丰度达到峰值后逐渐降低,在培养的第120小时,细菌丰度降至最低值,比对照组下降41%。在培养后期,细菌缓慢增长,而细菌丰度逐渐增加,高铁组细菌丰度比对照组增加了2%~15%。由此可见,不同浓度铁的添加均能延后黄海表层近海优势浮游细菌丰度峰值的出现,但峰值丰度均高于对照组,并且可以在培养前期短暂地刺激黄海表层近海优势浮游细菌的生长,呈现明显的促进作用,这与Westrich等[15]在佛罗里达群岛的一系列沙尘添加对弧菌生长的实验结果相似。同时,Westrich等[15]还发现,在沙尘添加的24 h内,与对照组相比,各添加组弧菌丰度均显著增加,且其丰度增加量主要与沙尘浓度有关;在最小沙尘添加量(溶解铁含量为0.02 nmol·L-1),弧菌平均生长速度为对照组的6倍。本研究中,在添加0.5 μmol/L无机铁后,黄海表层近海优势浮游细菌丰度在第12小时才增加到对照组的6.58倍,其生长速度远低于Westrich等研究中的溶藻弧菌和霍乱弧菌,这与不同细菌种类的自身特性、生长所需的营养物质、对外源营养物质的响应以及海水背景情况等因素有关[23,32]。
黄海近海磷酸盐浓度较低,优势细菌生长可能受到磷酸盐的限制,铁的添加使培养体系中的N/P值明显降低(见图3),促进细菌消耗DIN,释放出部分磷酸盐,缓解了培养体系的磷限制,从而在培养前期刺激优势细菌丰度增加。前期细菌快速生长,消耗了体系中的营养物质,后期体系中的N/P值逐渐增大,可能是由于营养缺乏导致细菌生长减慢,丰度下降,优势细菌矿化出无机氮。在新西兰近海的室内培养实验结果表明,异养细菌丰度对单独添加铁的响应很小,但在近海浅水区混合添加Co、Mn、Cu、Fe、Ni,可显著促进异养浮游细菌丰度增加,这表明新西兰近海细菌生长受多种金属的共同限制[34]。Hou等[22]在黄海进行的船基围隔实验结果表明,单独添加0.02 μmol/L的铁可显著促进海洋浮游细菌生物量的增加,表明黄海开阔海域浮游细菌生长受铁限制。由于不同海洋细菌细胞营养成分以及对营养物质的吸收率不同,开阔海域和沿海水域会出现不同的营养限制[35-37]。因此,即使在黄海近海铁浓度较高情况下,外源输入的铁仍然可以在短期内促进Rhodobacteraceaebacterium生长,同时减轻培养体系中的磷限制,添加铁的浓度越高,这种影响越明显。
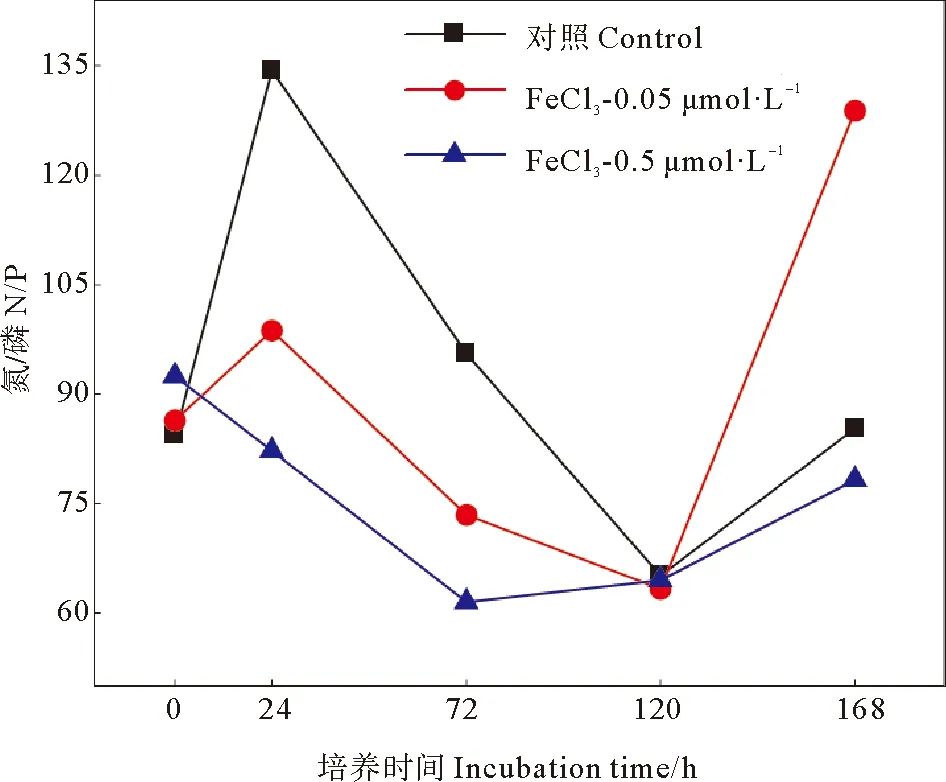
图3 添加FeCl3后各组N/P变化

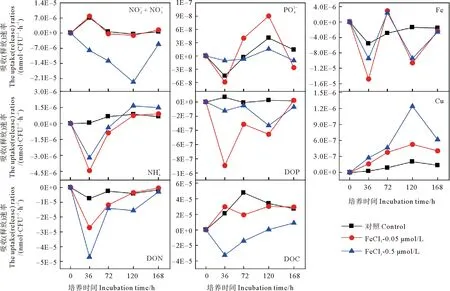
图4 添加FeCl3后各组中黄海表层近海优势浮游细菌对各营养盐的吸收(释放)速率
2.3 CuCl2添加对黄海表层近海优势浮游细菌丰度的影响
不同浓度铜的添加对黄海表层近海优势浮游细菌丰度影响结果如图5所示。结果显示,添加铜对细菌丰度有一定抑制,但与对照组并无显著差异(P>0.05)。在培养初期,低铜添加组细菌丰度逐渐增加,但略低于对照组。在培养的第24小时,低铜组细菌丰度比对照组降低了29%(见图6);在培养的第36小时低铜添加组细菌丰度达到峰值,但仍低于对照组。达到峰值后,低铜组细菌丰度开始降低,至第72小时降至最低值,比对照组降低了18%。之后低铜组细菌丰度开始缓慢增加,在第120小时达到第二个峰值,但此期间丰度均低于对照组,比对照组降低了10%~26%。这表明,低浓度铜的加入,对该优势浮游细菌的生长呈现一定的抑制作用。Baltar等[34]在新西兰沿海单独添加7 nmol·L-1铜的研究同样发现,海洋异养细菌丰度无显著变化。高铜添加组的细菌丰度变化趋势与对照组基本一致,整体表现为先升高后降低再升高的复杂变化。在培养初期,高浓度铜的加入对该优势浮游细菌的生长表现出一定的抑制作用,高铜组细菌丰度比对照组降低了4%~8%。随着培养时间的增加细菌丰度逐步增加,培养的第24小时,高铜组细菌丰度为对照组的1.46倍。与对照组不同,高铜组细菌丰度在培养的第48小时达到第一个峰值,但该峰值仍低于对照组,为对照组的94%。之后高铜组细菌丰度逐渐降低,在培养的第72小时降至最低值,比对照组低53%。培养后期,高铜组细菌丰度也在第120小时达到第二个峰值,细菌丰度仍低于对照组。总的来说,高浓度铜的添加对黄海表层近海优势浮游细菌生长的抑制作用高于低浓度铜的添加,影响更为复杂,这可能与细菌对铜生物利用性的响应以及其细胞铜配额有关[41]。由图7可知,在细菌指数生长时,铜的添加使培养体系中的N/P值降低,减轻了体系中的磷限制,而优势细菌丰度与对照组相近,甚至低于对照。由此可见,在体系中铜浓度相对较高的情况下,尽管铜的添加可以缓解磷限制,但铜的添加仍会抑制优势细菌生长,这可能与铜的毒性作用有关。

((a)培养168 h内各组细菌丰度比;(b)培养12 h内各组细菌丰度比。(a)Bacterial abundance ratio of each group within 168 h of culture;(b)Bacterial abundance ratio of each group within 12 h of culture.)
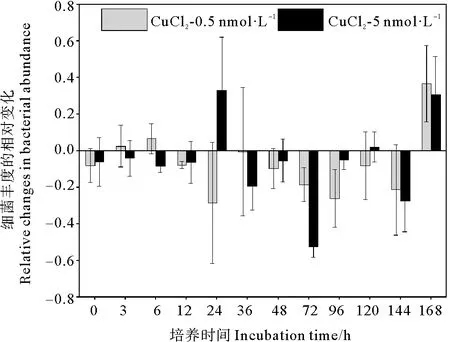
图6 添加CuCl2后各组细菌丰度的相对变化
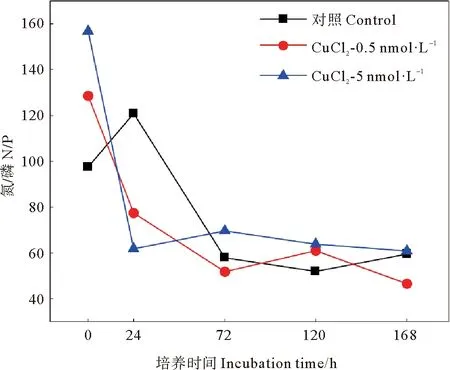
图7 添加CuCl2后各组N/P变化
2.4 沙尘添加对黄海表层近海优势浮游细菌丰度的影响
沙尘添加培养实验中黄海表层近海优势浮游细菌丰度的变化如图9所示。低浓度沙尘组与对照组优势细菌丰度变化趋势相似,对浮游细菌丰度具有一定促进作用,在第144小时存在显著差异(P<0.05)。在培养初期,低沙尘组细菌丰度逐渐增加,但比对照组低5%~13%(见图10)表现出轻微的抑制作用。而在培养的第12、72小时,低沙尘添加组细菌丰度高于对照组,相对增加了11%和16%。该组细菌丰度在培养的第144小时达到最大值,比对照组高60%,此时,低浓度沙尘显著刺激细菌生长(P<0.05)。高沙尘添加组优势浮游细菌丰度变化趋势与低沙尘添加组相似,无显著差异(P>0.05)。培养初期,高沙尘组细菌丰度逐渐增加,但比对照组低11%~19%。在培养中期,高浓度沙尘的添加主要促进了优势浮游细菌生长,细菌丰度约为对照组的1.01~1.2倍。培养后期,高浓度沙尘对优势细菌的生长具有较强的促进作用,细菌丰度为对照组的1.38~1.48倍。可见,沙尘添加对黄海表层近海浮游细菌的影响主要是初期抑制、后期促进。培养前期,沙尘的添加使得培养体系中N/P值增大(见图11),这可能是由于沙尘携带的铁、铜对优势细菌利用氮、磷的影响较小或者沙尘释放的无机氮浓度较高,磷酸盐浓度较低,从而加重了体系中的磷限制,对细菌生长有轻微的抑制作用。而后期,N/P值进一步增大,但细菌丰度却显著增加,这表明磷不再是影响优势细菌生长的主要限制因子,可能是沙尘颗粒中其他复杂的化学组分或者多种营养物质共同限制。
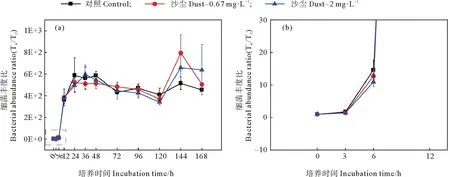
((a)培养168 h内各组细菌丰度比;(b)培养12 h内各组细菌丰度比。(a)Bacterial abundance ratio of each group within 168 h of culture;(b)Bacterial abundance ratio of each group within 12 h of culture.)

图10 添加沙尘后各组细菌丰度的相对变化

图11 添加沙尘后各组N/P变化
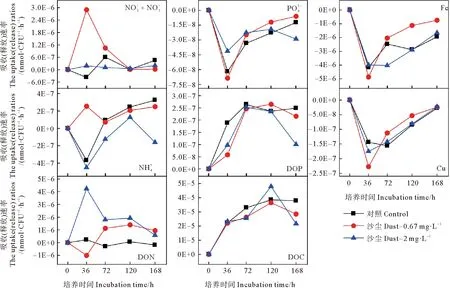
图12 添加沙尘后各组中黄海表层近海优势浮游细菌对各营养盐的吸收(释放)速率
本研究中,黄海表层近海优势浮游细菌(Rhodo-bacteraceaebacterium)对无机铁、铜以及沙尘的添加具有一定响应,与对照组相比,低铁组(第12小时)以及低沙尘组(第144小时)均可显著促进细菌生长。这表明,沙尘浓度与海洋浮游细菌生长紧密相关,在一定的阈值内,沙尘沉降对海洋细菌的丰度、活性和生产等会产生积极的影响[47]。在黄海进行的船基围隔培养实验显示,单独添加铁及沙尘显著促进海洋浮游细菌生长[7,34],而在北大西洋进行的沙尘添加实验表明,沙尘携带的无机铁并不是刺激弧菌生长的主要因子[48],因此,不同海区营养限制不同,沙尘沉降对海洋细菌的影响也不同。
沙尘沉降带来的外源营养物质可以直接影响海洋细菌生长,而Rhodobacteraceae类群与微型浮游植物密切相关[49],因此沙尘还可能通过刺激浮游植物生长[15],间接影响本研究中优势细菌的丰度。黄海近岸由于受人类活动影响,各营养物质浓度高于远洋[26],这也使得外源营养物质的输入对该优势浮游细菌生长产生的影响不如大洋显著,同时,培养前期沙尘携带的营养物质加剧了体系中的磷限制,因此优势细菌对沙尘的响应较小。Rahav等[50]在地中海低营养、低叶绿素海域四年现场研究中发现,在超寡营养海域,异养细菌丰度和细菌生产力增加更快,且生态系统营养越寡,沙尘添加对细菌丰度以及生产力的影响越明显。但本研究结果表明,即便在近岸高金属、高营养盐水体,沙尘输入仍对细菌丰度有一定影响,尤其在培养后期有显著促进作用,同时影响海洋细菌对营养盐、DOC和微量金属的利用。此外,沙尘沉降对近海浮游细菌丰度以及利用各营养物质的影响,仍然可能改变近海浮游细菌群落结构和代谢平衡,进而对海洋碳和营养物质循环产生重要影响[51-54]。
3 结论
(1)外源铁可以在培养前期内促进黄海表层近海优势浮游细菌(Rhodobacteraceaebacterium)丰度的增加,促进优势细菌对氮、磷、DOC和Fe的吸收利用,同时缓解体系中的磷限制。
(3)在近海富营养状态下,沙尘输入在前期对黄海表层近海优势浮游细菌生长有轻微的抑制作用,培养后期则促进优势细菌丰度增加。低浓度沙尘主要促进该优势浮游细菌对DON、Fe和Cu的吸收以及对DIN的释放,而高浓度沙尘则主要促进优势浮游细菌对DON的释放。沙尘沉降会加剧黄海近海的磷限制,对近海富营养海域的浮游细菌生长有明显影响。

