基于转录组挖掘球药隔重楼螺甾烷型重楼皂苷生物合成相关基因
曲别阿香,曲别军长,俸明康,何 斌,何晓勇,李 娟,冯景秋,盛华春,黄艳菲,阎新佳,刘 圆*,张绍山*
• 药材与资源•
基于转录组挖掘球药隔重楼螺甾烷型重楼皂苷生物合成相关基因
曲别阿香1, 2, 3,曲别军长1, 2, 3,俸明康1, 2, 3,何 斌1, 2, 3,何晓勇1, 2, 3,李 娟2, 3,冯景秋2, 3,盛华春2, 3,黄艳菲1, 3, 4,阎新佳2, 3,刘 圆2, 3*,张绍山2, 3*
1. 西南民族大学药学院,四川 成都 610041 2. 四川省羌彝药用资源保护与利用技术工程实验室,四川 成都 610225 3. 青藏高原民族药用资源保护与利用国家民委重点实验室,四川 成都 610225
以球药隔重楼根茎、茎和叶为材料,探究螺甾烷型重楼皂苷的生物合成基因。采用HPLC分析6个螺甾烷型重楼皂苷含量,进一步利用Illumina HiSeq X Ten平台进行转录组测序,结合定量和转录组数据进行生信分析。6个螺甾烷型重楼皂苷在球药隔重楼根茎、茎和叶中的含量具有显著差异。Illumina转录组测序共获得61 755条非冗余unigenes,其中30 263条(49.0%)被成功注释。催化生成薯蓣皂苷元的31个关键基因均被成功鉴定,且基因表达模式与皂苷的积累水平总体一致,其中、、、、、、、、、、、、、、和等基因与重楼皂苷的积累呈显著正相关。共获得了61条尿苷二磷酸糖基转移酶()基因,其中30条潜在参与重楼皂苷的糖基化修饰。球药隔重楼根茎、茎和叶中皂苷合成基因表达模式与皂苷积累规律存在一致性,鉴定的基因可指导该类活性产物的生物合成途径解析。
球药隔重楼;转录组;螺甾烷型重楼皂苷;生物合成途径;尿苷二磷酸糖基转移酶
螺甾烷型重楼皂苷是著名中药材“重楼”的主要活性成分,具有显著的抗肿瘤、抗菌、止血等药理活性,该类皂苷也是历版《中国药典》重楼项下的质控成分[1-3]。据螺甾烷型皂苷元C-17位上有无-OH,又分为薯蓣皂苷和偏诺皂苷,而偏诺皂苷又可在其C-23、C-24和C-27位加上-OH;除苷元母核的差异外,各皂苷结构的差异主要来自于苷元母核上连接的寡糖基[3]。进一步的药理研究表明,螺甾烷型重楼皂苷元的结构修饰,对其抗肿瘤、抗菌、止血等药理活性有显著影响,如糖基化后形成的重楼皂苷I、II、Ⅲ、VII、H,抗菌活性显著增强,其中重楼皂苷H的止血活性亦显著增强[3-5]。遗憾的是,自然界中,螺甾烷型重楼皂苷在重楼属植物中含量极低,外加重楼属植物生长缓慢,限制了该类化合物的开发利用[6-7]。因此,研究该类化合物在重楼属植物中的合成代谢,对该药材的药效形成机制和品质提升等具有重要意义。
螺甾烷型重楼皂苷的生物合成途径复杂。首先通过细胞质中的甲羟戊酸途径(mevalonate)和质体中的甲基赤藓糖醇-4-磷酸途径(methylerythritol 4-phosphate)合成法尼基焦磷酸(farnesyl pyrophosphate,FPP)[8-9]。FPP在角鲨烯合成酶(SQS)[10]、角鲨烯单氧化酶(SQE)[11]、环阿屯醇合成酶(CAS)[12]、甾醇-4α-甲基氧化酶(SMO1-3和SMO2-2)[13-14]、环桉烯醇环异构酶(CPI-5)[14-15]、甾醇-14α-去甲基酶(CYP51G)[14-16]、甾醇-C14-还原酶(C14-R-2)[14,17]、胆甾烯醇δ-异构酶(8,7SI-4)[14,18]、甾醇C-5(6)去饱和酶(C5-SD1)[14,19]、7-脱氢胆甾烯醇还原酶(7-DR1)[14,20]和δ(24)-甾醇还原酶(SSR1-3)[14,21]的催化下,形成胆甾烯醇。目前,从重楼中鉴定了3种不同的基因组合(CYP90G4/ CYP94D108、CYP90G4/CYP94D109、CYP90G4/ CYP94D72A616),可催化胆甾烯醇形成螺甾烷型皂苷元[22]。皂苷元最终在糖基转移酶(Uridine diphosphate glycosyltransferases,UGTs)的糖基化下,主要在C3-OH上连接不同种类(主要为葡萄糖基、鼠李糖基、阿拉伯糖基)、不同数量(主要为单糖、二糖、三糖和四糖)和不同位置(主要为C-2、C-3和C-4位的-OH)的糖基,从而形成不同的螺甾烷型重楼皂苷,糖基化步骤中报道了葡糖基化皂苷元C3-OH的UGT73CR1、UGT80A40和UGT80A41,2′--鼠李糖基化的UGT73CE1,以及6′--葡萄糖基化的UGT91AH1和UGT91AH2[12,23],而其他糖基化步骤的UGTs尚无研究报道。
球药隔重楼Franch.为重楼属L.多年生草本植物,为川渝地区珍稀品种,相较重楼属其他物种,其同时富含薯蓣型和偏诺型重楼皂苷,是探究螺甾烷型重楼皂苷生物合成相关基因的理想材料[24-25]。目前,关于螺甾烷型重楼皂苷的分子水平研究主要基于资源丰富的Smith(Franch.) Hand.Mazz.或七叶一枝花Smithvar.(Franch.) Hara[12,26]2022年,Hou等[27]利用Illumina NovaSeq 6000平台对七叶一枝花、云南重楼、球药隔重楼、狭叶重楼var.Franch.和毛重楼H. Léveillé的根茎和叶分别做了转录组测序,以云南重楼为参照,在叶中检测到了14 815个球药隔重楼特异性表达的基因,是其他3组中最多的,且在根茎中也检测到了6030个特异性表达基因,这说明球药隔重楼相比其他重楼品种,有着自身独特的遗传背景。
因此,本研究利用前期繁育的7年生球药隔重楼,基于RNA-Seq技术对其根茎、茎、叶进行转录组分析,进一步结合根茎、茎、叶中螺甾烷型重楼皂苷的含量数据,鉴定该类皂苷生物合成途径基因,为该类皂苷生物合成途径解析和优良重楼品种的分子育种提供科学支撑。
1 材料
1.1 植物和取样
通常重楼皂苷在重楼中的积累于7~8年时丰度最高[28],故本研究选择7年生无病害的球药隔重楼,于2022年8月采自四川省阿坝藏族羌族自治州汶川县水磨镇西南民族大学药材繁育试验基地,由西南民族大学刘圆教授和张绍山博士鉴定为球药隔重楼Franch.。将植株均分为3份,每份4株,取每份植株的根茎、茎、叶,按组织部位混匀后,一半40 ℃烘干,粉碎,过40目筛,干燥器保存,用于螺甾烷型重楼皂苷含量分析;一半装于洁净的离心管中,迅速用液氮固定,−80 ℃保存,用于转录组分析。
1.2 试药
对照品重楼皂苷I(批号RP200523)、重楼皂苷II(批号RP190315)、重楼皂苷H(批号RP190528)、重楼皂苷V(批号RP191217)、重楼皂苷VI(批号RP220807)购自成都麦德生科技有限公司,重楼皂苷VII(批号MUST-18062201)购自成都曼斯特生物有限公司。色谱级甲醇和乙腈均购于赛默非世尔科技有限公司;水为屈臣氏蒸馏水;其余试剂为分析纯。
2 方法
2.1 螺甾烷型重楼皂苷含量测定
2.1.1 色谱条件 Agilent 1260 Infinity II色谱仪;Diamonsil-C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A)-水(B),梯度洗脱:0~20 min,30%~40% A;20~45 min,40%~60% A;体积流量1 mL/min;柱温30 ℃;进样体积10 μL;检测波长203 nm。
2.1.2 对照品溶液的制备 分别精密称取重楼皂苷I、II、V、VI、VII和H对照品适量,加色谱甲醇制成含重楼皂苷I 0.478 mg/mL、重楼苷II 0.285 mg/mL、重楼皂苷V 0.500 mg/mL、重楼皂苷VI 0.514 mg/mL、重楼皂苷VII 0.240 mg/mL和重楼皂苷H 0.375 mg/mL的混合对照品溶液,摇匀后经0.45 μm滤膜滤过。
2.1.3 供试品溶液的制备 取不同部位球药隔重楼样品粉末约0.5 g,精密称定,按料液比1∶25精密加入甲醇,密封,称定质量,超声60 min(功率500 W,频率40 kHz),放冷至室温,再称定质量,加甲醇补足减失的质量,摇匀后经0.45 μm滤膜滤过。
2.1.4 线性方程的绘制 取对照品适量,配制成重楼皂苷I 、重楼皂苷II、重楼楼甙V、重楼皂苷VI、重楼皂苷VII、重楼皂苷H的对照品储备液,使其质量浓度分别为0.478、0.285、0.500、0.514、0.240、0.375 mg/mL,取混合对照品溶液 0.1、0.5、1.0、1.5、2.0、2.5mL于5 mL量瓶中加甲醇定容至刻度,按上述梯度洗脱条件,分别精密吸取供试品溶液各10 μL,注入液相色谱仪,测定,即得。以6种甾体皂苷的进样浓度为横坐标(),相应峰面积为纵坐标(),绘制标准曲线,计算回归方程,对应的对照品重楼皂苷I、重楼皂苷II、重楼皂苷H、重楼皂苷V、重楼皂苷VI、重楼皂苷VII的线性方程分别为=3 333.6+72.454、=3 003.1+3.740 4、=3 051.7+5.760 4、=3 500.8+169.78、=3 575.3+26.1、=10 330+31.919;对应的线性范围分别为0.015~0.478、0.009 5~0.285 0、0.012~0.375、0.016~0.500、0.017~0.514、0.008~0.240 mg/mL;2分别为0.999 9、0.999 9、1.000 0、0.994 3、0.999 9、0.999 9。结果表明各成分在相应范围内呈良好的线性关系。
2.1.5 精密度试验 精密称取“2.1.2”项下混合对照品一份,按“2.1.1”项下色谱条件连续进样6针,测得各指标成分色谱峰的峰面积,结果表明样品中6种指标成分峰面积RSD值在0.98%~1.70%。
2.1.6 重复性试验 精密称取球药隔重楼样品粉末,按“2.1.3”项下方法制备6份供试品溶液,按“2.1.1”项下色谱条件进样10 μL,测得各指标成分色谱峰的峰面积,结果表明样品中6种指标成分质量分数的RSD值在1.01%~1.92%。
2.1.7 稳定性试验 精密吸取同一份球药隔重楼样品粉末供试品溶液,按“2.1.1”项下色谱条件分别于制样后0、2、6、8、12、24 h进样,测得各指标成分色谱峰的峰面积,结果表明样品中6种指标成分峰面积的RSD值在1.05%~1.74 %,表明供试品溶液在制备后24 h内稳定。
2.1.8 加样回收率试验 精密称取球药隔重楼样品粉末 0.25 g,精密加入等量的对照品,按“2.1.3”项下供试品溶液制备方法平行制备6份样品溶液,测定6个指标性成分的含量,计算加样回收率,加样回收率均在95.72%~110.20%,RSD为0.99%~1.82%,符合定量分析要求。
2.1.9 样品含量测定 将“2.1.3”项下制得的9批(每个组织部位3个生物学重复)供试品溶液,按“2.1.1”项下色谱条件测定。
2.2 转录组测序和分析
2.2.1 文库构建和测序 利用mirVana miRNA Isolation Kit(Cat. AM1561,InVItrogen,Thermo Fisher Scientific Inc.,美国)分别提取根茎、茎和叶的总RNA。RNA用琼脂糖凝胶电泳检测降解和污染情况,NanoDrop 2000 spectrophotometer(Thermo Fisher Scientific,Waltham,MA,美国)检测RNA的纯度和浓度,Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,美国)评估RNA的完整性。符合高通量测序质量要求后,委托上海欧易生物医学科技有限公司采用Illumina HiSeq X Ten platform(Illumina,美国)进行测序,文库的构建采用TruSeq Stranded mRNA LTSample Prep Kit(Illumina,美国)试剂盒。
2.2.2数据质量控制与组装 首先使用Trimmomatic软件进行质控并去除接头,在此基础上过滤掉低质量碱基以及N碱基,最终得到高质量的clean reads。使用Trinity(version:2.4)软件paired-end的拼接方法,将clean reads拼接得到transcript序列,根据序列相似性及长度,挑选出最长的1条作为unigene。最终,利用CD-HIT(identify=98%)软件聚类去冗余得到非冗余的unigenes。
2.2.3 Unigenes功能注释和定量分析 利用diamond软件将unigenes的蛋白序列比对到NR、KOG、GO、Swiss-Prot、eggNOG、KEGG数据库,以及利用HMMER软件比对到Pfam数据库,对unigenes进行功能注释分析。使用软件bowtie2获取每个样本中比对到unigenes上的reads数,同时使用 eXpress软件来计算unigenes在各样本中的基因表达量(fragments per kilobase of exon model per million mapped fragments,FPKM)值。
2.2.4 差异基因分析 利用DESeq2 R package软件包筛选各样本间的差异基因(differentially expressed genes,),筛选差异的条件为<0.05且差异倍数(foldchange)>2,对差异表达基因做KEGG通路显著性分析。
2.3 螺甾烷型重楼皂苷生物合成相关基因的筛选和分析
以unigene序列集为数据库,利用已发表三萜甾体皂苷生物合成途径基因序列,进行blast检索,鉴定球药隔重楼中的同源基因,采用pearson相关性算法,计算上述同源基因与螺甾烷型重楼皂苷积累水平的关系。对尚未解析皂苷母核糖基修饰的,首先依据UGT的隐马尔可夫模型(HMM)文件(PF00201)进行基因家族鉴定和功能分析,结合上游已鉴定基因的表达模式和重楼皂苷定量分析结果,筛选参与皂苷母核糖基修饰的候选。运用TBtools绘制基因不同组织相对表达量热图;运用MEGA7软件,选取neighbor-joining方法,bootstrap为1000个重复,构建UGTs的系统发育进化树。
2.4 qRT-PCR
利用RNA提取试剂盒“FastPure® Universal Plant Total RNA Isolation kit(Vazyme,China)”从9份RNA-seq材料中提取RNA,质量经检测符合要求后,利用HiScript®II Q RT SuperMix for qPCR (+gDNA wiper) KitRNA反转录试剂盒获取cDNA,Primer6.0软件设计引物,RT-PCR检查引物特异性。qRT-PCR实验采用2×Taq Pro Universal SYBR qPCR Master Mix kit(Vazyme)试剂盒,具体操作按说明书进行。qRT-PCR 体系为10.0 μL:2×Taq Pro Universal SYBR qPCR Master Mix 5.0 μL,上游引物 0.20 μL,下游引物 0.20 μL,cDNA 1.0 μL,ddH2O 3.6 μL,配制过程在冰上完成。PCR 扩增程序为95 ℃、30 s;95 ℃、5 s,53 ℃、30 s,共40个循环;95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。以为内参基因,每个样品设置3个生物学重复和3个技术重复。
3 结果
3.1 不同组织部位6个螺甾烷型重楼皂苷含量测定
经对建立的高效液相色谱(High-performance liquid chromatography,HPLC)方法学考察,结果表明各方法学均符合要求,方法可用于相关重楼皂苷的定量分析。含量测定结果表明,球药隔重楼中含有薯蓣皂苷(重楼皂苷I、II和V)和偏诺皂苷(重楼皂苷H、VI和VII);重楼皂苷I在茎中没有检测到;重楼皂苷II和V仅在根茎中检测到;重楼皂苷H、VI和VII在3个组织部位均检测到,重楼皂苷H在根茎中的质量分数超过了30.0 mg/g,除重楼皂苷H在茎和叶中差异不显著外,其余皂苷在各组织部位间的含量差异显著(<0.05);此外,除重楼皂苷VII在叶中含量最高外,其余皂苷均在根茎中积累水平最丰富(图1)。以上结果表明球药隔重楼的根茎、茎和叶是揭示螺甾烷型重楼皂苷生物合成通路的理想材料。
3.2 转录组测序和de novo组装
球药隔重楼根茎、茎和叶的9个cDNA文库经Illumina HiSeq X Ten平台测序,获得了66.78 Gb raw reads(数据NCBI查询号:PRJNA915171),质控后得到64.15 Gb clean reads,所有文库raw_bases中Q phred数值大于30(Q30)的碱基数占总碱基的百分比均超过93%,表明所有样本文库均获得了高质量的raw reads。由于缺乏参考基因组,数据经拼接和去冗余后,最终获得61 755条非冗余unigenes,平均长度为971.5 bp,50值为1399 bp,其中38 070条(61.65%)的长度大于500 bp,19 867条(32.19%)的长度大于1000 bp。BUSCO评估转录本完整性,结果表明本课题组获得的unigenes集覆盖了BUSCO库中的87.9%,其中完全匹配且匹配上一个(complete and single-copy BUSCOs,S)的比例为77.2%。Raw reads质量和BUSCO评估结果表明,本研究获得的转录组数据是可靠和有效的。
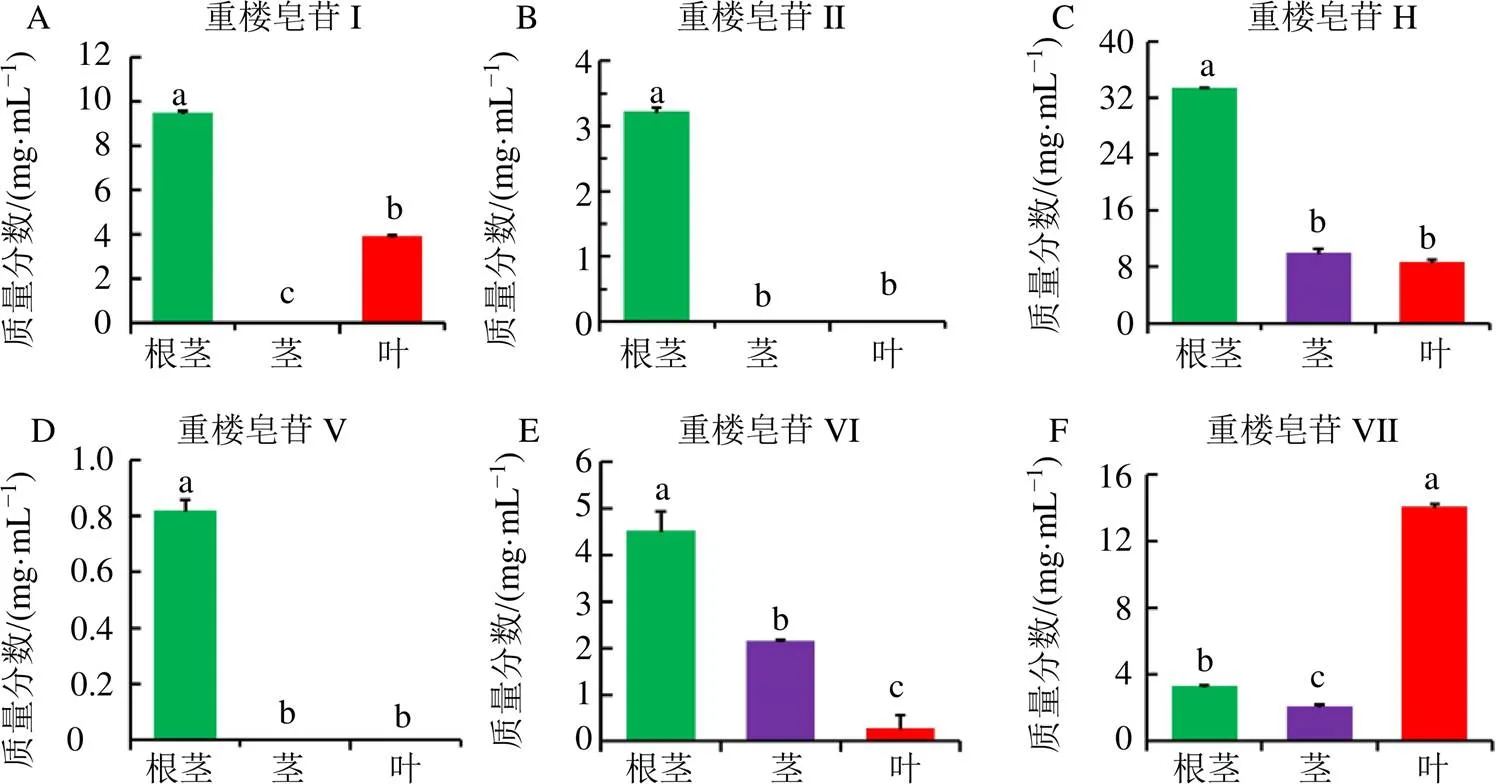
不同字母表示差异显著,P<0.05
3.3 转录本注释和功能归类
61 755条非冗余unigenes中29 837条(48.32%)、21 328条(34.54%)、6467条(10.47%)、17 726条(28.70%)、26 812条(43.42%)、18 557条(30.05%)、16 641条(26.95%)分别注释到NR、Swissprot、KEGG、KOG、eggNOG、GO和Pfam库。经去冗余分析,共30 263条(49.0%)unigenes至少在1个数据库中被成功注释到,3234条(5.23%)unigenes在7个数据库中均注释到。目前,重楼属植物所在目百合目(Liliales)中没有一个物种进行过基因组测序,因此本研究中超过50%的unigenes不能被成功注释是可以理解的,这些未注释的基因可能涉及未知的功能。
18557条注释到了GO数据库的unigenes中,注释到“metabolic process”和“catalytic actiVIty”的条数占比相对高于其他GO子类别(图2-A),这表明球药隔重楼中相当一部分基因参与物质代谢。6467条注释到了KEGG数据库的unigenes中,4066条(62.87%)注释为“Metabolism”,其中归类为“Metabolism of terpenoids and polyketides”的条数为213,进一步分析发现,70条注释为参与萜类化合物骨架的生成,39条注释为参与三萜的生物合成,这些基因可能与螺甾烷型重楼皂苷的生物合成相关(图2-B)。
3.4 差异基因分析
根茎茎组有14 056个,其中5344个上调,8712个下调;根茎叶组有18 724个,其中8259个上调,10 465个下调;叶茎组有10806个,其中5026个上调,5780个下调(图3-A)。分别对上调和下调的进行KEGG富集分析,结果表明,“photosynthesis”“porphyrin and chlorophyll metabolism”“photosynthesis-antenna proteins”等植物光合作用、生长发育相关途径的基因,主要在叶和茎中富集;“flavonoid biosynthesis”“flavone and flavonol biosynthesis”“carotenoid- biosynthesis pathway”等次生代谢途径基因,也主要在叶和茎中富集(图3-B、C)。而与萜类化合物上游代谢密切相关的“terpenoid backbone biosynthesis”的,主要在根茎中富集,与三萜重楼甾体皂苷下游代谢密切相关“steroid biosynthesis”的,也主要在根茎中富集(图3-B、C),这与重楼皂苷主要在根茎中积累一致(图1)。这些结果表明,球药隔重楼中螺甾烷型重楼皂苷生物合成密切相关的基因可能属于这些。
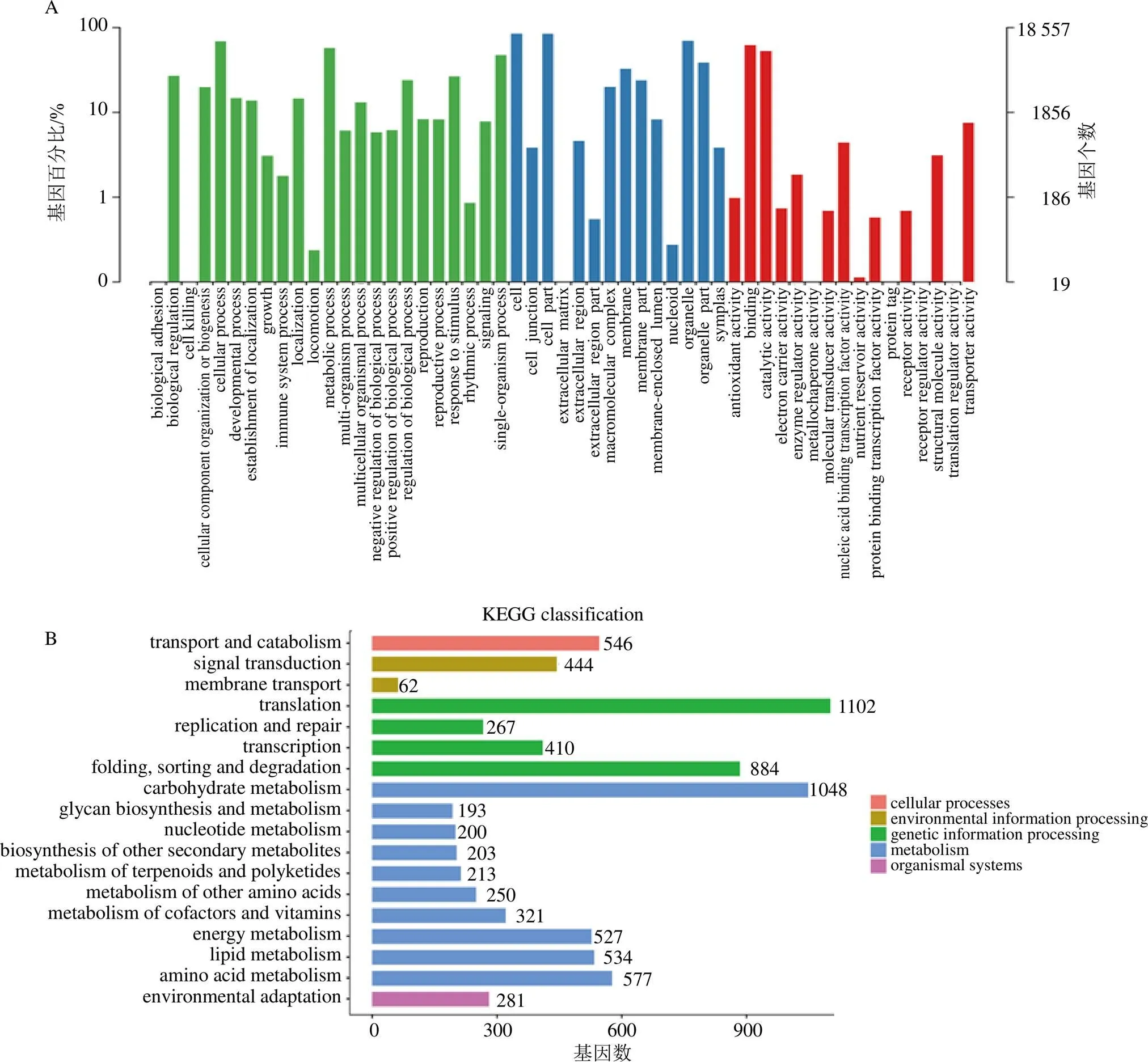
图2 Unigenes的GO (A) 和KEGG (B) 注释
3.5 螺甾烷型重楼皂苷生物合成途径已鉴定基因分析
基于KEGG注释和蛋白编码区(ORF)完整性结果,筛选到26条unigenes参与植物三萜类化合物共同前体角鲨烯的生成。其中8条基因编码MVA途径6个关键酶[8-9],包括2条乙酰辅酶A转乙酰酶(acetyl-CoA acetyltransferase,AACT)、2条甲羟戊二酰辅酶A合成酶(hydroxy-methylglutaryl-CoA synthase,HMGCS)、1条羟甲基戊二酰辅酶a还原酶(hydroxymethylglutaryl-CoA reductase,HMGCR)、1条甲羟戊酸激酶(mevalonate kinase,MVK)、1条磷酸甲羟戊酸激酶(phosphomevalonate kinase,mvaK2)和1条mevalonate diphosphate decarboxylase(MVD),这6个关键酶最终催化形成异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP);10条基因编码MEP途径7个关键酶[8-9],包括3条1-脱氧--酮糖5-磷酸合成酶(1-deoxy--xylulose 5-phosphate synthase,DXS)、1条1-脱氧--酮糖5-磷酸还原异构酶(1-deoxy--xylulose 5-phosphate reductoisomerase, DXR)、1条2--甲基--赤藓糖醇4-磷酸胞苷基转移酶(2--methyl--erythritol 4-phosphate cytidylyl- transferase,ispD)、2条4-二磷酸胞苷-2-甲基--赤藓糖醇激酶(4-diphosphocytidyl-2--methyl--erythritol kinase,ispE)、1条2--甲基--赤藓糖醇2,4-环二磷酸合酶(2--methyl--erythritol 2,4-cyclodiphosphate synthase,ispF)、1条()-4-羟基-3-甲基丁-2-烯基二磷酸合成酶[()-4-hydroxy-3-methylbut-2- enyl-diphosphate synthase,ispG]、1条()-4-羟基-3-甲基丁-2-烯基二磷酸还原酶[()-4-hydroxy-3- methylbut-2-enyl diphosphate reductase,ispH],这7个关键酶最终催化形成IPP和二甲基丙烯基二磷酸(dimethylpropyl diphosphate,DMAPP);此外,还包括了1条IDI,该基因可使上述MEP和MVA途径生成的IPP与DMAPP间相互转化,以及5条法呢基焦磷酸合酶(farnesyl diphosphate synthase,FPPS),FPPS可利用IPP与DMAPP为底物,生成倍半萜的共同前体FPP,最终2分子的FPP在SQS的催化下,形成植物三萜类化合物共同前体角鲨烯,本研究注释到了1条基因(图4)。基因表达量结果表明,MVA途径基因和基因在根茎中的表达量显著高于茎和叶,而MEP途径基因在叶中高度表达,而螺甾烷型重楼皂苷主要在根茎中富集,这表明球药隔重楼中螺甾烷型重楼皂苷生物合成所需的IPP和DMAPP可能主要来自MVA途径,这与三萜类化合物生物合成主要由MVA途径参与的结果一致[29]。
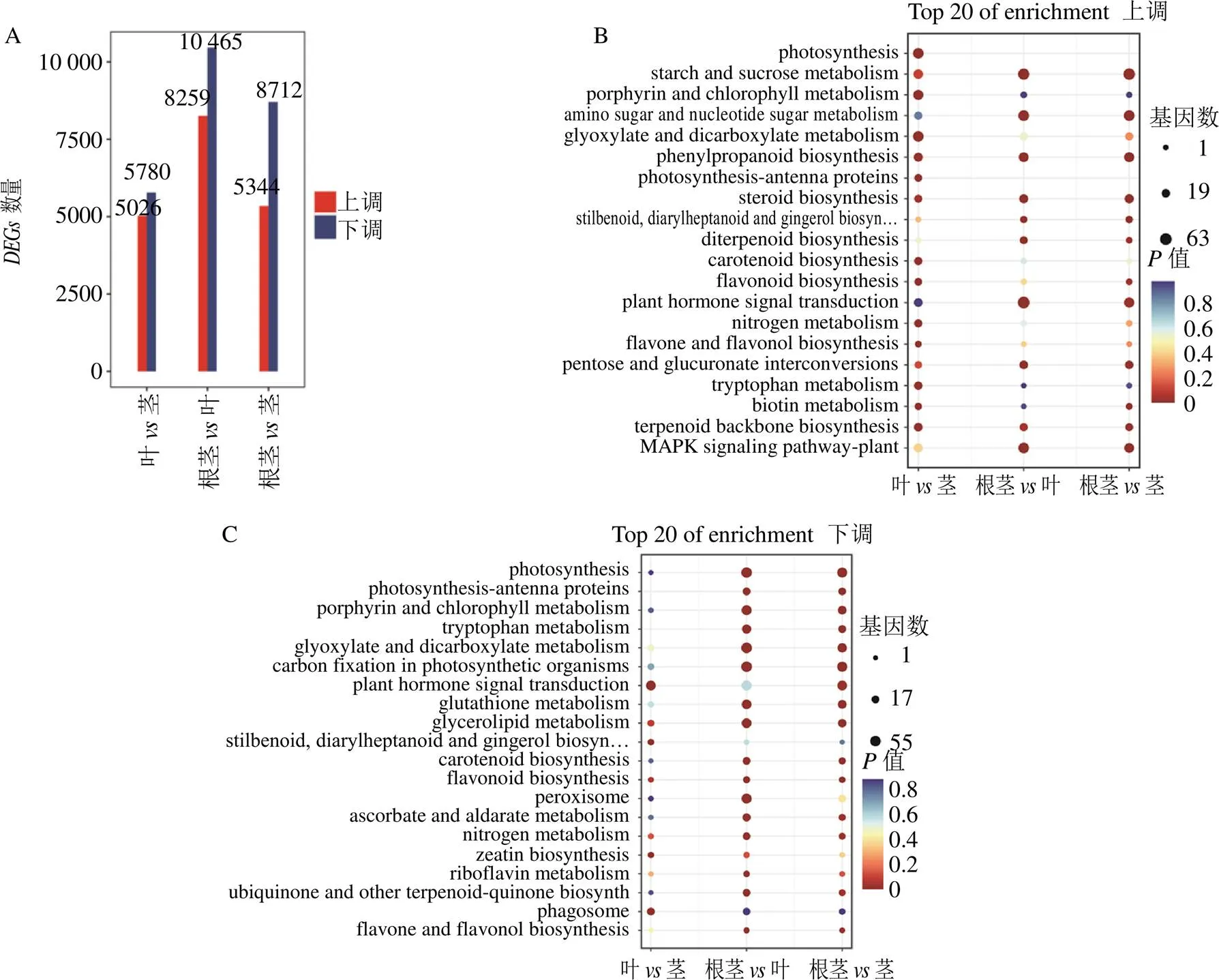
A-DEGs统计柱状图 B-表达上调DEGs的KEGG注释 C-表达下调DEGs的KEGG注释
基于已发表催化形成螺甾烷型甾体母核的文献报道(表1),利用同源基因blast的检索方法,去除不完整ORF及同源性≤80%的unigenes,最终筛选到17条unigenes参与后续螺甾烷型重楼皂苷母核“薯蓣皂苷元”的生成,其中2条SQE、1条CAS、1条SMO1-3、1条CPI-5、1条CYP51G、1条C14-R-2、1条8,7SI-4、1条C5-SD1、2条7-DR1、1条SSR1-3、2条CYP90G4、1条CYP94D108、1条CYP94D109和1条CYP72A616,在这些基因的共同催化下,最终生成了薯蓣皂苷元(图4)。而参与皂苷元侧链寡糖基的催化基因,报道了葡糖基化皂苷元C3-OH的UGT73CR1、UGT80A40和UGT80A41,2′--鼠李糖基化的UGT73CE1,以及6′--葡萄糖基化的UGT91AH1和UGT91AH2,本研究分别同源blast到了1条相关基因的同源序列。基因表达量结果表明,下游基因主要在根茎中高表达,这与螺甾烷型重楼皂苷主要在根茎中富集的结果一致;而末端的、、、、、和基因,在根茎中的表达量相对较低,可能是这些基因除参与螺甾烷型重楼皂苷合成外,还有其他更重要的生物学功能。此外,本研究在球药隔重楼中检索到的同源基因的编码区氨基酸序列,与在云南重楼中验证的同源基因高度同源,表明螺甾烷型重楼皂苷生物合成途径基因在重楼属植物中高度保守。

实线箭头为已验证的步骤,虚线为未验证步骤
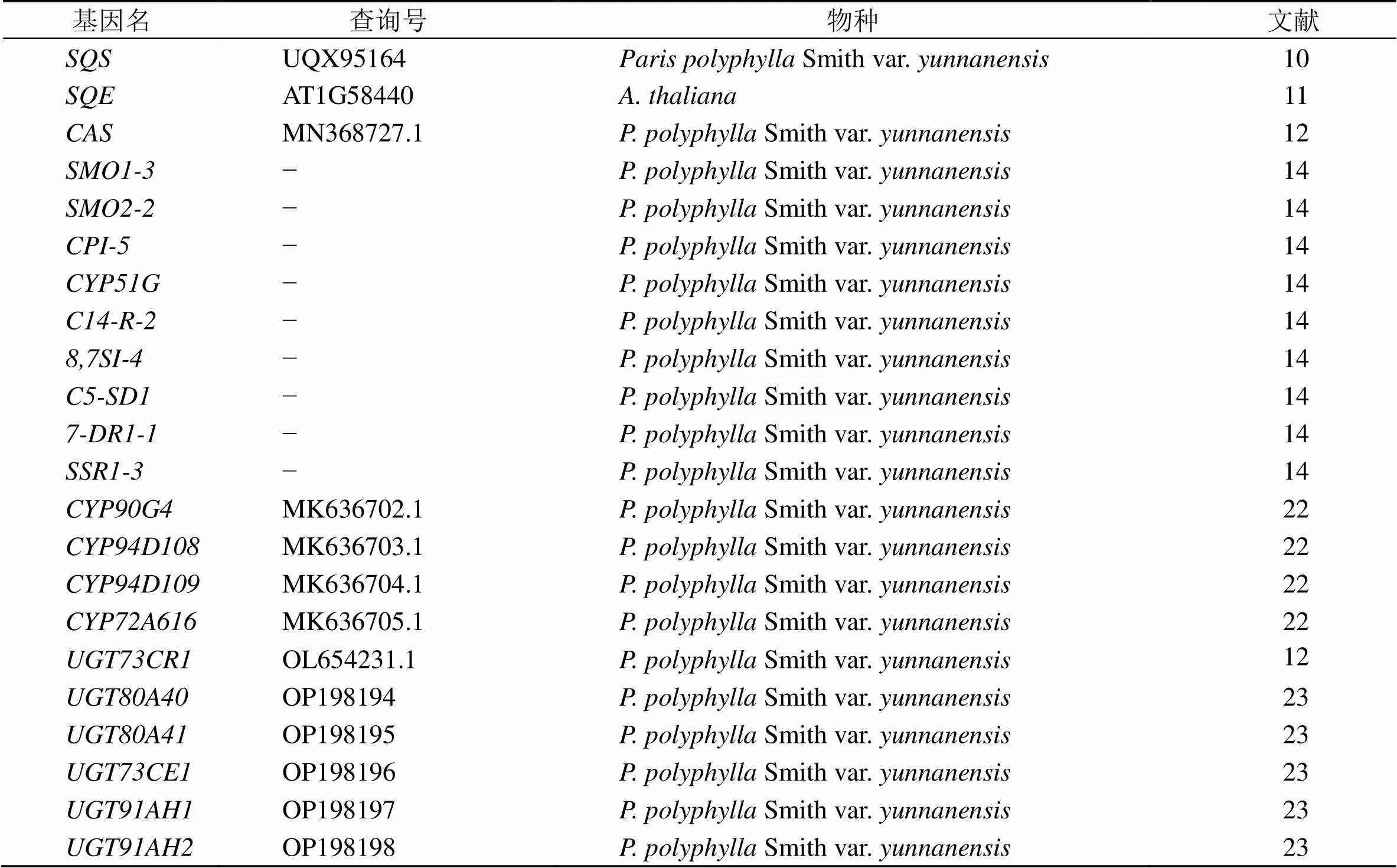
表1 同源基因检索所用基因清单及相关信息
3.6 螺甾烷型重楼皂苷与其生物合成途径基因相关性分析
使用pearson相关性计算方法,对螺甾烷型重楼皂苷的积累水平与其生物合成途径基因表达水平进行了关联性分析,结果见图5。由图可知,、、、、、、、、、、、、、、和等17个已知途径中的基因表达水平与螺甾烷型重楼皂苷的积累存在显著的正相关性,而基因的表达水平似乎负调控螺甾烷型重楼皂苷的积累。
3.7 螺甾烷型重楼皂苷生物合成途径中UGT的筛选与分析
螺甾烷型重楼皂苷的结构差异主要来自侧链的寡糖基,寡糖基的形成可能需要多个基因的参与,但仅被研究报道[12]。因此,我们结合上述皂苷的定量数据、转录组数据和已鉴定合成途径基因分析结果,筛选潜在参与螺甾烷型重楼皂苷糖基化的基因。首先,基于球药隔重楼unigenes的CDS数据库和UGT的HMM文件(PF00201),共检索得到75条UGTs,其中61条有完整的ORF。在糖基转移酶(GT)命名系统指导下[30],结合拟南芥和玉米中UGTs的分类[31-32],对61条PfUGTs进行了系统命名和分类,最终将PfUGTs分类到16个UGT家族,即UGT72、UGT73、UGT74、UGT75、UGT78、UGT80、UGT83、UGT84、UGT85、UGT87、UGT88、UGT89、UGT90、UGT91、UGT92和UGT93。其次,对61条在球药隔重楼根茎、茎和叶中的表达模式进行分析,结果表明,的表达模式可分为根茎中相对高表达(I类)、茎中相对高表达(II类)、茎叶中均相对高表达(III类)和叶中相对高表达(IV类)4类,分别有15条、12条、8条和26条基因(图5)。螺甾烷型重楼皂苷定量分析和皂苷母核合成途径基因表达分析结果表明,螺甾烷型重楼皂苷主要在根茎中积累(图1),同时皂苷母核合成途径关键基因在根茎中相对高表达(图4)。因此,推测参与皂苷母核糖基修饰的可能也在根茎中相对高表达,故I类中的15条可能参与了皂苷母核后期的糖基化修饰。此外,重楼皂苷I、H和VII在叶片中也有较高的积累水平,特别是重楼皂苷VII在叶中积累最高,且在重楼属植物中功能验证的、1、和基因在叶片中高表达,故认为在叶片中相对高表达且与、1、和存在相同表达模式的34条Ⅲ和Ⅳ类,也是潜在的候选基因。植物源UGT的研究表明,参与三萜类化合物糖基化的UGTs主要属于A组的UGT91和UGT94、D组的UGT73、E组的UGT71、L组的UGT74和UGT75、P组的UGT720家族[32]。上述筛选到的49条PfUGTs(I、Ⅲ和Ⅳ类)中,有2条属于UGT91家族,有24条属于UGT73家族,有3条属于UGT74家族,有1条属于UGT75家族(图6)。

图5 螺甾烷型重楼皂苷与合成途径基因表达相关性分析
进一步将61条PfUGTs与其他物种中已鉴定功能的UGTs构建混合系统发育树,发现来自苦荞麦L.和矮牵牛花L.能识别UDP-鼠李糖作为糖基供体的FeUGT79A8[33]和PhUGT79A1[34],来自黄芩L.能利用UDP-葡萄糖醛酸作为糖供体的UBGAT[35],以及来自拟南芥可利用UDP-木糖作为糖供体的AtUGT78D1[36],与PfUGTs成功构建了混合发育树(图7)。这表明与FeUGT79A8和PhUGT79A1高度聚合的A组PfUGT91家族基因,可能是球药隔重楼中其他识别UDP-鼠李糖作为糖基供体的UGTs;与UBGAT高度聚合的E组PfUGT72和PfUGT88家族基因可能是识别UDP-葡萄糖醛酸的UGTs;与AtUGT78D1高度聚合的F组PfUGT78D1基因可能是识别UDP-木糖的UGTs。有趣的是,螺甾烷型重楼皂苷的糖基化十分复杂,包括葡萄糖基化、鼠李糖基化、木糖化等,故这些家族的基因也是值得关注的。
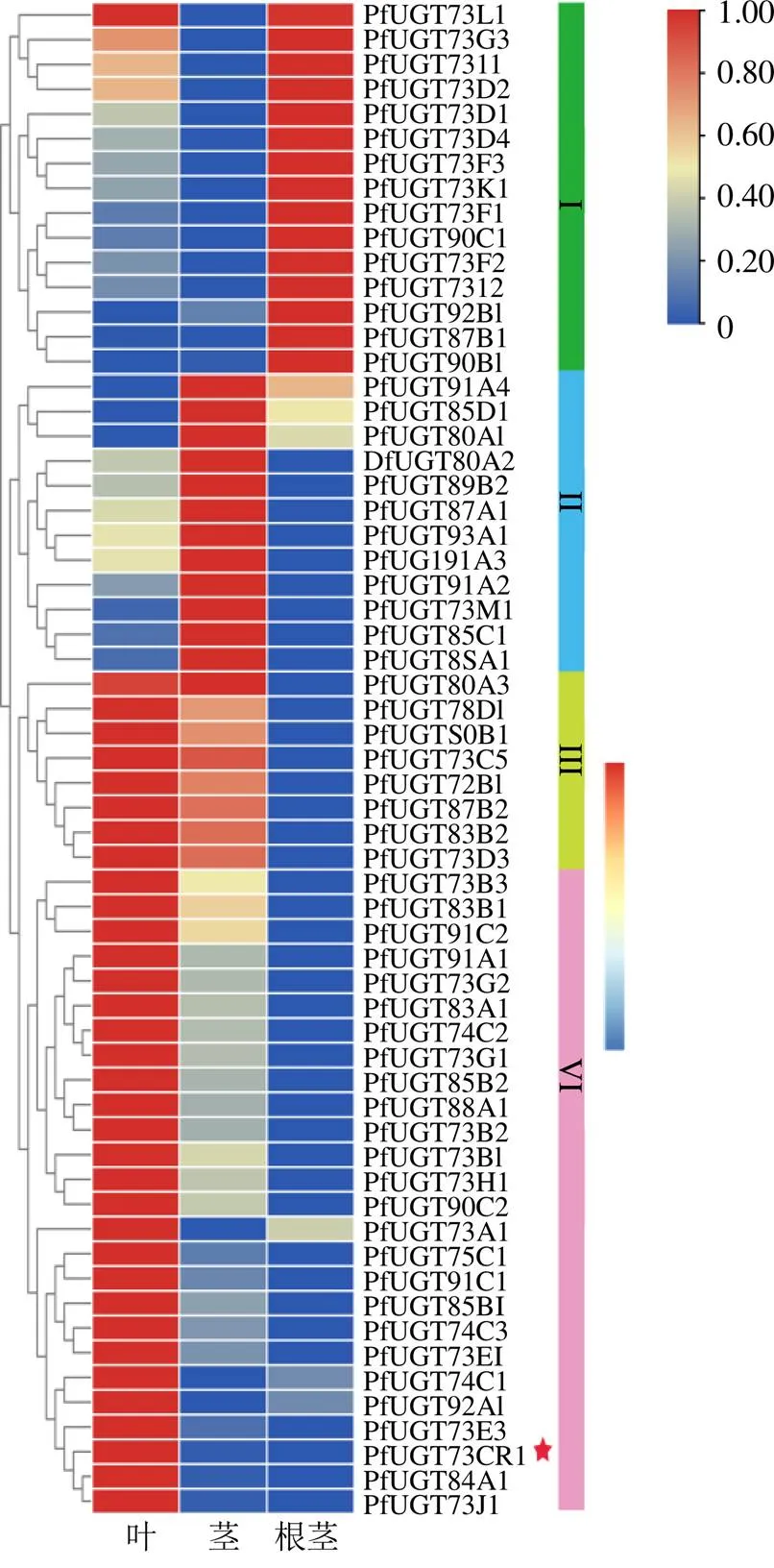
各组织表达量值为3个重复的平均值;红星号的为重楼属植物中功能验证的基因
Expression values for each tissue are the average of three replicates; Red asterisks are functionally verifiedgenes in the plant in
图6在根茎、茎和叶中的热图分析
Fig. 6 Heatmap ofin rhizome, stem and leaf tissues
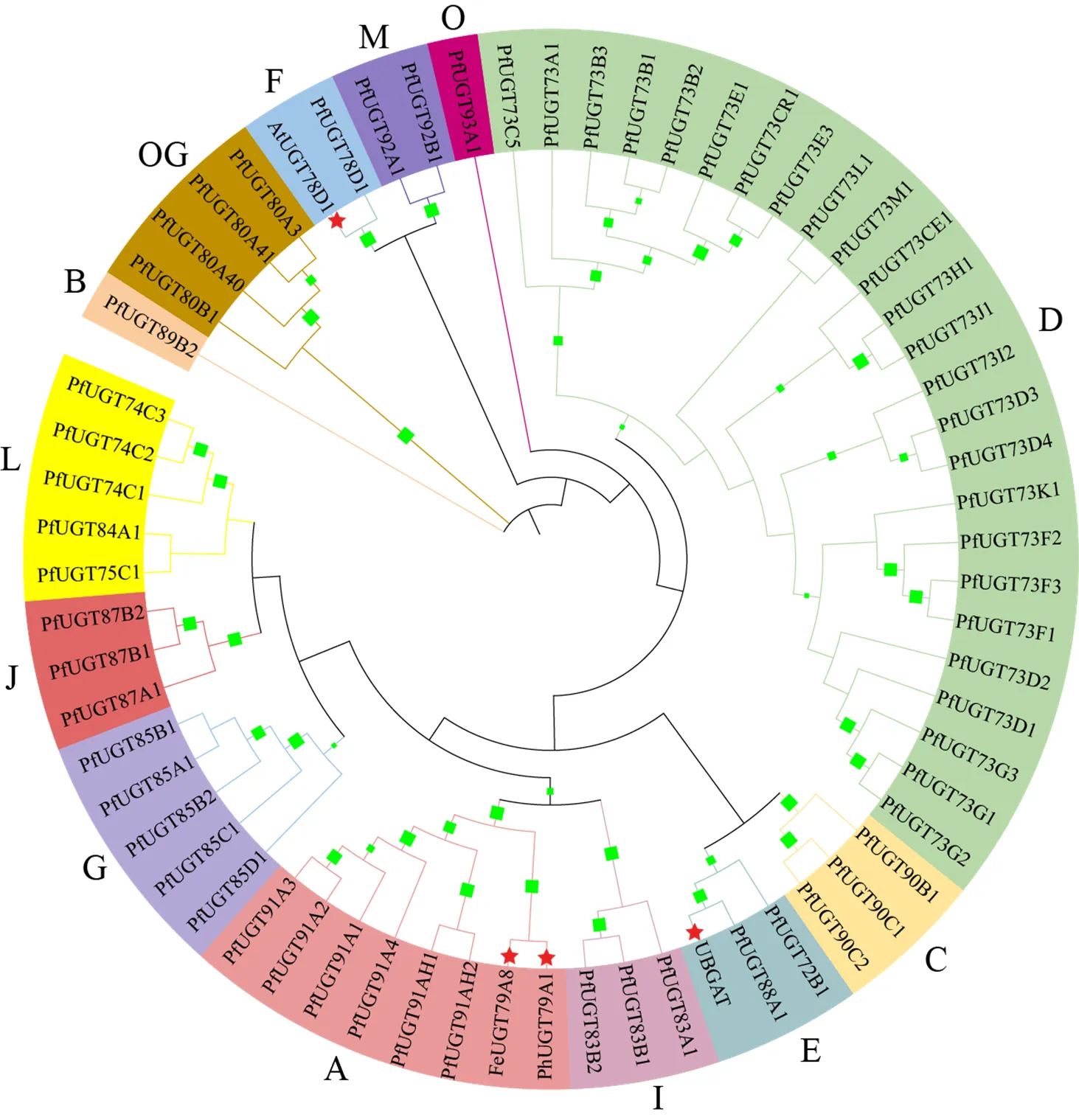
红色星号标识的是来自其他物种的UGT,绿色正方形表示bootstrap值超过50%
3.8 qRT-PCR验证基因表达的可靠性
为了确认RNA-seq结果的可靠性,选取了螺甾烷型重楼皂苷合成途径中的5个关键酶基因(、、、和),以及筛选的3个基因(、和)进行qRT-PCR定量分析。qRT-PCR的引物见表3。
实验结果表明,8个基因的qRT-PCR定量结果和转录组测序获得的FPKM值在球药隔重楼中根茎、茎和叶中的表达趋势相似(图8),这表明转录组测序结果是可靠的。

表3 qRT-PCR引物序列及产物大小
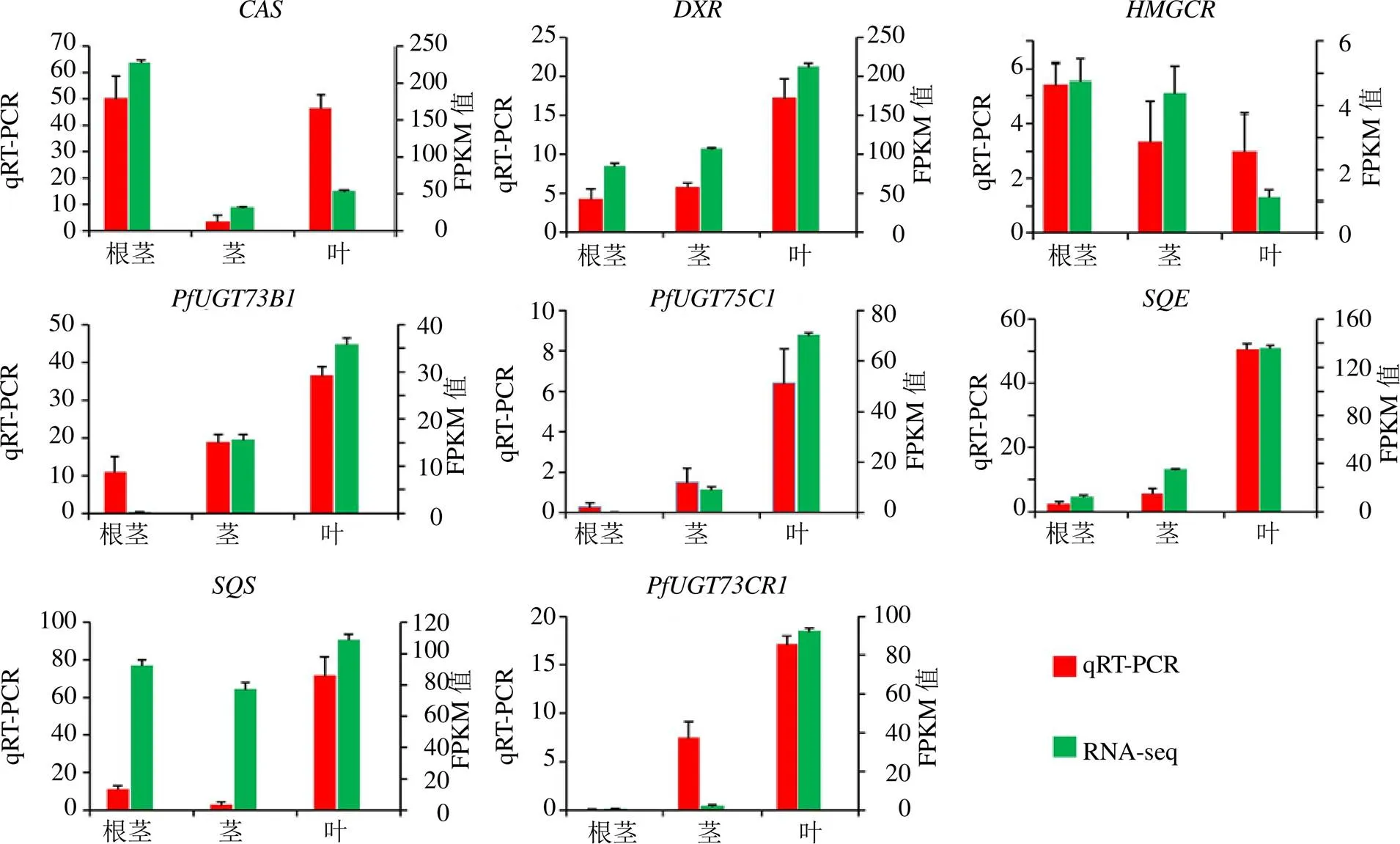
图8 qRT-PCR验证转录组测序数据
4 讨论
通常,植物合成特定的次生代谢产物帮助其适应逆境,如食草动物损伤和微生物感染可以刺激植物防御类化合物的积累[37]。三萜皂苷类次生产物具抗菌、杀虫、抗草食、植物毒性等广泛的生物活性[1,3,38]。相比其他重楼属植物,球药隔重楼更喜生长于易被微生物和蚊虫感染的阴湿环境,富含螺甾烷型三萜皂苷类成分可能是其遗传特性和环境互做的结果。参与螺甾烷型三萜皂苷生物合成的基因表达和该类成分的HPLC定量结果,反映了球药隔重楼茎、叶和根茎在该类皂苷生物合成和积累中的不同作用。本研究中,螺甾烷型三萜皂苷总体上在根茎中积累水平比较高,这与云南重楼等其他同属植物测定结果一致[6-7,26],但偏诺皂苷在球药隔重楼中积累更加丰富,如其他重楼中很难检测到的重楼皂苷VI[7,39]。此外,茎和叶中也积累了一定数量的三萜皂苷,特别是重楼皂苷VII。因此,球药隔重楼是偏诺皂苷类成分来源的理想植物材料,同时,地上部分具有资源替代利用的潜力。
2010年,Pellicer等[40]用流式细胞仪分析日本重楼,发现其基因组大小高达约150 Gb,是最大的真核生物基因组之一,可见重楼属植物在植物进化过程中占有举足轻重的作用,巨大的基因组也制约了该属植物基因组的获取,因此,关于该属植物基因层面的研究主要集中于转录组和叶绿体基因组等。Gao等[26]利用RNA-seq技术对云南重楼营养期和果期的叶和根茎分别进行转录组测序,拼接获得了85 677条unigenes,N50为668 bp,仅34 020条(39.71%)unigenes被成功注释。Yang等[41]同样利用RNA-seq对华重楼花期的根、根茎、茎、叶和花进行转录组测序,获得了57 537条unigenes,N50为664 bp,平均长度为992 bp,有33 449条(58.13%)被成功注释。本研究获得了球药隔重楼的61755条非冗余unigenes,平均长度为971.5 bp,N50为1399 bp,30 263条(49.0%)unigenes被成功注释,三萜皂苷生物合成途径基因分析中,除基因未检测到外,其余通路基因均同源blast到,以上结果表明本研究的RNA-seq转录组数据,用于研究重楼三萜皂苷合成途径基因是科学可靠的,亦可为今后该品种的分子研究提供一定的数据支撑。
三萜重楼甾体皂苷下游合成密切相关的“steroid biosynthesis”的主要在根茎中富集,合成途径下游关键基因也主要在根茎中表达;“terpenoid backbone biosynthesis”途径和“steroid biosynthesis”途径不仅是三萜重楼甾体皂苷生物合成的中间步骤,也是类胡萝卜素生物合成不可缺少的步骤[42],而类胡萝卜素生物合成相关基因主要在叶和茎中高表达。此外,油菜素甾醇代谢途径(brassinosteroid biosynthesis)也需要消耗三萜甾体途径的中间产物[43],而“Brassinosteroid biosynthesis”途径基因主要在叶和茎中高表达。这些因素可能限制了叶片和茎生物合成重楼甾体皂苷的能力。三萜甾体皂苷生物合成途径中的关键酶基因研究表明,MVA途径中的HMGCR和甾体类化合物下游代谢总开关的CAS为代谢途径上的限速酶[44];此外,最近在本氏烟草中异源合成胆甾烯醇的研究表明,SSR1-3、SMO1-3、CPI-5、CYP51G、SMO2-2和C5-SD1对胆甾烯醇的合成有显著影响[14];而本研究中除上述8个关键酶外,发现IDI、8,7SI-4、CYP90G4、C14-R-2、CYP94D108、HMGCS、SQS、ispH和DXR也可能显著影响着重楼三萜甾体皂苷的积累,这些关键酶可作为实现人工精准调控重楼皂苷积累的潜在靶标基因。Hua等[12]利用PacBio三代测序平台对云南重楼进行了全长转录组测序,从39 875条unigenes中鉴定到了199条UGTs,系统发育分析将其分到11个不同的组(A~E、I、J、L、O、P和OG),其中D组的UGT73家族成员最多。本研究中,仅鉴定到61条UGTs,这可能是重楼属基因在不同生长期的转录水平有巨大差异导致(本研究仅检测了果期,而全长转录组检测多个时期),也可能是因球药隔重楼和云南重楼的遗传背景差异所致。此外,本研究中61条UGTs划分到了13个不同的组(A~G、I、J、L、M、O和OG),较云南重楼多了F、G和M组,缺失了P组,这表明球药隔重楼基因较云南重楼发生了明显的分化,可能是该植物三萜皂苷较同属其他植物差异的原因之一,球药隔重楼中D组UGT73家族的成员也是最多的,这与前人研究结果一致[12, 32]。已有研究表明,OG组的UGT成员主要负责修饰甾醇和脂类化合物[45-46],螺甾烷型重楼皂苷属于三萜甾醇类皂苷,因此该组的UGT基因(即UGT80家族)也是值得重点关注的。
利益冲突 所有作者均声明不存在利益冲突
[1] Gupta D D, Mishra S, Verma S S,. Evaluation of antioxidant, anti-inflammatory and anticancer actiVIties of diosgenin enrichedrhizome extract of Indian Himalayan landraces [J]., 2021, 270: 113842.
[2] 中国药典[S]. 一部. 2020: 108.
[3] Puwein A, Thomas S C. An overVIew of, a highly vulnerable medicinal herb of eastern Himalayan region for sustainable exploitation [J]., 2020, 10(1): 3-14.
[4] Ding Y G, Zhao Y L, Zhang J,. The traditional uses, phytochemistry, and pharmacological properties ofL. (Liliaceae): A review [J]., 2021, 278: 114293.
[5] 管鑫, 李若诗, 段宝忠, 等. 重楼属植物化学成分、药理作用研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4838-4852.
[6] Man S L, Gao W Y, Zhang Y J,. Qualitative and quantitative determination of major saponins inandby HPLC-ELSD and HPLC-MS/MS [J]., 2010, 878(29): 2943-2948.
[7] 刘巨钊, 马苗苗, 田晓黎, 等. 基于文献计量学的重楼研究现状及热点分析[J]. 药物评价研究, 2022, 45(11): 2347-2356.
[8] Tholl D. Biosynthesis and biological functions of terpenoids in plants [J]., 2015, 148: 63-106.
[9] Wang J F, Li S Y, Xiong Z Q,. Pathway mining-based integration of critical enzyme parts forbiosynthesis of steviolglycosides sweetener in[J]., 2016, 26(2): 258-261.
[10] Gao J X, Chen Y G, Li D S,. Cloning and functional characterization of a squalene synthase fromvar.[J]., 2021, 18(7): e2100342.
[11] Laranjeira S, Amorim-Silva V, Esteban A,.squalene epoxidase 3 (SQE3) complements SQE1 and is important for embryo development and bulk squalene epoxidase activity [J]., 2015, 8(7): 1090-1102.
[12] Hua X, Song W, Wang K Z,. Effective prediction of biosynthetic pathway genes involved in bioactive polyphyllins in[J]., 2022, 5(1): 50.
[13] Darnet S, Bard M, Rahier A. Functional identification of sterol-4alpha-methyl oxidase cDNAs fromby complementation of a yeast erg25 mutant lacking sterol-4alpha-methyl oxidation [J]., 2001, 508(1): 39-43.
[14] Yin X, Liu J, Kou C X,. Deciphering the network of cholesterol biosynthesis inlaid a base for efficient diosgenin production in plant chassis [J]., 2023, 76: 232-246.
[15] Lovato M A, Hart E A, Segura M J,. Functional cloning of ancDNA encoding cycloeucalenol cycloisomerase [J]., 2000, 275(18): 13394-13397.
[16] Kushiro M, Nakano T, Sato K,. Obtusifoliol 14α-demethylase (CYP51) antisenseshows slow growth and long life [J]., 2001, 285(1): 98-104.
[17] Schrick K, Mayer U, Horrichs A,. FACKEL is a sterol C-14 reductase required for organized cell division and expansion inembryogenesis [J]., 2000, 14(12): 1471-1484.
[18] Grebenok R J, Ohnmeiss T E, Yamamoto A,. Isolation and characterization of anC-8, 7 sterol isomerase: Functional and structural similarities to mammalian C-8, 7 sterol isomerase/emopamil-binding protein [J]., 1998, 38(5): 807-815.
[19] Husselstein T, Schaller H, Gachotte D,. Delta7-sterol-C5-desaturase: Molecular characterization and functional expression of wild-type and mutant alleles [J]., 1999, 39(5): 891-906.
[20] Lecain E, Chenivesse X, Spagnoli R,. Cloning by metabolic interference in yeast and enzymatic characterization ofsterol delta 7-reductase [J]., 1996, 271(18): 10866-10873.
[21] Choe S, Dilkes B P, Gregory B D,. Thedwarf1 mutant is defective in the conversion of 24-methylenecholesterol to campesterol in brassinosteroid biosynthesis [J]., 1999, 119(3): 897-907.
[22] Christ B, Xu C C, Xu M L,. Repeated evolution of cytochrome P450-mediated spiroketal steroid biosynthesis in plants [J]., 2019, 10(1): 3206.
[23] ChenY, YanQ, JiY,. Unraveling the serial glycosylation in the biosynthesis of steroidal saponins in the medicinal plantand their antifungal action [J]., 2023, 5: 33.
[24] Zhao W S, Gao W Y, Huang L Q,. Study on the chemical constituents of the[J]., 2011,23 (6) : 1017-1020.
[25] 汪瑶, 薛丹, 文飞燕, 等. HPLC测定球药隔重楼中的5种重楼皂苷 [J]. 华西药学杂志, 2015, 30(4): 469-470.
[26] Gao X Y, Zhang X, Chen W,. Transcriptome analysis ofvar.illuminates the biosynthesis and accumulation of steroidal saponins in rhizomes and leaves [J]., 2020, 178: 112460.
[27] Hou L X, Zhang F R, Yuan X C,. Comparative transcriptome analysis reveals key genes for polyphyllin difference in fivespecies [J]., 2022, 174(6): e13810.
[28] 尹显梅, 张开元, 蒋桂华, 等. 华重楼皂苷类成分的动态分布规律对药材质量的影响 [J]. 中草药, 2017, 48(6): 1199-1204.
[29] Kempinski C, Chappell J. Engineering triterpene metabolism in the oilseed of[J]., 2019, 17(2): 386-396.
[30] MacKenzie P I, Owens I S, Burchell B,. The UDP glycosyltransferase gene superfamily: Recommended nomenclature update based on evolutionary divergence [J]., 1997, 7(4): 255-269.
[31] Li Y, Baldauf S, Lim E K,. Phylogenetic analysis of the UDP-glycosyltransferase multigene family of[J]., 2001, 276(6): 4338-4343.
[32] Wilson A E, Tian L. Phylogenomic analysis of UDP-dependent glycosyltransferases provides insights into the evolutionary landscape of glycosylation in plant metabolism [J]., 2019, 100(6): 1273-1288.
[33] Koja E, Ohata S, Maruyama Y,. Identification and characterization of a rhamnosyltransferase involved in rutin biosynthesis in(common buckwheat) [J]., 2018, 82(10): 1790-1802.
[34] Brugliera F, Holton T A, Stevenson T W,. Isolation and characterization of a cDNA clone corresponding to the Rt locus of[J]., 1994, 5(1): 81-92.
[35] Nagashima S, Hirotani M, Yoshikawa T. Purification and characterization of UDP-glucuronate: Baicalein 7-- glucuronosyltransferase fromGeorgi. cell suspension cultures [J]., 2000, 53(5): 533-538.
[36] Pandey R P, Malla S, Simkhada D,. Production of 3--xylosyl quercetin in[J]., 2013, 97(5): 1889-1901.
[37] Yang C Q, Fang X, Wu X M,. Transcriptional regulation of plant secondary metabolism [J]., 2012, 54(10): 703-712.
[38] WAller G R, Yamasaki K.[M]. Berlin: Springer Science & Business Media, 2013.
[39] 张绍山, 刘璇, 王景富, 等. UPLC法测定云南省不同地区云南重楼及多芽品系中7种甾体皂苷量及其指纹图谱建立 [J]. 中草药, 2016, 47(23): 4257-4263.
[40] Pellicer J, Fay M F, Leitch I J. The largest eukaryotic genome of them all? [J]., 2010, 164(1): 10-15.
[41] Yang Z Y, Yang L F, Liu C K,. Transcriptome analyses ofvar. chinensis,, andcharacterize their steroidal saponin biosynthesis pathway [J]., 2019, 135: 52-63.
[42] Sandmann G. Diversity and origin of carotenoid biosynthesis: Its history of coevolution towards plant photosynthesis [J]., 2021, 232(2): 479-493.
[43] Hou L X, Yuan X C, Li S,. Genome-wide identification ofgene family and expression patterns related to jasmonic acid treatment and steroidal saponin accumulation in[J]., 2021, 22(20): 10953.
[44] 尹艳, 关红雨, 张夏楠. 甾体皂苷生物合成相关酶及基因研究进展 [J]. 天然产物研究与开发, 2016, 28(8): 1332-1336.
[45] Paquette S, Møller B L, Bak S. On the origin of family 1 plant glycosyltransferases [J]., 2003, 62(3): 399-413.
[46] Stucky D F, Arpin J C, Schrick K. Functional diversification of two UGT80 enzymes required for steryl glucoside synthesis in[J]., 2015, 66: 189-201.
Identification of genes involved in biosynthesis of spirostane-type polyphyllin inbased on transcriptome analysis
QUBIE A-xiang1, 2, 3, QUBIE Jun-zhang1, 2, 3, FENG Ming-kang1, 2, 3, HE Bin1, 2, 3, HE Xiao-yong1, 2, 3, LI Juan2, 3, FENG Jing-qiu2, 3, SHENG Hua-chun2, 3, HUANG Yan-fei1, 3, 4, YAN Xin-jia2, 3, LIU Yuan2, 3, ZHANG Shao-shan2, 3
1. College of Pharmacy, Southwest Minzu University, Chengdu 610041, China 2. Sichuan Technology and Engineering Laboratory of Qiang-Yi Medicinal Resources Protection and Utilization, Chengdu 610225, China 3. Key Laboratory of Tibetan Plateau Ethnic Medicinal Resources Protection and Utilization of National Ethnic Affairs Commission, Chengdu 610225, China
To investigate the biosynthetic genes of spirostane-type polyphyllins of.Based on the rhizome, stem and leaf materials of, the contents of six spirostane-type polyphyllins were analyzed by HPLC. The transcriptome sequencing was performed using Illumina HiSeq X Ten platform. The quantitative data and transcriptome data were combined for bioinformatics analysis.The content of six spirostane-type polyphyllins had significant differences in the rhizome, stem and leaf of. A total of 61755 non-redundant unigenes were obtained by Illumina sequencing, of which 30263 (49.0%) were successfully annotated. Thirty-one key genes in the biosynthesis pathway of diosgenin had been successfully identified, and the gene expression pattern was generally consistent with the accumulation level of spirostane-type polyphyllins. The accumulation level of spirostane-type polyphyllins were positively correlated with,,,,,,,,,,,,,,and. A total of 61 uridine diphosphate glycosyltransferase () genes were obtained, of which 30 were potentially involved in the glycosylation modification of spirostane-type polyphyllins.There was a consistency between the expression pattern of genes involved in the biosynthesis pathway of polyphyllins and the accumulation level of polyphyllins in the rhizome, stems and leaves of. The genes identified in this study can help to elucidate the biosynthetic pathway of this kinds of active products.
Franch.; transcriptome; spirostane-type polyphyllins; biosynthesis pathway; uridine diphosphate glycosyltransferase
R286.12
A
0253 - 2670(2023)20 - 6798 - 15
10.7501/j.issn.0253-2670.2023.20.023
2023-02-03
四川省自然科学基金资助项目(22NSFSC3136);西南民族大学2023年研究生创新型项目资助硕士重点项目(ZD2023459)
曲别阿香(1999—),女,在读硕士,主要从事民族药品质评价及品质形成分子机理研究。E-mail: 1814910468@qq.com
通信作者:张绍山,助理研究员,主要从事民族药资源品质评价、生态栽培及次生代谢产物生物调控研究。E-mail: shaoshanzhang_smu@qq.com
刘 圆,教授,主要从事民族药资源品质评价研究。E-mail: 499769896@qq.com
[责任编辑 时圣明]

