肠道菌群代谢转化中药皂苷类成分研究进展
韩 冰,李静娜,吕西雨,陈明月,杜德峰,李 菲,张 超
肠道菌群代谢转化中药皂苷类成分研究进展
韩 冰,李静娜,吕西雨,陈明月,杜德峰,李 菲,张 超*
山东中医药大学药学院,山东 济南 250355
近年来,肠道菌群代谢转化中药皂苷成为国内外研究的热点。中药皂苷类成分口服后难以直接在肠道中吸收,生物利用度低,肠道菌群产生的代谢酶可参与中药皂苷的代谢转化,使其生成低极性的次级苷、苷元或其他代谢物而发挥药理作用。通过综述中药皂苷在肠道菌群下的代谢反应、参与中药皂苷代谢转化的肠道菌群、代谢产物的活性、影响肠道菌群代谢转化中药皂苷的因素,为后续中药皂苷类成分在肠道中的代谢转化研究提供理论指导。
肠道菌群;皂苷;代谢转化;代谢酶;影响因素
中药皂苷根据其苷元结构可分为三萜皂苷和甾体皂苷两大类,三萜皂苷主要存在于五加科、毛茛科、豆科、伞形科、鼠李科、桔梗科等植物中,甾体皂苷主要分布于百合科、薯蓣科等植物中。绝大多数中药通过口服途径给药,皂苷因相对分子质量较大、脂溶性差,口服后难以直接在肠道中吸收,生物利用度低。肠道菌群是寄居在肠道中种类繁多、数量庞大的微生物群落,可分泌许多与代谢相关的酶,这些酶可参与皂苷在肠道中的代谢,使其发生脱糖、脱氢、氧化和脱水等反应,生成相应的次级苷、苷元或其他代谢物,这些皂苷的肠菌代谢产物在抗肿瘤、抗炎、心肌保护等方面往往具有更强的药理活性。近年来,肠道菌群代谢转化中药皂苷类成分的研究逐渐成为热点,笔者通过查阅国内外近10年相关文献,对中药皂苷在肠道菌群下的代谢反应及代谢产物活性、参与中药皂苷代谢转化的肠道菌群、影响肠道菌群代谢转化中药皂苷的因素(图1)进行归纳、总结,为中药皂苷类成分的体内代谢研究提供参考,为中药皂苷及其代谢产物的新药开发奠定基础。
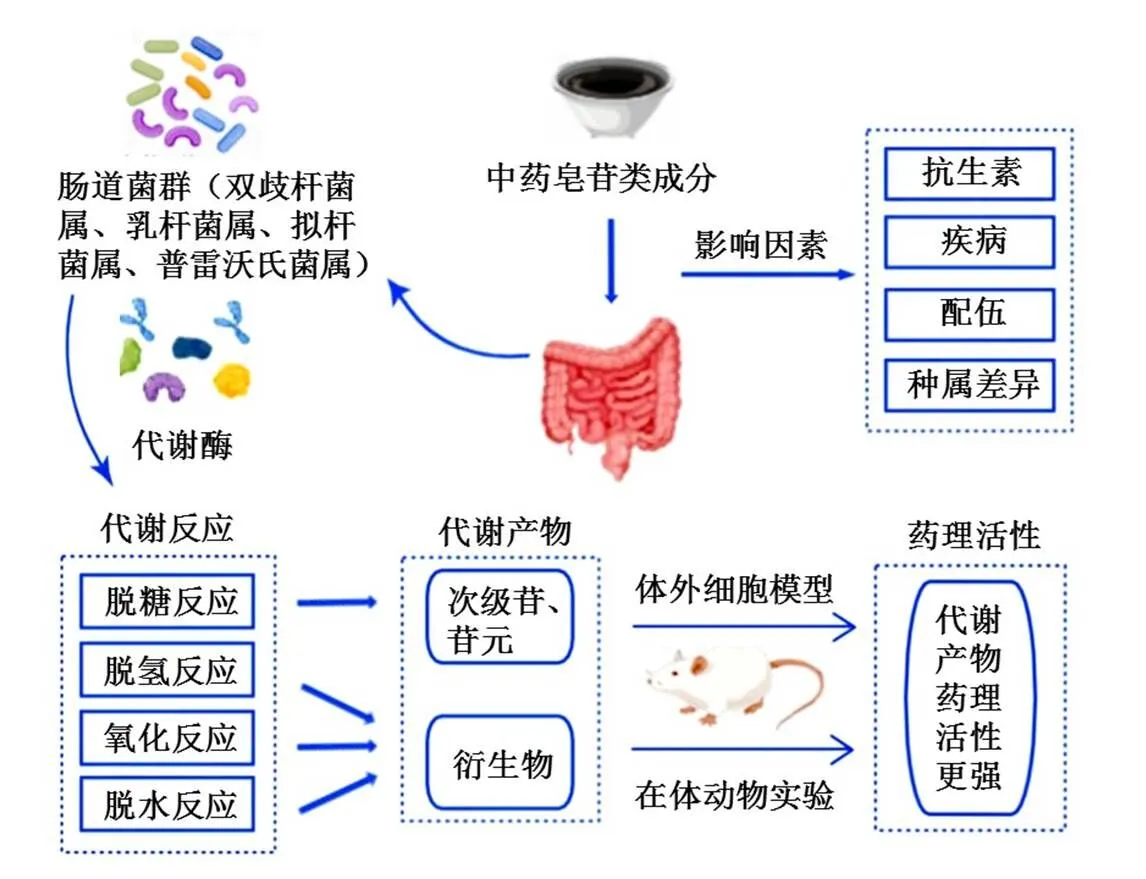
图1 肠道菌群代谢转化中药皂苷类成分示意图
1 中药皂苷类成分在肠道菌群下的代谢反应
中药皂苷类成分口服进入肠道后不可避免的要与肠道菌群接触,经肠道菌作用发生脱糖、脱氢、氧化、脱水、羟基化等反应,从而改变皂苷类化合物的结构,生成低极性的次级苷、苷元或其他代谢产物。其中,脱糖反应是皂苷类成分在肠道中的主要代谢方式,而脱氢、氧化、脱水等反应为次要的肠道代谢途径。
1.1 脱糖反应
在肠道菌群代谢中药皂苷的研究报道中,人参皂苷是研究较多的一类成分,其逐级脱糖反应代谢途径已经明确。人参皂苷根据苷元结构不同可分为2类,一类是达玛烷型四环三萜,包括20()-原人参二醇[20()-protopanaxadiol,20()-PPD] 型和20()-原人参三醇[20()-protopanaxatriol,20()-PPT] 型;另一类是齐墩果烷型五环三萜。PPD型人参皂苷(如人参皂苷Rb1、Rb2、Rb3、Rc)在C-3和C-20位各有1个糖链,在肠道菌群中的代谢途径有2种,一种为Rb1/Rb2/Rb3/Rc→Rd→F2→化合物K(compound K,CK)→PPD,即:原型化合物先脱C-20位外侧糖,再依次脱C-3位2分子葡萄糖,最后脱C-20位内侧糖生成PPD[1-6];另一种为Rb1/Rb2/Rb3/Rc→Rd→Rg3→Rh2→PPD,即原型化合物先依次脱去C-20位所有糖基,再依次脱去C-3位2分子葡萄糖,最终形成PPD[7-10]。此外,Shen等[11]研究发现,人参皂苷Rb1在人肠道菌群中还可经“Rb1→绞股蓝皂苷ⅩVII(gypenoside ⅩⅦ,G-ⅩⅦ)→G-ⅬⅩⅩⅤ→CK”这一代谢途径进行转化,即人参皂苷Rb1先脱去C-3位的2分子葡萄糖,再脱去C-20位的1分子葡萄糖形成CK。PPT型人参皂苷(如人参皂苷Re、Rg1、Rg2、Rf、Rh1、F1)在C-6和C-20位各有1个糖链,具有如下代谢转化途径:Re→Rg1/Rg2→Rh1/F1→PPT[12-13]、Rg1→Rh1/ F1→PPT[14-15]、Rg2→Rh1→PPT、Rf→Rh1→PPT[16]、Rh1/F1→PPT[17-18],即通过丢失C-6和C-20位糖基生成苷元PPT。人参皂苷Ro和竹节参皂苷IV为齐墩果烷型人参皂苷,在C-3和C-28位有糖链,经体外人肠道菌群作用,可分别失去C-3位糖链末端葡萄糖和阿拉伯糖生成次级皂苷竹节参皂苷IVa[19]。
不论中药皂苷糖链和糖基数目的多少,在肠道菌群的作用下均可发生逐级脱糖反应生成相应次级皂苷和苷元。五糖苷酸枣仁皂苷A及其同分异构体酸枣仁皂苷A1在肠道中脱去C-3位糖链末端葡萄糖分别生成酸枣仁皂苷B和酸枣仁皂苷B1[20-21],酸枣仁皂苷B再继续脱去C-3位吡喃木糖、葡萄糖、鼠李糖和阿拉伯糖得到酸枣仁皂苷元[22-23]。大鼠口服三七皂苷Fc(五糖苷)后,在粪便中鉴定出去糖基化产物人参皂苷Rb3、R7、Rd、G-Ⅸ、三七皂苷ST4、G-ⅩIII、CK和20()-PPD[24]。同样,五糖苷白头翁皂苷B4在肠道菌群中发生脱糖反应生成白头翁皂苷元[25]。苦丁茶冬青皂苷D是C-3位连接3个糖基的三萜皂苷,其在大鼠肠道菌群中的代谢过程为:苦丁茶冬青皂苷D→苦丁茶冬青皂苷LZ11/苦丁茶冬青苷P→3--α--吡喃阿拉伯糖基-α-苦丁内酯→α-苦丁内酯,即苦丁茶冬青皂苷D逐级脱去C-3位葡萄糖、阿拉伯糖和鼠李糖得到苷元α-苦丁内酯[26]。同样,C-3位连接3个糖基的白头翁皂苷B3在大鼠离体肠道菌群中失去C-3位葡萄糖、鼠李糖和阿拉伯糖生成白头翁皂苷元[27-28]。双糖链的三糖苷知母皂苷BII逐级脱C-26和C-3位上的葡萄糖及半乳糖生成知母皂苷AIII、AI和菝葜皂苷元[29]。二糖苷在肠道菌群作用下可脱去2分子糖生成相应苷元。如柴胡皂苷A在大鼠肠菌液中先脱去C-3位葡萄糖,转化为柴胡次皂苷F,再脱去C-3位岩藻糖,生成柴胡皂苷元F[30];黄芪甲苷在大鼠肠菌液中先失去C-3位木糖,转化成环黄芪醇-6--β--吡喃葡萄糖苷,再失去C-6位葡萄糖,生成环黄芪醇[31-32]。综上可知,中药皂苷在肠道菌群作用下,通过逐级脱糖反应均可代谢生成相应次级苷和苷元。
1.2 脱氢反应
中药皂苷经脱氢反应生成含醛基或酮基的衍生物,降低极性。欧阳辉等[33-34]发现,白头翁皂苷D在大鼠肠道菌群作用下转化成含醛基的脱氢产物(C47H74O17)。大鼠口服知母皂苷AIII后,在粪便中检测到知母皂苷AIII脱氢产物(C39H63O13)[35]。不仅皂苷能发生脱氢反应,苷元也能发生脱氢反应,如PPT在离体大鼠肠道菌群中转化为脱氢原人参三醇[36],但该研究未明确脱氢位置。进一步研究发现皂苷元的脱氢反应主要发生在C-3位羟基上,如环黄芪醇在人肠道中脱氢生成含酮基衍生物20,24-环氧-6α,16β,25-三羟基-9,19-环烷-3-酮[37];在牛膝提取物与大鼠粪便厌氧孵育中,发现齐墩果酸被代谢为含酮基衍生物齐墩果酸-H2(C30H46O3)[38]。
1.3 氧化反应
Wang等[39]口服给予大鼠人参皂苷Rg1后,在粪便中鉴定出单氧化Rg1和单氧化PPT。另有文献报道皂苷元亦可在肠道菌群下发生氧化反应,PPT的24(25)位双键在大鼠肠道中发生氧化反应,转化为单氧代谢产物(20, 24或24)-环氧-达玛烷-3, 6,12,25-四醇[40]。皂苷元经肠道菌群作用发生氧化反应后不仅可以得到单氧化物,还可得到多氧化物,如CK在肠道菌群作用下发生单氧化反应生成M1和M2(C36H61O9),而PPD经肠道菌群作用发生顺序氧化反应得到一氧化物M4(C30H51O4)、二氧化物M5和M6(C30H51O5)、三氧化物M10和M11(C30H49O6)[41]。
1.4 脱水反应
皂苷或苷元经肠道菌群作用发生脱水反应,脱去羟基生成双键,降低极性,形成稀有皂苷。文献报道人参皂苷的脱羟基位置主要发生在C-20位上,如PPD型人参皂苷Rg3在人肠道菌群中发生脱水反应生成稀有人参皂苷Rk1、Rg5,PPT型人参皂苷Rh1和Rg2被代谢为稀有人参皂苷Rk3、Rh4和Rg6、F4[42-43]。还有文献报道柴胡皂苷C在人粪便悬浮液中脱去C-3或C-15位羟基生成醉鱼草皂苷Ⅳb、柴胡皂苷A[44]。
1.5 其他反应
除脱糖、脱氢、氧化、脱水反应外,中药皂苷在肠道中还可发生羟基化和酯化反应。Huang等[45]发现甘草水提取物中3-酮基-18(α,β)-甘草次酸(C30H44O4)在大鼠肠道中发生C-22或C-24位羟基化反应生成3-酮基-18(α,β)-甘草次酸+O(C30H44O5)。Wang等[46]将红参提取物与人粪便厌氧培养,首次检测到人参皂苷Rd、Rg1在肠道菌群中的酯化产物乳酸-人参皂苷Rd和乳酸-人参皂苷Rg1。
2 参与中药皂苷类成分代谢转化的肠道菌群研究
研究发现主要是肠道菌群中的双歧杆菌属、乳杆菌属、拟杆菌属和普雷沃氏菌属参与中药皂苷的代谢转化。乳酸菌催化PPD、PPT型人参皂苷发生脱糖反应分别产生人参皂苷Rg3、CK、PPD和Rh1、PPT[47]。动物双歧杆菌GM1水解人参皂苷Rb1的C-20位糖链末端葡萄糖生成人参皂苷Rd[48]。另一项研究表明,拟杆菌、双歧杆菌和普雷沃氏菌可将人参皂苷Rb1代谢为CK[49-50]。Chen等[51]发现,PPT经颤螺菌属和考拉杆菌属作用可发生脱氢、羟基化反应产生双脱氢-原人参三醇。还有研究报道,三七总皂苷在肠道菌群作用下发生脱糖反应生成人参皂苷F1、Rh2、CK、PPT和PPD,青春双歧杆菌和鼠李糖乳杆菌在代谢过程中起着重要作用[52]。
事实上,是肠道菌群产生的代谢酶实际参与了中药皂苷的代谢转化,其中的糖苷水解酶是参与中药皂苷脱糖反应的主要代谢酶。人参皂苷Rg3经β-葡萄糖苷酶作用发生脱糖代谢生成人参皂苷Rh2[53]。CK在罗氏菌属分泌的β-糖苷酶作用下转化为PPD[54]。Jiang等[55]发现β-葡萄糖苷酶将知母皂苷BIII降解为知母皂苷BIII-a、(20,25)-5β-螺甾烷-3β-醇-3--β--吡喃葡萄糖基- (1→2)-β--半乳糖苷及知母皂苷AIII。除糖苷水解酶能代谢转化中药皂苷外,Xiao等[56]发现拟杆菌门(Bacteroidetes)分泌的氧化还原酶催化三七皂苷R1发生脱氢、氧化、去甲基化反应分别生成R1-M7(C47H78O18)、R1-M10(C47H76O19)、R1-M11(C46H76O19)。Akao[57]发现甘草次酸经盲肠中3β-羟基类固醇脱氢酶作用后,在C-3位羟基发生脱氢反应转化为3-氧-甘草次酸。
随着分子生物学技术的不断发展,已有研究者使用基因克隆技术对参与人参皂苷代谢的糖苷酶进行克隆。Hyun等[58]首次克隆并表达了短双歧杆菌K-110分泌的β--木糖苷酶,该酶具有将人参皂苷Ra1代谢为人参皂苷Rb2的能力。Jung等[59]从长双歧杆菌H-1中克隆了编码β--葡萄糖苷酶的基因,发现此酶可将人参皂苷Rb1转化成CK。随后,Yan等[60]克隆了来自长双歧杆菌KACC 91563的β-葡萄糖苷酶,发现该酶可高效的将人参皂苷Rb1转化为人参皂苷Rd。
3 中药皂苷类成分代谢产物的活性研究
中药皂苷被肠道菌群代谢后,生成相应次级苷、苷元或衍生物等代谢产物,研究者利用体外细胞模型比较了中药皂苷与其代谢产物的抗肿瘤活性。Niu等[61]测定人参皂苷Rb1及其代谢产物对A/J小鼠转移性肺癌LM1细胞的抗肿瘤活性和在人结直肠腺癌细胞单层中的渗透性,结果发现次级人参皂苷F2、CK具有显著的抗肿瘤活性,而原型人参皂苷Rb1不具有这种活性;CK具有比人参皂苷Rb1、F2更高的渗透性。与该渗透性报道相反的是,与薯蓣皂苷相比,其脱C-3位所有糖基生成的苷元薯蓣皂苷元的肠道渗透性较差[62]。体外实验证实,人参皂苷Rb1对人结肠癌HT-29细胞无明显的抗肿瘤作用,但其去糖基化产物CK的抗肿瘤作用增强[63]。还有研究表明,人参皂苷Rb1转化生成的次级苷CK和苷元PPD对肺癌A549细胞的抗肿瘤活性强于其衍生物3-羰基-PPD[64]。Chen等[65]研究发现,衍生物26-羟基-20()-PPD、7β-羟基-20()-PPD、7-羰基- 20()-PPD对前列腺癌细胞DU-145和PC-3的抑制作用比原型20()-PPD强。研究者不仅研究了人参皂苷及其肠菌代谢物的抗肿瘤活性,还对其他中药皂苷及其肠菌代谢物的抗肿瘤活性进行了研究。白头翁皂苷B4失去C-28位鼠李糖、葡萄糖生成的次级苷M6(C47H76O17)剂量相关性降低人肝癌SMMC-7721细胞活力,具有比白头翁皂苷B4更强的抗肿瘤活性[66]。刘艳平等[67]发现,次级苷知母皂苷AIII对胰腺癌PANC-1细胞的抑制作用强于原型知母皂苷BII。以上体外细胞实验结果证实中药皂苷肠菌代谢产物次级苷、苷元或衍生物具有更强的抗肿瘤活性。
除此之外,还有文献通过在体动物实验比较了中药皂苷及其肠菌代谢产物次级苷、苷元的药理活性。研究发现,与三萜皂苷酸枣仁皂苷A相比,其脱C-3位1分子葡萄糖转化成的次级苷酸枣仁皂苷B的镇静安神效果更佳[68];与甾体皂苷知母皂苷AIII相比,其脱去C-3位2分子糖生成的苷元菝葜皂苷元的抗炎作用更强[69]。Jiang等[55]通过旷场实验、悬尾实验和强迫游泳实验发现,知母皂苷BIII及其次级苷知母皂苷AIII、衍生物知母皂苷BⅢ-a均能明显缩短小鼠不动时间,说明三者均具有良好的抗抑郁活性。Feng等[70]利用大鼠心肌缺血模型观察到,穿龙薯蓣提取物及其肠菌代谢物薯蓣皂苷元保护心肌免受缺血性损伤的效果几乎相同,推断穿龙薯蓣提取物可能在体内经肠道菌群代谢为薯蓣皂苷元发挥作用。
4 影响肠道菌群代谢转化中药皂苷类成分的因素
4.1 抗生素
正常情况下,肠道菌群与宿主和外部环境保持相对平衡状态,而使用抗生素会打破这种平衡状态,使菌属种类明显下降,引起肠道菌群失调,以致与代谢相关的糖苷酶活性显著降低,从而抑制中药皂苷的代谢转化。Ju等[71]研究证实硫酸链霉素(100 mg/kg)和硫酸新霉素(100 mg/kg)使大鼠肠道中β-葡萄糖苷酶和β-木糖苷酶活性降低,显著抑制三七皂苷Fc发生脱糖反应。抗生素不但可以抑制代谢反应的进行,还可造成代谢产物的生成量减少。钱静[72]发现抗生素(杆菌肽和硫酸新霉素各500 mg/kg、纳他霉素125 μg/kg)诱导菌群失调大鼠肠道中的厌氧支原体属、颤杆菌克属、布劳特氏菌属、瘤胃菌属和粪球菌属丰度下降,所表达的β-葡萄糖苷酶、β-半乳糖苷酶及β-葡萄糖醛酸苷酶活性降低,导致人参皂苷Rb1、Rb2、Rb3、Rc和Rg1脱糖代谢生成的CK、人参皂苷F1显著减少。将人参皂苷Rb1分别与抗生素混合物(新霉素500 mg/kg、杆菌肽500 mg/kg、海松霉素0.125 mg/kg)和盐酸林可霉素(5000 mg/kg)诱导的菌群失调大鼠粪便共同孵育,发现菌群失调大鼠粪便中β-葡萄糖苷酶活性降低,致使人参皂苷Rb1逐级脱糖代谢为人参皂苷Rd、F2和CK的量减少[73-74]。
抗生素处理后的肠道菌群不仅会导致中药皂苷代谢产物的生成量减少,而且还会影响代谢产物的种类。Xu等[75]发现,人参皂苷Rb1在正常大鼠肠道中转化48 h后产生人参皂苷Rd、CK,在0.12 g/kg林可霉素处理的伪无菌大鼠肠道中降解为人参皂苷Rd、F2,在4.8 g/kg林可霉素处理的伪无菌大鼠肠道中仅代谢成人参皂苷Rd。Guo等[76]观察头孢曲松钠(350 mg/kg)、硫酸庆大霉素(126 mg/kg)制备的伪无菌大鼠和正常大鼠肠道菌群介导的三七总皂苷代谢差异,发现去糖基化产物人参皂苷Rh2只能在正常大鼠肠道菌群中检测到。金艺等[77-78]在正常大鼠肠道菌群中检测到黄芪甲苷去糖基化产物brachyoside B、cyclogaleginoside B、环黄芪醇以及环黄芪醇脱氢产物环黄芪醇-2H,而在硫酸链霉素和杆菌肽混合溶液(各200 mg/kg)处理的大鼠肠道菌群中没有检测到相关代谢物。
然而,与大部分研究证明的抗生素抑制中药皂苷代谢转化不同的是,Xiao等[56]发现大鼠口服抗生素混合物(硫酸新霉素和链霉素各100 mg/kg)后,肠道中拟杆菌门(Bacteroidetes)特别是拟杆菌属、丹毒杆菌属和布劳特氏菌属丰度上调,氧化还原酶活性增强,进而促进三七总皂苷发生氧化、去甲基化和脱氢反应分别生成三七皂苷R1-M10(C47H76O19)、三七皂苷R1-M11(C46H76O19)和人参皂苷Re-M6(C48H78O18)、三七皂苷R1-M7(C47H78O18)。
4.2 疾病
在病理情况下,肠道菌群的种类、数量会发生改变,结构向有害菌偏移[79],影响中药皂苷类成分的代谢转化。一方面,疾病可抑制肠道菌群代谢转化中药皂苷。严桐等[80]研究发现,与健康人肠道菌群相比,人参皂苷Rg3在肝癌患者肠道菌群中脱糖代谢生成人参皂苷Rh2的速率显著变慢。此外,疾病还可使肠道菌群代谢中药皂苷的产物生成量减少。有研究报道[81-82]在过度疲劳和急性冷应激造成的气虚模型大鼠中观察到普雷沃氏菌大量生长的同时乳酸杆菌、拟杆菌显著减少,从而降低β-葡萄糖苷酶和α-鼠李糖苷酶活性,使人参皂苷Re、Rc脱糖转化成人参皂苷Rg1、Rd的量显著减少。Shen等[83]发现,葡聚糖硫酸钠诱导的实验性结肠炎大鼠肠道中肠杆菌科(Enterbacteriaceae)和脆弱拟杆菌增加,而双歧杆菌、乳酸杆菌、柔嫩梭菌和球形梭菌减少,导致β-葡萄糖苷酶活性降低,使人参皂苷F2代谢为CK的量变少。随后,Guo等[54]研究发现,CK生物转化率与健康人肠道富集的布劳特氏菌属、栖水菌属、粪杆菌属及罗氏菌属呈强正相关,而与结直肠癌患者肠道富集的细菌呈非相关特性,所以CK在后者肠道中降解为PPD的量减少。
另一方面,疾病可使中药皂苷在肠道中发生不同的代谢反应。酸枣仁皂苷B在健康人肠道菌群中发生糖基化反应生成酸枣仁皂苷B+C5H10O5,在心肝血虚失眠患者肠道菌群中则发生氧化反应被代谢为酸枣仁皂苷B+O[84]。严桐等[80]观察到白头翁皂苷D在健康人和肝癌患者肠道菌群中均可发生脱糖反应生成常春藤皂苷元3--β--吡喃葡萄糖- (1→4)-α--吡喃阿拉伯糖苷、常春藤皂苷元3---吡喃鼠李糖-(1→2)-α--吡喃阿拉伯糖苷和常春藤皂苷元,而在健康人肠道菌群中还能发生甲基化反应得到白头翁皂苷D甲基化产物(C48H78O17),在肝癌患者肠道菌群中则能发生羟基化反应生成白头翁皂苷D羟基化产物(C47H76O18)。
4.3 配伍
中药多以配伍的形式使用,而配伍则会影响中药皂苷在肠道菌群中的代谢转化。三七与黄连配伍后,肠道菌群分泌的β-葡萄糖苷酶活性降低,使三七中人参皂苷Rb1、Rg1在肠道中的脱糖代谢速率变慢[85]。李娉婷[86]定性、定量比较柴胡牡蛎、柴胡黄芩配伍对柴胡皂苷代谢的影响。结果显示,柴胡与牡蛎配伍后,在肠道菌群中鉴定出柴胡皂苷B2的去糖基化产物前柴胡苷元D且发现柴胡皂苷A的含量减少;而柴胡与黄芩配伍后,在肠道菌群中未检测到前柴胡苷元D但发现柴胡皂苷A含量增加,推测有其他成分转化为柴胡皂苷A。还有文献报道了更多药味的配伍对中药皂苷肠菌代谢的影响,肖娟等[87]比较了单味甘草、人参与半夏泻心汤中甘草、人参的皂苷类成分在大鼠肠道菌群中的代谢差异,发现在半夏泻心汤中肠道菌群转化甘草酸为甘草次酸的速率加快,并促进人参皂苷Re代谢为人参皂苷Rg1,但抑制人参皂苷Rg1继续转化为人参皂苷Rh1,且人参皂苷Rb1降解为人参皂苷Rd的速率减慢。然而,由于较多药味的复方影响因素更多,这给分析皂苷类成分配伍前后肠菌代谢的差异带来一定困难。
多糖是肠道菌群的有利碳源,有助于益生菌生长,可以促进中药皂苷在肠道中代谢转化。Shen等[83]发现人参多糖促进CK脱糖代谢形成苷元PPD。正常情况下,人参皂苷Re在肠道中转化48 h后,除终产物PPT,中间产物人参皂苷Rg1、Rg2、F1仍可被检测到,而加入人参多糖后只能检测到PPT[88]。不仅人参多糖能促进肠道菌群代谢转化皂苷类成分,麦冬多糖对中药皂苷的代谢转化也具有促进作用。麦冬多糖能增强肠道菌群分泌的β--葡萄糖苷酶、β--木糖苷酶、α--鼠李糖苷酶和β--岩藻糖苷酶活性,促进麦冬皂苷D、麦冬皂苷D′发生脱糖反应分别生成鲁斯可皂苷元和薯蓣皂苷元[89]。另外,Wang等[90]还发现,麦冬与人参配伍后,麦冬多糖显著促进人参中人参皂苷Rb1、Re代谢生成PPD和人参皂苷Rg1、PPT。
4.4 种属差异
不同种属之间肠道菌群结构有异,对同一中药皂苷的代谢转化可能产生差异。大鼠肠道菌群以鞘脂杆菌纲(Sphingobacteria)、鞘脂杆菌目(Sphingobateriales)、伯克氏菌目(Burkholderiales)为主,小鼠肠道菌群则主要由厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)构成[91]。Jeon等[92]研究红参提取物在SD大鼠和ICR小鼠肠道中的代谢差异,发现SD大鼠粪便中去糖基化产物20()-PPD和20()-PPT的量最高,而ICR小鼠粪便中去糖基化产物20()-Rd和20()-Rg3的含量最高,说明人参皂苷在大鼠肠道菌群中的脱糖代谢程度比在小鼠中的高。厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为人肠道菌群的优势菌门[93]。人和大鼠肠道菌群结构差异对中药皂苷代谢的影响可以体现在代谢产物的种类不同。如人参、三七水煎液中人参皂苷Rb1、Rd、Rg1、Re被人肠道菌群降解成苷元PPD、PPT[94],但是在SD大鼠肠道菌群中仅代谢为PPT[95-96]。Zhang等[97]将桔梗皂苷D分别与人和SD大鼠粪便厌氧培养,在SD大鼠肠道细菌培养液中鉴定出C-28寡糖水解代谢物M5(C41H66O16)、M6(C30H48O7),但在人肠道细菌培养液中未鉴定出M5和M6。除探讨人、鼠类肠道菌群结构差异对中药皂苷代谢的影响外,Zhang等[98]利用体外厌氧培养系统评估人参皂苷Rb1、Rb2、Rb3、Rc在人、SD大鼠和兔肠道菌群中代谢的差异,结果表明,CK氧化物和PPD氧化物只能在人肠道菌群中检测到。同时,还发现兔肠道菌群中β-葡萄糖苷酶活性、原型化合物代谢率及代谢产物人参皂苷Rd生成率显著高于人和SD大鼠,提示不同种属之间除代谢产物有差异外,代谢速率也有一定差别。
此外,相同种属由于性别、饮食习惯等方面的差异,肠道菌群的代谢功能也不完全相同。唐岚等[99]研究发现,与雄鼠肠道菌群相比,三七总皂苷中人参皂苷Rb1在雌鼠肠道菌群中降解24 h后未代谢完全,原因可能是不同性别大鼠肠道细菌比例有所不同,导致雄鼠肠道菌群代谢人参皂苷Rb1的能力强于雌鼠。不同饮食习惯会影响肠道菌群的丰富度和多样性[100-101],进而影响中药皂苷在肠道中的代谢。与西方饮食受试者肠道菌群相比,人参皂苷Rb1在亚洲饮食受试者肠道菌群中脱糖代谢生成CK的量较少[102]。Chen等[51]和Wang等[52]发现,低脂肪和富含植物纤维饮食受试者肠道菌群中布劳特氏菌属、双歧杆菌属、罗氏菌属、瘤胃球菌属和增加,使三七总皂苷主要发生脱糖反应生成人参皂苷Rh2、PPD、PPT,而在高脂肪和高蛋白饮食受试者中,三七总皂苷主要发生脱氢、羟基化反应生成双脱氢-原人参三醇。益生元是一种不易被消化的食品成分,可以选择性的刺激肠道有益菌群的生长,从而促进人参皂苷代谢转化。研究发现,灌胃低聚果糖、低聚半乳糖和松谷纤维的大鼠肠道中普雷沃氏菌增加[50],β-葡萄糖苷酶活性增强,继而增强人参皂苷Rb1代谢为CK的能力[103]。另外,Kim等[104-105]发现,添加可溶性益生元纤维Nutriose的大鼠粪便悬浮液中α/β--葡萄糖苷酶、α--鼠李糖苷酶活性较不加处理中的强,从而促进人参皂苷Rb1向人参皂苷Rd、CK代谢转化。
5 结语与展望
虽然目前已有大量关于肠道菌群代谢转化中药皂苷的报道,但仍存在研究不够深入的问题。首先,参与皂苷代谢转化的酶类研究主要集中在糖苷酶,对脱氢酶和氧化酶的关注较少。因而,脱氢酶、氧化酶如何介导肠道菌群代谢转化中药皂苷需要进一步探索。其次,临床用药多中西药联合用药,如合用抗生素和皂苷类药物。然而,抗生素会抑制肠道菌群代谢转化中药皂苷,抗生素与皂苷类药物合用对疗效是否有影响亦值得进一步研究。目前对肠道菌群代谢转化中药皂苷的研究多围绕单一成分展开,复方配伍是中医用药的主要形式,且单一成分不能正确反映配伍中各成分相互作用后在肠道中的代谢转化过程。因此,后续应加强复方配伍中各成分间相互作用的研究,明确配伍中其他成分对中药皂苷在肠道中代谢转化的影响,以期阐释中药配伍理论,指导临床合理用药,更好体现中医药应用特色。
值得关注的是,本文所引文献绝大部分采用动物实验和体外培养的方法研究肠道菌群对中药皂苷类成分的代谢。动物实验可以较好的模拟中药皂苷体内代谢转化过程,但是不同种属之间肠道菌群结构和代谢能力存在差异,因而实验结果不能直接用于人体。体外培养代谢条件可控,代谢体系制备简单,可在短时间内得到大量代谢产物,且易于确定中药皂苷的结构变化和代谢途径。但体外培养的菌种单一,不能很好的反应体内肠道菌群对中药皂苷类成分的代谢转化。虽然已有体外消化系统的设计,如荷兰国家应用科学研究院胃肠道模型[106]、人体肠道微生态模拟器,但都不具备真实肠道形态和生理结构特征。因此,构建一个能够全方位模拟人体消化道的体外仿生消化系统[107]对深入研究中药皂苷类成分在肠道中的代谢转化过程具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 马丽媛, 王洪平, 杨秀伟. 人参茎叶总皂苷的人肠内细菌生物转化 [J]. 中国现代中药, 2021, 23(1):23-36.
[2] 姚玲玲. LC-MS技术在不同炮制程度甘草、白芍质量标志物的发现及肠道菌对人参皂苷代谢转化研究中的应用 [D]. 南京: 南京中医药大学, 2022.
[3] 韩铭鑫. 肠道菌群对二醇型人参皂苷代谢的研究 [D]. 长春: 长春中医药大学, 2020.
[4] 钱静, 康安, 狄留庆, 等. 人参皂苷Rb1在体外肠道菌群模型中的代谢研究 [J]. 南京中医药大学学报, 2015, 31(6): 567-570.
[5] 李佳欣, 赵聪, 李璐, 等. 花旗泽仁主要活性成分在大鼠体外肠道菌群中代谢研究 [J]. 辽宁中医药大学学报, 2019, 21(6): 58-65.
[6] Zhang L, Liu X Y, Xu W,. Pharmacokinetics comparison of 15 ginsenosides and 3 aglycones in Ginsengetand Baoyuan decoction using ultra-fast liquid chromatography coupled with triple quadrupole tandem mass spectrometry [J]., 2019, 59: 152775.
[7] Zheng F, Zhang M Y, Wu Y X,. Biotransformation of ginsenosides (Rb1, Rb2, Rb3, rc) in human intestinal bacteria and its effect on intestinal flora [J]., 2021, 18(12): e2100296.
[8] Kim J K, Choi M S, Jeung W,. Effects of gut microbiota on the pharmacokinetics of protopanaxadiol ginsenosides Rd, Rg3, F2, and compound K in healthy volunteers treated orally with red ginseng [J]., 2020, 44(4): 611-618.
[9] 韩铭鑫, 李方彤, 张琰, 等. 稀有原人参二醇型皂苷的人肠道菌群生物转化 [J]. 高等学校化学学报, 2019, 40(7): 1390-1396.
[10] Zhao C Y, Sun R B, Cao B,. Anmetabolic system of gut flora and the metabolism of ginsenoside Rg3and cholic acid [J]., 2014, 39(2): 129-137.
[11] Shen H, Leung W I, Ruan J Q,. Biotransformation of ginsenoside Rb1via the gypenoside pathway by human gut bacteria [J]., 2013, 8(1): 22.
[12] Kim U, Park M H, Kim D H,. Metabolite profiling of ginsenoside Re in rat urine and faeces after oral administration [J]., 2013, 136(3/4): 1364-1369.
[13] Shen H, Zhang L, Xu J D,. Effect of sulfur-fumigation process on ginseng: Metabolism and absorption evidences [J]., 2020, 256: 112799.
[14] 李雪晴, 李丽, 刘秀峰, 等. 三七皂苷的人肠道菌群体外代谢研究 [J]. 药物生物技术, 2017, 24(3): 218-223.
[15] Dong W W, Han X Z, Zhao J H,. Metabolite profiling of ginsenosides in rat plasma, urine and feces by LC-MS/MS and its application to a pharmacokinetic study after oral administration ofextract [J]., 2018, doi: 10.1002/bmc.4105.
[16] Dong W W, Zhao J H, Zhong F L,. Biotransformation ofextract by rat intestinal microflora: Identification and quantification of metabolites using liquid chromatography-tandem mass spectrometry [J]., 2017, 41(4): 540-547.
[17] 张琰, 李方彤, 韩铭鑫, 等. 通过RRLC-Q-TOF MS和UPLC-QQQ MS分析原人参三醇型皂苷在人肠道菌群中的代谢产物 [J]. 质谱学报, 2020, 41(1):66-75.
[18] 张琰. 原人参三醇型皂苷在离体肠道菌群代谢的研究 [D]. 长春: 长春中医药大学, 2020.
[19] 杨秀伟, 张雷, 徐嵬, 等. 人参水提取物中的人参三萜在人肠内菌体外温孵体系的转化研究 [J]. 中国现代中药, 2021, 23(7): 1172-1181.
[20] 崔小芳, 杜晨晖, 裴香萍, 等. 基于肠道菌群转化的酸枣仁质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4634-4642.
[21] 庞萌萌, 张惠惠, 窦家聪, 等. 人体粪便孵育液对酸枣仁皂苷A的代谢转化研究 [J]. 辽宁中医杂志, 2016, 43(7): 1459-1462.
[22] Zhang Y Q, Zhang Y, Zhang K S,. Degradation kinetics of jujuboside b by rat intestinal florawith an RRLC-MS-MS method [J]., 2014, 52(7): 691-696.
[23] 张妍. 酸枣仁皂苷A大鼠胃肠道转化及镇静催眠作用研究 [D]. 天津: 天津商业大学, 2017.
[24] He C Y, Li J, Xu N S,. Pharmacokinetics, bioavailability, and metabolism of Notoginsenoside Fc in rats by liquid chromatography/electrospray ionization tandem mass spectrometry [J]., 2015, 109: 150-157.
[25] 连姗. 白头翁三萜皂苷的提取分离和体内代谢研究 [D]. 哈尔滨: 哈尔滨商业大学, 2019.
[26] 白春艳, 吴三同, 张雅琼, 等. 大鼠肠道菌群对苦丁茶冬青皂苷D体外代谢的影响 [J]. 中成药, 2020, 42(7): 1903-1906.
[27] 刘亚丽, 宋永贵, 魏韶锋, 等. UPLC-ESI-Q-TOF- MS/MS分析白头翁皂苷B3在大鼠肠道菌群中的代谢产物 [J]. 中国实验方剂学杂志, 2015, 21(23): 72-76.
[28] 刘亚丽. 白头翁皂苷主要活性成分的药代动力学研究 [D]. 苏州: 苏州大学, 2014.
[29] Dong G M, Yu H, Pan L B,. Biotransformation of timosaponin BII into seven characteristic metabolites by the gut microbiota [J]., 2021, 26(13): 3861.
[30] 于蓓蓓, 王亮, 尹利顺, 等. 基于HPLC-DAD-MSn的柴胡皂苷A的体外生物转化研究 [J]. 中草药, 2017, 48(2): 333-338.
[31] 刘晓亚. 黄芪甲苷和环黄芪醇的体内外代谢研究 [D]. 北京: 北京中医药大学, 2013.
[32] 孙桂霞, 赵园园, 苗培培, 等. 黄芪甲苷的生物样品稳定性考察及在大鼠体外肠菌中代谢转化研究 [J]. 中国中药杂志, 2014, 39(21): 4258-4264.
[33] 欧阳辉, 郭宜城, 何明珍, 等. UPLC-Q-trap-MS鉴定白头翁皂苷D在大鼠离体肠道菌群中的代谢产物 [J]. 中草药, 2014, 45(4):523-526.
[34] Ouyang H, Zhou M, Guo Y,. Metabolites profiling ofsaponin D in rat by ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC/Q-TOF-MS/MS) [J]., 2014, 96: 152-158.
[35] Sun Y, Liu L Y, Peng Y,. Metabolites characterization of timosaponin AIIIandby using liquid chromatography-mass spectrometry [J]., 2015, 997: 236-243.
[36] 高霞, 耿婷, 马阳, 等. 离体大鼠肠道菌对6种皂苷类成分代谢研究 [J]. 中国中药杂志, 2016, 41(12): 2329-2338.
[37] 孟欣桐, 乐世俊, 杨智睿, 等. 黄芪皂苷类成分在人源肠道菌群中生物转化特征研究 [J]. 食品与药品, 2018, 20(3): 161-167.
[38] Fu J, Wu H, Wu H,. Chemical and metabolic analysis ofbidentate saponins with intestinal microflora-mediated biotransformation by ultra- performance liquid chromatography-quadrupole time-of- flight mass spectrometry coupled with metabolism platform [J]., 2019, 170: 305-320.
[39] Wang X Y, Wang C C, Pu F F,. Metabolite profiling of ginsenoside Rg1 after oral administration in rat [J]., 2014, 28(10): 1320-1324.
[40] He C Y, Zhou D D, Li J,. Identification of 20()-protopanaxatriol metabolites in rats by ultra- performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry and nuclear magnetic resonance spectroscopy [J]., 2014, 88: 497-508.
[41] Xie T T, Li Z G, Li B,. Characterization of ginsenoside compound K metabolites in rat urine and feces by ultra-performance liquid chromatography with electrospray ionization quadrupole time-of-flight tandem mass spectrometry [J]., 2019, 33(11): e4643.
[42] Wan J Y, Wang C Z, Liu Z,. Determination of American ginseng saponins and their metabolites in human plasma, urine and feces samples by liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]., 2016, 1015/1016: 62-73.
[43] Wan J Y, Liu P, Wang H Y,. Biotransformation and metabolic profile of American ginseng saponins with human intestinal microflora by liquid chromatography quadrupole time-of-flight mass spectrometry [J]., 2013, 1286: 83-92.
[44] Tang C, Fu Q C, Chen X,. The biotransformation ofby human gut microbiota [J]., 2020, 50(9): 1011-1022.
[45] Huang M L, Cheng Z Z, Wang L,. A targeted strategy to identify untargeted metabolites fromto: Rapid and sensitive metabolites profiling of licorice in rats using ultra-high performance liquid chromatography coupled with triple quadrupole-linear ion trap mass spectrometry [J]., 2018, 1092: 40-50.
[46] Wang H Y, Hua H Y, Liu X Y,.biotransformation of red ginseng extract by human intestinal microflora: Metabolites identification and metabolic profile elucidation using LC-Q-TOF/MS [J]., 2014, 98: 296-306.
[47] Jeon J H, Lee J, Park J H,. Effect of lactic acid bacteria on the pharmacokinetics and metabolism of ginsenosides in mice [J]., 2021, 13(9): 1496.
[48] Dong W W, Xuan F L, Zhong F L,. Comparative analysis of the rats' gut microbiota composition in animals with different ginsenosides metabolizing activity [J]., 2017, 65(2): 327-337.
[49] Kim K A, Jung I H, Park S H,. Comparative analysis of the gut microbiota in people with different levels of ginsenoside Rb1degradation to compound K [J]., 2013, 8(4): e62409.
[50] Zhang X Y, Chen S, Duan F P,. Prebiotics enhance the biotransformation and bioavailability of ginsenosides in rats by modulating gut microbiota [J]., 2021, 45(2): 334-343.
[51] Chen M Y, Shao L, Zhang W,. Metabolic analysis ofsaponins with gut microbiota- mediated biotransformation by HPLC-DAD-Q-TOF- MS/MS [J]., 2018, 150: 199-207.
[52] Wang L, Chen M Y, Shao L,. Personalized bioconversion ofsaponins mediated by gut microbiota between two different diet-pattern healthy subjects [J]., 2021, 16(1): 60.
[53] 郭跃龙, 钱静, 狄留庆, 等. 人参皂苷Rg3及人参皂苷Rh2在肠道菌群失调大鼠体内的药动学研究 [J]. 中草药, 2016, 47(23): 4198-4203.
[54] Guo Y P, Shao L, Wang L,. Bioconversion variation of ginsenoside CK mediated by human gut microbiota from healthy volunteers and colorectal cancer patients [J]., 2021, 16(1): 28.
[55] Jiang W X, Guo J, Xue R,. Anti-depressive activities and biotransformation of timosaponin B-III and its derivatives [J]., 2014, 28(18): 1446-1453.
[56] Xiao J, Chen H, Kang D,. Qualitatively and quantitatively investigating the regulation of intestinal microbiota on the metabolism ofsaponins [J]., 2016, 194: 324-336.
[57] Akao T. Effects of glycyrrhizin and glycyrrhetic acid on the growth, glycyrrhizin beta--glucuronidase and 3 beta-hydroxysteroid dehydrogenase of human intestinal bacteria [J]., 2000, 23(1): 104-107.
[58] Hyun Y J. Cloning and characterization of ginsenoside Ra1-hydrolyzing β--xylosidase frombreve K-110 [J]., 2012, 22(4): 535-540.
[59] Jung I H, Lee J H, Hyun Y J,. Metabolism of ginsenoside Rb1 by human intestinal microflora and cloning of its metabolizing β--glucosidase fromH-1 [J]., 2012, 35(4): 573-581.
[60] Yan S, Wei P C, Chen Q,. Functional and structural characterization of a β-glucosidase involved in saponin metabolism from intestinal bacteria [J]., 2018, 496(4): 1349-1356.
[61] Niu T, Smith D L, Yang Z,. Bioactivity and bioavailability of ginsenosides are dependent on the glycosidase activities of the A/J mouse intestinal microbiome defined by pyrosequencing [J]., 2013, 30(3): 836-846.
[62] Manda V K, Avula B, Ali Z,. Characterization ofADME properties of diosgenin and dioscin from[J]., 2013, 79(15): 1421-1428.
[63] Li Z P, Ji G E. Ginseng fermented by mycotoxin non-producing: Ginsenoside analysis and anti-proliferative effects [J]., 2017, 26(4): 987-991.
[64] Jin Y, Jung S Y, Kim Y J,. Microbial deglycosylation and ketonization of ginsenoside byand their anticancer activity [J]., 2016, 109(2): 179-185.
[65] Chen G T, Yang M, Nong S J,. Microbial transformation of 20(S)-protopanaxadiol by. Cytotoxic activity of the metabolites against human prostate cancer cells [J]., 2013, 84: 6-10.
[66] Wan J Y, Zhang Y Z, Yuan J B,. Biotransformation and metabolic profile of anemoside B4 with rat small and large intestine microflora by ultra-performance liquid chromatography-quadrupole time-of-flight tandem mass spectrometry [J]., 2017, 31(5): e3873.
[67] 刘艳平, 余自成, 陈红君. 基于肠道菌群代谢的知母皂苷BII体外代谢转化研究 [J]. 中国中医药信息杂志, 2018, 25(5): 66-70.
[68] 张群. 酸枣仁总皂苷的提取纯化及酸枣仁皂苷A的生物转化研究 [D]. 济南: 山东中医药大学, 2017.
[69] Lim S M, Jeong J J, Kang G D,. Timosaponin AIII and its metabolite sarsasapogenin ameliorate colitis in mice by inhibiting NF-κB and MAPK activation and restoring Th17/Treg cell balance [J]., 2015, 25(2): 493-503.
[70] Feng J F, Tang Y N, Ji H,. Biotransformation ofby rat intestinal microflora and cardioprotective effects of diosgenin [J]., 2017, 2017: 4176518.
[71] Ju Z C, Li J, Lu Q,. Identification and quantitative investigation of the effects of intestinal microflora on the metabolism and pharmacokinetics of notoginsenoside Fc assayed by liquid chromatography with electrospray ionization tandem mass spectrometry [J]., 2019, 42(9): 1740-1749.
[72] 钱静. 菌群失调下人参总皂苷的药代动力学差异及机制研究 [D]. 南京: 南京中医药大学, 2020.
[73] Kang A, Zhang S J, Zhu D,. Gut microbiota in the pharmacokinetics and colonic deglycosylation metabolism of ginsenoside Rb1in rats: Contrary effects of antimicrobials treatment and restraint stress [J]., 2016, 258: 187-196.
[74] 康安, 张圣洁, 单进军, 等. 人参皂苷Rb1在林可霉素诱导的菌群失调大鼠体内的药代动力学 [J]. 中国药科大学学报, 2016, 47(2): 182-187.
[75] Xu R, Peng Y, Wang M,. Effects of broad-spectrum antibiotics on the metabolism and pharmacokinetics of ginsenoside Rb1: A study on rats’ gut microflora influenced by lincomycin [J]., 2014, 158: 338-344.
[76] Guo Y P, Shao L, Chen M Y,.metabolic profiles ofsaponins mediated by gut microbiota in rats [J]., 2020, 68(25): 6835-6844.
[77] 金艺. 黄芪甲苷生物转化与生物利用影响因素研究 [D]. 沈阳: 沈阳药科大学, 2021.
[78] Jin Y, Guo X J, Yuan B,. Disposition of astragaloside IV via enterohepatic circulation is affected by the activity of the intestinal microbiome [J]., 2015, 63(26): 6084-6093.
[79] 殷瑞霞, 皇甫建, 肖瑞, 等. 2型糖尿病及并发肾病模型大鼠肠道菌群多样性分析 [J]. 动物医学进展, 2022, 43(4): 30-37
[80] 严桐, 易婷, 郑婷婷. 人体肠道菌群对人参皂苷Rg3、白头翁皂苷D代谢转化的影响 [J]. 中成药, 2018, 40(9): 1902-1909.
[81] Zhang L, Li F, Qin W J,. Changes in intestinal microbiota affect metabolism of ginsenoside Re [J]., 2021, 35(8): e5189.
[82] Zhou S S, Xu J, Zhu H,. Gut microbiota-involved mechanisms in enhancing systemic exposure of ginsenosides by coexisting polysaccharides in ginseng decoction [J]., 2016, 6: 22474.
[83] Shen H, Gao X J, Li T,. Ginseng polysaccharides enhanced ginsenoside Rb1and microbial metabolites exposure through enhancing intestinal absorption and affecting gut microbial metabolism [J]., 2018, 216: 47-56.
[84] 崔小芳. 酸枣仁总皂苷的肠道菌群体外代谢转化研究 [D]. 太原: 山西中医药大学, 2020.
[85] 周律. 三七和黄连提取物肠道菌群代谢及药代动力学初步研究 [D]. 广州: 广东药科大学, 2019.
[86] 李娉婷. 柴胡药对配伍对皂苷类成分影响及调节RCT的实验研究 [D]. 广州: 广州中医药大学, 2017.
[87] 肖娟, 张宜凡, 王莹, 等. 不同配伍对半夏泻心汤皂苷类成分的肠菌代谢影响研究 [J]. 中国中药杂志, 2013, 38(4):611-617.
[88] 李瑞刚, 朱娜, 赵幻希, 等. 人参多糖对人参皂苷Re体内代谢和体外转化的影响 [J]. 高等学校化学学报, 2018, 39(10): 2192-2197.
[89] Wang H Y, Guo S C, Peng Z T,.polysaccharide promotes themetabolism of ophiopogonins by human gut microbiota [J]., 2019, 24(16): 2886.
[90] Wang H Y, Wang C, Guo S C,. Polysaccharide deriving frompromotes metabolism of ginsenosides in the present of human gut microbiota based on UPLC-MS/MS assay [J]., 2019, 175: 112779.
[91] Kim Y S, Kim J, Park S J. High-throughput 16S rRNA gene sequencing reveals alterations of mouse intestinal microbiota after radiotherapy [J]., 2015, 33: 1-7.
[92] Jeon J H, Lee J, Choi M K,. Pharmacokinetics of ginsenosides following repeated oral administration of red ginseng extract significantly differ between species of experimental animals [J]., 2020, 43(12): 1335-1346.
[93] 臧晓明, 景彩, 肖宁, 等. 基于16S rDNA基因测序技术分析不同身体质量指数人群的肠道菌群结构差异 [J]. 中华中医药杂志, 2021, 36(1): 451-455.
[94] 吕宁. 泻下药/补益药与肠道菌群相互作用的初步研究 [D]. 郑州: 河南中医药大学, 2019.
[95] 李寒冰, 董贝贝, 吴宿慧, 等. 人参与大鼠及人源肠道菌相互作用的差异研究 [J]. 中华中医药杂志, 2020, 35(6): 3113-3118.
[96] 李根林, 齐月娟, 李寒冰, 等. 基于UPLC法测定离体大鼠及人源肠道菌对三七中人参皂苷代谢的差异 [J]. 天然产物研究与开发, 2019, 31(7): 1203-1210.
[97] Zhang W, Qian S H, Qian D W,. Screening of intestinal bacterial metabolites of platycodin D using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry [J]., 2016, 44(4): 817-833.
[98] Zhang Y, Yao L L, Tang C P,. Qualitatively and quantitatively investigating the metabolism of 20()-protopanaxadiol-type ginsenosides by gut microbiota of different species [J]., 2021, 35(12): e5219.
[99] 唐岚, 傅璐璐, 沈丽婷, 等. 大鼠肠道菌群对三七总皂苷体外降解的研究 [J]. 中草药, 2018, 49(2): 396-399.
[100]黄东旭. 不同饮食方式下肠道菌群结构及粪便脂肪酸的关系 [D]. 哈尔滨:东北农业大学, 2019.
[101]肖炜. 不同膳食类型人群肠道来源发酵乳杆菌缓解炎症性肠病的差异效果探究 [D]. 无锡:江南大学, 2022.
[102]Wan J Y, Wang C Z, Zhang Q H,. Significant difference in active metabolite levels of ginseng in humans consuming Asian or Western diet: The link with enteric microbiota [J]., 2017, doi: 10.1002/bmc.3851.
[103]张小燕. 益生元干预对人参皂苷Rb1体内代谢的影响研究 [D]. 淮北: 淮北师范大学, 2020.
[104]Kim K A, Yoo H H, Gu W,. Effect of a soluble prebiotic fiber, nutriose, on the absorption of ginsenoside Rd in rats orally administered ginseng [J]., 2014, 38(3): 203-207.
[105]Kim K A, Yoo H H, Gu W,. A prebiotic fiber increases the formation and subsequent absorption of compound K following oral administration of ginseng in rats [J]., 2015, 39(2): 183-187.
[106]赵伟, 王扬眉, 潘迎捷, 等. 人工模拟胃肠道模型在食源性致病菌异质性研究中的应用进展 [J]. 食品科学, 2021, 42(23): 268-274.
[107]仝小林, 房敏, 高慧, 等. 2021年度中医药重大科学问题和工程技术难题 [J]. 中医杂志, 2021, 62(11): 921-929.
Research progress on metabolic transformation of traditional Chinese medicine saponins by intestinal flora
HAN Bing, LI Jing-na, LV Xi-yu, CHEN Ming-yue, DU De-feng, LI Fei, ZHANG Chao
College ofPharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
In recent years, the metabolic transformation of traditional Chinese medicine (TCM) saponins by intestinal flora has become a hot topic at home and abroad. The saponins of TCM are difficult to be absorbed directly in the intestine after oral administration, and their bioavailability is low. Metabolic enzymes produced by intestinal flora can participate in the metabolic transformation of saponins of TCM, making them produce low-polarity secondary glycosides, aglycones or other metabolites to play a pharmacological role. In this paper, the metabolic reaction of TCM saponins in intestinal flora, the intestinal flora involved in the metabolic transformation of TCM saponins, and the factors affecting the metabolic transformation of TCM saponins in intestinal flora were reviewed to provide theoretical guidance for the subsequent research on the metabolic transformation of TCM saponins in the intestine.
intestinal flora; saponins; metabolic transformation; metabolic enzymes; influencing factors
R284
A
0253 - 2670(2023)20 - 6922 - 11
10.7501/j.issn.0253-2670.2023.20.035
2023-04-21
国家自然科学基金资助项目(82274102);国家中医药管理局中药炮制技术传承基地项目(国中医药科技中药[2022]59号);2022年山东省研究生优质教育教学资源项目(SDYKC2022035);山东省2023年中医药高层次人才培育项目(鲁卫函[2023]143号)
韩 冰,女,硕士研究生,研究方向为中药新药与中药炮制原理。E-mail: 3390785865@qq.com
通信作者 张 超,男,博士,教授,从事中药新药与中药炮制原理研究。E-mail: tougaotcm@163.com
[责任编辑 王文倩]

