基于HPLC指纹图谱和多成分定量的玄参质量评价研究
孙庆妹,王琼晓,尤金玲,王洪珂,郭坤元,朱 波*,秦路平*
基于HPLC指纹图谱和多成分定量的玄参质量评价研究
孙庆妹1,王琼晓1,尤金玲1,王洪珂2,郭坤元3,朱 波1*,秦路平1*
1. 浙江中医药大学药学院,浙江 杭州 310053 2. 时珍堂巴东药业有限公司,湖北 恩施 444300 3. 湖北民族大学生物与食品工程学院,湖北 恩施 445000
建立玄参的HPLC指纹图谱及多成分定量测定方法。采用HPLC法建立浙江、湖北、四川、安徽等9个省份116批玄参指纹图谱,进行相似度评价,结合聚类分析(hierarchical cluster analysis,HCA)、正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)对玄参进行化学模式识别分析。同时对8个活性成分(桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷)进行含量测定,分析其与生境因子的相关性。建立了116批玄参的指纹图谱,相似度为0.746~0.997,共标定34个共有峰。聚类分析将116批玄参分为4类,OPLS-DA分析能有效地将3个传统道地产区玄参与非道地产区玄参进行区分(2>0.5)。不同产地玄参中化学成分含量存在差异,与海拔、经纬度存在相关性。建立的玄参HPLC指纹图谱及多成分含量分析方法稳定、可靠,结合化学识别模式可为玄参药材的产地判别及质量评价提供参考。
玄参;指纹图谱;桃叶珊瑚苷;哈巴苷;咖啡酸;对香豆酸;阿魏酸;类叶升麻苷;安格洛苷C;哈巴俄苷;化学模式识别;质量评价;相关性分析
玄参为玄参属植物玄参Hemsl.的干燥根,为“浙八味”之一[1-2]。玄参作为传统大宗药材,始载于《神农本草经》,被列为中品[3]。性微寒,味甘、苦、咸,具有清热凉血、滋阴降火、解毒散结的功效,常用于热病伤阴、舌绛烦渴、津伤便秘等症[4]。现代研究表明,玄参中含有环烯醚萜苷类、苯丙素苷类、有机酸类等成分,具有抗炎、抗肿瘤、抗氧化、保护心血管、保肝、解热、神经保护以及抑菌等作用[5-10]。
中药材产区直接影响药材的质量以及有效成分的含量,玄参传统道地产区为浙江、湖北、四川等地[11]。玄参种植广泛,因不同产地经纬度、海拔等生态因子的不同,进而导致不同产地间玄参有效成分的含量差异较大[12]。中药化学成分复杂,目前《中国药典》2020年版、《浙江省中药炮制规范》2015年版等对玄参有效成分检测仅包括哈巴苷、哈巴俄苷2个环烯醚萜苷类成分[1,13],而玄参中含有的苯丙素苷类以及有机酸类同样具有药理作用[14-17]。因此,研究不同产地玄参多成分含量的差异对保障药材质量、临床疗效以及规范化种植等具有重要意义。
指纹图谱技术能够体现有效成分的整体性、稳定性以及不同产地间的共有性,在成分鉴别、质量控制等方面应用广泛[18-21]。化学识别方法结合指纹图谱信息,能够快速筛选出不同产地差异性成分,达到区分质量差异的目的[22]。为了合理评价玄参的质量,本研究在玄参的主产地收集了116批玄参样品,采用HPLC法建立了玄参的指纹图谱,并测定了8个活性成分桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷的含量,结合聚类分析(hierarchical cluster analysis,HCA)、正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)和生境因子的相关性分析等,拟从化学角度阐明不同产地玄参的质量特征,为玄参产地判别、质量评价和资源利用提供依据。
1 仪器与试药
1.1 仪器
Waters e2695高效液相色谱仪(PDA检测器)(美国Waters公司);色谱柱Symmetry C18(250 mm×4.6 mm,5 μm)(美国Waters公司);KQ-300DV型数控超声波清洗器(昆山市超声仪器有限公司);CPA225D型电子分析天平(赛多利斯公司);超纯水仪(默克Millipore公司);SUS304型粉碎机(杭州泥宿科技有限公司);DHG-9080A型电热鼓风干燥箱(上海哈伟实业有限公司)。
1.2 试剂
桃叶珊瑚苷(批号B21238)、哈巴苷(批号B20481)、咖啡酸(批号B20660)、对香豆酸(批号B20335)、阿魏酸(批号B20007)、类叶升麻苷(批号B20715)、安格洛苷C(批号B20012)、哈巴俄苷(批号B20480)均购于上海源叶生物科技有限公司,以上对照品质量分数均≥98%。乙腈、甲醇(色谱级,美国天地公司),磷酸(上海麦克林生化科技有限公司)。
1.3 药材
116批玄参药材采集于浙江、湖北、四川、安徽、河南、陕西、湖南、重庆、山东9个省份,经浙江中医药大学张巧艳教授鉴定为玄参科植物玄参Hemsl.的根。样品信息见表1。
2 方法与结果
2.1 指纹图谱的建立
2.1.1 供试品溶液的制备 将洗净后的玄参根切片,置于60 ℃烘箱烘干至恒重,粉碎后过3号筛。精密称取玄参样品粉末0.5 g,置于具塞锥形瓶中,加入50%甲醇10 mL,密塞,摇匀,称定质量,室温静置1 h,超声提取(300 W,40 kHz)45 min,放冷,再称定质量,用50%甲醇补足减失之量,摇匀,离心(12 000 r/min、5 min),取上清液,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.2 对照品溶液的制备 精密称取各对照品适量,加甲醇制成桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷质量浓度分别为2.06、1.56、0.59、0.59、0.56、0.59、0.67、0.90 mg/mL的混合对照品溶液。
2.1.3 色谱条件 Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.03%磷酸水(B),梯度洗脱:0~8 min,5% A;8~20 min,5%~16% A;20~28 min,16%~24% A;28~38 min,24%~44% A;38~39 min,44%~5% A;39~44 min,5% A;体积流量1.0 mL/min;柱温35 ℃;进样量10 μL;程序变化波长:0~19 min,210 nm;19~44 min,280 nm。
2.1.4 精密度试验 精密称定玄参样品(S105),按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件连续进样6次,以分离度较好且峰面积较大的32号色谱峰哈巴俄苷为参照峰,计算各共有峰的相对保留时间与相对峰面积。结果表明各共有峰的相对保留时间以及相对峰面积的RSD值均小于3.0%,表明仪器精密度良好。
2.1.5 稳定性试验 精密称定玄参样品(S105),按“2.1.1”项下方法制备供试品溶液,分别于制备后的0、2、4、8、12、24 h按“2.1.3”项下色谱条件进样,以哈巴俄苷为参照峰,结果表明各共有峰相对保留时间以及相对峰面积的RSD值均小于3.0%,表明供试品溶液在24 h内稳定性良好。
2.1.6 重复性试验 精密称定玄参样品(S105),按“2.1.1”项下方法平行制备6份供试品溶液,按“2.1.3”项下色谱条件进样,以哈巴俄苷为参照峰,结果表明各共有峰相对保留时间以及相对峰面积的RSD值均小于3.0%,表明该方法重复性良好。
2.1.7 指纹图谱的建立 将116批玄参样品按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进样检测,记录色谱图。将116批色谱图导入“中药色谱指纹图谱相似度评价系统”,以S1为参照图谱,中位数为基准,时间窗口为0.5,得到116批玄参样品指纹图谱共有模式以及对照指纹图谱(图1、2)。经匹配后共标定34个共有峰,通过与混合对照品溶液色谱图比对共指认出8个色谱峰,其中5号峰为桃叶珊瑚苷、6号峰为哈巴苷、12号峰为咖啡酸、16号峰为对香豆酸、18号峰为阿魏酸、19号峰为类叶升麻苷、21号峰为安格洛苷C、32号峰为哈巴俄苷。
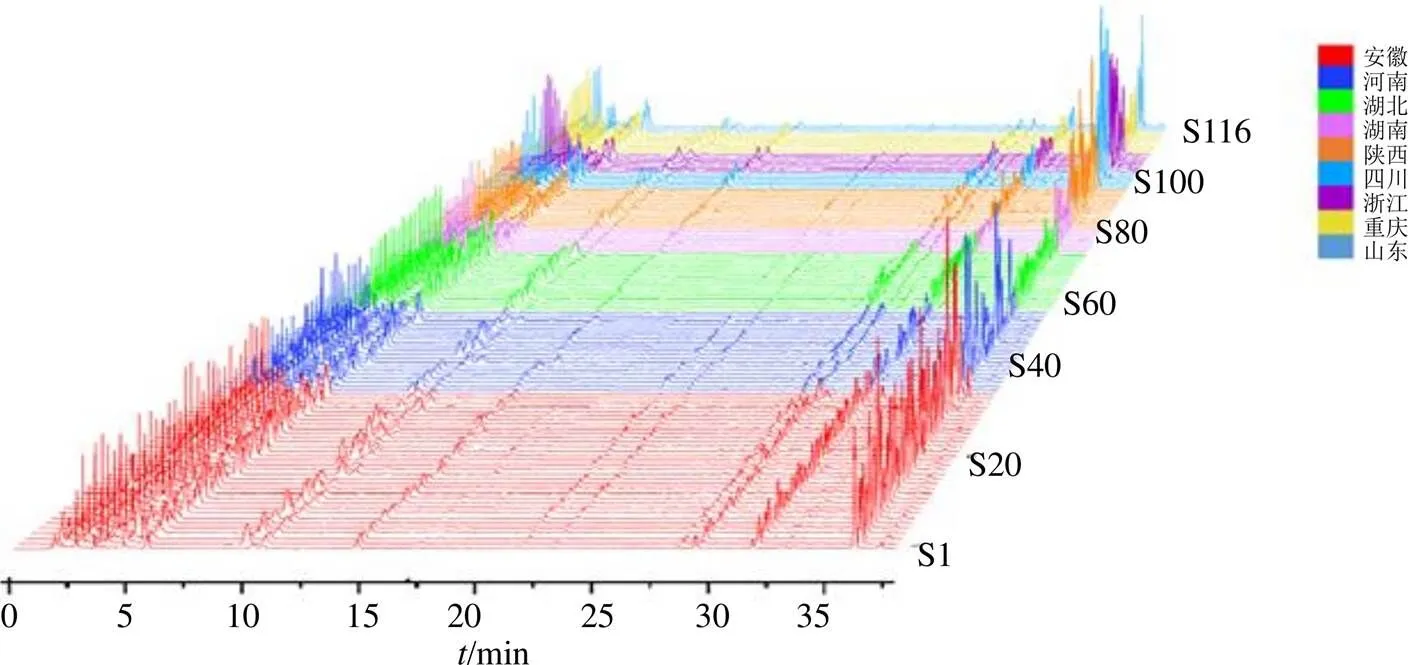
图1 116批玄参药材HPLC指纹图谱
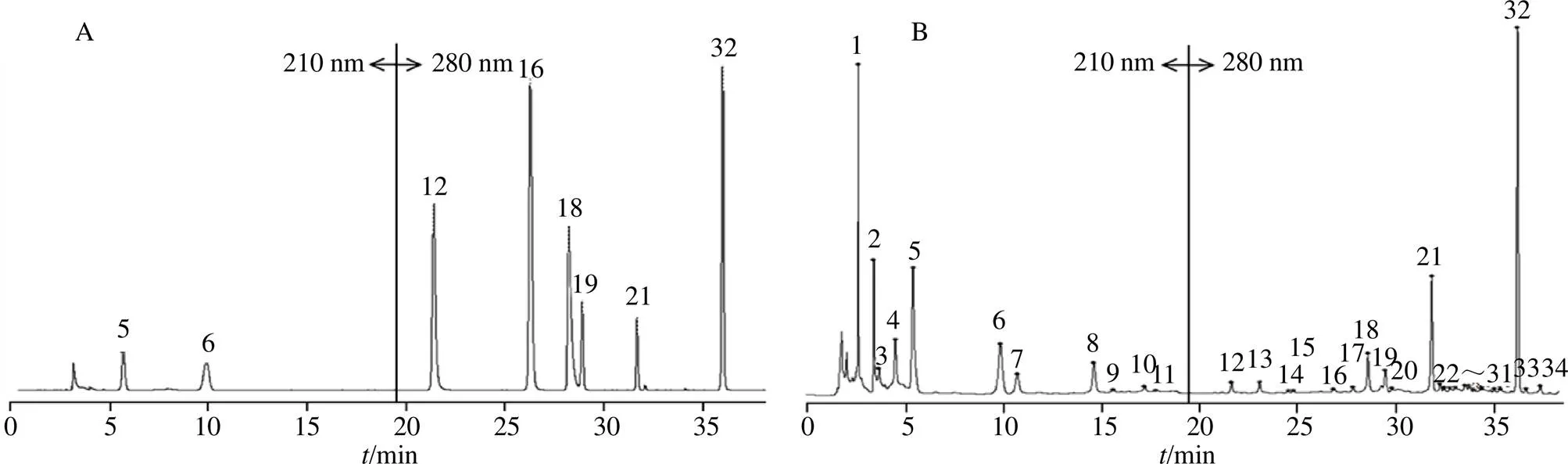
5-桃叶珊瑚苷 6-哈巴苷 12-咖啡酸 16-对香豆酸 18-阿魏酸 19-类叶升麻苷 21-安格洛苷C 32-哈巴俄苷
2.1.8 相似度分析 将116批玄参样品指纹图谱与对照图谱进行相似度评价,如表2所示,116批玄参样品相似度范围是0.746~0.997,不同产地间玄参样品整体化学成分类似,药材质量稳定,但可能由于受到环境因素影响,导致药材内在化学成分的含量存在一定差异。
2.2 化学模式识别分析
2.2.1 HCA 以指纹图谱中34个共有峰的峰面积为变量,应用SPSS 25.0软件,以平方欧式距离为区间,采用组间联接法进行聚类分析,结果见图3。116批玄参可以被分为4类,Ⅰ类包括S1~S28、S30~S83、S85~S94、S99~S116,Ⅱ类包括S95、S98、S29,Ⅲ类包括S96、S97,Ⅳ类包括S84。结果表明,不同产地玄参的质量存在一定地域差异性,除四川和陕西的个别产地外,其余产地的玄参具有一定的相似性。
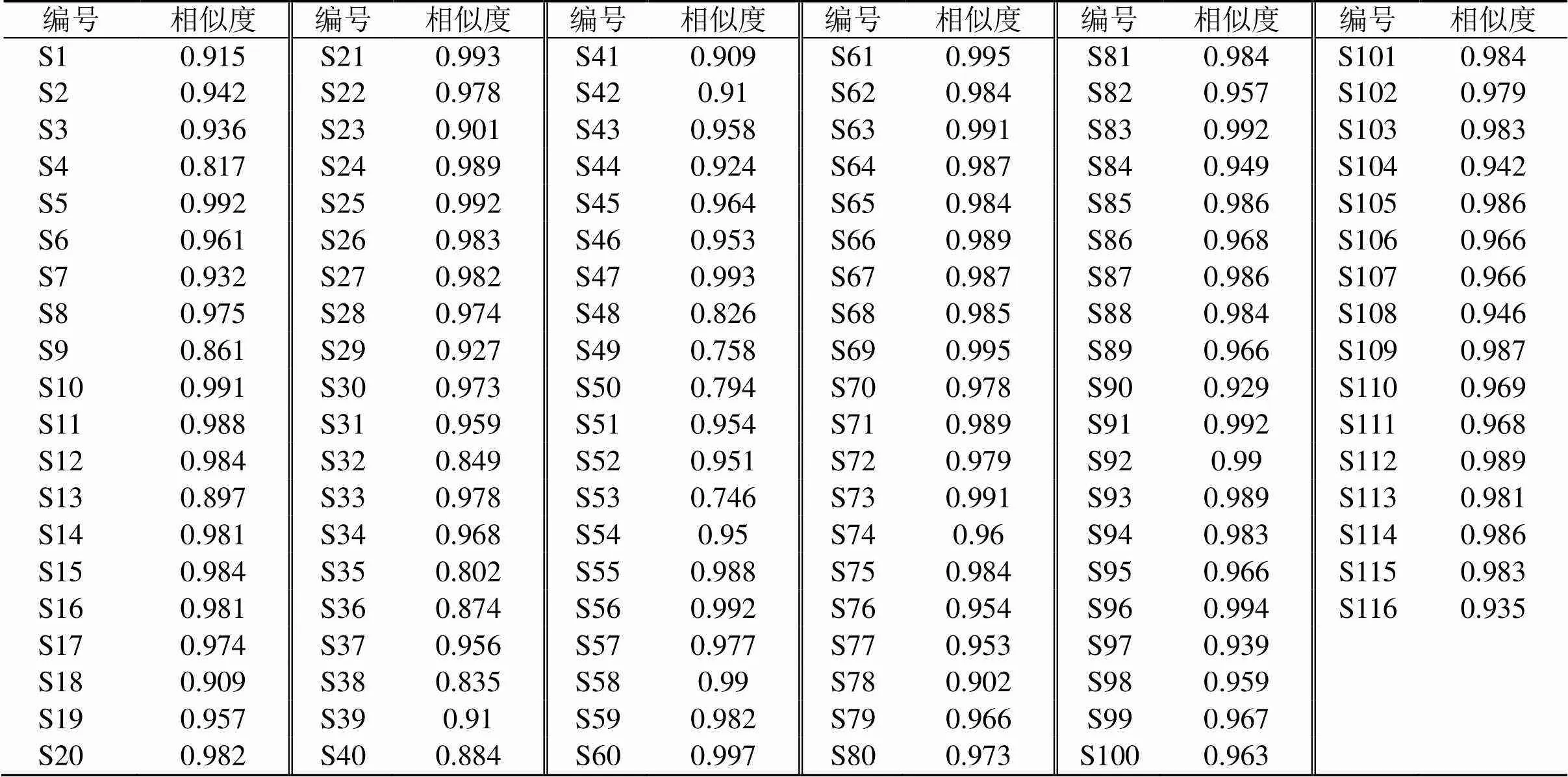
表2 116批玄参药材HPLC图谱的相似度
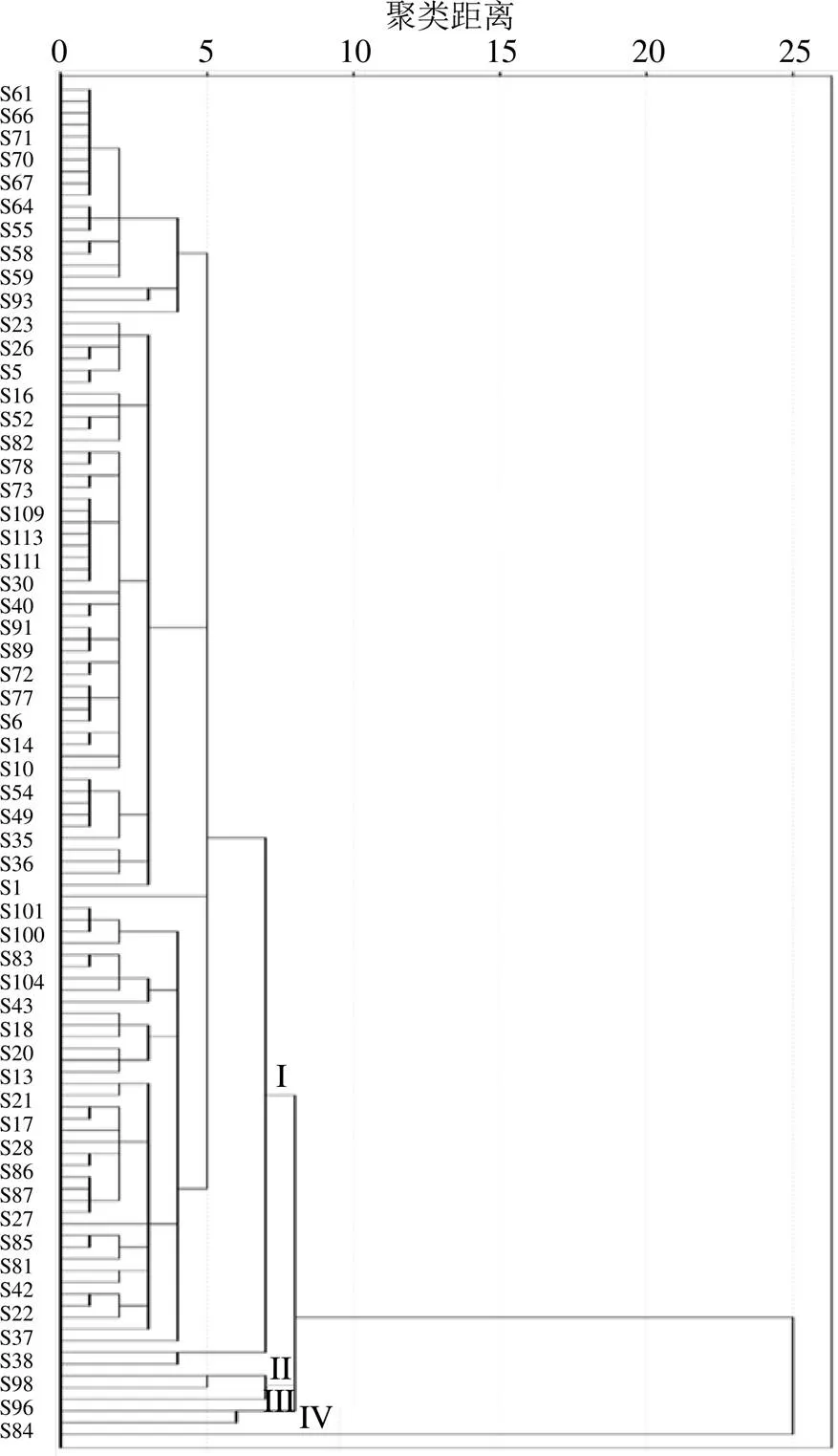
图3 116批玄参药材聚类树状图(仅显示部分产地)
2.2.2 OPLS-DA 为进一步分析浙江、湖北、四川传统道地产地与其他产地玄参的差异标志物,以116批玄参样品指纹图谱的34个共有峰峰面积为变量,应用SIMCA 14.1软件进行OPLS-DA分析,建立OPLS-DA模型,该模型2=0.796,Q2=0.576,均大于0.5,表明模型稳定可靠,可用于玄参传统道地产地与其他产地间的分析(图4)。结合变量重要性投影值(variable importance for the projection,VIP),以VIP>1筛选出差异成分,结果见图5,标记出贡献较大的成分,分别为峰32(哈巴俄苷)、峰5(桃叶珊瑚苷)、峰18(阿魏酸)、峰6(哈巴苷)、峰19(类叶升麻苷)、峰1、峰21(安格洛苷C)、峰4、峰2、峰8,以上成分是引起差异的主要标志性成分,故此,可为玄参多成分含量测定提供依据。
2.3 不同产地玄参药材8种成分含量测定
2.3.1 色谱条件及供试品溶液、混合对照品溶液的制备 同“2.1.1”“2.1.2”“2.1.3”项下方法。
2.3.2 线性关系考察 精密移取“2.1.2”项下混合对照品溶液适量,分别用甲醇稀释成不同质量浓度的对照品溶液,按照“2.1.3”项下色谱条件进样分析,以对照品溶液质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,以信噪比为10∶1计算定量限(LOQ),信噪比为3∶1计算检测限(LOD),结果表明各成分在浓度范围内线性关系良好,见表3。
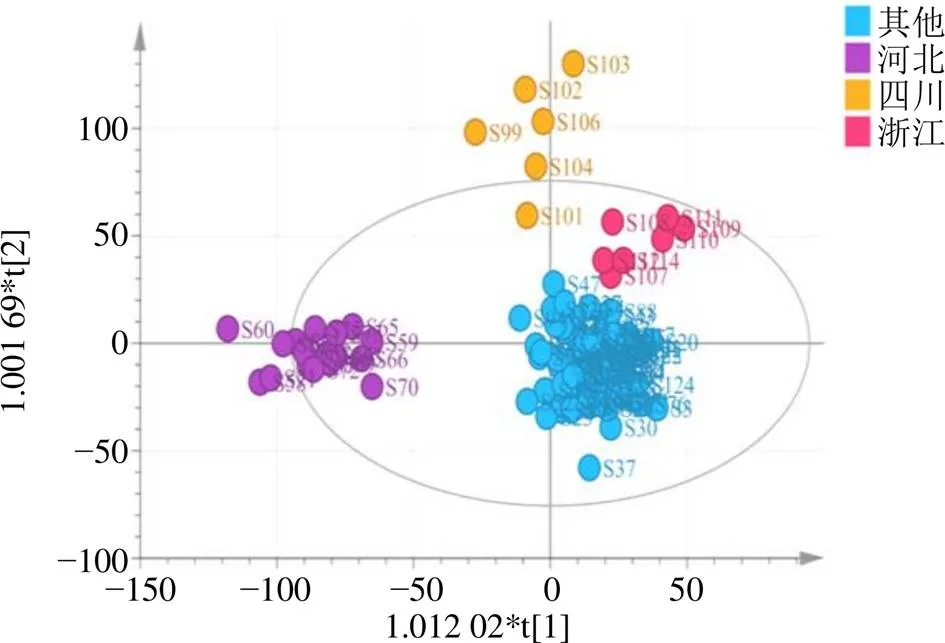
图4 不同产地玄参OPLS-DA散点图
2.3.3 精密度试验 精密移取“2.1.2”项下混合对照品溶液,按“2.1.3”项下色谱条件连续进样 6 次,记录峰面积,计算桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷的各成分峰面积的RSD值分别为0.66%、0.53%、0.21%、0.19%、0.33%、0.36%、0.16%、0.22%,表明该仪器精密度良好。
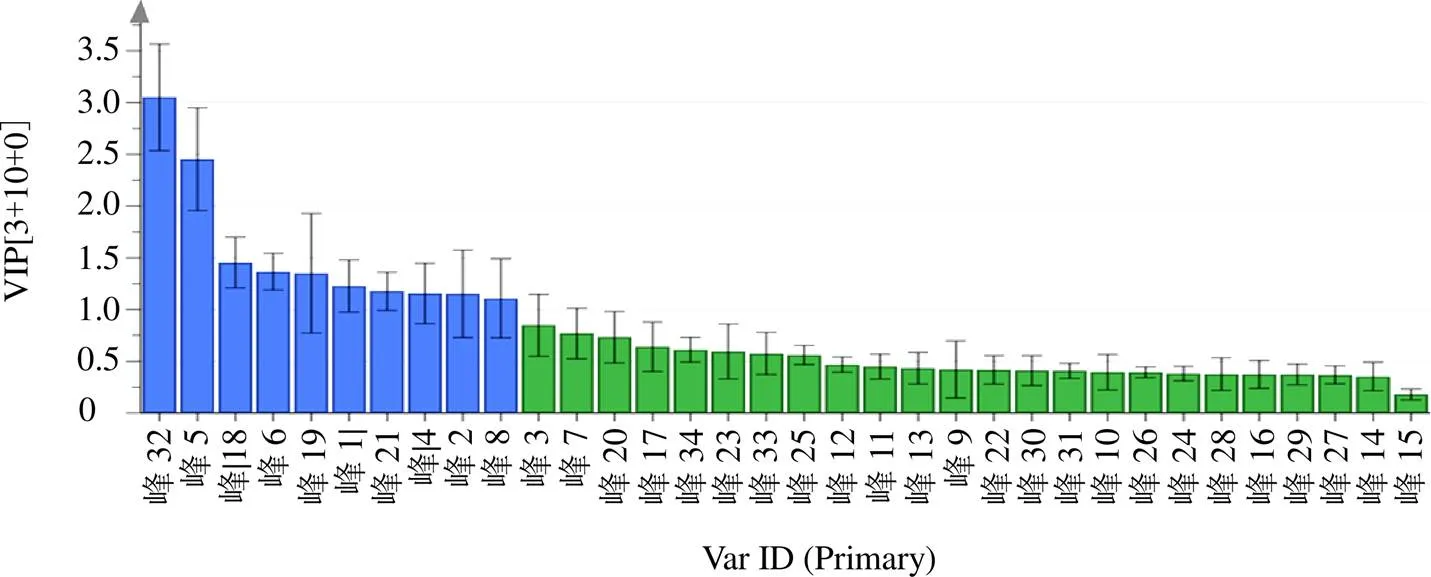
图5 116批玄参34个共有峰在OPLS-DA模型中的VIP值
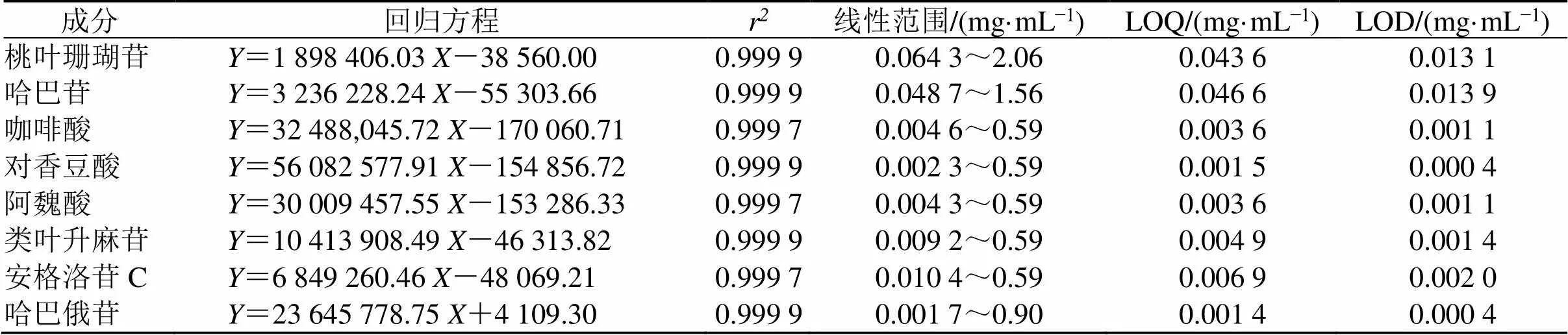
表3 线性关系考察
2.3.4 稳定性试验 精密称取玄参样品(S105),按照“2.1.1”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h按“2.1.3”项下色谱条件进样分析,记录峰面积,计算桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷的峰面积的RSD值分别为0.96%、0.31%、0.63%、0.90%、0.30%、1.71%、0.57%、0.65%,表明供试品溶液24 h内稳定性良好。
2.3.5 重复性试验 精密称取玄参样品(S105)6份,按照“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进样分析,记录峰面积,计算桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷的质量分数的RSD值分别为0.81%、0.24%、1.30%、1.43%、1.40%、1.63%、0.66%、0.64%,表明该方法重复性良好。
2.3.6 加样回收率试验 精密称取已知含量的玄参样品6份,每份0. 25 g,精密加入与样品含量相当的桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷对照品溶液,按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进样分析,计算各成分的加样回收率,结果桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷的加样回收率分别为99.79%、101.20%、99.22%、100.96%、98.74%、99.69%、101.02%、97.97%,RSD值分别为2.32%、1.63%、2.52%、4.04%、2.72%、2.99%、1.92%、0.99%。
2.3.7 样品测定 精密称取116批玄参样品,按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件进样分析,记录峰面积,计算8种化学成分在样品中的质量分数,平行重复3次,见图6。不同产地间8个成分的含量以及哈巴苷、哈巴俄苷的总量均存在显著差异(<0.01),桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷以及哈巴苷与哈巴俄苷总量平均含有量分别为24.905、9.500、0.199、0.054、0.527、1.199、4.392、3.409、12.908 mg/g,所有产地玄参中哈巴苷与哈巴俄苷总量在5.016~23.330 mg/g,均符合《中国药典》2020年版规定的哈巴苷与哈巴俄苷总量不低于0.45%的质量标准。湖北玄参中8个成分的总量整体较高,四川玄参次之。
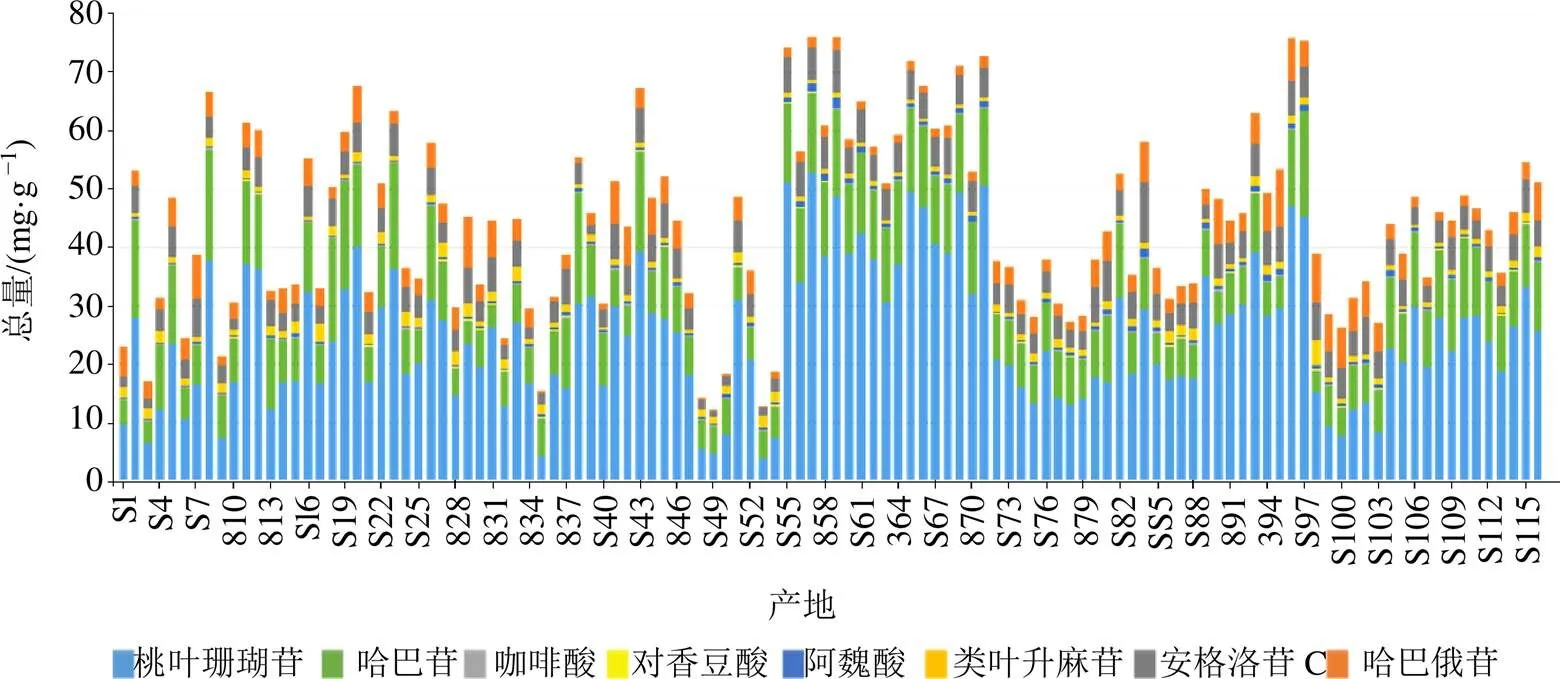
图6 不同产地间玄参药材中8种活性成分含量测定
2.4 生境因子相关性分析
对不同产地间有效成分含量与生境因子之间进行Pearson相关性分析,结果见表4。桃叶珊瑚苷、阿魏酸、安格洛苷C与海拔呈极显著正相关(<0.01),哈巴苷与海拔呈显著正相关(<0.05);咖啡酸、类叶升麻苷与海拔呈极显著负相关(<0.01)。咖啡酸与经度呈极显著正相关(<0.01);桃叶珊瑚苷、阿魏酸与经度呈极显著负相关(<0.01)。咖啡酸、类叶升麻苷与纬度呈极显著正相关(<0.01);阿魏酸与纬度呈极显著负相关(<0.01)。
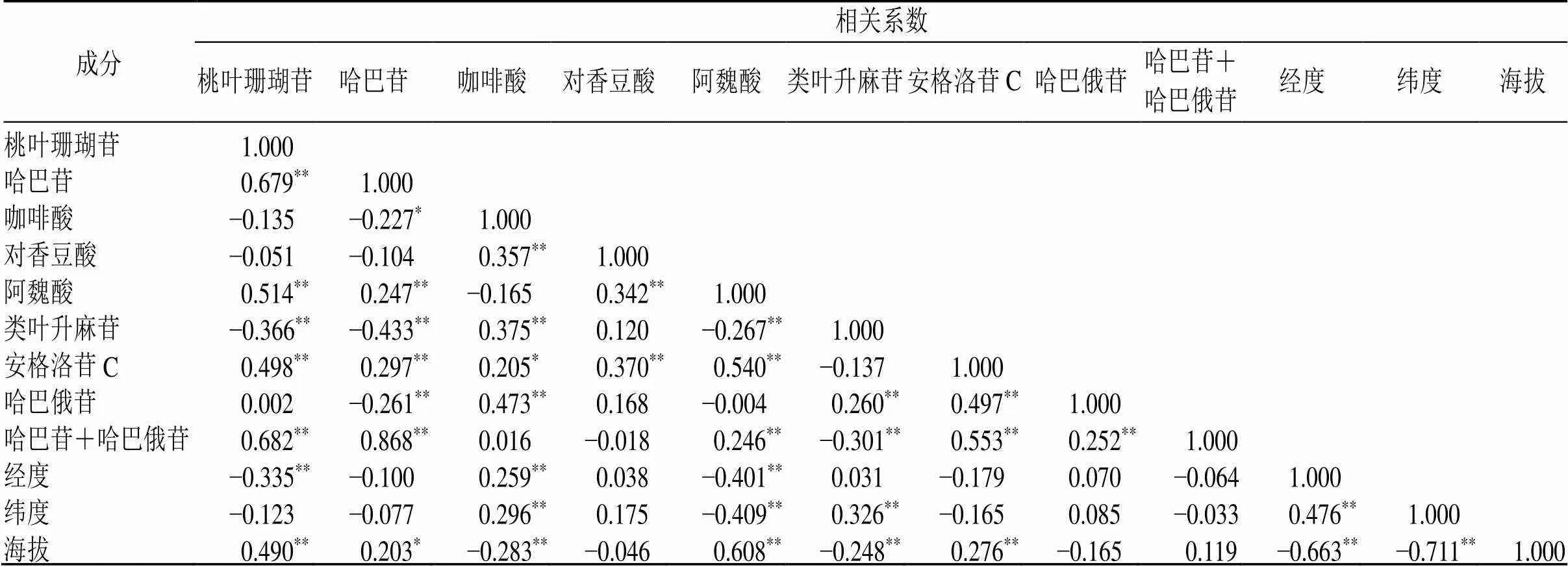
表4 玄参中8种活性成分与生境因子相关性分析
*表示在<0.05水平(双侧)上显著相关;**表示<0.01水平(双侧)上极显著相关
*Denotes significant correlation atlevel of< 0.05 (bilateral);**Denotes significant correlation at level of< 0.01 (bilateral)
3 讨论
对玄参样品提取方式(超声、旋蒸)、不同体积分数(50%、80%)甲醇以及不同料液比(1∶20、1∶40、1∶60、1∶80、1∶100)进行了综合考察。结果表明最佳提取条件为超声提取(300 W,40 kHz),50%甲醇,料液比为1∶20。通过HPLC全波长扫描分析发现,相较于单一波长,在双波长切换(0~19 min,210 nm;19~44 min,280 nm)的条件下色谱基线平稳,色谱峰分离度较好,可兼顾各个色谱峰的吸收波长,获取更多的色谱峰信息,能够较为全面地体现出玄参中的化学成分信息。
据考证,浙江、湖北、四川为玄参的传统道地产地[11]。玄参适应性较强,在平原、丘陵和低山坡均可栽培,所以玄参在我国多省份均有种植。仅从外观性状很难明确其产地来源和内在差异。市场上,传统道地产区的玄参与非道地产区玄参易混淆,常以次充好。因此本实验采集了湖北、浙江、四川传统道地产地以及安徽、陕西、湖南等其他产地共9个省份116批玄参样品,使取样具有全面性、代表性。OPLS-DA结果显示浙江、湖北、四川3个传统道地产地与其他产地样品可以明显分开。VIP值筛选出10个引起差异的主要成分,为含量测定成分的选择提供参考。含量测定结果表明,湖北玄参以及四川玄参8个活性成分的含量整体高于其他地区。
目前对玄参的质量控制研究着重于对环烯醚萜苷类成分的测定,《中国药典》2020年版中对玄参质量标准制定也仅限于哈巴苷和哈巴俄苷[23]。玄参主要成分为环烯醚萜苷类、苯丙素苷类和有机酸类等多元功效成分[24]。药理研究发现,环烯醚萜苷类和苯丙素苷类成分具有抗炎、保护心血管和保肝作用等药理活性[6, 25],有机酸类具有解热和神经保护的作用,对于常见的细菌如金黄色葡萄球菌、大肠杆菌等具有较好的抑制作用[10]。因此,选择文献报道较多的桃叶珊瑚苷、哈巴苷、咖啡酸、对香豆酸、阿魏酸、类叶升麻苷、安格洛苷C、哈巴俄苷以上8个活性成分进行含量测定,作为玄参质量评价的指标性成分是合理可靠的,可更加客观地评价药材质量。中药材特定的外观形状与其品质密切相关,性状特征是药材内含有效成分的外在体现[26]。因此,外观性状也是判断药材质量的重要指标,在后续的工作中,将考察玄参外观性状,并结合本实验化学成分综合评价玄参药材质量。
药用植物的生长环境包括经纬度、海拔等因素,其对次生代谢产物的积累起着非常关键的作用[27]。玄参药材原植物生长环境差别大,不同生境因子下玄参质量参差不齐,且在栽培过程中,栽培品系繁多混杂,严重阻碍了玄参产业的可持续发展。根据本实验中玄参8个成分含量与生境因子的相关性分析结果,可为以特定成分为目标性状的高含量玄参品种选育及栽培种植选择不同生境因子提供参考。综上,本实验较为系统地对全国主产区玄参药材资源进行收集,通过指纹图谱、含量测定以及化学模式识别的方法对不同产地玄参药材进行综合分析,阐明玄参药材质量特征,为玄参产地判别、质量评价和资源开发利用提供了参考依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 122-123.
[2] 黄雄, 黄嬛. 中药玄参的研究进展 [J]. 中医药导报, 2007, 13(10): 103-105.
[3] 刘树民, 张宁, 于卉, 等. 玄参性味的本草考证 [J]. 中华中医药杂志, 2017, 32(2): 429-431.
[4] 谢小艳, 夏春森. 中药玄参的化学成分及药理研究进展 [J]. 亚太传统医药, 2010, 6(5): 121-125.
[5] 季金玉, 张云, 丛晓东, 等. 玄参的化学成分及质量控制研究进展 [J]. 中华中医药学刊, 2010, 28(12): 2507-2510.
[6] 李医明, 曾华武, 贺祥, 等. 玄参中环烯醚萜甙和苯丙素甙对LTB4产生及血小板聚集的影响 [J]. 第二军医大学学报, 1999, 20(5): 301-303.
[7] 黄才国, 李医明, 贺祥, 等. 玄参中苯丙素苷对大鼠肝损伤细胞凋亡的影响 [J]. 中西医结合肝病杂志, 2004, 14(3): 160-161.
[8] 宋健. 玄参多糖对游泳小鼠力竭时间及糖储备的影响 [J]. 食品科学, 2009, 30(15): 217-219.
[9] 王锋, 王胜男, 朱小燕. 中药玄参研究进展[J]. 饮食保健, 2018, 42(5): 87-88.
[10] 刘应蛟, 楚世峰, 胡耀梅, 等. 玄参中阿魏酸和肉桂酸的含量测定及神经保护活性研究 [J]. 湖南中医药大学学报, 2018, 38(12): 1393-1397.
[11] 黄紫妍, 任丹, 王诗语, 等. 玄参的本草考证 [J]. 安徽农业科学, 2022, 50(4): 176-180.
[12] 王玲娜, 苏征, 刘星劼, 等. 金银花活性成分与生态因子相关性研究 [J]. 中国实验方剂学杂志, 2016, 22(17): 27-31.
[13] 浙江省中药炮制规范[S]. 2016: 26.
[14] Li Y M, Han Z H, Jiang S H. Fast repairing of oxidized OH radical adducts of dAMP and dGMP by phenylpropanoid glycosides fromHemsl [J]., 2000, 21(12): 1125-1128.
[15] 孙奎, 姜华. 玄参中苯丙素苷对肝细胞损伤保护作用的研究 [J]. 药学实践杂志, 2002, 20(4): 234-235.
[16] Hua J, Qi J, Yu B Y. Iridoid and phenylpropanoid glycosides fromHemsl. and their α-glucosidase inhibitory activities [J]., 2014, 93: 67-73.
[17] 许福泉, 许旭东, 陈士林. 玄参化学成分及药理活性研究进展 [J]. 中国现代中药, 2013, 15(9): 752-759.
[18] 王金艳, 冯娜, 刘艳芳, 等. 灵芝抱子粉中麦角举醇的测定分析及其脂溶性成分指纹图谱田[J]. 菌物学报, 2018, 37(9): 109-117.
[19] 张剑霜, 喻浩, 钟欣, 等. 冬虫夏草水提物HPLC指纹图谱及模式识别分析 [J]. 食品工业科技, 2018, 39(22): 219-224.
[20] 姚广哲, 马文娟, 贾琪, 等. 东北苦菜UPLC指纹图谱建立及化学模式识别 [J]. 中成药, 2020, 42(2): 392-396.
[21] 王宝林, 丘海芯, 甘金月, 等. 基于指纹图谱结合化学模式识别及多成分定量的千斤拔质量评价研究 [J]. 药物评价研究, 2022, 42(12): 2464-2472.
[22] Gao S M, Liu J S, Wang M,. Quantitative and HPLC fingerprint analysis combined with chemometrics for quality evaluation ofprocessed with different methods [J]., 2019, 11(2):160-168.
[23] 刘芳, 周小江, 袁志鹰, 等. 基于指纹图谱结合多指标测定的玄参药材等级质量研究[J]. 中草药, 2019, 50(5): 1238-1243.
[24] 袁培培, 赵真真, 周文杰, 等. 不同产地玄参饮片高效液相色谱指纹图谱及6种化学成分含量测定 [J]. 中南药学, 2019, 17(5): 641-646.
[25] 黄才国, 李医明, 贺祥, 等. 玄参中苯丙素苷对大鼠肝损伤细胞凋亡的影响 [J]. 中西医结合肝病杂志, 2004, 14(3): 160-161.
[26] 张勇纯, 刘彦玲, 王铭爽, 等. 基于内在成分含量差异辨别玄参药材品质优劣可行性研究[J]. 中草药, 2022, 53(2): 544-556.
[27] 张翠英. 云南玄参主要真菌病害病原菌鉴定及生物学特性研究[D]. 昆明: 云南农业大学, 2009.
Quality evaluation ofbased on HPLC fingerprint and multi-component content determination
SUN Qing-mei1, WANG Qiong-xiao1, YOU Jin-ling1, WANG Hong-ke2, GUO Kun-yuan3, ZHU Bo1, QIN Lu-ping1
1. School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2. Shizhentang Badong Pharmaceutical Co., Ltd., Enshi 444300, China 3. College of Biological and Food Engineering, Hubei Minzu University, Enshi 445000, China
To establish the HPLC fingerprint and multi-component content determination method offrom different origins.The fingerprints of 116samples from nine provinces, including Zhejiang, Hubei, Sichuan, Anhui, Henan, Hunan, Shanxi, Chongqing and Shandong, were established by high performance liquid chromatography (HPLC), while their similarity was evaluated. Chemical pattern recognition ofwas studied by hierarchical cluster analysis (HCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA). The contents of eight active ingredients were determined and their correlation with habitat factors was analyzed.The fingerprints of 116samples were established with similarities ranged from 0.746 to 0.997, and a total of 34 common peaks were identified. According to HCA, the samples were divided into four groups, and OPLS-DA can be used in distinguishing three traditional production origins offrom non-traditional production origins (2> 0.5). There were differences in the chemical component contents offrom different production origins, while the contents were correlated with altitude, latitude and longitude.The HPLC fingerprint combined with the simultaneous determination of multi-component content analysis method established in this study is stable and reliable . The fingerprint combined with the chemical pattern recognition can provide a basis for the identification of origins and quality evaluation of.
Hemsl.; fingerprints; aucubin; harpagide; caffeic acid;-coumaric acid; ferulic acid; cimicifugate like glycoside; angoroside C; habagoside; chemical pattern recognition; quality evaluation; correlation analysis
R286.2
A
0253 - 2670(2023)20 - 6827 - 09
10.7501/j.issn.0253-2670.2023.20.026
2023-02-03
浙江省重点研发项目(2021C04029)
孙庆妹(1997—),女,硕士研究生,研究方向为中药材质量评价。E-mail: sunqingmei1018@163.com
通信作者:朱波(1986—),男,博士,副研究员,硕士生导师,研究方向为中药资源与植物内生菌。E-mail: zhubo@zcmu.edu.cn
秦路平(1966—),男,博士,教授,博士生导师,研究方向为中药资源与品质评价。E-mail: lpqin@zcmu.edu.cn
[责任编辑 时圣明]

