妊娠期糖尿病患者肠道菌群特征与妊娠期高血压疾病的关联研究
代愉恒,高畅,梁新袖,卢莎,3,华雯,郑钜圣*,胡文胜,3*
1.310008 浙江省杭州市妇产科医院
2.310024 浙江省杭州市,西湖大学生命科学学院
3.310008 浙江省杭州市,杭州师范大学附属妇产科医院
4.310053 浙江省杭州市,浙江中医药大学第四临床医学院
妊娠期糖尿病(gestational diabetes mellitus,GDM)不仅在短期内与围生期发病风险的增加相关,而且在未来会增加母亲和子代发生不良健康后果的风险,如代谢综合征、心血管疾病和肥胖症[1]。最新的系统综述和荟萃分析显示我国GDM的总体患病率约为14.8%[2]。同样作为妊娠期常见的疾病之一,妊娠期高血压疾病(hypertension disorders of pregnancy,HDP)可严重危害孕妇健康及胎儿成长发育,可导致早产、死产等不良结局,在我国的发病率为6%~8%,而美国疾病控制与预防中心提供的数据显示近年在分娩住院期间发生的孕产妇死亡中,31.6%存在HDP记录[3-4]。GDM与HDP拥有共同的风险因素,如BMI增加、胰岛素抵抗和空腹高血糖[5]。一项大型前瞻研究表明,患有GDM的妇女在妊娠后患高血压的风险显著增加[6],而二者在妊娠期的共同存在可引发更严重的不良妊娠结局[7]。已有研究显示,GDM和HDP的独立发生、发展伴随着肠道菌群的改变,且细菌的丰度和炎症指标存在强相关性[8-9]。目前GDM并发HDP的发病机制尚不明晰,且较少有研究区分单独存在GDM与GDM合并HDP两类人群肠道菌群的差异。因此,本研究拟探讨在GDM人群中母体孕中期肠道微生物群与并发HDP的关系,从而从微生态结构的角度为GDM合并HDP的发病机制探究提供参考。
1 对象与方法
1.1 研究对象
本研究选取2019年8月—2020年1月在杭州市妇产科医院行产前检查的孕妇,孕前无高血压病史,在妊娠24~28周期间被确诊为GDM,并在全妊娠期均未被诊断为HDP的孕妇作为GDM组。同时选取同期在杭州市妇产科医院行产前检查并被确诊为GDM,同时患有HDP的孕妇作为GDM合并HDP组,HDP包括妊娠期高血压、子痫前期、子痫、妊娠合并慢性高血压等,被确诊为其中任一项即归为GDM合并HDP组。纳入标准:(1)年龄为20~40岁;(2)单胎妊娠;(3)产检资料完整。排除标准:(1)妊娠前存在糖尿病;(2)多胎妊娠;(3)合并其他严重器质性病变或者自身免疫性疾病等;(4)3个月内有抗生素、免疫毒性药物、激素拮抗剂和大剂量益生菌服用史。入组孕妇均由本人签署知情同意书,本项目已通过杭州市妇产科医院伦理委员会审批(2018-009-01)。
1.2 研究方法
1.2.1 相关诊断标准及定义:妊娠24~28周的孕妇经由75 g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),空腹及OGTT 1、2 h的血糖值应分别低于5.1、10.0、8.5 mmol/L,任何一项血糖值达到或超过以上标准即诊断为GDM[10]。HDP诊断标准参考《妊娠期高血压疾病诊治指南(2015)》[11]。
1.2.2 临床资料收集:记录入组孕妇年龄、身高、体质量、孕前BMI、基线孕周、家庭总年收入和受教育程度。
1.2.3 炎症指标检测:取入组孕妇的空腹静脉血后,采用全自动血细胞分析仪(迈瑞,型号BC-6900)检测白细胞计数、淋巴细胞计数、嗜酸粒细胞计数、中性粒细胞计数、嗜碱粒细胞计数和单核细胞计数,并用酶联免疫吸附试验检测血清中超敏C反应蛋白。
1.2.4 粪便样本采集及肠道菌群检测:所有入组孕妇于妊娠24~28周留取空腹粪便标本,后置于-80 ℃保存。采用Qiagen公司Stool DNA提取试剂盒提取粪便DNA,以DNA为扩增模板,使用通用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物扩增16S rRNA基因的V3和V4区域;反应条件:94 ℃预变性3 min,随后进行18个循环(包括94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min,扩增序列经2%琼脂凝胶电泳测试检验质量。产物纯化使用Beckman Coulter Genomics公司的Agencourt AMPure XP回收试剂盒。
1.2.5 生物信息学分析:将等摩尔量的扩增产物汇集在一个试管中,汇集库的浓度由Qubit定量系统测定。扩增子测序在Illuimina MiSeq系统上进行,并通过Quantitative Insights into Microbial Ecology(QIIME)软件(1.9.0版)进行质量过滤。使用Greengenes数据库(13_8版)对扩增序列变体(Amplicon Sequence Variant,ASV)进行分类并注释,得到对应物种的丰度分布情况。为获取有效数据,滤过并删除了低丰度菌群(各水平覆盖率<10%,相对丰度<0.01%的菌)。
1.3 统计学方法
采用Stata 15和R 3.5.3软件进行统计学分析。经正态性分布和方差齐性检验后,连续变量以(±s)表示,组间比较采用双样本t检验;分类变量以人数(百分比)表示,组间比较采用Pearson's chi-squared检验。采用4个指标,包括Shannon熵、Observed features指数、Faith's PD(Faith's Phylogenetic Diversity)指数和Pielou均匀度指数计算α-多样性,并进行均一化处理。基于Bray-Curtis距离的主坐标分析(PCoA)和置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)(999次)观察不同组别间在ASV组成的β-多样性差异。采用LEfSe分析,对不同组别的孕妇肠道菌群科和属水平上的相对丰度进行比较。采用Logistic回归,在校正年龄、孕前BMI、基线孕周和产次的基础上,分析探索肠道菌群α-多样性与GDM合并HDP的关联。后采用Spearman秩相关分析探究肠道菌群与炎症指标的关联。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象基本特征
GDM组与GDM合并HDP组年龄、孕前BMI、基线孕周、产次、受教育程度比较,差异均无统计学意义(P>0.05)。GDM组与GDM合并HDP组家庭总年收入比较,差异有统计学意义(P<0.05),见表1。
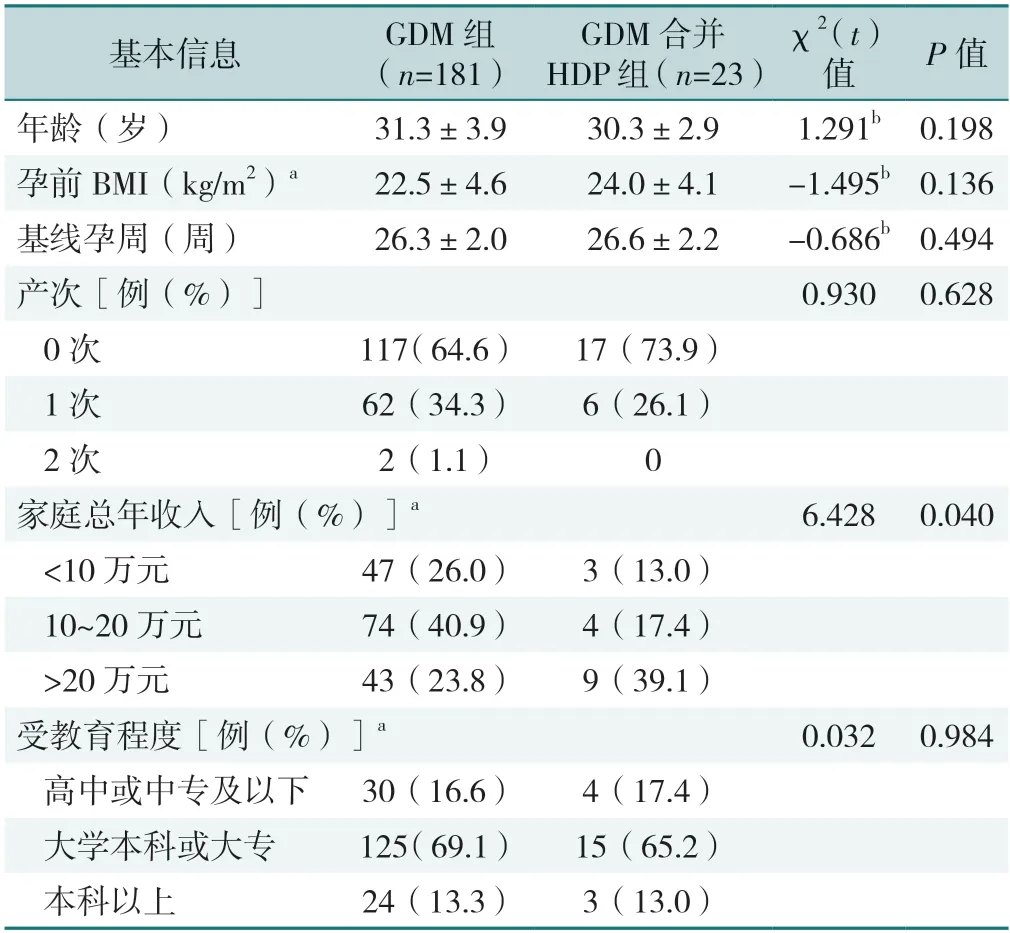
表1 研究对象基本特征Table 1 Basic characteristics of the participants
2.2 肠道菌群组成比较
2.2.1α-多样性分析:以GDM是否合并HDP(赋值:是=1,否=0)为因变量,以Shannon熵、Observed features指数、Faith's PD指数及Pielou均匀度指数4个α-多样性指标(皆为连续变量,赋值为实测值)为自变量,在校正年龄、孕前BMI、基线孕周和产次后进行Logistic回归分析,结果未发现与GDM合并HDP的显著相关的肠道菌群多样性指标(P>0.05),见表2。
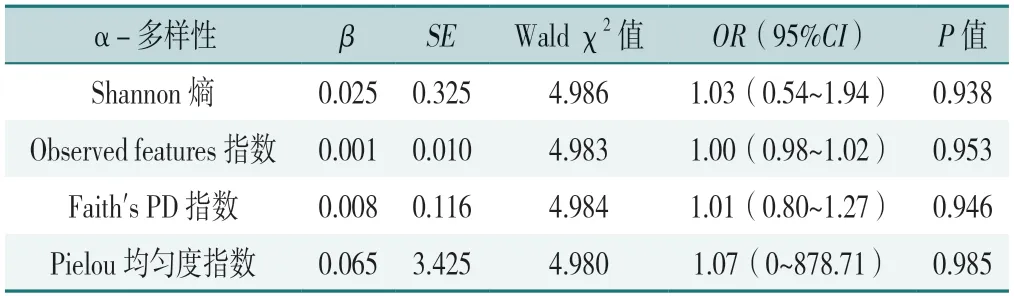
表2 肠道菌群α-多样性与GDM合并HDP关联的Logistic回归分析Table 2 Logistic regression analysis of the association between alphadiversity of gut microbiota and concurrent HDP in GDM
2.2.2β-多样性分析:PCoA分析显示,在属水平,主成分1和2的解释度分别为16.7%和11.6%,两组肠道菌群组成上比较,差异无统计学意义(P>0.05),见图1。
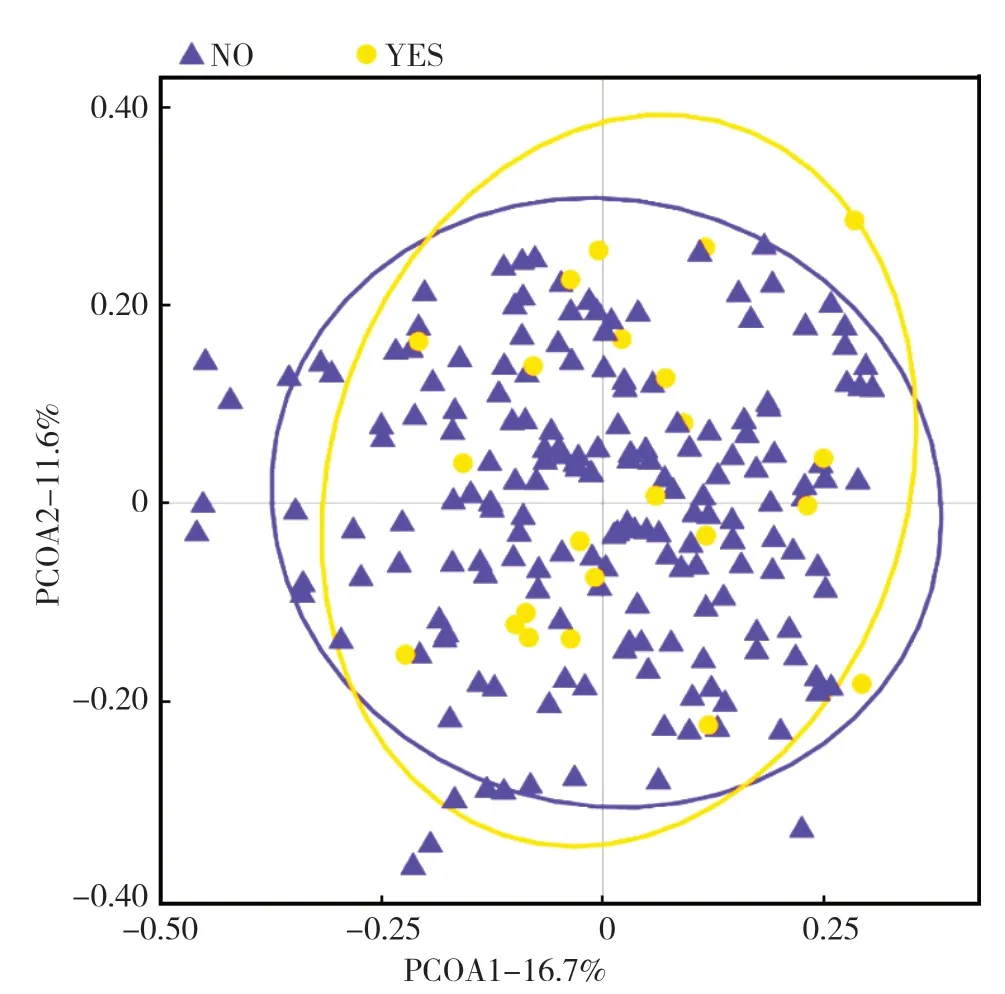
图1 肠道菌群β-多样性分析Figure 1 Beta-diversity analysis of gut microbiota
2.2.3 门水平分析:所有研究对象肠道菌群共检测出厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Protecobacteria)4个主要的门,其中Firmicutes在两组中占绝对优势。两组在主要门水平上的菌群相对丰度比较,差异均无统计学意义(P>0.05),见图2。
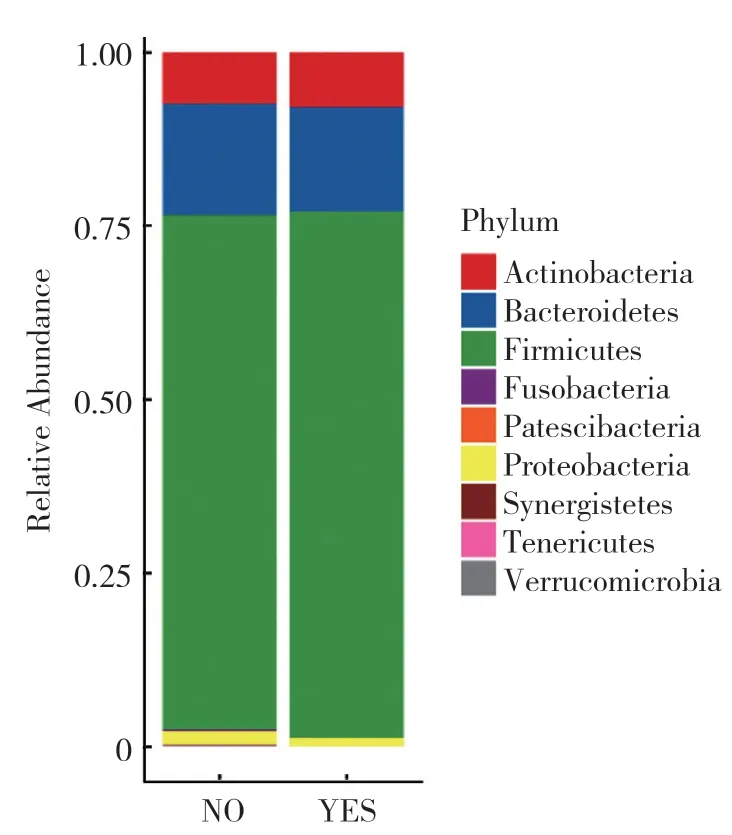
图2 肠道菌群门水平分析Figure 2 The analysis of gut microbiota at phylum level between the two groups
2.2.4 LEfSe分析:(1)科水平分析显示,与GDM组相比,韦荣氏菌科(Veillonellaceae)在GDM合并HDP组明显富集(P<0.05),而柔膜菌纲RF39未分类菌科(Mollicutes RF39 unclassified family)和毛螺菌科(Lachnospiraceae)的相对丰度降低(P<0.05);(2)属水平分析显示,与GDM组相比,小杆菌属(Dialister)、肠杆菌属(Intestinibacter)、真杆菌属(Eubacterium)和副萨特氏菌属(Parasutterella)在GDM合并HDP组明显富集(P<0.05);与GDM合并HDP组相比,嗜木聚糖真杆菌属([Eubacterium] xylanophilum group)、Ruminiclostridium 6、柔膜菌纲RF39未分类菌属(Mollicutes RF39 unclassified genus)和毛螺菌科未分类菌属(Lachnospiraceae unclassified genus)在GDM组明显富集(P<0.05),见图3。
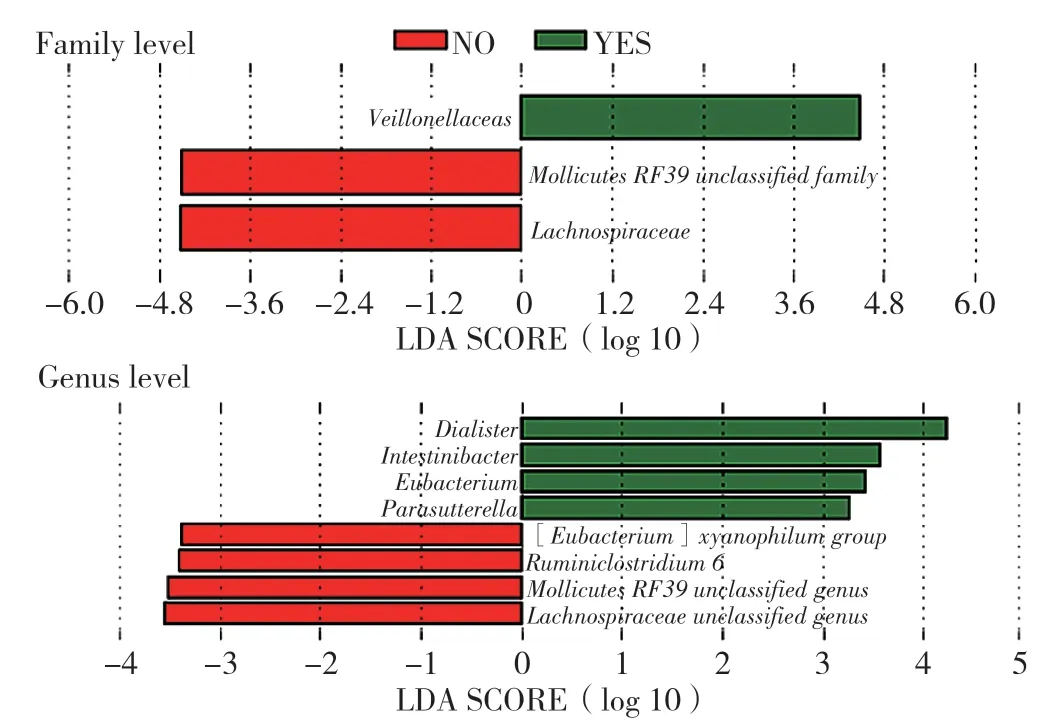
图3 两组肠道菌群科水平和属水平相对丰度比较Figure 3 Comparison of relative abundance of gut microbiota at family and genus levels between the two groups
2.3 肠道菌群与GDM合并HDP的Logistic回归分析
以GDM基础上是否合并HDP(赋值:是=1,否=0)为因变量,以2.2.4中组间差异有统计学意义的菌科和菌属的相对丰度为自变量(赋值:实测值),进行相同模型的Logistic回归分析,结果显示,Veillonellaceae、Dialister、Intestinibacter丰度上升是GDM孕妇合并HDP的独立危险因素(P<0.05);Lachnospiraceae unclassified genus丰度上升是GDM孕妇合并HDP的保护因素(P<0.05),见表3。
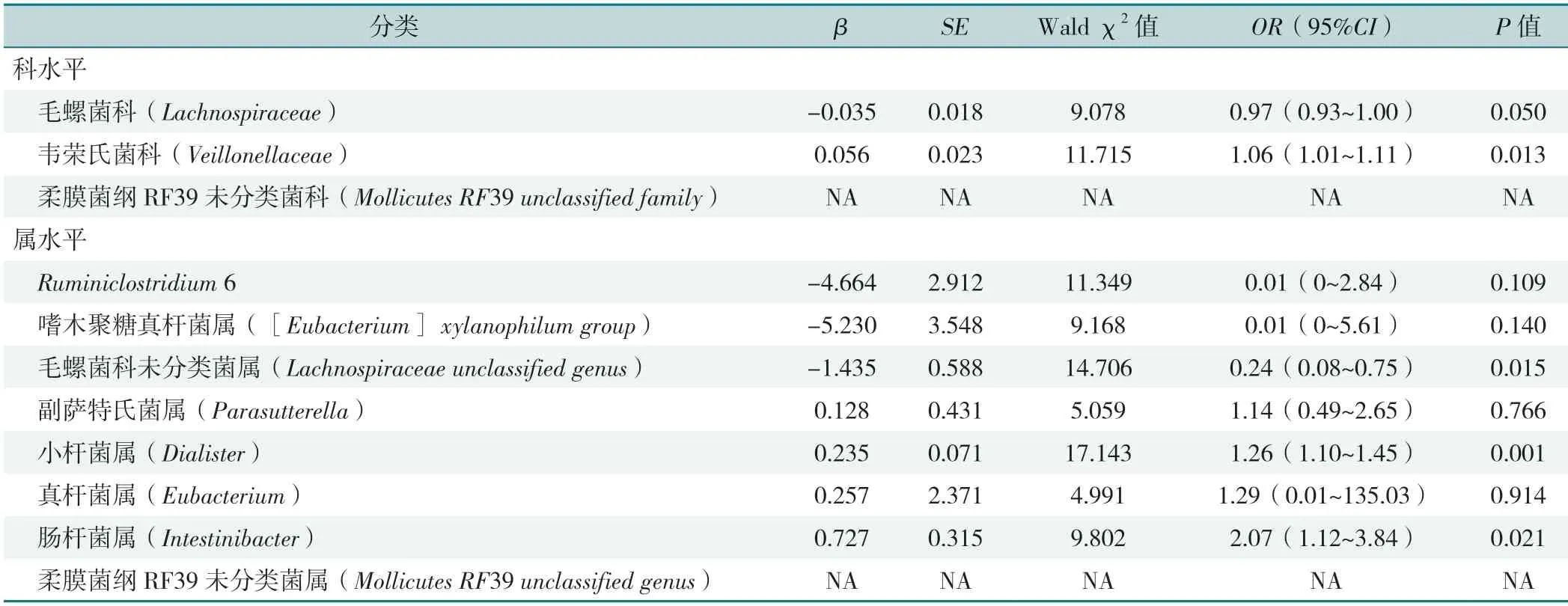
表3 肠道菌群科水平和属水平与GDM合并HDP的Logistic回归分析Table 3 Logistic regression analysis of gut microbiota at family and genus levels in relation to concurrent HDP in GDM
2.4 肠道菌群与炎症指标的相关性分析
基于2.3中Logistic回归筛选出的与HDP结局显著相关的科水平及属水平菌群与炎症指标进行Spearman秩相关分析,结果显示:Veillonellaceae与单核细胞比例呈正相关(P<0.05);Dialister与白细胞计数、嗜酸粒细胞比例、嗜酸粒细胞计数呈正相关(P<0.05),见表4。
3 讨论
GDM及HDP均为妊娠期常见的代谢并发症,GDM合并HDP可极大增加孕妇及子代近远期不良结局的风险。然而目前GDM及HDP的发病机制仍未完全阐明,大量研究证据表明肠道微生物的组成变化可作为GDM与HDP病理状态的生物标志物,肠道菌群在免疫系统乃至全身充当着重要的角色,可能在心血管疾病和代谢紊乱的发展中发挥着作用[12-15]。本研究中纳入的204例GDM孕妇的肠道菌群主要由4个门Firmicutes、Bacteroidetes、Actinobacteria、Protecobacteria组成,其中Firmicutes相对丰度最高,这与近几年针对GDM或HDP人群的同类菌群分析结果基本一致[8-9,12]。本研究结果显示,Veillonellaceae、Dialister及Intestinibacter丰度上升是GDM合并HDP的独立危险因素,而Lachnospiraceae unclassified genus丰度上升对于GDM合并HDP则呈现保护作用;并且Veillonellaceae和Dialister与机体炎症指标(如嗜酸粒细胞、单核细胞)存在显著正相关。
前期研究证明大鼠模型中Veillonellaceae与血压呈显著正向相关[16]。另一项研究表明,Veillonellaceae可诱导宫颈上皮细胞促炎反应,使促炎细胞因子和趋化因子分泌上调[17]。本研究结果与上述结论一致,即GDM合并HDP组孕妇较单纯GDM组肠道菌群中富集Veillonellaceae,并在Logistic回归结果中得到验证,且其丰度与单核细胞比例增加存在关联,提示Veillonellaceae与高血压表型及机体炎症可能存在着潜在的联系。既往研究证实Dialister作为脊柱关节炎疾病活动的微生物标志物,与肠道的炎症反应呈现强相关[18]。本研究发现,Dialister明显富集于GDM合并HDP组,Logistic回归分析得出Dialister丰度上升是GDM孕妇合并HDP不良妊娠结局的独立危险因素,该菌属更是与多个炎症指标(白细胞计数、嗜酸粒细胞比例、嗜酸粒细胞计数)显著相关,与既往研究基本一致[18]。
Lachnospiraceae unclassified genus属于著名的丁酸生产者Lachnospiraceae[19];短链脂肪酸,如丁酸,被证明有助于维持肥胖孕妇的正常血压,并可直接影响血管的张紧度[9]。不仅如此,丁酸盐还具有抗炎潜力,可抑制在炎症反应中发挥核心作用的核因子κB(NFκB)的激活,从而降低促炎细胞因子mRNA的表达[20]。本研究同样发现此菌对于GDM合并HDP呈现保护作用,即OR<1(P<0.05)。既往研究发现Intestinibacter在克罗恩病患者中富集[21],本研究发现其与GDM合并HDP有显著的正向关联。另一方面,在一项涉及508名健康男性的横断面研究中,炎症标志物(包括细胞间黏附分子1和白介素6)的浓度与血压之间存在显著的正相关[22]。由此,初步推测GDM患者菌群对并发HDP的可能影响机制如下:部分有益菌(如产短链脂肪酸的菌属)减少及促炎相关菌增多,从而导致肠道微生物的代谢物,如丁酸的生产能力下降,由此造成纤溶酶原激活物抑制剂1(PAI-1)水平分泌增加,继而引发机体炎症反应,伴随高血压和子痫前期的风险增加[9,23-24]。但是上述结论需要在进一步的机制研究和更大规模的人群研究中进行验证。
综上所述,Veillonellaceae、Dialister、Intestinibacter丰度上升是GDM孕妇合并HDP的独立危险因素,Lachnospiraceae unclassified genus丰度上升是GDM孕妇合并HDP的保护因素,其中Veillonellaceae、Dialister 与多项炎症指标呈正相关,提示差异菌可能通过改变机体炎症状态而对GDM合并HDP的发生、发展产生影响,但是仍有待后续开展更多相关研究进一步确定发病机制以及因果关系,以改善不良妊娠结局造成的影响。
本研究特别关注GDM患者这一群体特有的肠道菌群特征与常见并发症HDP之间的关联性,将16S rDNA测序的物种注释结果用于与GDM合并HDP的风险进行关联,提示了肠道菌群特征可作为GDM人群进行早期无创精准筛查HDP的良好指标之一,并启示肠道菌群的差异性富集与GDM并发HDP病理机制之间的潜在关联性。
作者贡献:郑钜圣进行文章的构思与研究的设计;高畅、梁新袖、卢莎、华雯进行数据收集及整理;梁新袖进行统计学处理;代愉恒、高畅负责撰写论文,进行结果的分析与解释;胡文胜进行论文的修订,负责文章的质量控制及审校。
本文无利益冲突。

