广东省稻水象甲生活史及越冬规律
袁龙宇, 雷浩霖, 李燕芳, 肖汉祥, 魏洪义, 张振飞,*
(1. 广东省农业科学院植物保护研究所, 广州 510640; 2. 广东省植物保护新技术重点实验室, 广州 510640;3.江西农业大学农学院, 南昌 330045)
稻水象甲Lissorhoptrusorvzophitus属鞘翅目(Coleoptera)象甲科(Curculionidae),是一种严重危害水稻生产的世界性检疫害虫;成虫取食水稻嫩叶的上表皮以及叶肉,影响水稻叶片光合作用;而幼虫取食水稻根部,造成植株断根、倒伏,严重影响水稻产量(谭文珠和黄凤翔, 2016)。国际自然保护联盟(International Union for Conservation of Nature, IUCN)已将其列为全球100种最具威胁的外来入侵生物之一(Grigarick and Beards, 1965),我国也将之列为水稻上重点检测的检疫性害虫(农业农村部, 2020)。稻水象甲原产于北美洲,20世纪70年代初,孤雌生殖型稻水象甲始传入亚洲日本,我国于1988年在河北省唐海县首次发现稻水象甲(方世凯等, 2008)。目前稻水象甲已扩散至我国23个省(自治区、直辖市)463个县(市或地区)(河江等, 2020)。2017年广东省首次在梅州市五华县安流镇发现稻水象甲,此后,梅州市平远县也报道了稻水象甲的发生。
在我国不同稻水象甲发生区,该虫发生世代数及越冬习性等明显不同,这对有效控制该虫的扩散危害带来了难度。在辽宁省东港市,稻水象甲每年发生1代(田春晖等, 1997),但在辽阳地区年发生1代并存在1个不完整世代的第2代(刘建武和陈雅丽, 2010),而在双季稻区的浙江省台州市年发生2代,但第2代虫源有限,对晚稻不构成威胁(林云彪等, 1997)。在越冬习性方面,该虫在辽阳地区主要集中在山坡的土堆里越冬,越冬时不取食,卵巢不发育(曲辉等, 1998);在滇中地区其主要集中在田埂的土堆里越冬,越冬时取食少量再生稻,卵巢发育等级低(峗薇等, 2011)。由于广东省处于我国亚热带和热带季风气候区,适于部分农作物害虫的终年繁殖(齐国君和吕利华, 2016)。因此,该虫传入广东省定殖后的生物学特性,是首先需要探明的重要问题。目前广东省尚无该虫生物学特性的研究报道。
基于此,本研究首先于广东省梅州市开展了稻水象甲的年生活史调查,同时结合室内笼罩饲养实验进一步明确其发生规律。其次,通过PCR技术检测和分析越冬稻水象甲成虫中肠内容物中的植物DNA,鉴别该虫越冬期间取食的植物种类,分析其在广东省潜在越冬生境。最后,使用特征序列扩增区(sequence characterized amplified region, SCAR)标记技术分析了稻水象甲越冬期的主要捕食性天敌。上述研究结果可为广东稻区稻水象甲疫情的有效防控提供理论参考。
1 材料与方法
1.1 材料
1.1.1供试昆虫:稻水象甲越冬成虫采自广东省梅州市平远县石正镇东台村(24.5272°N, 115.8366°E);该虫生活史研究的虫态采自广东省梅州市五华县双华镇潮塘村(23.7871°N, 115.8029°E)。
1.1.2仪器:Optika LAB-2 光学立体显微镜,Optika公司(意大利);VHX-S650E超景深显微镜,基恩士(中国)有限公司;Biometra TRIO三槽PCR仪,德国耶拿分析仪器股份公司;CAVOY Power BU多用途电泳仪,北京凯元盛世科技发展有限责任公司。
1.2 稻水象甲生活史调查
于2019年3-11月在广东省梅州市五华县和平远县发生区田间观察稻水象甲,采用五点调查法,随机调查25丛,观察水稻植株是否其上有稻水象甲成虫危害;之后,将受害水稻植株拔起,将水稻根部浸泡于装有饱和食盐水的塑料桶中充分搅拌,静置10 min后在桶中漂浮物中观察稻水象甲幼虫;最后,洗净稻株根部泥土观察其是否携带虫蛹,并剥开水稻茎秆检查虫卵。并在五华县双华镇潮塘村农田旁设置3个养虫笼(长×宽×高=50 cm×50 cm×70 cm),每个养虫笼移栽3丛水稻,每丛接入稻水象甲成虫10头;每10 d观察1次和记录该虫虫龄、数量、发育历期、卵巢发育等级及成虫取食斑。
1.3 稻水象甲越冬特性调查
1.3.1越冬生境调查:于2020年12月下旬在平远县的东台村和南台村(24.5272°N, 115.8366°E)以及五华县的潮塘村和桂岭村(23.8390°N, 115.8167°E)进行稻水象甲越冬生境调查。重点对调查点的稻桩、田埂、沼泽地、路边、坡地和林带等区域进行系统调查。采用目测观察法以及查土法,稻桩、田埂和沼泽地采用目测观察法,每种环境调查667 m2;路边、坡地和林带采用查土法,每种环境随机选择5个样点挖取长×宽=50 cm×50 cm以及深5 cm的土壤过筛后在阳光下观察是否有稻水象甲成虫。
1.3.2越冬期稻水象甲卵巢发育情况:取2020年12月越冬成虫和2021年4月水稻分蘖期于平远县的东台村和五华县潮塘村采集的成虫,放入PBS缓冲液中,在体视镜下用镊子先去除其鞘翅和膜翅,再轻轻将其腹部与胸部分离,从侧面用镊子撕开腹部背面薄膜,剔除消化道和脂肪体等非生殖器官的组织,即可看到完整的生殖器官,观察其卵巢发育程度并记录所含卵粒数,卵巢发育程度分级参考翟保平等(1999)。
1.3.3稻水象甲越冬寄主植物特异引物设计与检测灵敏度:选择李氏禾Leersiahexandraycf4(GenBank登录号:KF797362.1)、双穗雀稗PaspalumdistichumndhF(GenBank登录号: KF852892.1)和水稻OryzasativaAGL20(GenBank登录号: AY332476.1) 3个基因设计特异性引物(表1),以同生境内其他植物和饥饿处理的稻水象甲成虫DNA为对照验证引物特异性。结果表明,李氏禾LH-ycf4扩增效果明显,且条带单一清晰,扩增片段大小为216 bp。引物对同域其他3种植物DNA无扩增效果,物种特异性强;PD-ndhF对双穗雀稗扩增条带单一,扩增片段为247 bp,物种特异性强;OS-AGL对水稻DNA扩增效果单一,扩增片段为203 bp。引物对同域其他植物和稻水象甲成虫DNA无扩增效果,物种特异性强(图1)。

图1 PCR鉴定李氏禾ycf4(A)、双穗雀稗ndhF(B)和水稻AGL20(C)特异性引物的特异性Fig. 1 PCR identification of the specificity of specific primers of Leersia hexandra ycf4 (A),Paspalum distichum ndhF (B) and Oryza sativa AGL20 (C)M: DNA分子量标准DNA molecular weight marker; LH: 李氏禾 L. hexandra; PD: 双穗雀稗P. distichum; OS: 水稻 O. sativa; PO: 二歧蓼 Polygonim dichotomum; LO: 稻水象甲Lissorhoptrus oryzophilus. 图7同。The same for Fig. 7.
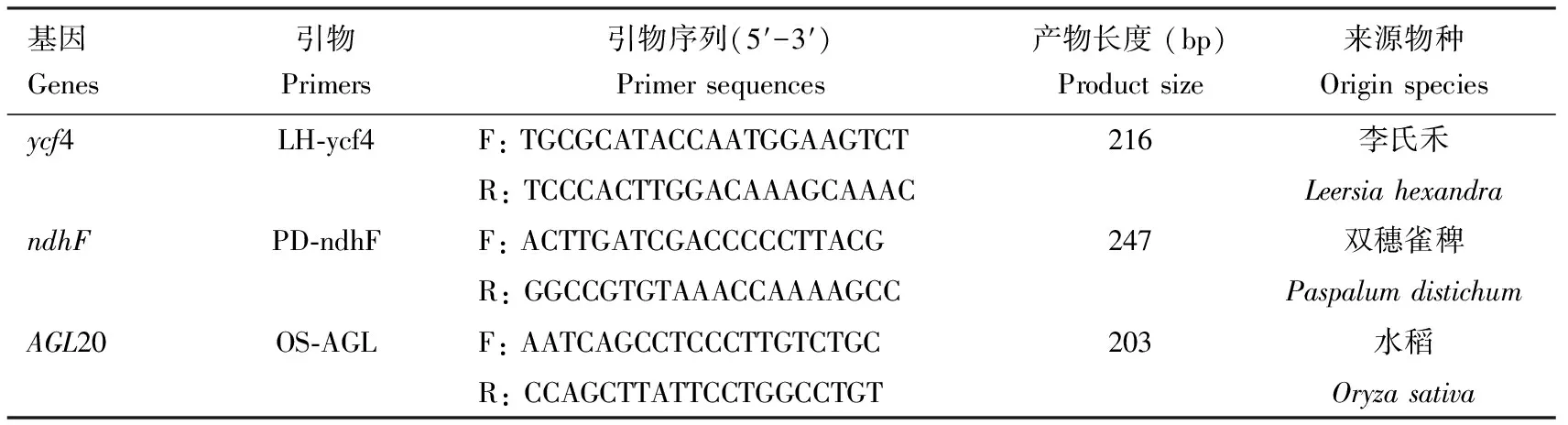
表1 本研究所用引物Table 1 Primers used in this study
植物特异性引物的灵敏性是稻水象甲肠道内容物检测的关键。将李氏禾DNA稀释成5个浓度的DNA样品,分别为10.160, 5.080, 1.016, 0.508和0.102 ng/μL;将双穗雀稗DNA稀释成5个浓度的DNA样品,分别为9.760, 4.880, 0.976, 0.488和0.098 ng/μL;将水稻DNA稀释成5个浓度的DNA样品,分别为10.389, 5.194, 1.039, 0.519和0.104 ng/μL;以不同浓度DNA样品为模板进行PCR扩增,使用凝胶电泳查看结果。结果表明,李氏禾DNA在0.102 ng/μL浓度下仍可检测出,灰度值为4 864.933;双穗雀稗DNA在0.098 ng/μL浓度下仍可检测出,灰度值为7 660.004;水稻DNA在0.104 ng/μL浓度下仍可检测出,灰度值为13 917.368(图2)。由此可知,这些引物的灵敏度很高,可用于稻水象甲寄主植物种类的鉴别。
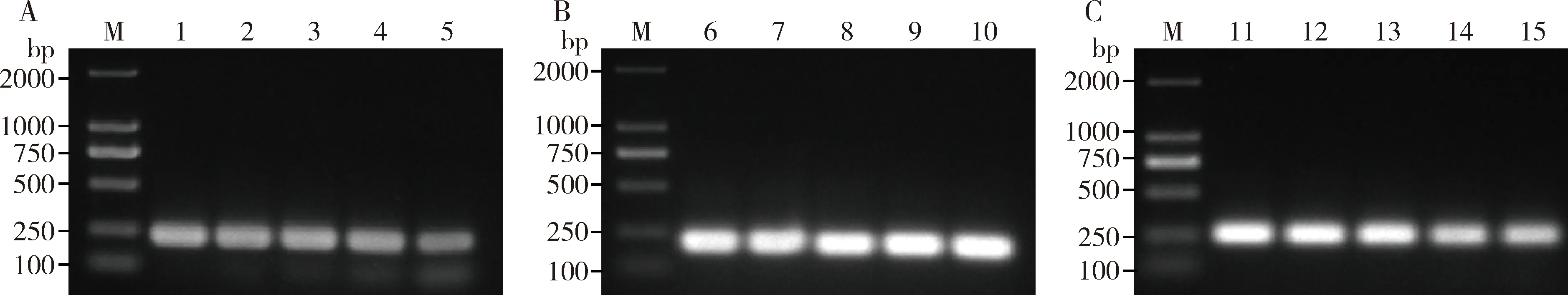
图2 PCR鉴定李氏禾ycf4(A)、双穗雀稗ndhF(B)和 水稻AGL20(C)特异性引物的灵敏度Fig. 2 PCR identification of the sensitivity of specific primers of Leersia hexandra ycf4 (A),Paspalum distichum ndhF (B) and Oryza sativa AGL20(C)M: DNA分子量标准DNA molecular weight marker; 1-5: 分别为10.160, 5.080, 1.016, 0.508 和0.102 ng/μL的李氏禾DNA (10.160, 5.080, 1.016, 0.508 and 0.102 ng/μL of DNA of L. hexandra, respectively); 6-10: 分别为9.760, 4.880, 0.976, 0.488和0.098 ng/μL的双穗雀稗DNA (9.760, 4.880, 0.976, 0.488 and 0.098 ng/μL of DNA of P. distichum, respectively); 11-15: 分别为10.389, 5.194, 1.039, 0.519 和0.104 ng/μL的水稻DNA(10.389, 5.194, 1.039, 0.519 and 0.104 ng/μL of DNA of O. sativa, respectively).
1.3.4越冬稻水象甲成虫中肠内容物检测:将12月越冬期采集的稻水象甲成虫在体视镜下解剖出中肠,使用动物基因组DNA提取试剂盒(北京擎科生物科技有限公司)提取中肠内的总DNA。以中肠总DNA为模板,使用寄主植物特异引物和GenStar 2×HiFiTaq PCR StarMix进行PCR反应。PCR反应体系(25 μL): PCR Mix 12.5 μL, DNA模板 1 μL, 正反向引物各1 μL, ddH2O 9.5 μL。PCR反应程序: 94 ℃预变性5 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 30个循环;72 ℃终延伸5 min。将反应产物作为模板再进行一轮巢式PCR反应,反应体系与条件同上。反应完成后使用2%琼脂糖凝胶电泳检测PCR产物。
1.3.5稻水象甲SCAR特异引物的设计与灵敏度检测:选择稻水象甲的COⅠ基因(GenBank登录号: KC510131.1)设计特异性引物(F: 5′-TCTCTCAT CGGAGATGACCA-3′; R: 5′-TGTCCATCCTGTACCT ACTCCT-3′),产物长度为246 bp。以同域内其他昆虫(稻象甲Echinocnemussquameus、大螟Sesamiainferens、二化螟Chilosuppressalis、台湾稻螟C.auricilius、稻纵卷叶螟Cnaphalocrocismedinalis、草地贪夜蛾Spodopterafrugiperda、斜纹夜蛾S.litura、稻苞虫Parnaraguttata、褐飞虱Nilaparvatalugens和白背飞虱Sogatellafurcifera)幼虫DNA为对照验证引物特异性。结果表明,引物对稻水象甲DNA具有明显的扩增且条带单一清晰,而对其他10种昆虫幼虫DNA无扩增效果(图3)。

图3 PCR鉴定稻水象甲COI引物在不同水稻害虫中的特异性Fig. 3 PCR identification of the specificity of COI primers of Lissorhoptrus orvzophitus in different rice pests insectsM: DNA分子量标准DNA molecular weight marker; LO: 稻水象甲成虫DNA(DNA of L. oryzophilus adults); LLO: 稻水象甲幼虫DNA(DNA of L. oryzophilus larva); ES: 稻象甲幼虫DNA(DNA of Echinocnemus squameus larva); SI: 大螟幼虫DNA(DNA of Sesamia inferens larva); CS: 二化螟幼虫DNA(DNA of Chilo suppressalis larva); CA: 台湾稻螟幼虫DNA(DNA of Chilo auricilius larva); CM: 稻纵卷叶螟幼虫DNA(DNA of Cnaphalocrocis medinalis larva); SF: 草地贪夜蛾幼虫DNA(DNA of Spodoptera frugiperda larva); SL: 斜纹夜蛾幼虫DNA(DNA of Spodoptera litura larva); PG: 稻苞虫幼虫DNA(DNA of Parnara guttata larva); NL: 褐飞虱幼虫DNA(DNA of Nilaparvata lugens larva); SFH: 白背飞虱幼虫DNA(DNA of Sogatella furcifera larva).
稻水象甲SCAR引物灵敏性是天敌肠道内容物检测的关键。将提取的稻水象甲DNA稀释成5个浓度的DNA样品,分别为 103.114, 51.557, 10.311, 5.156和1.031 ng/μL。以不同浓度DNA样品为模板进行PCR扩增,凝胶电泳查看结果。结果表明,在1.031 ng/μL浓度DNA仍可检测出,灰度值为3 682.154(图4)。由此可知,这些引物的灵敏度很高,可用于稻水象甲捕食性天敌物种检测。

图4 PCR鉴定稻水象甲SCAR引物的灵敏度Fig. 4 PCR identification of the sensitivity of SCAR primers of Lissorhoptrus orvzophitusSCAR: 特征序列扩增区Sequence characterized amplified region; M: DNA分子量标准DNA molecular weight marker; 1-5: 分别为103.114, 51.557, 10.311, 5.156 和 1.031 ng/μL稻水象甲成虫DNA (103.114, 51.557, 10.311, 5.156 and 1.031 ng/μL of DNA of L. orvzophitus adults, respectively).
1.3.6越冬生境蜘蛛肠道内容物检测:于12月在稻水象甲越冬生境采集游猎型蜘蛛,并将这些蜘蛛浸泡于无水乙醇中,使用1.2.3节中的DNA提取试剂盒提取成蛛腹部的总DNA。以提取的蜘蛛腹部总DNA为模板使用稻水象甲SCAR引物和GenStar 2×HiFiTaq PCR StarMix进行PCR反应。PCR反应体系(25 μL): PCR Mix 12.5 μL, DNA模板 1 μL, 正反向引物(0.5 μmol/L)各1 μL, ddH2O 9.5 μL。PCR反应程序: 94 ℃预变性5 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 30个循环;72 ℃终延伸5 min。将反应产物作为模板再进行一轮PCR反应,反应完成后使用2%琼脂糖凝胶电泳检测PCR产物。
1.4 数据分析
利用Office Excel整理分析稻水象甲发育历期;电泳图使用Adobe Photoshop处理;稻水象甲卵巢发育等级以及卵粒数使用Graphpad 8.0通过t检验进行分析。
2 结果
2.1 稻水象甲生活史
结合在梅州市五华县开展的笼罩观察实验和大田定点调查研究,发现稻水象甲在广东双季稻地区一年发生2代,具有越冬和越夏的习性。稻水象甲的生育期与水稻的生育期高度重合。水稻的分蘖期和拔节期是稻水象甲成虫主要发生期,也是水稻受害最严重的时期。通过室内饲养发现,稻水象甲幼虫共4 龄,幼虫发育需要20 d左右,且幼虫各龄期历期与虫龄呈正相关关系;蛹历期为(8.26±0.24) d;卵历期(7.26±0.05) d;成虫历期最长,为(110.26±0.46) d(表2),一个完整的世代需要(140.86±1.05) d(表2)。
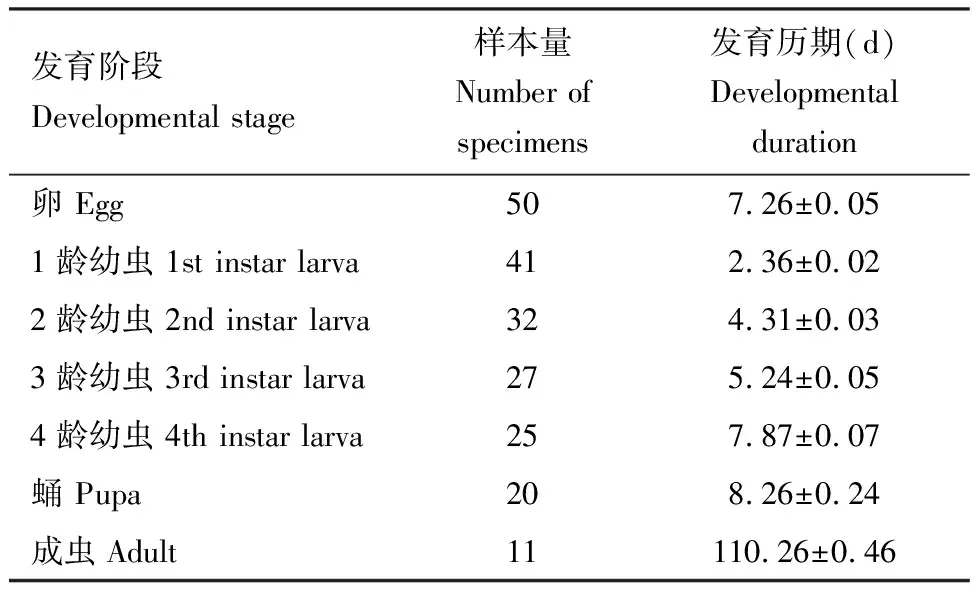
表2 广东省稻水象甲各发育阶段的历期Table 2 Duration of various developmental stages ofLissorhoptrus orvzophitus in Guangdong province
2.2 稻水象甲越冬特性
2.2.1稻水象甲越冬生境:2021年1月在平远县周正村、东台村和南台村以及五华县潮塘村和桂岭村总计约400 hm2水稻田附近可能的区域进行稻水象甲越冬生境调查,共采集样本15头,均在沼泽地内发现,并且不同沼泽地的虫态发育基本一致,表明沼泽地是广东稻水象甲成虫的越冬生境,越冬生境主要由水稻种植区、过渡带和越冬带组成(图5)。水稻种植区含有再生稻,过渡带有部分再生稻及禾本科杂草,越冬带常年有水且富含禾本科杂草。

图5 广东稻水象甲越冬生境实景(A)和越冬生境示意图(B)Fig. 5 Actual view (A) and schematic plot (B) of Lissorhoptrus orvzophitus overwintering habitats in Guangdong province
2.2.2越冬稻水象甲的卵巢发育:将稻水象甲越冬期(12月-翌年2月)和水稻分蘖期(3-4月)捕捉到的稻水象甲成虫带回实验室,解剖结果显示,越冬代成虫(2020年12月下旬至翌年2月下旬)的卵巢以Ⅰ级为主,2月中旬以前Ⅰ级卵巢占100%;稻水象甲在3月下旬取食杂草或秧苗,3月下旬卵巢开始发育为Ⅱ级,4月下旬开始出现Ⅲ级卵巢的高峰期(图6)。同时从图6可以看出,越冬期稻水象甲野外成虫的平均卵粒数均为0,水稻分蘖期田间稻水象甲的平均卵粒数为5粒/头。值得注意的是,稻水象甲的卵巢发育为逐级发育,解剖记录仅为中输卵管内的成熟卵粒数,未包括卵巢小管内未成熟和已产的卵粒。因此,单头稻水象甲的实际产卵量应大于解剖记录所得结果。在调查的100株水稻苗中,稻水象甲65%的产卵部位为水稻基部第1叶鞘,30%在第2叶鞘。田间调查产卵情况时,需注意水稻苗基部第1叶鞘部分。
2.2.3稻水象甲越冬取食植物:稻水象甲在广东地区的越冬生境(图5)的植物主要有双穗雀稗、李氏禾等杂草和部分残留再生稻,在这些植物上发现了稻水象甲的取食斑。为了确定稻水象甲是否取食上述几种植物,针对这几种植物设计了特异性引物,以进一步明确广东稻水象甲寄主植物种类。结果表明,从稻水象甲的越冬生境中提取的稻水象甲成虫中肠DNA样本中都检测到了水稻,李氏禾的检出率为42.86%,但均没有检测到双穗雀稗(图7)。由此说明,广东越冬稻水象甲取食水稻和李氏禾,且以水稻为主。
2.2.4稻水象甲越冬生境捕食性天敌:生境调查发现稻水象甲在广东地区的越冬生境中存在许多捕食性天敌。为了确定这些天敌是否捕食稻水象甲,设计了稻水象甲mtDNACOI特异性引物。以水稻上其他水稻害虫作为对照,验证了稻水象甲SCAR引物的特异性并分析了检测灵敏度(图3),最终使用PCR方法明确了广东稻水象甲的一种天敌——沟渠豹蛛Pardosalaura。
越冬生境内发现大量天敌,特别是游猎型蜘蛛沟渠豹蛛成蛛。因此用稻水象甲SCAR引物检测沟渠豹蛛成蛛肠道的DNA是否存在稻水象甲DNA残余,确定天敌对稻水象甲的捕食作用。图8凝胶电泳结果显示15 号泳道中的DNA条带清晰,说明14号样品的肠道中存在稻水象甲的 DNA。此结果证明沟渠豹蛛对稻水象甲具有捕食作用是稻水象甲的捕食性天敌之一。同时也证明,图5类型的越冬生境中确实存在稻水象甲。

图8 沟渠豹蛛成蛛肠道中稻水象甲DNA的检测Fig. 8 Detection of DNA of Lissorhoptrus orvzophitus in the intestinal tract of Pardosa laura adultsM: DNA分子量标准DNA molecular weight marker; LO: 稻水象甲成虫DNA DNA of L. oryzophilus adults; 1-16: 沟渠豹蛛成蛛腹部DNA DNA of the abdomen of P. laura adults.
3 讨论与结论
稻水象甲是我国水稻上唯一的检疫性害虫,严重威胁水稻生产,对粮食安全和生态安全有极高的风险,截止2015年全国已有23个省份报道发生(齐国君和吕利华, 2016), 2017年4月于梅州市五华县首次在广东省内发现稻水象甲疫情。但是由于我国幅员辽阔,地理环境差异较大,稻水象甲的发生世代会随着当地环境、气候和耕作制度等因素产生较大差异。因此亟需研究稻水象甲定殖广东的习性,并结合防控措施,科学精准地降低其危害。
广东稻水象甲发育历期有其特殊性,温度的差异导致广东地区稻水象甲的发育历期较其他地方更短,只需140 d左右,这也是其一年发生2个世代的主要原因。浙江省象山县第2代稻水象甲卵历期为8.1 d,幼虫历期为35 d(蔡灿等, 2002)。而广东省稻水象甲卵历期只有7 d,幼虫历期更短,只有20 d左右(表2)。广东稻水象甲全年有2个产卵繁殖期,产卵期主要处于早稻的分蘖期(3月下旬和4月中旬) 和晚稻的分蘖期(7月下旬和8月中旬)。而在贵州省滇中稻区稻水象甲全年只有1个产卵繁殖期,产卵期主要处于当地水稻的分蘖期(5月下旬和6月中旬)(尹艳琼等, 2019)。在浙江南方双季稻区一年也可发生2代(商晗武等, 2003)。稻水象甲在越冬期卵巢发育受到抑制,在越冬期卵巢发育等级为Ⅰ级(图6),而到了水稻分蘖期,稻水象甲迁入大田取食,卵巢快速发育,到4月中旬卵巢发育到Ⅲ级,能够开始产卵,卵巢卵粒数达到5粒/头。这一结果与贵州滇中地区稻水象甲在7月时的数据(尹艳琼等, 2019)一致。
广东稻水象甲的越冬模式为稻田-过渡带(草地)-沼泽地(水草丰盛)(图5)。沼泽地为其主要的越冬生境,目前没有在稻田附近土层内发现稻水象甲,这可能与其对温度、水及过渡寄主植物的依赖性较高有关。杨茂发等(2013)研究发现稻水象甲越冬成虫在水中的行为时间分配超过40%。稻水象甲越冬代成虫随着气候变暖等适宜条件开始出来取食,先取食田埂及周边荒地的杂草,7月中旬以及8月上旬再转移到水稻上为害。广东稻水象甲主要在沼泽地过渡寄主植物再生稻、李氏禾上越冬(图7)。这一点与贵州、辽宁等地稻水象甲的发生特点不同,贵州稻水象甲成虫越冬的主要场所是稻田附近的沟(河)边表层土壤、田埂的表层土壤中(峗薇等, 2011)。而在辽宁省稻水象甲成虫的越冬场所主要在山坡、荒草格、林带的土壤中,土壤上面还常常覆盖大量或较厚的杂草以及残叶,有一定的保暖性能,是辽宁省第2年大量虫源的主要来源(曲辉等, 1998)。稻水象甲在长春地区主要在稻田周围向阳地带的田埂土壤中群集越冬,草皮下的土壤中居多(朱晓敏等, 2005)。产生如此差异的原因主要是在温度上,广东地区冬季温度常年在5 ℃以上,稻水象甲不需要进入土壤之中进行保温,而且在广东的越冬地还存在大量禾本科替代寄主植物,可维持稻水象甲越冬时期的能量需求。
目前,使用特异性引物检测昆虫体内DNA是最简单快捷的诊断PCR技术。本研究利用SCAR标记技术,采集了稻水象甲越冬地多种不同的水草,设计这些水草的SCAR特异性引物(图4)。Staudacher等(2011)根据玉米和小麦的trnL序列开发出了玉米和小麦的特异性引物,并通过实验证明金针虫在取食后72 h内都可通过PCR检测到植物DNA。本研究从稻水象甲成虫中肠中发现稻水象甲在越冬时期主要取食的寄主植物是水稻和李氏禾(图7)。越冬生境寄主植物种类的研究,可以为稻水象甲越冬防控提供理论基础。
同样,运用分子标记的方法对天敌肠道内害虫残体进行检测,具有操作简便,反应灵敏的特点,适合应用于田间害虫的捕食性天敌种类调查。在茶园蜘蛛中,通过拍网法所采集到的游猎型蜘蛛经过PCR检测,可以从蜘蛛体内大量检测到茶尺蠖DNA,检测率达到43%(袁龙宇, 2015)。Yang等(2017)利用qPCR技术监测了目标片段的阳性率和捕食者肠道中的茶小绿叶蝉DNA残留最小数量,分别估算了捕食者的捕食率和每个捕食者的捕食数量。但是 SCAR标记技术只能确定天敌与稻水象甲的捕食与被捕食的关系,目前还不能准确评价天敌对稻水象甲控制作用的大小,具体的控制作用有待进一步研究。
综上所述,本研究通过稻水象甲发生情况实地调查、笼罩饲养实验和卵巢解剖系统研究了稻水象甲在广东的生活史和越冬规律。明确了稻水象甲在广东省越冬时期主要取食的寄主植物是水稻和李氏禾。同时还探明了稻水象甲在广东省越冬地的主要天敌为游猎型蜘蛛——沟渠豹蛛。这些研究结果将为广东省稻水象甲越冬期的预测预报及精准防控研究提供理论依据。

