急腹症脓毒症患者外周血单核细胞的活化和复方清下汤的治疗作用
张盛林,陈海龙,殷 朔
(大连医科大学附属第一医院 普外科,辽宁 大连 116011)
急腹症并发脓毒症或脓毒性休克已经成为急腹症病人病情加重甚至死亡的主要原因。单核巨噬细胞系统活化释放的肿瘤坏死因子(tumor necrosis factor-alpha ,TNF-α )是导致脓毒症和多器官功能障碍综合征的重要炎症因子[1]。为此,本研究通过检测急腹症并发脓毒症患者外周血单核细胞TNF-α的基因表达,研究其与血清TNF-α和血浆内毒素(endotoxin,ET)水平的相关关系。并观察中药复方清下汤的治疗效果,探讨急腹症并发脓毒症患者外周血单核细胞的活化及复方清下汤治疗作用的可能机制。
1 资料与方法
1.1 病例选择及分组
2002年8月~2003年2月收入大连医科大学附属第一医院普外科及急诊ICU的38例外科急腹症并发脓毒症患者。脓毒症的诊断符合1991年美国胸科医师学会(ACCP)和危重病医学会(SCCM)联席会议制定的脓毒症诊断标准[2]。凡重度营养不良、免疫系统疾病、使用免疫抑制剂及接受放射或化学治疗的恶性肿瘤患者均予排除。其中男性21例,女性17例;年龄(59.8±17.3)岁。患者被随机分成常规治疗组(简称常规组)和常规+中药治疗组(简称中药组)。(1)常规组:22例,采用西医综合治疗。 (2)中药组:16例,西医综合治疗的基础上给予复方清下汤。(3)对照组:健康志愿者10例。全部患者中30例存活,8例死亡。若无临床死亡、提前离院则观察7 d。所有患者在确定为研究对象时,进行APACHEⅡ评分。两组病人年龄、性别、疾病构成、脓毒性休克例数及APACHEⅡ评分之间差异无显著性意义。见表1。
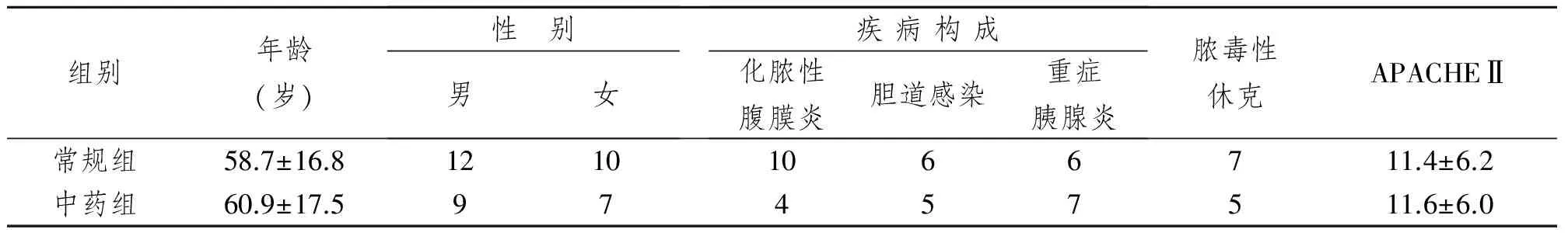
表1 两组病人一般情况的比较Tab 1 Comparison of patient characteristics in two groups (n)
1.2 中药复方清下汤成份及给药方法
大黄15 g、川朴15 g、枳实12 g、芒硝15 g、连翘20 g、公英20 g、双花30 g、栀子20 g、牡丹皮20 g;其中大黄后下,芒硝冲服。水煎法制成汤剂,每日一剂,每剂200 mL,早晚分服,不能口服者经胃管注入后闭管2 h或由肛管给药保留灌肠,直至消化功能恢复。
1.3 血浆ET与血清TNF-α测定
分别于入院后24 h内,第3、7天清晨无菌操作采集外周静脉血,分离血浆及血清。鲎试剂偶氮基质显色法定量检测血浆ET含量,放免法检测血清TNF-α水平。
1.4 外周血单核细胞的分离
分别于入院后24 h内、第7天取肝素抗凝血3 mL,用pH7.4的含HEPES的RPMI1640培养基等倍稀释后,置于淋巴细胞分离液上,两者体积比为2∶1;室温下,水平离心(2,000 r/min,25 min);用毛细吸管于血浆与分离液界面上吸出界面层细胞,移入另一离心管中;PBS液离心(1500 r/min,10 min)洗涤3次;用RPMI1640培养基(含10%胎牛血清,2 mmol/L谷氨酰胺,25mmol/L Hepes)培养,调整细胞浓度为2×106/ mL的细胞悬液,接种24孔培养板,于5%CO2、37℃潮湿培养1 h,去除上清液。胎盘兰染色,鉴别细胞活力大于95%,GIMSA-Wright氏染色细胞纯度大于90% 。
1.5 RT-PCR法检测单核细胞TNF-α mRNA表达水平
1.5.1 细胞总RNA的提取及单链cDNA的合成:按照试剂盒说明书提取细胞总RNA,定量,逆转录合成cDNA:反应体系如下:4 μL Mgcl2,2 μL 10×RNA PCR Buffer,8.5 μL Rnase Free H2O,2 μL DNTP Mixture,0.5 μL Rnase inhibitor,1 μL AMV Reverse Transcriptase,1 μL Random 9mers,1 μL模板RNA ,总反应体积20 μL。反应条件:30℃ 10 min,50℃ 30 min,95℃ 5 min,5℃ 5 min。
1.5.2 PCR反应:TNF-α 引物[3]:P(T1) (sense) 5’-CAG AGG GAA GAG TTC CCC AG-3’;P(T2) (anti-sense) 5’-GCA GAG GAT GGT CTG GTT CC-3’。扩增片断为325个碱基。内参β-actin引物[3]:P(A1) (sense) 5’-TTC CAG CCT TCC TTC CTG G-3’;P(A2) (anti-sense) 5’-aac gag gag gac tcg cgt t-3’。扩增片段为225碱基。反应体系如下:3 μL Mgcl2,4 μL 10×LA PCR Buffer Ⅱ,30.75 μL灭菌蒸馏水,0.25 μL TakaRa LA Taq,0.5 μL P(T1),0.5 μL P(T2),0.5 μL P(A1),0.5 μL P(A2),10 μL S(cDNA),总反应体积50 μL。反应条件(30个循环):94℃ 20 min,94℃ 30 s,55℃ 30 s,72℃ 1.5 min,72℃ 10 min,4℃ 5 min。
1.5.3 定量:取10 μL PCR产物,3%琼脂糖凝胶电泳。采用计算机凝胶扫描成像系统进行扫描分析图像,以灰度表示电泳带的强弱,与内参照的比值作为基因表达的相对含量。
1.6 统计学方法
2 结 果
2.1 血浆内毒素(ET)浓度变化
常规组24 h、第3、7天及中药组24 h、第3天血浆内毒素含量均明显高于正常对照组(P<0.01);第7天,常规组和中药组其血浆内毒素水平与入院24 h相比均明显降低(P<0.05),尤以中药组更为显著(P<0.01);第7天,中药组血浆内毒素水平明显低于常规治疗组(P<0.05)。见表2。
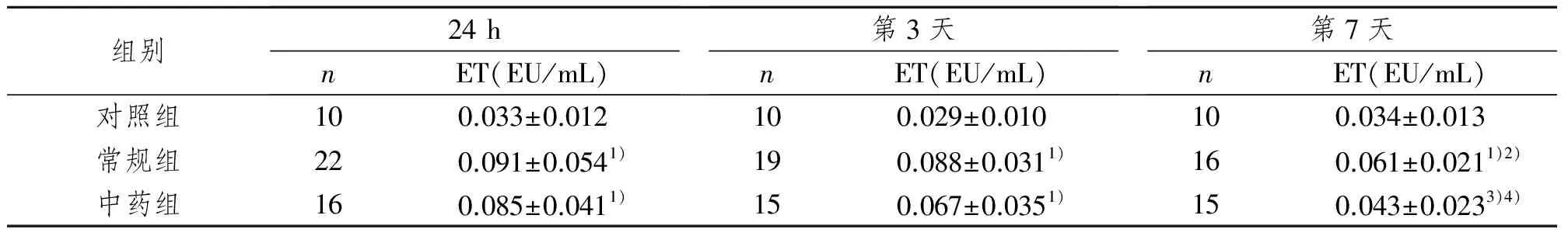
表2 各组血浆内毒素浓度比较Tab 2 Plasma levels of ET in each group
1)与对照组相比,P<0.01;2)与24 h组相比,P<0.05,3)P<0.01;4)与常规组相比,P<0.05
2.2 血清TNF-α 浓度变化
常规组24 h、第3、7天血清TNF-α 水平明显高于对照组(P<0.01)且无下降趋势;中药组第3、7天血清TNF-α 水平与入院24 h及常规组同期相比均有所下降,第7天差异有显著性意义(P<0.05)。见表3。
2.3 外周血单核细胞TNF-α mRNA表达
入院24 h内常规组和中药组外周血单核细胞TNF-α mRNA表达水平,与对照组相比,明显增强(P<0.01);与入院24 h相比,第7天,常规组和中药组TNF-α mRNA水平明显降低(P<0.01);第7天,中药组TNF-α mRNA表达水平低于常规组(P<0.05)。见图1、表4。
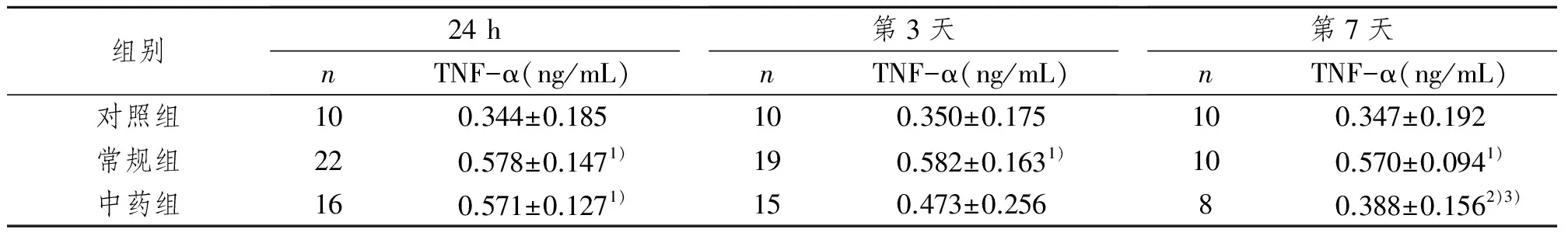
表3 各组血清TNF-α 浓度比较Tab 3 Serum levels of TNF-α in each group
1)与对照组相比,P<0.01;2)与入院24 h组相比,P<0.05;3)与常规组相比,P<0.01
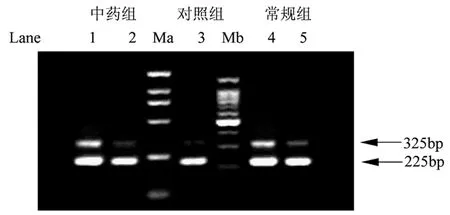
图1 各组TNF-α mRNA RT-PCR产物电泳图例
←所示为:TNF-αmRNA 扩增片段(325bp)及β-action mRNA(内参照)扩增片段(225bp);Lane 1:中药组24 h;Lane 2:中药组7 d;Lane 3:对照组;Lane 4:常规组24 h;Lane 5:常规组7 d;Ma:DL2,000 DNA Marker;Mb:100bp DNA Ladder Marker.
Fig 1 Electropherogram of TNF-α mRNA RT-PCR product in each group
表4各组单核细胞TNF-α mRNA表达比较(TNF-α /actin灰度比值)
Tab 4 TNF-αmRNA expression in monocytes of each group patients (TNF-α /actin)
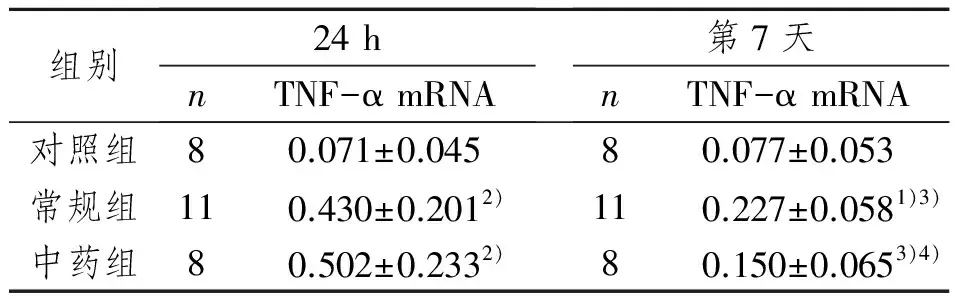
组别24hnTNF-αmRNA第7天nTNF-αmRNA对照组80.071±0.04580.077±0.053常规组110.430±0.2012)110.227±0.0581)3)中药组80.502±0.2332)80.150±0.0653)4)
1)与对照组相比,P<0.05;2)与对照组相比,P<0.01;3)与入院24 h组相比,P<0.01;4)与常规组相比,P<0.05
2.4 脓毒症患者外周血单核细胞TNF-α mRNA、内毒素、TNF-α 三者之间的相关分析
脓毒症患者入院24 h、第7天TNF-α mRNA表达与同期血浆内毒素水平及血清TNF-α 含量之间分别呈显著正相关(P<0.05)。见表5。
表5脓毒症患者外周血单核细胞TNF-α mRNA、内毒素、TNF-α相关分析
Tab 5 Correlation analysis of ET,TNF-αand TNF-αmRNA expression in peripheral blood monocytes of sepsis patients

24h第7天TNF-αmRNA/TNF-αr0.5750.787P<0.05<0.01TNF-α/ETr0.430.592P<0.01<0.05
3 讨 论
目前认为,严重感染所诱发的全身性炎症反应及器官功能损害并不是细菌或毒素直接作用的结果,而是由于细菌和毒素刺激机体释放过量的细胞因子等炎性介质,形成瀑布样链锁放大反应,引起严重的组织细胞损伤,最终导致多器官功能衰竭[4,5]。TNF-α 是一个具有157个氨基酸的蛋白,主要由激活的单核巨噬细胞分泌,具有广泛的生物活性,是机体免疫反应和炎症反应中的重要介质[6]。多种致炎因子中,G-菌胞壁成分特别是内毒素脂多糖(LPS)是TNF-α 释放的强有力刺激物。Turpin 等[7]用LPS刺激离体的外周血单核细胞,结果显示:培养单核细胞的上清液中TNF-α 浓度增高并伴有TNF-α mRNA表达增强。袁建成等[8]在严重烫伤大鼠模型研究中发现:烫伤早期,即可见门、腔静脉血浆内毒素和TNF-α 含量明显升高,并且肝、脾、肺、肾及小肠组织中TNF-α mRNA表达也增强,两者具有明显相关性;原位杂交技术显示单核巨噬细胞是TNF-α 的主要分泌细胞。上述体外及动物实验证实:单核巨噬细胞系统在有LPS存在的环境中,受刺激活化,表现出TNF-α mRNA表达增强及TNF-α分泌增多。本研究实验结果显示:与对照组相比,急腹症并发脓毒症常规组患者血清TNF-α浓度显著增高,外周血单核细胞TNF-α mRNA表达也增强。相关分析表明:脓毒症患者血清TNF-α水平与血浆内毒素水平呈显著正相关,外周血单核细胞TNF-α mRNA表达水平与内毒素水平也呈显著正相关。提示:增高的血浆内毒素刺激了单核细胞的活化,引起了TNF-α mRNA表达增强,合成、释放TNF-α 入血增多引起了血清TNF-α水平升高。随着血浆内毒素水平的下降,对单核细胞刺激减弱,单核细胞TNF-α mRNA表达下降,合成释放减少,血清中的TNF-α 水平降低,患者的脓毒性反应缓解。增高的TNF-α :(1)可致血管内皮细胞凋亡等直接细胞毒性作用[9];(2)诱导 IL-6、IL-1等基因表达,导致IL-6、IL-1等前炎症细胞因子的释放;(3)促进中性粒细胞积聚、激活、释放多种炎症介质包括血小板活化因子、白三烯B4、一氧化氮、血栓素A2、前列腺素和氧自由基,介导组织和器官损伤[10]。因此,减少血浆内毒素水平,抑制单核细胞的活化,对阻断脓毒症的发展具有重要的意义。本课题组以往的临床研究发现,急腹症患者肠道屏障损伤,肠黏膜通透性增强,并且均具有不同程度的肠麻痹,肠内容物的运行不畅,以致肠道瘀滞,肠道细菌和内毒素易于移位入血,形成内毒素血症。国外研究表明,绝大多数临床病例可能是肠道细菌及其产生的内毒素易位进入血流而导致脓毒症的发生[11]。因此,肠道可能是内毒素血症的“策源地”。 本研究中药组应用复方清下汤,主用枳(枳实)、朴(厚朴)、硝(芒硝)、黄(大黄)四味,进行通里攻下,排除胃肠积滞、泻下通便,泻火解毒;同时辅以连翘、公英、双花、栀子和牡丹皮清热、解毒、凉血[12]。如此清下兼施,清热通腑,通腑泄热,相辅相成。本研究显示,常规组其血浆内毒素水平下降缓慢,至第7天仍明显高于正常对照组,而中药组则下降迅速,至第7天其内毒素水平明显低于同期常规组,接近正常对照组。其根源可能在于,应用中药复方清下汤通里攻下,排出肠道积滞后,肠道内的细菌和内毒素随肠内容物排出体外,减少内毒素吸收入血及细菌移位,血浆内毒素浓度降低,抑制了单核细胞的活化,导致单核细胞TNF-α mRNA表达及内源性酶促反应减弱,TNF-α释放减少,血清中TNF-α含量降低,机体脓毒症状减轻。因此,复方清下汤治疗脓毒症是通过减少肠源性内毒素的吸收及抑制单核细胞的活化而减少TNF-α的释放,从而阻断脓毒症进一步发展成为多器宫功能障碍综合征,提高临床治疗效果。
[1] 李冠兰,刘先哲,余旻.TNF-α、IL-10、MMPs与MODS关系的研究进展[J].山东医药,2007,(14): 77-78.
[2] Ulevitch RJ,Tobias PS.Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin[J].Annu Rev Immunol,1995,13:437-457.
[3] Takeichi O,Saito I,Tsurumachi T,et al.Human polymorphonuclear leukocytes derived from chronically inflamed tissue express inflammatory cytokines in vivo[J].Cell Immunol,1994,156(2):296-309.
[4] Wang H,Ma S.The cytokine storm and factors determining the sequence and severity of organ dysfunction in multiple organ dysfunction syndrome[J].Am J Emerg Med,2008,26(6):711-715.
[5] 3rd JKM,Gonzalez EA,McGuire MF,et al.Early cytokine production risk stratifies trauma patients for multiple organ failure[J].J Am Coll Surg,2009,209(3):320-331.
[6] 徐世豪.肿瘤坏死因子[J].解放军医学杂志,1990,15(06): 404.
[7] Turpin J,Mehta K,Blick M,et al.Effect of retinoids on the release and gene expression of tumor necrosis factor-alpha in human peripheral blood monocytes[J].J Leukoc Biol,1990,48(5): 444-450.
[8] 袁建成,秦孝建,黎鳌.严重烫伤大鼠早期肺组织 TNF mRNA 表达及其细胞定位[J].中华创伤杂志,1995,(02): 45-47,84.
[9] 郜宇,陈丽.TNF-α诱导血管内皮细胞凋亡的研究[J].医学综述,2007,(17): 1297-1299.
[10] De Beaux AC,Goldie AS,Ross JA,et al.Serum concentrations of inflammatory mediators related to organ failure in patients with acute pancreatitis[J].Br J Surg,1996,83(3): 349-353.
[11] Demling R,LaLonde C,Saldinger P,et al.Multiple-organ dysfunction in the surgical patient: pathophysiology,prevention,and treatment[J].Curr Probl Surg,1993,30(4):345-414.
[12] 陈海龙,关凤林,周俊元.从中西医结合角度对阳明腑实证本质的探讨[J].中国中西医结合杂志,1993,13(11):690-691.

