乙型肝炎患者外周血单个核细胞HBV cccDNA含量的检测及其临床意义
肖晓光,李艳莲,王 晶,曲淑贤
(1.大连医科大学附属第一医院 检验科,辽宁 大连 116011;2.辽宁省医学细胞分子生物学重点实验室,辽宁 大连 116044)
乙型肝炎在我国广泛流行,人群感染率极高。目前虽然出现了许多治疗乙型肝炎的药物,但是对于药物疗效的观察还多依赖于转氨酶的测定、eAg 的变化及HBV DNA的定量测定,这些项目在乙肝早期治疗效果的监测上还不够敏感。乙肝病毒共价闭合环状DNA(HBV cccDNA)是乙肝病毒的mRNA和前基因组RNA的复制模板,它的存在是病毒复制存在的标志,也是乙型肝炎慢性化的主要原因之一[1]。本文通过对乙肝患者外周血外周血单个核细胞中HBV cccDNA检测,探讨外周血单个核细胞中HBV cccDNA的定量测定对乙型肝炎患者治疗效果监测的临床意义。
1 材料与方法
1.1 标本来源
2009年1月~2009年11月,在大连医科大学附属第一医院门诊和住院患者随机抽取进行肝功检测乙肝HBsAg(+),且未经过药物治疗的乙型肝炎患者,共100例,采集血清标本进行HBV DNA检测,采集EDTA 抗凝血进行单个核细胞HBV cccDNA检测。同时随机留取在大连医科大学附属第一医院门诊和住院患者已确诊为慢性乙肝患者40例,乙肝HBsAg(+)肝硬化患者30例,采集EDTA 抗凝血进行单个核细胞中HBV cccDNA检测。此外,还留取在大连医科大学附属第一医院感染病房住院治疗的急性乙肝患者1例,分别在其发病初期,治疗1周,2周,1个月和3个月时,采集患者血清标本进行HBV DNA检测,采集EDTA 抗凝血进行单个核细胞HBV cccDNA检测。对乙型肝炎的诊断均符合2000年中华传染病与寄生虫病分会、肝病学分会修订的病毒性肝炎防治方案的诊断标准,慢性乙型肝炎的诊断符合2005年《慢性乙型肝炎防治指南》标准,肝硬化诊断标准符合中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒肝炎防治方案。
1.2 仪器与试剂
1.2.1 仪器:Lightcycler荧光PCR仪为ROCHE公司生产。
1.2.2 试剂:血清HBV DNA检测试剂盒购自深圳匹基生物有限公司。
外周血淋巴细胞HBV cccDNA检测试剂由北京索奥生物药业科技有限公司提供。
外周血淋巴细胞HBV cccDNA提取试剂盒由北京帕弗瑞公司提供。
1.3 HBV DNA和HBV cccDNA检测
1.3.1 外周血单个核细胞HBV cccDNA提取:在微量离心管中加入20 μL蛋白酶 K,200 μL全血样本和200 μL溶血剂,震荡15 s,56 ℃ 放置10 min,加入无水乙醇200 μL,震荡15 s,将全部液体移入提取柱中,按照操作逐步洗脱。最后获得HBV cccDNA模板。
1.3.2 HBV cccDNA标准品的配置:将阳性质控品用双蒸水进行10倍,100倍,1000倍的稀释,得到1×106copies/mL,1×105copies/mL,1×104copies/mL的标准品。
1.3.3 试剂准备:HBV cccDNA试剂准备:按样本数(血清样本+阴性对照+阳性对照+标准品)N取HBV cccDNA PCR反应液n×24 μL、Tap酶n×2 μL,混合均匀后低速离心5 s,按每管26 μL加入毛细管中。分装后反应管可在2~8 ℃放置3 h。
HBV DNA试剂准备:按样本数(血清样本+阴性对照+阳性对照+标准品)N取HBV PCR反应液n×17.8 μL、Tap酶n×0.2 μL,UNG n×0.03 μL混合均匀后低速离心5 s,按每管18 μL加入毛细管中。分装后反应管可在2~8 ℃放置3 h。
1.3.4 标本加样:HBV cccDNA标本加样:将HBV cccDNA模板、阴性对照、阳性对照和标准品,各4 μL加入于反应毛细管中,低速离心5 s,取出置全自动定量PCR仪上进行反应。
HBV DNA标本加样:将HBV DNA模板、阴性对照、阳性对照和标准品,各2 μL加入于反应毛细管中,低速离心5 s,取出置全自动定量PCR仪上进行反应。
1.3.5 PCR扩增:HBV cccDNA PCR扩增:取PCR反应管,按顺序放入Lightcycler-PCR扩增仪中,按下面的程序进行设定反应条件: 93℃,2 min→(93℃,30 s→ 55℃,45 s)循环40次。
HBV cccDNA PCR扩增:取PCR反应管,按顺序放入Lightcycler-PCR扩增仪中,按下面的程序进行设定反应条件: 37℃,3 min→92℃,1 min→(92℃,5 s→60℃,30 s)循环40次。
1.3.6 结果分析:取高于样本噪声线和阴性对照的荧光值作为检测阈值。
1.3.7 质量控制:试剂质量完好并操作正确,阳性对照应检测为相应的范围,阴性对照应表现为阴性结果。
1.3.8 结果检测:采用 LightCycler Data Analysis分析结果。
1.4 统计学方法
通过χ2检验对各组间差异性进行分析。P<0.05为差异有显著性意义。
2 结 果
2.1 随机乙型肝炎患者HBV DNA和 HBV cccDNA检测结果
100例随机选取的乙型肝炎患者中, HBV DNA和 HBV cccDNA含量比较,见表1。
在57例HBV DNA阴性(含量<5×102copies/mL)的乙型肝炎患者中,HBV cccDNA含量均为阴性(含量<5×102copies/mL)。
2.2 HBV DNA含量>5×102乙肝患者人群中HBV cccDNA含量对比
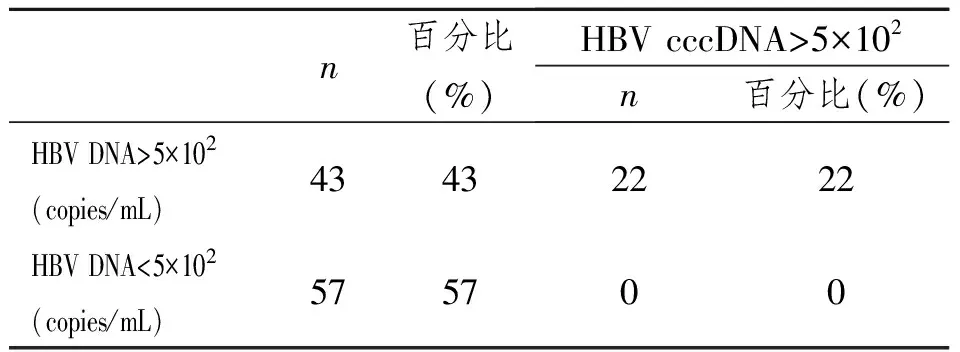
表1 HBV DNA和 HBV cccDNA含量比较
43例HBV DNA含量>5×102乙肝患者人群中,血清HBV DNA和外周血单个核细胞中HBV cccDNA含量对比情况,结果见表2。
2.3 随机乙肝人群,慢性乙肝和肝硬化患者HBV cccDNA 的含量比较
100例随机乙肝人群,40例慢性乙肝患者和30例肝硬化患者,外周血单个核细胞 HBV cccDNA 的含量比较,结果见表3。

表2 HBV DNA含量>5×102乙肝患者人群中血清HBV DNA和外周血单个核细胞中HBV cccDNA含量对比Tab 2 Compare the concentration of HBV cccDNA in peripheral blood mononuclear cells and HBV DNA in serum within concentration of HBV DNA>5×102 copies/mL
1)与HBV DNA含量>1×105copies/mL乙肝患者人群比例比较,P>0.05;2)与1×102 表3 随机乙肝人群、慢性乙肝患者和肝硬化患者外周血 HBV cccDNA含量比较Tab 3 Compare the concentration of HBV cccDNA of the random hepatitis B patients,chronic hepatitis B patients and HBsAg(+),liver cirrhosis patients 1)与随机乙肝人群组比较,P<0.05;2)与慢性乙肝患者组之间比较,P<0.05 1例急性乙肝患者,治疗过程中HBV DNA 和HBV cccDNA变化情况,见表4。 表4急性乙肝患者治疗过程中HBV DNA和HBV cccDNA变化情况 Tab 4 Compare the concentration change of HBV DNA and HBV cccDNA in acute hepatitis B patient during the therapy HBVDNA含量(copies/mL)HBVcccDNA含量(copies/mL)治疗前>5×1076.8×106第1周1.2×1074.7×104第2周3.3×1051.1×1031个月1.6×103<5×1023个月<5×102<5×102 HBV cccDNA是乙肝病毒前基因组RNA复制的原始合成模板,是乙肝病毒持续感染的关键因素,也是乙肝病毒复制的“发动机”,当乙肝病毒进入肝细胞后,释放出的基因组为松弛环状DNA(rcDNA),然后将其转运到细胞核内进行复制,此时rcDNA 缺口闭合,转变成cccDNA,开始复制周期。因此,HBV cccDNA是乙肝病毒复制的最早中间体。虽然其含量较少,每个肝细胞内只有约5~50个拷贝,但对于乙肝病毒的复制以及感染状态的建立具有十分重要的意义。 本文中作者采用实时荧光定量PCR(RT-PCR)法对乙型肝炎患者血清中HBV DNA含量和外周血中单个核细胞中HBV cccDNA含量情况进行研究。结果表明:在HBV DNA 阴性(含量<5×102copies/mL)的乙型肝炎患者人群中HBV cccDNA全部阴性(含量<5×102copies/mL);在HBV DNA较高含量(>1×105copies/mL)的17例乙肝患者中,HBV cccDNA>5×102例数为13例(76.4%),两者差异无显著性意义;而在HBV DNA低含量(<1×105copies/mL)的26例乙肝患者中,HBV cccDNA>5×102为9例(34.6%),阳性率明显降低,(P<0.05)。说明进行外周血单个核细胞中HBV cccDNA检测可以作为乙肝病毒高复制的一个检测指标[2]。 通过实验作者还检测到在100例随机乙型肝炎患者中,HBV cccDNA>5×102例数为22例,占22%;40例慢性乙肝患者中HBV cccDNA>5×102例数为17例,占42.5%;30例肝硬化患者中,HBV cccDNA>5×102例数为20例,占66.7%;各组患者之间比例明显增加(P<0.05)。这与马艳丽等[3]的研究结果是一致的。说明乙肝患者病情轻重和乙肝病毒复制的强弱有一定关系,从理论上推测,当肝脏组织处于炎症活动阶段时,存在于肝细胞胞质和线粒体中的转氨酶等酶类在肝细胞被破坏时能释放到血液中,那么存在于肝细胞核内的HBV cccDNA分子在肝细胞变性、坏死时应该也可以释放到血液中,而且病情越严重、变性坏死的细胞越多[4]。因此,随着病情的发展,从慢性乙肝到肝硬化患者人群中HBV cccDNA的阳性率在逐渐增加[5]。 此外,在对1例急性乙型肝炎患者的治疗追踪结果发现,当使用抗乙肝药物治疗后,从第1周起,患者体内的HBV cccDNA 含量就开始呈现明显的下降趋势,比HBV DNA 的下降要早的多。说明HBV cccDNA的动态检测对抗乙肝药物疗效的观察是比HBV DNA检测更敏感的指标。目前,临床上评价干扰素、核苷类似物这些抗乙肝病毒药物的疗效,主要依靠检测乙肝病毒e抗原和乙肝病毒DNA水平高低、肝功能变化情况以及肝组织的病理学改变等[6],这些指标对临床医师判断患者病情而言非常重要和实用,也是临床医师选用抗乙肝病毒药物的依据[7]。但是,对于药物早期疗效的监测,光靠血清中HBsAg或HBVDNA是远远不够的,需要结合HBV cccDNA的动态定量测定才能更准确地反应出患者体内的真实情况[8]。应该把治疗前后外周血中HBV cccDNA含量的变化纳入到抗乙肝病毒药物评价的指标体系中来。由于外周血中HBV cccDNA含量较低,用普通的PCR 方法检测比较困难,而肝内HBV cccDNA的检测标本来源比较困难,所以对HBV cccDNA的检测一直开展不起来。本研究采用RT-PCR 的方法检测外周血单个核细胞中HBV cccDNA 的含量,具有高灵敏性和高特异性,适用于大量临床标本的快速检测,使临床对HBV cccDNA进行常规检测成为可能。 应用RT-PCR 的方法对外周血单个核细胞中HBV cccDNA的检测,对于乙型肝炎患者的抗病毒治疗效果的监测和预后的判断都具有深远的临床意义。 [1] 张新枝,陈文郁,吴诗品,等.乙型肝炎病毒 cccDNA 研究进展[J].国际消化病杂志,2006,26(2):116-118. [2] 董庆鸣,魏红山,刘顺爱,等.外周血单个核细胞中 HBV cccDNA的定量检测[J].中国医学检验学杂志,2005,6 (4):258-260. [3] 马艳丽,任万华,董振芳,等.乙型肝炎病毒cccD NA 定量与乙型肝炎临床及病理关系[J].胃肠病学和肝病学杂志,2005,14 (6):584-586. [4] 李红,唐红.乙肝病毒cccDNA检测方法及临床意义的研究进展[J].生物医学工程学杂志,2009,26(3):662-665. [5] 宋培新,李军,韩亚萍,等.慢性乙型肝炎患者 HBV cccDNA 的检测[J].江苏医药,2006,32( 6 ):525-527. [6] Yuen MF,Wong DK.Fung J,et al.HBsAg seroclearance in chronic hepatitis B in Asian patients:rsplicative level and risk of hepatoceuvlar carcinoma[J].Gastroenterology,2008,135(4):1192-1199. [7] 吴凤婷,吕其军.肝病患者血清中HBV cccDNA 检测的临床意义[J].Chin Hepatol,2007,12(4):246-248. [8] 张雪娟,李全荣.cccDNA的最新研究进展[J].临床和实验医学杂志.2008,7(7):173-174.
2.4 治疗过程中HBV DNA 和HBV cccDNA变化情况

3 讨 论

