利用毛细管电泳测定牛乳和山羊乳混合乳的蛋白质
石 燕,姜金斗,刘 宁,*
(1.乳品科学教育部重点实验室,东北农业大学食品学院,哈尔滨 150030;2.国家乳业工程技术研究中心,黑龙江省乳品工业技术开发中心,哈尔滨 150086)
随着人们生活水平的不断提高,鲜乳的消费量日渐增加,在欧洲,绵羊乳和山羊乳的饮用已经有千年的历史,具有重要的营养价值与经济价值[1]。奶山羊是人类的三大奶源之一,是羊乳的主要来源,被誉为“不用冰箱的奶库”和“贫民的奶牛和聚宝盆”[2]。近些年,由于羊乳产业的发展和羊乳需求量的增大,掺假行为屡有发生。出现这种掺假行为的原因有:绵羊和山羊乳产量不高,季节性波动大,并且价格较贵;国外不法企业将产量过剩的牛乳掺入羊乳,以减少损失[3]。而在我国,一些不法分子为了追求高额利润,在牛乳中掺入价格相对低廉的山羊乳,严重影响了牛乳的口感与质量,也影响到了一些以鲜乳为原料的干酪制品的质量[4],使乳制品生产厂家蒙受巨大损失。因此,混合乳检测方法的确立,是食品检验和执法部门当前所面临的重要问题。
目前毛细管区带电泳(CE)测定羊乳中掺入牛乳已有报道,主要以乳清蛋白的分析为基础,有研究用毛细管电泳和质谱联用(CE-MS)的方法检测羊乳中掺入的牛乳量,根据所测的不同乳中的β-乳球蛋白(β-LG)的峰值进行定量检测[3]。Bramanti等利用高效液相色谱(HPLC)分析 αs1/κ、αs2/β、β/κ和αs2/αs1,这些酪蛋白的峰面积值可作为羊乳中掺入牛乳的检测指标[5]。HPLC同大多数定性定量分析乳中蛋白质的方法一样,要求首先把乳清蛋白和酪蛋白分离开,再进行分析,而毛细管电泳则不需要此过程,因此它可以提供一种快速、高分辨率、良好量化并适合于各种混有乳产品的分析手段[6-7]。
通过参考并比较国内外相关研究文章,本文采用毛细管电泳法研究了混合乳中的蛋白,选取特定酪蛋白的迁移时间做定性研究,根据特定酪蛋白峰面积的比值做定量研究,建立混合乳的定性定量检测方法。
1 材料与方法
1.1 材料
1.1.1 试剂
新鲜牛乳、山羊乳(采自八五二农场);5种乳蛋白标准品(购自Sigma公司);柠檬酸(购自天津东丽化学试剂公司);柠檬酸钠(购自天津凯通化学试剂公司);羟丙基甲基纤维素(HPMC)(购自山东瑞泰化工);氨基丁三醇(Tris)(购自Sigma公司);3-(N 吗啉)-2-羟基丙磺酸(MOPOS)(购自索来宝公司);乙二胺四乙酸二钠(EDTA)(购自Sigma公司);二硫代苏糖醇(DTT)(购自Sigma公司);尿素(购自天津市风船化学试剂公司)。
1.1.2 仪器
P/ACE MDQ毛细管电泳仪,配有紫外检测器,美国Beckman公司;聚丙烯酰胺涂层毛细管;60 cm×50 μm i.d.美国 Beckman 公司;台式离心机TCL-16C,上海安亭科学仪器厂;DELTA320 pH计,梅特勒-托利多公司;超纯水仪,美国MILLPORE公司。
1.2 方法
1.2.1 缓冲溶液的配制[8]
电泳缓冲液:0.32 mol·L-1柠檬酸,20 mmol·L-1柠檬酸钠,6 mol·L-1尿素,0.05%HPMC,调节pH到3.0,用0.45 μm滤膜过滤,备用。
样品缓冲液:用 167 mmol·L-1Tris、42 mmol·L-1MOPOS、67 mmol·L-1EDTA 钠盐、17 mmol·L-1DTT、6 mol·L-1尿素和 0.5 g·L-1HPMC,调节 pH 到 8.6,用0.45 μm滤膜过滤,备用。
1.2.2 样品处理[9]
原料乳:将鲜乳与样品缓冲溶液按1:4 V/V的比例混合,室温下放置1 h,10 000 r·min-1离心5 min,取中间澄清液用0.45 μm滤膜过滤,备用。
混合乳:各取新鲜牛乳、山羊乳分别按体积比10: 90、 20: 80、 30: 70、 40: 60、 50: 50、 60: 40、70: 30、80:20 和 90: 10 的比例混合,然后将混合溶液与样品缓冲液按1:4 V/V的比例混合,室温下放置1 h, 10 000 r·min-1离心5 min,取中间澄清液用0.45 μm滤膜过滤,备用。
标准蛋白:用样品缓冲液将α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg)、α-酪蛋白(α-CN)、β-酪蛋白(β-CN)和 κ-酪蛋白(κ-CN)分别配制成不同浓度的标准溶液,备用。
仪器操作条件:压力进样:0.5 psi,5 s,柱温25℃,分离电压为25 KV,紫外检测波长214 nm。进样前和样品间冲洗程序:0.1 mol·L-1HCl冲洗2 min,超纯水冲洗2 min,电泳缓冲液冲洗5 min。
1.2.3 分析指标
根据混合乳中各酪蛋白的迁移时间作为定性检测指标,且满足分析条件的迁移时间和峰面积的RSD<5%。根据选定的酪蛋白峰面积之间的比值作为定量检测指标。
2 结果与分析
2.1 牛乳和山羊乳混合乳的研究
2.1.1 不同物种间乳的毛细管区带电泳图谱
测定牛乳和山羊乳中蛋白质得到的电泳图谱如图1所示。通过对照牛乳中各个乳蛋白标准样品的迁移时间,可定性明确其中的主要乳蛋白成分,如图1b所示。参考Jose等研究的山羊乳中的蛋白迁移时间及顺序,根据本研究结果可明确该山羊乳样品中的主要蛋白成分,如图1a所示[8,10]。根据迁移时间的不同,能够明显看出两种原料乳中的蛋白成分不同,表明山羊乳与牛乳所含蛋白成分有很大差别。另外,该实验方法能够使乳中所含的各种蛋白成分得到较好的分离,且图谱清晰明了。
利用酪蛋白片段迁移时间的不同作为检测指标。由图1可知,不同乳中酪蛋白迁移顺序相同:牛乳酪蛋白:αs2-CN<αs1-CN<αs0-CN<κ-CN<βcasein A1<β-casein A2;羊乳酪蛋白:αs2-CN<αs1-CN<κ-CN<β2-CN<β1-CN。但迁移时间不同。通过对比发现不同品种乳的αs0-CN、αs1-CN、κ-CN和β-CN等的迁移时间明显不同,因此选取了牛乳的αs1-CN、αs0-CN、κ-CN、β-casein A1和山羊乳的β-CN、β1-casein来进行进一步的研究。

图1 乳蛋白毛细管区带电泳Fig.1 Capillary electropherogram of milk protein
2.2 混合乳的定性检测
将混合比例为50:50(V/V)的牛乳和山羊乳混合样品进样分析,得到混合乳的电泳图谱如图2所示。连续进样10次,根据电泳图计算各酪蛋白片段迁移时间和峰面积的平均值以及它们的相对标准偏差,结果如表1所示。并从中选出迁移时间和峰面积的RSD较小值对应的酪蛋白作为定性鉴定的酪蛋白。

图2 混合乳的毛细管区带电泳Fig.2 Capillary electropherogram of milk mixture
由表1可知,所测的迁移时间的RSD值中,牛乳的αs0-CN、β-CN A1和山羊乳中的β-CN、β1-CN所得的值相对较小;而相对峰面积的RSD值中,牛乳的αs1-CN、β-CN A1和山羊乳的β-CN、β1-CN相对较小,而牛乳的κ-CN和αs0-CN的相对峰面积的RSD较高。各酪蛋白的迁移时间和相对峰面积的RSD值均小于5%,表明选择的酪蛋白片段的重复性和稳定性较好,这些酪蛋白均可以作为定性检测混合乳的特定酪蛋白。
2.3 混合乳的定量检测
综合考虑上述所得结果,排除峰值较小的牛乳中的κ-CN和αs0-CN,选定牛乳αs1-CN、β-CN A1和山羊乳β-CN、β1-CN做定量研究。将配制成不同比例的混合乳样品进样分析,计算不同酪蛋白的峰面积之间的比值,并考察各酪蛋白峰面积比值与混合乳比例是否呈线性相关性,结果见表2。

表1 混合乳中酪蛋白迁移时间、相对峰面积平均值及相对标准偏差(n=10)Table 1 Mean and relative standard deviation of the migration times and the relative peak areas of the caseins in milk mixture(n=10)

表2 酪蛋白峰面积比值及检测限Table 2 Ration of different casein peak area and the detection limit of mixed milk
混合乳中的牛乳αs1-CN和山羊乳β1-CN峰面积比值与牛乳百分含量的关系如图3所示,以混合乳中牛乳的百分含量为横坐标,以αs1-CN/(β1-CN+αs1-CN)峰面积的比值为纵坐标做的标准曲线图,由图3可见线性关系良好,相关系数可达0.9973。
混合乳中的牛乳β-CN A1和山羊乳β-CN峰面积比值与牛乳百分含量的关系如图4所示,以混合乳中牛乳的百分含量为横坐标,以β-CN A1/(β-CN+β-CN A1)峰面积的比值为纵坐标做的标准曲线图,由图4可见线性关系良好,相关系数可达0.998。
由表2所列数据和图3和图4所做的标准曲线可知 αs1-CN/(β1-CN+αs1-CN)和 β-CN A1/(β-CN+β-CN A1)的峰面积比值与混合乳的比例存在着良好的线性关系,相关系数均大于0.997,因此αs1-CN/(β1-CN+αs1-CN)和β-CN A1/(β-CN+β-CN A1)的峰面积比值可以作为混合乳的定量检测指标。牛乳的检测限分别能达到2%和3%。
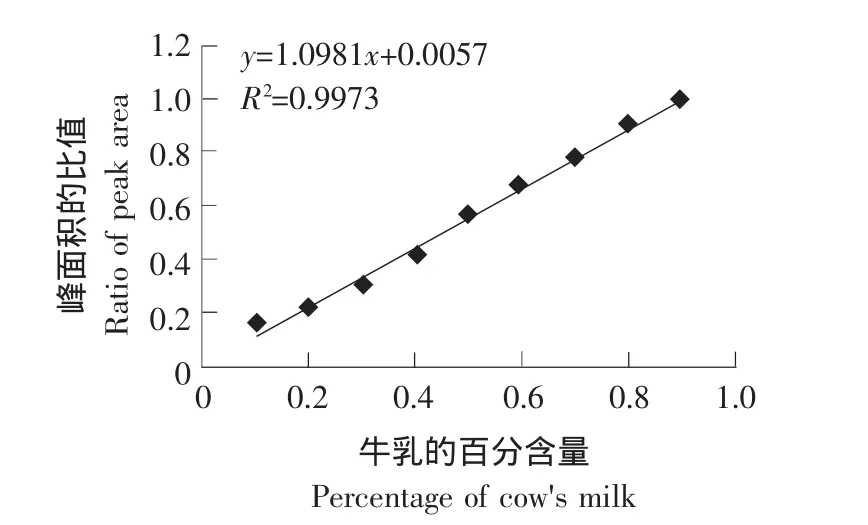
图3 牛乳αS1-CN和山羊乳β1-CN峰面积比值与牛乳的百分量的线性关系Fig.3 Linear correlation of peak areas on cow's casein αS1-CN and goat's casein β1-CN with cow's milk contents

图4 牛乳β-CN A1与山羊乳β-CN峰面积比值与牛乳的百分量的线性关系Fig.4 Linear correlation of peak areas on cow's casein β-CN A1and goat's casein β-CN with cow's milk contents
3 讨论
a.选取涂层毛细管区带电泳法分析了不同物种间的乳蛋白,由于毛细管电泳技术具有高效和明显减少溶剂浪费等特点,加速了乳品质量快速检测和自动化分析的进程[11-13]。因此选择毛细管电泳方法来测定混合乳中的蛋白比其他检测方法更具优势。由于毛细管电泳中蛋白质对管壁有较强的吸附作用,影响分离效率,常会出现峰高降低甚至不出峰的现象,蛋白质吸附同时引起电渗流的变化和分离效率显著降低,所以蛋白质分离首要解决的问题就是吸附问题,本文选择的聚丙烯酰胺涂层毛细管柱可有效的抑制管壁对蛋白的吸附,得到较好的分离效果[14]。本研究中各主要蛋白均得到基线分离,证明该方法分离效果较好。根据不同乳的蛋白迁移时间可以区别不同物种乳之间的乳蛋白成分。
b.测定羊乳中掺入牛乳的研究已有报道,主要是以乳清蛋白的定量分析为基础。毛细管区带电泳测得牛乳含量在0~20%的范围内时,牛乳β-乳球蛋白和羊乳α-乳白蛋白的峰面积比率与牛乳含量线性相关[15];反相高效液相色谱分析乳清蛋白适合于常规检测,但是同时乳清蛋白存在遗传变异和热不稳定等方面的限制,某些色谱图谱十分复杂,分析困难,有些情况下检测时间过长。而本文得到的乳蛋白电泳图中酪蛋白较丰富,因此本文选取乳中的酪蛋白作为检测指标。与以乳清蛋白为检测指标的研究相比较,本文可选的检测指标范围更广,线性结果较好,相关系数均大于0.997。
c.利用乳酪蛋白迁移时间的不同来定性检测混合乳,但从混合乳蛋白电泳图中能够明显看出有的蛋白峰减小甚至消失,而有的蛋白峰增大。减小的蛋白峰如牛乳的αs2-CN和山羊乳的αs2-CN,可能是由于各自进样量的减小,峰型不好,不能选择其作为定性酪蛋白。而牛乳中的β-CN A2和山羊乳中的β2-CN峰重叠,使得混合乳的电泳图中该位置的峰有所增大,也不能选择这两种酪蛋白作为定性酪蛋白。综合分析,选择能够明显区分不同物种间且峰型较好的酪蛋白作为定性鉴定的酪蛋白,与利用高效液相色谱研究分析所选的α1-、α2-、β-和κ-casein[5]相比,本研究中选取的酪蛋白包括β-CN亚型,如β1-CN和β-CN A1,酪蛋白峰更加具体,且各种酪蛋白相对迁移时间和相对峰面积的RSD均小于5%,均可以作为定性鉴定的酪蛋白。选择稳定性和重现性相对较好的牛乳中的αs1-CN、β-CN A1和山羊乳的β-CN、β1-CN做定性研究,结果表明 αs1-CN/(β1-CN+αs1-CN)、β-CN A1/(β-CN+β-CN A1)可以作为混合乳的定量检测指标,结果可靠。
本研究结果表明该方法准确、快速、无污染,为乳的质量监控提供了一个新的途径,对乳品产业具有重要意义。
4 结 论
本研究通过采用涂层毛细管区带电泳方法测得的混合乳中的蛋白成分,较好的分离各种乳酪蛋白分离效果较好,得到的电泳图谱清晰明了,且该方法的稳定性和重复性良好。研究选取择了稳定性好的牛乳 αs1-CN、αs0-CN、κ-CN、β-CN A1和山羊乳的β-CN、β1-CN作为定性检测混合乳的掺假特定酪蛋白,根据混合乳的不同混合比例与特定酪蛋白 αs1-CN/(β1-CN+αs1-CN)、β-CN A1/(β-CN+β-CN A1)峰面积的比值之间存在着良好的线性关系,且相关系数均大于0.997,可以作为定量检测混合乳掺假的指标。
[1] 王坤,叶兴乾,关荣发.羊乳及其奶酪中掺入牛乳检测的研究[J].食品与发酵工业,2005,31(10):136-138.
[2] 刘书亮,袁春桥,杨冠东.雅安山羊乳与牛乳质量性状比较分析[J].肉品卫生,2000,10(4):4-5.
[3] M ller L,Barták P,Bedná P,et al.Capillary electrophoresis-mass spectrometry-a fast and reliable tool for the monitoring of milk adulteration[J].Electrophoresis,2008,29(10):2088-2093
[4] 甄贞,许晓曦,滕国新,等.以羊奶和牛奶为原料的新鲜干酪风味的对比研究[J].东北农业大学学报,2009,40(6):89-96.
[5] Brabant E,Sortino C,Onor M,et al.Separation and determination of denatured αs1,αs2, β-and κ-caseins by hydrophobic interaction chromatography in cows',ewes'and goats'milk,milk mixtures and cheese[J].Journal of Chromatography A,2003,994(1-2):59-74.
[6] Beatriz M,Volker R,María A M,et al.Improved method for the simultaneous determination of whey proteins,caseins and para-κcasein in milk and dairy products by capillary electrophoresis[J].Journal of Chromatography A,2001,915(1-2):225-230.
[7] Virginia G C,Alejandro C.Recent advances in the application of capillary electromigration methods for food analysis[J].Electrophoresis,2008,29(1):294-309.
[8] Gomez-RuizJA,BeatrizM,PastoraA,etal.Quantitativedetermination of αs2-and αs1-casein in goat's milk with different genotypes by capillary electrophoresis[J].Journal of Chromato-graphy A,2004,1054(1-2):279-284.
[9] 唐萍,田晶,佘振宝,等.奶制品中蛋白质测定的毛细管电泳法研究[J].分析科学学报,2006,22(1):5-8.
[10] Molina E,Pedro Jesús Martín-Álvarez,Ramos M.Analysis of cows',ewes'andgoats'milkmixturesbycapillaryelectrophoresis:quantication by multivariate regression analysis[J].International Dairy Journal,1999,9(2):99-105.
[11] Huang H Y,Shih Y C,Chen Y C.Determining eight colorants in milk beverages by capillary electrophoresis[J].Journal of Chromatography A,2002,959(1-2):317-325
[12] Terabe S,Otsuka K,Ando T.Electrokinetic chromatography with micellar solution and open-tubular capillary[J].Analytical Chemistry,1985,57(4):834-841.
[13] 王晴,王静,张英春,等.毛细管电色谱技术研究进展及应用[J].东北农业大学学报,2009,40(3):136-139.
[14] Schmalzing D,Piggee C A,Foret F,et al.Characterization and performance of a neutral hydrophilic coating for the capillary electrophoretic separation of biopolymers[J].J Chromatogr,1993,652(1):149-159.
[15] GiampaoloC,FrancoC,RenataJ,etal.Deter-mination of cows'milk in goats'milk and cheese by capillary electrophoresis of the whey protein fraction[J].Journal of Chroma-tography A,1999,846(2):135-141.

