人痩素基因的克隆及原核表达
双 宝,李 明,李 成,王 晴,高继国,向文胜,刘忠华
(东北农业大学生命科学学院,哈尔滨 150030)
瘦素(Leptin)主要是由肥胖基因(OB基因,位于人类染色体7q32)编码的,在白色脂肪组织中产生的一种多肽类激素[1]。Leptin是一种分泌型蛋白质,是一个分子质量为16 ku的脂肪源循环蛋白,连同氨基端21个氨基酸的分泌信号序列共167个氨基酸。信号序列引导瘦蛋白进入分泌途径,最后被除去,因此在血液中循环的瘦蛋白为146个氨基酸的蛋白质[2]。
Leptin具有广泛的生物学功能。它可以调节脂肪代谢和进食量,对生殖、免疫功能、激素以及中枢神经的早期发育都有作用[3]。它被广泛地应用于重要的生物学指标[4-5]和疾病治疗[6]。该基因的多态性[7-8]以及其在食品科学上的应用[9]也受到了人们的重视。然而,Leptin的一些特性还有待进一步考证。例如,Takeda指出Leptin可以控制骨头的形成[10],然而我国学者通过观察生长激素缺乏症(GHD)儿童血清Leptin、骨钙素水平的变化及两者相关性分析,得出一个新的结论,认为GHD儿童骨代谢的调控很可能与Leptin无关[11]。这就需要进一步深入研究Leptin对骨代谢的作用。本试验克隆了人OB基因,使其产物Leptin在原核生物大肠杆菌重组高量表达,为Leptin的深入研究打下了良好基础。
1 材料与方法
1.1 脂肪组织
取一例正常体重的急性阑尾炎患者(女性、36岁)腹壁脂肪组织,总量200 mg。取出后置-70℃保存,一周内使用。
1.2 菌株和质粒
菌株 E.coli XL1-Blue 和 E.coli BL21(DE3)质粒pMD18-T Vector购于宝生物公司,pET32a Vector为本实验室保存。
1.3 工具酶和试剂
总RNA提取试剂盒Trizol Reagent、RT-PCR一步反应试剂盒(购自GIBCO-BRL公司);DEPC(购自Invitrogen公司);DNA Marker(购自大连宝生物),蛋白质小分子质量Marker(ku)(购自天根生物工程公司);其他试剂均为Sigma公司或国产分析纯生化试剂。DNA片段快速回收试剂盒、质粒快速提取试剂盒购自北京博大泰克公司。
1.4 PCR引物
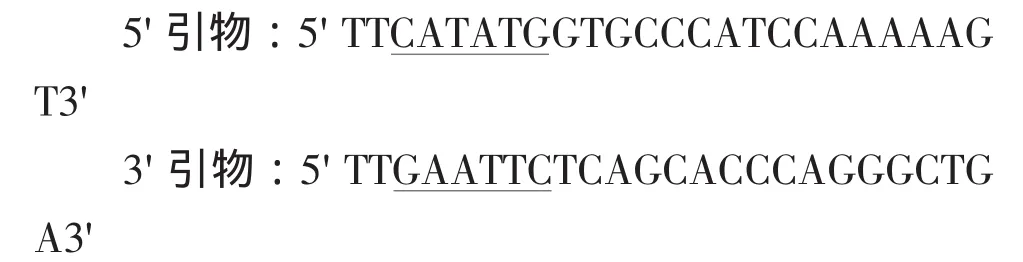
根据已报道的人Leptin基因(OB基因)去除信号肽的成熟区序列设计PCR引物,引物由北京赛百盛生物公司合成。其中5'引物中导入NdeⅠ酶切位点,3'引物中导入Eco RⅠ酶切位点(划线部分)。
1.5 目的基因的扩增
1.5.1 脂肪组织总RNA的制备
取脂肪组织100 mg放入1.5 mL EP管中,加入1 mL Trizol溶液,冰浴中匀浆数次后静置5 min,2~8 ℃ 12 000 r·min-1离心 10 min,取下层匀浆液移至新EP管中加入200 μL氯仿,快速震荡15 s后室温放置 3 min,2~8 ℃ 11 000 r·min-1离心15 min,吸取水相,加入500 μL异丙醇,混匀后室温放置 10 min, 2~8℃ 11 000 r·min-1离心 10 min,75%乙醇1 mL洗涤沉淀,2~8℃7 500 r·min-1离心5 min,弃乙醇真空抽干,溶于20 μL无RNA酶的水中,-20℃保存备用。
1.5.2 逆转录-聚合酶链式反应(RT-PCR)
取5 μL所提取的脂肪组织总RNA为模板,利用RT-PCR一步反应试剂盒进行RT-PCR。
RT-PCR 反应体系(50 μL):2×Reaction Mix 25 μL、5'引物(10 μmol·L-1)1 μL、3'引物(10 μmol·L-1)1 μL、RT/Taq Mix 1 μL、模板 5 μL、H2O 17 μL。
反应步骤:50℃反应20 min;94℃2 min后进入以下程序:94℃变性15 s,55℃退火30 s,72℃延伸45 s,扩增35个循环后,72℃延伸15 min。
1.5.3 配制琼脂糖凝胶及电泳
1%的琼脂糖胶、在RT-PCR产物中加入样品缓冲液,电极缓冲液为1×TAE,100 V稳压电泳,至指示剂至适当位置。
1.6 RT-PCR产物回收
依照鼎国生物工程公司DNA片段快速回收试剂盒操作说明进行。
1.7 测序质粒构建
将获得的人Leptn基因PCR回收产物连入测序载体中。
连接反应体系(10 μL):pMD18-T Vector 1 μL、纯化的OB基因 PCR产物 4 μL、SolutionⅠ5 μL。以上连接体系16℃反应30 min后转化XL1-Blue感受态细菌,37℃培养过夜。
1.8 质粒提取和纯化
挑取单一克隆至2~5 mL含100 mg·L-1氨苄青霉素(Amp)液体LB培养基中,37℃过夜振荡培养后按照博大泰克生物工程公司质粒快速提取试剂盒实验方法提取质粒。
1.9 表达质粒的构建
分别将测序正确的pMD18-T-OB质粒和大肠杆菌pET32a载体质粒用NdeⅠ、Eco RⅠ进行双酶切,37℃酶切过夜,回收片断,进行片断连接;转化XL1-Blue感受态细胞后提取质粒,通过PCR和NdeⅠ-Eco RⅠ双酶切鉴定。
1.10 重组蛋白诱导表达
将经PCR和NdeⅠ-Eco RⅠ双酶切鉴定正确的pET32a-OB阳性克隆转化到大肠杆菌BL21(DE3)感受态细胞中,挑取单克隆分别接种含100 μg·mL-1氨苄青霉素(Amp)的液体LB培养基中,37℃过夜振荡培养后,以1:100分别稀释至含Amp(100 μg·mL-1)的 LB 培养基中,37 ℃振荡培养至OD600值为0.4~0.6,加入诱导剂IPTG至终浓度1 mmol·L-1,37 ℃继续培养 4 h 后,4 ℃、5 000 r·min-1离心10 min收集菌体。SDS-PAGE检测蛋白的表达情况,鉴定表达产物。阴性对照为在同等条件下不加诱导剂继续培养。
2 结果与分析
2.1 目的基因的扩增
以人脂肪组织中所提取的总RNA为模板逆转录后进行PCR反应,扩增产物经1%琼脂糖凝胶电泳后出现一条长度约450 bp的DNA扩增产物,与预期结果相符(见图1)。
2.2 测序质粒的构建和鉴定
从电泳胶中纯化回收RT-PCR产物,与pMD18-T Vector连接,转化感受态大肠杆菌XL1-Blue。采用PCR和NdeⅠ-Eco RⅠ酶切方法鉴定,选取2个含有插入片断的阳性克隆用pMD18-T载体的上游通用M13-47引物进行测序分析,其中,pMD18-T-OB 1序列与其他学者报道GI:904211的序列一致。
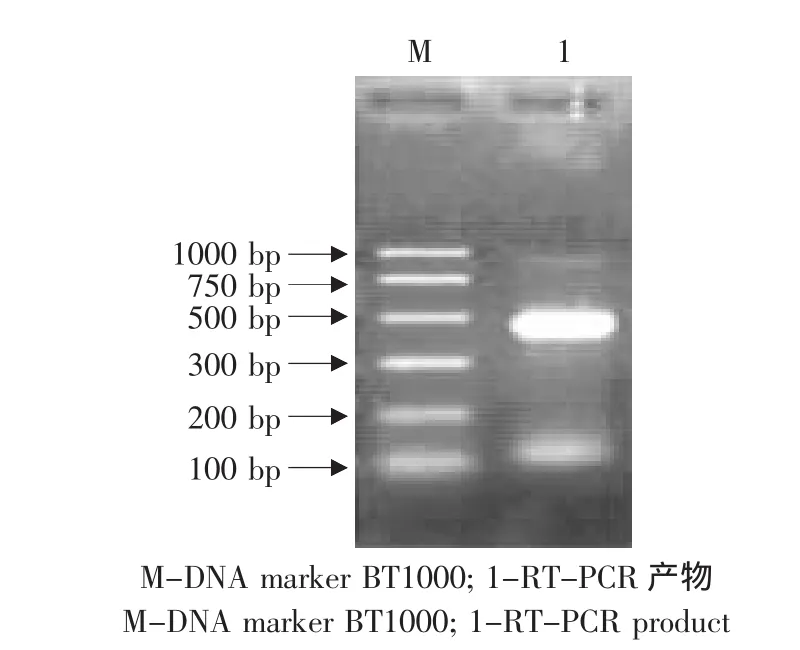
图1 重组质粒的PCR鉴定Fig.1 PCR assay of recombinant plasmid
2.3 阳性重组质粒的鉴定
PCR鉴定出阳性质粒3个(见图2),再用双酶切鉴定,发现在450 bp处有切出的特异带,确定了这3个确为阳性质粒(见图3)。
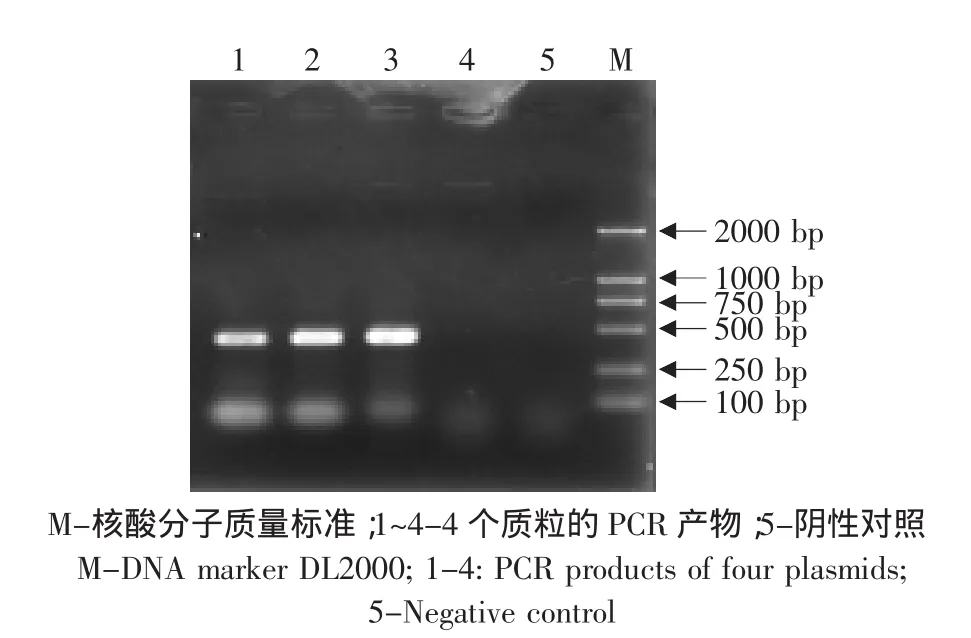
图2 阳性重组质粒的PCR鉴定Fig.2 PCR assay of positive recombinant plasmid
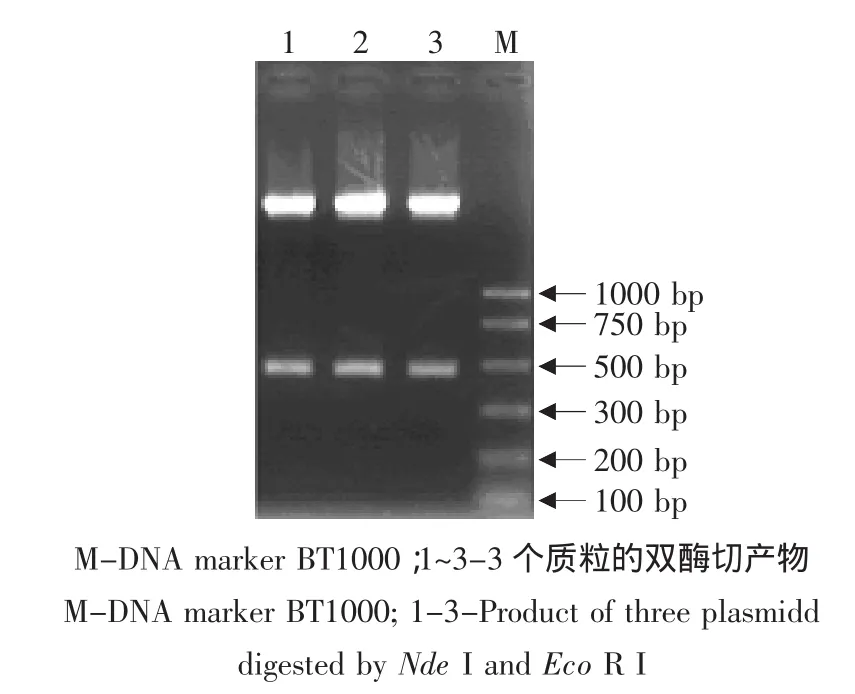
图3 重组质粒的双酶切鉴定Fig.3 Digest assay of recombinant plasmid by Nde I and Eco R I
2.4 重组人Leptin蛋白在大肠杆菌BL21(DE3)中的表达
将测序正确的pMD18-T-OB质粒与大肠杆菌载体pET32a质粒同时进行NdeⅠ-Eco RⅠ双酶切,回收纯化酶切片断后T4连接酶连接。经PCR和NdeⅠ-Eco RⅠ双酶切鉴定的pET32a-OB阳性克隆质粒转化大肠杆菌BL21(DE3)感受态细胞,挑取单个克隆培养,诱导后,收集菌体,并用菌体用煮沸法制成样品,SDS-PAGE检测到在分子质量16 ku处有一特异性表达带,通过凝胶扫描系统Alpha分析,表达的目的蛋白占总蛋白的20%(见图4)。
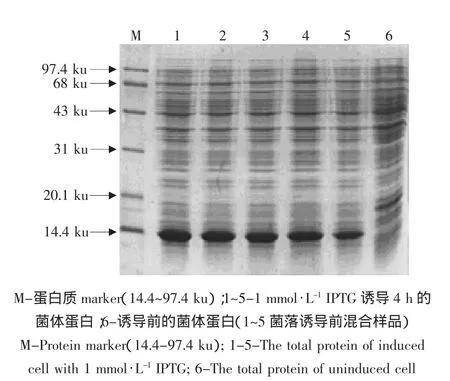
图4 表达蛋白SDS-PAGE分析Fig.4 SDS-PAGE analysis of expressed protein
3 讨论与结论
本研究采用RT-PCR技术人从脂肪组织提取总RNA,克隆到了人瘦素cDNA,序列分析显示与其他学者的研究结果相同。为了获得足够量的蛋白用以进一步的研究,选用简便、高效及便于生物学活性研究的原核表达系统载体pET32a进行瘦素蛋白的体外表达,成功构建了瘦素蛋白的原核表达载体pET32a-OB。将阳性质粒转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导,SDS-PAGE检测所获得的目的蛋白与预期一致,目的蛋白的表达效率在20%以上。国内瘦素的研究大多以探讨其相关作用为主,而对其表达方面的研究尚不多见。通过对瘦素进行高效表达就使得获得大量的瘦素进行更深入的试验成为可能。而且本实验室克隆表达的人的瘦素,为其应用于临床研究奠定了基础。
[1]付莉,叶本兰.瘦素与慢性肾功能衰竭[J].临床和实践医学杂志,2008,7(1):158-159.
[2]李玉成.ATGL在Leptin介导脂解过程中的表达调控及其机理研究[D].杨凌:西北农林科技大学,2008:8.
[3]胡建忠,王子朴.瘦素(Leptin)的生理作用机制及长期运动对其水平的影响[J].上海体育学院学报,2008,32(5):41-43.
[4]孟扬.瘦素与儿童肥胖研究进展[J].医学研究生学报,2008,21(11):1211-1213.
[5]王希龙,梁华平,张连阳.创伤后瘦素及其受体的变化及临床意义研究[J].解放军医学杂志,2008,33(12):1410-1412.
[6]林季,颜光涛,薛辉,等.Leptin在大鼠肝缺血/再灌注介导的肠道损伤中的作用[J].世界华人消化杂志,2008,31(16):3485-3490.
[7]刘新武.中国荷斯坦奶牛DGAT2、Leptin基因多态性与产奶性状关系研究[D].杨凌:西北农林科技大学,2008:1-2.
[8]喻妍,赵靖平,关仁容,等.瘦素基因-2548G/A多态性与抗精神病药物所致体重增加的关联分析[J].中国神经精神疾病杂志,2008,34(10):616-617.
[9]Palou A,Pico C.Leptin intake during lactation prevents obesity and affects food intake and food preferences in later life[J].Appetite,2009,52:249-252.
[10]Takeda S.Osteoporosis:a neuroskeletal disease[J].The International Journal of Biochemistry and Cell Biology,2009,41:455-459.
[11]杨海英,董俊华,王明月,等.生长激素缺乏症儿童血清瘦素、骨钙素水平变化及其相关性分析[J].中国现代医生,2008,46(24):9-10.

