杜氏盐藻寡糖基转移酶亚基STT3a功能结构域的克隆与表达分析
王翠,李杰,柳丽平,曾磊,薛乐勋
郑州大学生物工程系 细胞生物学研究室,郑州 450001
杜氏盐藻寡糖基转移酶亚基STT3a功能结构域的克隆与表达分析
王翠,李杰,柳丽平,曾磊,薛乐勋
郑州大学生物工程系 细胞生物学研究室,郑州 450001
为了研究STT3a基因在杜氏盐藻耐盐及鞭毛再生方面的作用,根据衣藻、拟南芥等STT3a蛋白的氨基酸高度保守序列VCVFTA、DVDYVL设计一对简并引物,采用RT-PCR及3'RACE的方法扩增杜氏盐藻STT3a蛋白功能结构域的cDNA序列。序列分析显示克隆的cDNA全长1 650 bp,具有一定保守性,与衣藻、拟南芥和人的相似性分别为48%、50%和46%。实时荧光定量PCR结果显示杜氏盐藻STT3amRNA水平随着盐浓度的升高而逐渐增加,其水平在3.5 mol/L NaCl浓度时比在1.5 mol/L NaCl浓度时升高了11倍(P<0.01)。另外,与没有脱鞭毛的杜氏盐藻相比,STT3amRNA在鞭毛再生过程中持续高表达。本研究显示杜氏盐藻STT3a基因的高表达可以增强其盐适应和鞭毛再生能力。
杜氏盐藻,STT3a基因,耐盐,鞭毛再生
Abstract:To investigate the function ofSTT3agene in salt adaptation and flagellar regeneration ofDunaliella salina(D.salina), a pair of degenerate primers was designed according to conserved homologous amino acid sequences of VCVFTA and DVDYVL of STT3a fromChlamydomonas,Arabidopsis thalianaand other organisms.A cDNA sequence of 1 650 bp encoding a whole functional domain of STT3a was amplified fromD.salinaby RT-PCR and 3′ Rapid Amplification of cDNA Ends(RACE), which shared homology withChlamydomonas(48%),Arabidopsis thaliana(50%),Homo sapiens(46%), etc.Real-time fluorescence quantitative PCR(real-time Q-PCR)demonstrated that theSTT3amRNAs fromD.salinawere induced by increased concentration of NaCl, and increased to 11-fold higher by 3.5 mol/L NaCl than that by 1.5 mol/L NaCl(P<0.01).Also,STT3amRNA ofD.salinamaintained at a higher level in the process of flagellar regeneration with than without experiencing deflagellar treatment.In conclusion, the findings of this study demonstrate that the high expression of theSTT3agene enhances the capability of salt adaptation and flagellar regeneration inD.salina.
Keywords:Dunaliella salina,STT3agene, salt adaptation, flagellar regeneration
N-连接糖基化是内质网中最常见的蛋白质修饰,这个过程是由位于糙面内质网膜上的寡糖基转移酶(OST)催化的。一系列的研究发现酿酒酵母的OST包含8个亚基:Ost1p,Ost2p,Wbp1,Stt3p,Swp1p,Ost4p,Ost5p,Ost3p/Ost6p[1],STT3p 在已知的OST亚基中是最保守的[2],它在酵母中编码一个78 kDa的蛋白,为OST的催化亚基[3]。几乎所有的真核生物基因组中都存在编码酵母 Stt3p蛋白的同系物。哺乳动物细胞表达 Stt3p的两种同系物STT3a和 STT3b,它们的表达具有组织特异性,并能调节OST的活性,且含有一个STT3a亚基的OST复合物比含有STT3b亚基的OST复合物对于选择完全装配的长链寡糖供体(Glac3Man9GlcNAc2-PP-Dol)更具有特异性[3]。最近的研究还发现拟南芥OST的STT3a亚基作为一种跨膜蛋白在高盐应激反应中发挥一定作用[4]。
杜氏盐藻Dunaliella salina(D.salina)是一种高度耐盐的单细胞真核绿藻,它能在 0.5~5 mol/L NaCl盐浓度下生存,但是目前关于其耐盐机制还不清楚。另外,我们前期的研究发现:在高盐条件下,盐藻的运动性明显降低,而盐藻的鞭毛直接参与了盐藻自身的运动。为了探讨盐藻的盐耐受性和鞭毛介导的运动性之间是否有潜在的联系,本研究根据已知物种的 STT3a高度保守序列设计一对简并引物,通过RT-PCR及RACE方法获得STT3a功能结构域的cDNA序列,并通过实时荧光定量PCR技术监测STT3a基因mRNA在杜氏盐藻盐适应及鞭毛再生过程中的动态变化,以期了解STT3a基因在杜氏盐藻耐盐及鞭毛再生中的作用。
1 材料与方法
1.1 杜氏盐藻藻株、载体与菌株
杜氏盐藻藻株为 UTEX-LB-1644,购自美国德州大学。载体 pMD18T-vector购自大连宝生物工程公司。大肠杆菌DH5α为本室保存。
1.2 主要试剂
EcoRⅠ、Hind Ⅲ、LATaq酶、rTaq酶、胶回收试剂盒、质粒提取试剂盒及反转录试剂盒均购自大连宝生物工程公司。实时定量PCR荧光染料购自天根生化科技(北京)有限公司。First Choice RLMRACE Kit购自美国Ambion公司。
1.3 杜氏盐藻cDNA的制备及简并引物的设计
杜氏盐藻细胞按照 5×105/mL的接种量接种于改良的PKS液体培养基中,培养温度为26℃,光照强度为4500 Lux,光/暗培养各12 h。取对数生长期的杜氏盐藻细胞,用 Trizol法提取杜氏盐藻细胞的总RNA,琼脂糖凝胶电泳及分光光度计检测所提取总RNA的质量和浓度。取6 μg RNA作为模板,按照反转录试剂盒说明书制备反转录反应液,于37℃反转录1 h后,70 ℃ 10 min ,置于−20℃保存。从GenBank上搜索近10个物种的STT3a蛋白的氨基酸序列进行比对,找出两段相对比较保守的序列设计简并引物,上游引物:5′-GTNTG(T/C)GTNTT(T/C)ACNGC-3′,下游引物:5′-A(A/G)NAC(A/G)TA(A/G)TCNAC(A/G)TC-3′,引物由上海博尚生物技术有限公司合成。
1.4 RT-PCR
以制备的 cDNA为模板,利用合成的简并引物,用PCR的方法扩增STT3a的部分基因片段。PCR 反应体系为:cDNA 0.5 μL,10× LA Buffer 10 μL,dNTPs(10 mmol/L)8 μL,上、下游引物(20 μmol/L)各 1 μL,LATaq酶 0.5 μL,dH2O 补至100 μL。反应程序:95 ℃ 5 min;94℃ 30 s,50℃~60℃30 s,72 ℃ 2 min ,30个循环;72 ℃ 1 0 min,4℃终止反应。PCR反应结束后,1%的琼脂糖凝胶电泳检测扩增结果。将PCR产物胶回收,连接至pMD18T-vector中并转化大肠杆菌 DH5α,用含有 Amp、IPTG和 X-Gal的平板进行蓝白斑筛选,挑取阳性菌落扩大培养并提取质粒,将鉴定正确的菌样送北京博尚生物技术有限公司测序,序列通过Primer Premier 5.0整理并用BLAST进行同源性分析。
1.5 STT3a基因的3′RACE扩增
根据简并引物扩增得到的已知序列,设计STT3a的3′RACE引物(表1),提取杜氏盐藻的总RNA,按照 FirstChoice RLM-RACE Kit说明进行操作。PCR反应程序:95 ℃ 5 min;94℃ 30 s,58℃ 30 s,72 ℃ 1 min ,30个循环;72℃ 1 0 min,4℃终止反应。巢式PCR反应产物经1%的琼脂糖凝胶电泳检测。对目的片段进行胶回收后连接于pMD18T-vector上,转化大肠杆菌DH5α,挑取阳性菌落提取质粒,双酶切鉴定,正确后由北京博尚生物技术有限公司进行测序,序列通过Primer Premier 5.0整理并用BLAST进行同源性分析。
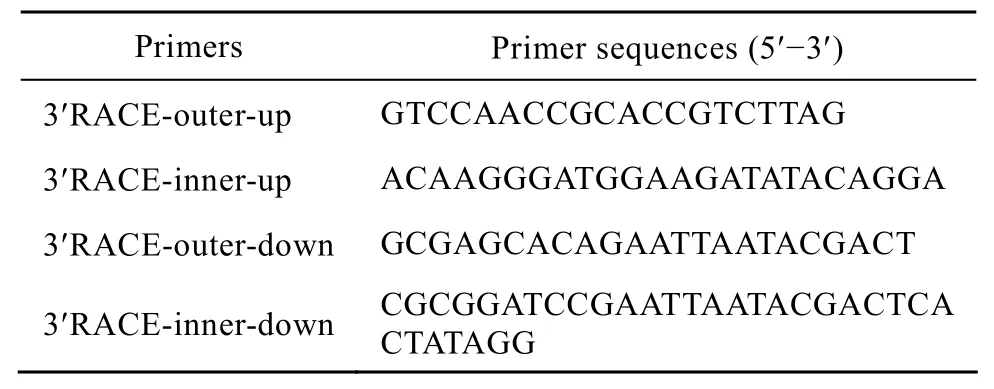
表1 设计的3′RACE引物序列Table 1 Primers used in 3′RACE
1.6 STT3a结构域的功能分析
通过Primer Premier 5.0在STT3a结构域中设计一对特异性引物,通过实时荧光定量 PCR分析STT3a在杜氏盐藻盐诱导及鞭毛再生过程中的作用。将对数生长期的杜氏盐藻分别转入0.75、1.0、1.5、2.0、3.0及3.5 mol/L NaCl的PKS液体培养基中光培养10 h后,收集不同盐浓度下的杜氏盐藻细胞;同时,将对数生长期的杜氏盐藻分别转入1.5、3.0 mol/L NaCl的PKS液体培养基中光照培养,分别收集0、2、4、6、8和10 h的杜氏盐藻细胞,分别提取上述处理细胞的总RNA,取6 μg RNA作为模板反转录为cDNA。取0.8 μL cDNA作为模板,按照实时荧光定量 PCR说明书进行操作,同时以GAPDH为内参。反应程序:95 ℃ 5 min ;94℃ 30 s,60℃ 30 s,72℃ 30 s,35 个循环;95℃ 15 s,60℃30 s,95℃ 15 s。PCR产物通过琼脂糖凝胶电泳检测及测序,并运用 2-△△Ct方法[5]分析STT3a基因的相对表达量。
另外,取对数生长期的杜氏盐藻细胞,在添加甘油的电击缓冲液中用机械方法[6]去除鞭毛后,分别收集 0、15、30、45、60、90、120、150、180、210、240、270、300、360和420 min时的杜氏盐藻细胞,同时以未经过去鞭毛处理的杜氏盐藻细胞作为对照组。按上述方法制备 cDNA,进行实时荧光定量PCR。
1.7 杜氏盐藻鞭毛再生不同时期的鞭毛银染
运用改进的银染法[7]对杜氏盐藻鞭毛及藻体进行银染。
1.8 杜氏盐藻鞭毛再生不同时期鞭毛长度的测量
用荧光显微镜在相同条件下对鞭毛再生不同时期的杜氏盐藻细胞照相,然后每个时期分别取30个杜氏盐藻样本,利用细线拟合鞭毛,进行鞭毛长度的测量,取其鞭毛生长平均值,根据公式V=(S2−S1)/t(其中V为相对生长速率,S2和S1分别为相邻两个时间点的鞭毛长度平均值,t代表间隔时间),最终求出杜氏盐藻鞭毛不同时期的相对生长速率。
1.9 统计学分析
试验中每项处理均重复 3次。数据运用 SPSS统计分析软件对样本进行方差检验,每次试验中P<0.05,表明差异显著。
2 结果
2.1 杜氏盐藻总RNA的纯度和质量鉴定
所提取的杜氏盐藻总RNA质量完好,28S和18S rRNA带比较清晰,无拖尾现象,其亮度比约为2∶1,无 RNA降解和 DNA、蛋白质污染,可以用于下步实验。
2.2 RT-PCR产物鉴定
电泳结果如图1所示,所得片段长度约为1 500 bp,与理论值相符。胶回收后连接于pMD18T-vector上,得到载体pMD-stt3,用EcoRⅠ和Hind Ⅲ进行双酶切鉴定,可见一条载体片段和一条插入片段,插入片段与回收片段大小一致。
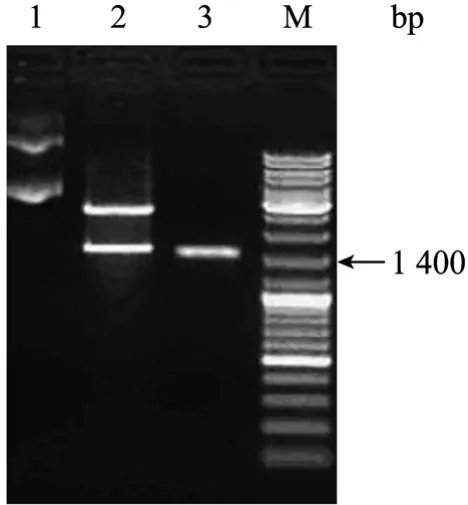
图1 RT-PCR扩增杜氏盐藻STT3a cDNAFig.1 Amplification ofSTT3acDNA fromD.salinaby RT-PCR. 1: pMD-stt3; 2: pMD-stt3 digested withEcoRⅠ andHind Ⅲ ; 3: PCR amplification product; M: DNA marker.
2.3 杜氏盐藻STT3a基因3′下游序列的扩增
经过巢式PCR,电泳结果如图2所示:所得片段长度约为 850 bp,胶回收后连接于 pMD18T-vector上,得到载体pSTT3-1,用EcoRⅠ和Hind Ⅲ进行双酶切鉴定,可见一条载体片段和一条插入片段,插入片段与回收片段大小一致。
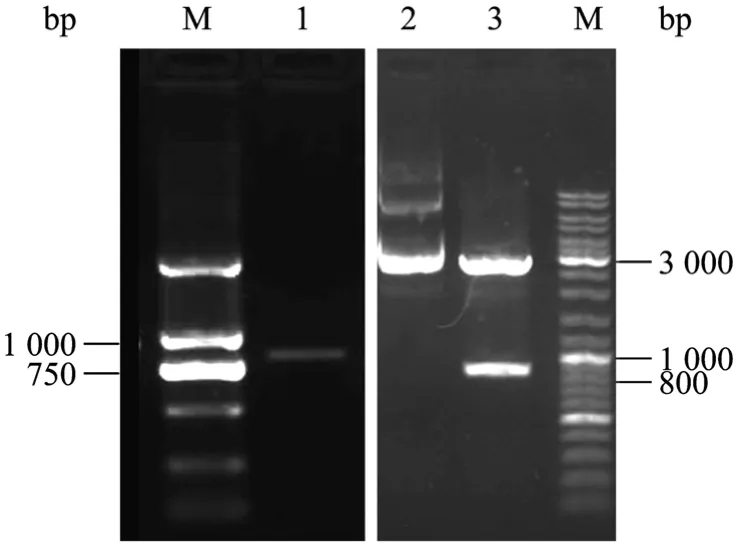
图2 巢式PCR扩增杜氏盐藻STT3a基因3′下游序列Fig.2 Amplification of the 3′ downstream sequence ofD.salinaSTT3agene by nested PCR.M: DNA marker; 1: 3′downstream sequence amplification product ofSTT3agene; 2:pSTT3-1; 3: pSTT3-1 digested withEcoRⅠandHind Ⅲ.
2.4 同源性分析
STT3a基因的同源性分析表明:在STT3a基因的3'下游序列中发现WWDYG与DK两个保守的基序。克隆获得STT3a基因1 869 bp,其中STT3a的功能结构域cDNA序列约为1 650 bp,编码550个氨基酸(图3),BLAST比对显示它和衣藻、拟南芥、稻、高粱、毛果杨、玉米、人等的 STT3a同源性分别为 48%、50%、50%、50%、49%、50%和46%。GenBank登录序列号:GU301076。
2.5 不同盐浓度诱导下STT3a mRNA表达情况
如图4所示:相对于1.5 mol/L NaCl盐浓度的正常培养条件,杜氏盐藻STT3amRNA水平在0.75、1.0、2.0、3.0和3.5 mol/L NaCl盐浓度培养条件下明显升高(P<0.01),且在3.5 mol/L NaCl浓度时比在1.5 mol/L NaCl浓度时升高了11倍。图5中可以看出,在高盐胁迫下(3.0 mol/L NaCl),STT3amRNA的水平高于正常盐浓度条件(1.5 mol/L NaCl)下的STT3amRNA水平(P<0.05),在 10 h时,STT3amRNA的水平相对于0 h升高了8.5倍。这说明STT3a基因的表达与盐诱导有关,STT3a基因可能直接或间接参与了杜氏盐藻的耐盐机制。
2.6 杜氏盐藻鞭毛再生不同时期STT3a mRNA表达情况

图3 STT3a蛋白推测的功能结构域Fig.3 Putative functional domains of STT3a fromD.salina.

图4 不同盐浓度诱导下 STT3a基因表达情况(**P<0.01)Fig.4 Expression ofD.salinaSTT3agene in different salt concentrations.**P<0.01.
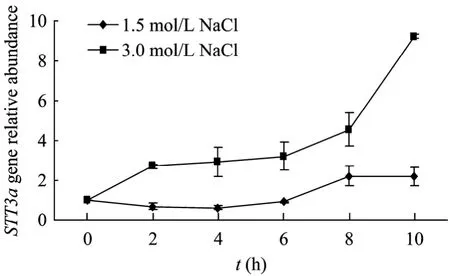
图5 高盐胁迫(3.0 mol/L NaCl)下杜氏盐藻STT3a基因表达情况Fig.5 Expression ofD.salinaSTT3agene in high salt stress(3.0 mol/L NaCl).
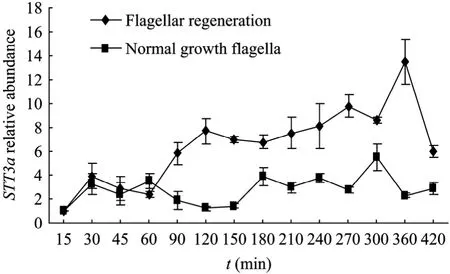
图6 鞭毛再生不同时期STT3a基因表达情况Fig.6 Expression ofD.salinaSTT3agene in different states of flagellar regeneration.
如图6所示:杜氏盐藻鞭毛再生过程中STT3amRNA水平较正常培养条件下没有脱鞭毛的持续高表达。鞭毛再生过程0~60 min中STT3amRNA的水平基本没有变化,60~120 min中STT3amRNA的水平逐渐升高,说明杜氏盐藻鞭毛在最初受损再生过程中延迟至 60 min才开始逐渐大量表达,120~300 min中STT3amRNA的水平处于平台期,但相比较正常培养条件下的杜氏盐藻,其STT3amRNA仍大量表达,这个时期的杜氏盐藻鞭毛仍在逐渐生长,420 min后,STT3amRNA的水平逐渐趋于正常值(P<0.05)。
2.7 杜氏盐藻鞭毛再生不同时期鞭毛长度变化及相对生长速率
从图7中可以清楚地看出杜氏盐藻鞭毛再生的前15 min鞭毛增长比较明显,随着时间的延长,杜氏盐藻鞭毛逐渐延长,至420 min时基本上完成鞭毛再生。图8中可以看出,在杜氏盐藻鞭毛再生的初级阶段,鞭毛生长较快,在前15 min内,其相对生长速率为 0.0835 μm/min,30~240 min 时鞭毛的相对生长速率逐步降低,300~360 min时鞭毛相对生长速率降低至0.0017 μm/min,表明鞭毛的生长基本完成。在杜氏盐藻鞭毛再生的不同时期,其鞭毛相对生长速率的变化与STT3a基因mRNA水平的变化基本相一致。

图8 杜氏盐藻鞭毛再生不同时期的相对生长速率Fig.8 The relative growth rates ofD.salinain different times of flagellar regeneration.
3 讨论
OST是蛋白进入分泌途径的门户,它负责催化完整的多萜醇结合前体聚糖向多肽接纳体的转移,这种酶的特异性决定需要有Asn-X-Ser/Thr(X是除脯氨酸以外的任何氨基酸)这一接纳体序列的存在。在OST的作用下,寡糖链与膜上的磷酸多萜醇分离,而与Asn的N-端相连。完整的寡糖链向新生多肽链的转移发生在内质网的腔内侧。
以往对STT3a的研究多集中在对其结构方面的研究,但对其功能的研究还相对较少。研究发现STT3为 OST的催化亚单位,它有一个Ncyt-Clum拓扑结构,含有 11个跨膜螺旋[8],3′下游序列中有WWDYG与 DK两个保守的基序[9]。Koiwa 等[4]发现拟南芥OST的STT3a亚基对盐和渗透压有反应,本研究中我们也证实了STT3a基因的表达与盐诱导有关,随着盐浓度的逐渐升高,STT3a的mRNA表达也提高。
杜氏盐藻的耐盐机制比较复杂,到目前为止还没有完全研究清楚。研究发现杜氏盐藻的耐盐机制除受到甘油和离子流动的调节外,还有一些蛋白质的参与[10]。Fisher等[11]在杜氏盐藻细胞膜中发现了一种 p60蛋白质,它是一种双拷贝的碳酸酐酶(DCA)基因,具有调节细胞渗透压的作用,而且随着盐浓度的升高,其mRNA水平和细胞外DCA的活性也同时提高。本研究室也发现杜氏盐藻细胞膜中的DCA基因mRNA水平随着盐浓度的升高而升高,并且在2.0 mol/L NaCl盐浓度下杜氏盐藻DCA活性达到最高。STT3a作为杜氏盐藻一种新发现的跨膜蛋白,能直接感受培养基中盐浓度的变化,本研究也证实杜氏盐藻STT3a的 mRNA水平随着盐浓度的升高而升高。这些结果可能为我们研究杜氏盐藻DCA与STT3a在耐盐方面的协同作用提供理论依据。
鞭毛与纤毛是一种由细胞质膜延伸的细胞表面突起,主要由微管组成。鞭毛膜作为特化的细胞膜,其再生受到多种基因的精确调控,然而关于其调控机制知之甚少。为了解跨膜蛋白STT3a在杜氏盐藻鞭毛再生中的作用,本研究监测了鞭毛再生不同时期STT3amRNA水平的变化。结果显示,STT3a基因在杜氏盐藻鞭毛最初受损再生过程中延迟至60 min才开始逐渐大量表达,之后直至鞭毛完成再生过程中都高表达。这可能是因为杜氏盐藻藻体本身储存的一些STT3a蛋白在鞭毛再生的初期起到作用,随着鞭毛再生过程中对STT3a蛋白需求的增加,STT3a基因开始逐渐大量表达。这提示STT3a可能作为一种跨膜蛋白,直接或间接参与了杜氏盐藻鞭毛膜的再生或者鞭毛再生过程中所需相关蛋白的糖基化修饰,这些结果可能为我们研究杜氏盐藻鞭毛再生过程中基因的调控机制提供理论依据。
鞭毛作为杜氏盐藻的运动细胞器直接参与盐藻的游动,而高盐条件下杜氏盐藻运动迟缓是否和高盐影响相关基因的表达有关,目前还没有实验证据。本研究发现跨膜蛋白STT3a既参与了杜氏盐藻的耐盐调控,又参与了杜氏盐藻鞭毛的再生过程,提示杜氏盐藻的盐耐受性和鞭毛介导的运动性之间可能有潜在的联系,值得进一步的研究。
REFERENCES
[1]Knauer R, Lehle L.The oligosaccharyltransferase complex from yeast.Biochim Biophys Acta, 1999, 1426(2):259−273.
[2]Burda P, Aebi M.The dolichol pathway of N-linked glycosylation.Biochim Biophys Acta, 1999, 1426(2):239−257.
[3]Kelleher DJ, Karaoglu D, Mandon EC.Oligosaccharyltransferase isoforms that contain differentcatalytic STT3 subunits have distinct enzymatic properties.Mol Cell, 2003, 12(1): 101−111.
[4]Koiwa H, Li F, McCully MG,et al.The STT3a subunit isoform of theArabidopsisoligosaccharyltransferase controls adaptive responses to salt/osmotic stress.Plant Cell, 2003, 15(10): 2273−2284.
[5]Livak KJ, Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod.Methods, 2001, 25(4): 402−408.
[6]Rosenbaum JL, Moulder JE, Ringo DL.Flagellar elongation and shortening inChlamydomonas.The use of cycloheximide and colchicine to study the synthesis and assembly of flagellar proteins.J Cell Biol, 1969, 41(2):600−619.
[7]Jia YL, Xue LX, Li J,et al.Isolation and proteomic analysis of the halotolerant algaDunaliella salinaflagella using shotgun strategy.Mol Biol Rep, 2010, 37: 311−316.
[8]Kim H, von Heijne G, Nilsson I.Membrane topology of the STT3 subunit of the oligosaccharyl transferase complex.J Biol Chem, 2005, 280(21): 20261−20267.
[9]Igura M , Maita N, Kamishikiryo J,et al.Structureguided identi fi cation of a new catalytic motif of oligosaccharyltransferase.EMBOJ, 2008, 27(1):234−243.
[10]Li J, Lu YM, Xue LX,et al.A structurally novel salt-regulated promoter of duplicated carbonic anhydrase gene 1 fromDunaliella salina.Mol Biol Rep, 2010, 37:1143−1154.
[11]Fisher M, Gokhman I, Pick U,et al.A salt-resistant plasma membrane carbonic anhydrase is induced by salt inDunaliella salina.J Biol Chem, 1996, 271(30):17718−17723.
Characterization of the functional domain of STT3a of oligosaccharyltransferase from Dunaliella salina
Cui Wang, Jie Li, Liping Liu, Lei Zeng, and Lexun Xue
Laboratory for Cell Biology, Department of Bioengineering, Zhengzhou University, Zhengzhou 450001, China
Received:December 29, 2009;Accepted:April 21, 2010
Supported by:International Cooperative Project of the National Science and Technology Ministry(No.2007DFA01240), National Natural Science Foundation of China(No.30700014).
Corresponding author:Jie Li.Tel: +86-371-66658332; E-mail: lijiechen@zzu.edu.cn Lexun Xue.Tel: +86-371-66658332; E-mail: xuelx@371.net科技部国际科技合作项目(No.2007DFA01240),国家自然科学基金项目(No.30700014)资助。

