五个水稻类受体激酶的抗体制备及检测
王博,李莉云,曹英豪,刘子光,刘国振
河北农业大学生命科学学院,保定 071001
五个水稻类受体激酶的抗体制备及检测
王博,李莉云,曹英豪,刘子光,刘国振
河北农业大学生命科学学院,保定 071001
类受体激酶在植物发育、自交不亲和、雄性不育、抗逆和抗病等生命过程中起着重要的调控作用。为了对水稻类受体激酶的功能及生物学特性进行深入研究,本实验克隆表达了水稻中 5个类受体激酶抗原表位片段,以纯化的蛋白质为抗原免疫新西兰兔,获得了特异性较高的多克隆抗体。Western blotting检测结果表明,5个类受体激酶均在叶片中表达。
水稻,类受体激酶,蛋白质纯化,多克隆抗体
Abstract:Receptor-like kinase involves self-incompatibility, male sterility, stress responses, and disease resistance.To better understand the physiological function and biological characteristics of rice receptor-like kinase, we cloned five predicted epitope fragments of rice receptor-like kinase.The purified fusion protein was used as antigen to immunize rabbit to get specific polyclonal antibodies.Western blotting analysis shows that the five receptor-like kinases were expressed in rice leaves.
Keywords:rice, receptor-like kinase, protein purification, polyclonal antibody
水稻Oryza sativaL.是世界上最重要的谷类作物之一,是研究作物产量、转基因、杂种优势、植物病虫害抗性和其他抗逆等方面的重要遗传材料。近年来,随着水稻基因组的测序完成,越来越多的研究者将目光投向了这一模式植物。
植物类受体激酶(Receptor-like kinase,RLK)在真核生物中广泛存在,水稻中已经发现了约1 130个类受体激酶,其数目大约是拟南芥的 2倍[1],它们在抗病、发育、自交不亲和性、植物激素的信号传递、器官脱落、细胞分裂和生长等过程中发挥重要作用。目前克隆的植物类受体激酶数目不多,主要来源于拟南芥、水稻、油菜和烟草等植物[1],对植物类受体激酶的功能更是知之甚少。
植物类受体激酶主要由胞外结构域、跨膜结构域和胞内激酶结构域 3部分组成。根据胞外受体结构域的特点,植物类受体蛋白激酶可分为以下几类:含S-结构域类(S-Domain Kinase,SRK)、富含亮氨酸类(LRR-RLK)、细胞壁连接类(Wall-associated kinase,WAK)、表皮生长因子类(Epidermal growth factor,EGF)、肿瘤坏死因子受体类(Tumor necrosis factor receptor,TNFR)和组氨酸类受体蛋白激酶[1]。其中,WAK通过细胞的伸长生长,调控侧根的生长发育[2];对玉米的Crinkly4(TNFR类)基因研究发现,它编码的激酶参与调控叶表皮细胞和胚乳中糊粉细胞的分化[3];LRR-RLKs,其胞外受体部分具有重复出现的富含亮氨酸的结构域,在分子识别中起重要作用[4],如抗病基因Xa21[5]、Xa26[6]、Pi-d2[7]等属于此类;S位点受体激酶与自交不亲和反应相关[8]。
目前,采用纯化蛋白质或合成多肽作为抗原免疫动物制备抗体,并用于植物中的蛋白质功能研究这一实验手段已很常见[9-10],但是针对植物类受体激酶的抗体还为数不多[11-12],本研究室在对水稻类受体激酶的克隆、表达和磷酸化活性等研究的基础上[13],从中挑选出5个功能和类别不同的类受体激酶,分析了它们的抗原表位片段,并克隆到细菌表达载体上,进行体外的表达和纯化,以纯化蛋白质为抗原免疫新西兰兔,制备抗体,为进一步研究类受体激酶的生化特性及其生物学功能提供了有力工具。
1 材料与方法
1.1 材料
水稻93-11、水稻根cDNA文库、pET-30a质粒为本实验室保存。限制性内切酶EcoR I、BglII、Hind III购自NEB公司。ExTaqDNA聚合酶购自TaKaRa公司。大肠杆菌菌株DH5α、ER2566为本实验室保存。
1.2 抗原决定簇预测
用 BEPITOPE软件[14]对候选RLKs基因编码的蛋白质进行抗原表位预测,根据不同表位预测方法(疏水性、可及性、二级结构等)加和修正之后得到的一致峰图,选出峰值较高的片段后,用 BLASTP对水稻蛋白质库进行唯一性检测后选出目标片段。
1.3 细菌表达载体的构建
根据 NCBI公布的水稻序列设计引物,见表1。PCR扩 增 条 件 为 :94 ℃ 4 min ;94 ℃ 1 min,58℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 1 0 min。
将pET-30a载体进行双酶切,与PCR产物连接。连接产物转化大肠杆菌DH5α,提取质粒进行酶切验证。挑选出正确的重组子送北京华大基因研究中心测序验证。
1.4 融合蛋白质的诱导表达及其大量纯化
将测序正确的重组子质粒转化大肠杆菌ER2566,挑取单菌落到 LB+Kan(50 μg/mL)培养基中,37℃振荡培养,次日将过夜菌转接至LB+Kan+1%葡萄糖培养基中,培养至OD600约为0.7,加入1 mmol/L的IPTG,37℃振荡培养3 h。收集细胞沉淀,超声后分别取上清和沉淀进行15% SDS-PAGE检测,考马斯亮蓝染色观察。
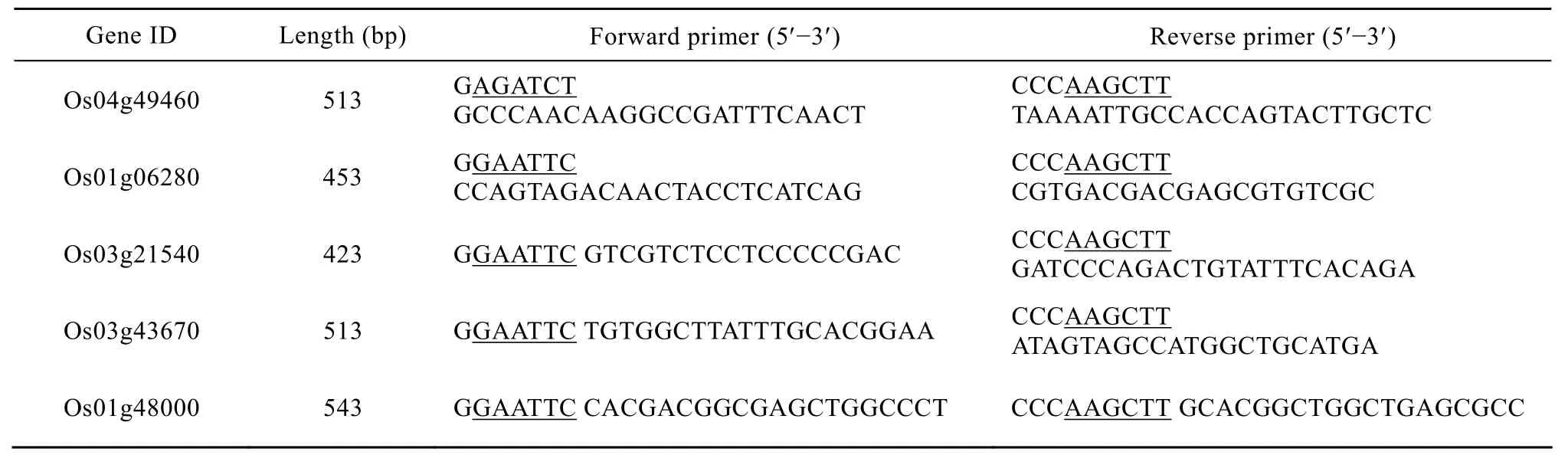
表1 Gene ID及扩增引物信息Table 1 Gene ID and information of primers
将诱导的菌液离心,在沉淀中加入 10 mmol/L Tris;再加2 mol/L尿素和10 mmol/L Tris,吹匀沉淀后离心,于沉淀中加入 0.5~1 mL 10 mmol/L Tris;再加 5~10 mL 8 mol/L 尿素+0.5 mol/L NaCl+10 mmol/L Tris,冰水浴超声。4℃放置30 min,离心,弃上清,向沉淀中加入10 mmol/L Tris,将溶解后的样品上样,过镍柱进行亲和层析。上样结束后,分别用15 mmol/L和60 mmol/L咪唑溶液洗去杂蛋白质,最后,用300 mmol/L咪唑溶液,洗脱目的蛋白质。利用15% SDS-PAGE电泳检测,考马斯亮蓝染色观察。
1.5 抗体的制备与检测
将纯化后并富集的重组蛋白质送至北京华大蛋白质研发中心有限公司,免疫新西兰兔,获得多克隆抗体。
将免疫新西兰兔得到的抗体血清,按1∶1加入100%甘油稀释后,以1∶5 000和1∶2 500的一抗稀释倍数,分别与纯化的重组抗原和水稻叶片蛋白质进行免疫印记检测。
1.6 水稻叶片蛋白质的提取
用液氮研磨新鲜水稻组织至粉末状,加入蛋白质裂解液(62.5 mmol/L Tris,pH 7.4,10%甘油,2%SDS,20 mmol/L NaF,2 mmol/L EDTA,1 mmol/L PMSF,1 mmol/L DTT),冰水混合物中孵育10 min,4℃,12 000 r/min 离心15 min,取上清,转移到新的1.5 mL 离心管中。
1.7 Western blotting检测
将提取的水稻蛋白质进行SDS-PAGE后,电转移到PVDF膜上,用5%脱脂奶粉封闭PVDF膜,用制备的抗体室温孵育3 h,TTBS(2 mmol/L Tris(pH 7.6),13.6 mmol/L NaCl,0.1% Tween-20)洗膜3次,每次10 min,之后加入羊抗兔二抗室温孵育1 h,TTBS洗膜3次,每次10 min,加ECL Plus检测液检测,暗室X光片曝光。
2 结果
2.1 水稻 RLKs基因序列的获得和抗原决定簇的预测
根据前期工作,挑取不同类别和功能各异的 5个水稻类受体激酶,分别为WAKs(Os04g49460)、Calcium-regulated protein kinase (CRPK1L-1)(Os01g06280、Os03g21540)、Crinkly 4_Like(Os03g43670)和 SRKs(Os01g48000)。
使用BEPITOPE软件对5个RLKs的抗原表位进行了预测分析,选取抗原表位峰值较高的蛋白片段进行研究,由于胞外区在激酶调控过程中具有重要作用,我们最终确定的克隆片段均位于胞外区。然后进行蛋白质的唯一性检测,确定了在CDS上的位置依次为 115~627 bp(Os04g49460);79~531 bp(Os01g06280);601~1023 bp(Os03g21540);511~1 023 bp(Os03g43670);310~852 bp(Os01g48000)(图1)。
2.2 水稻RLKs基因片段的克隆
用水稻根的 cDNA为模板,进行 PCR,结果表明,扩增产物的片段大小与预测的类受体激酶基因片段的大小相符合。从转化平板上挑取单菌落,提取质粒DNA,酶切后琼脂糖电泳检测。将酶切正确的重组质粒送到北京华大基因研究中心进行测序,结果证明重组子的序列是正确的(结果未显示)。
2.3 融合蛋白质的诱导表达及其纯化
对克隆得到的融合蛋白质进行了体外的诱导表达,SDS-PAGE电泳检测结果显示,融合蛋白质在工作浓度为1 mmol/L的IPTG的诱导条件下,在沉淀中均有大量表达(图2),且融合蛋白质的大小符合预测大小(22、19、17、22、25 kDa)。
通过特异识别His-Tag的beads获得了体外纯化的类受体激酶胞外区域表位片段与 6×His融合蛋白质,融合蛋白质的大小符合预测值。将纯化的蛋白质过大量蛋白纯化柱进行富集,当抗原的量积累到约5~10 mg时,进行洗脱,得到较纯的高浓度目的蛋白质(图3),并用其对新西兰兔进行免疫,制备抗体。
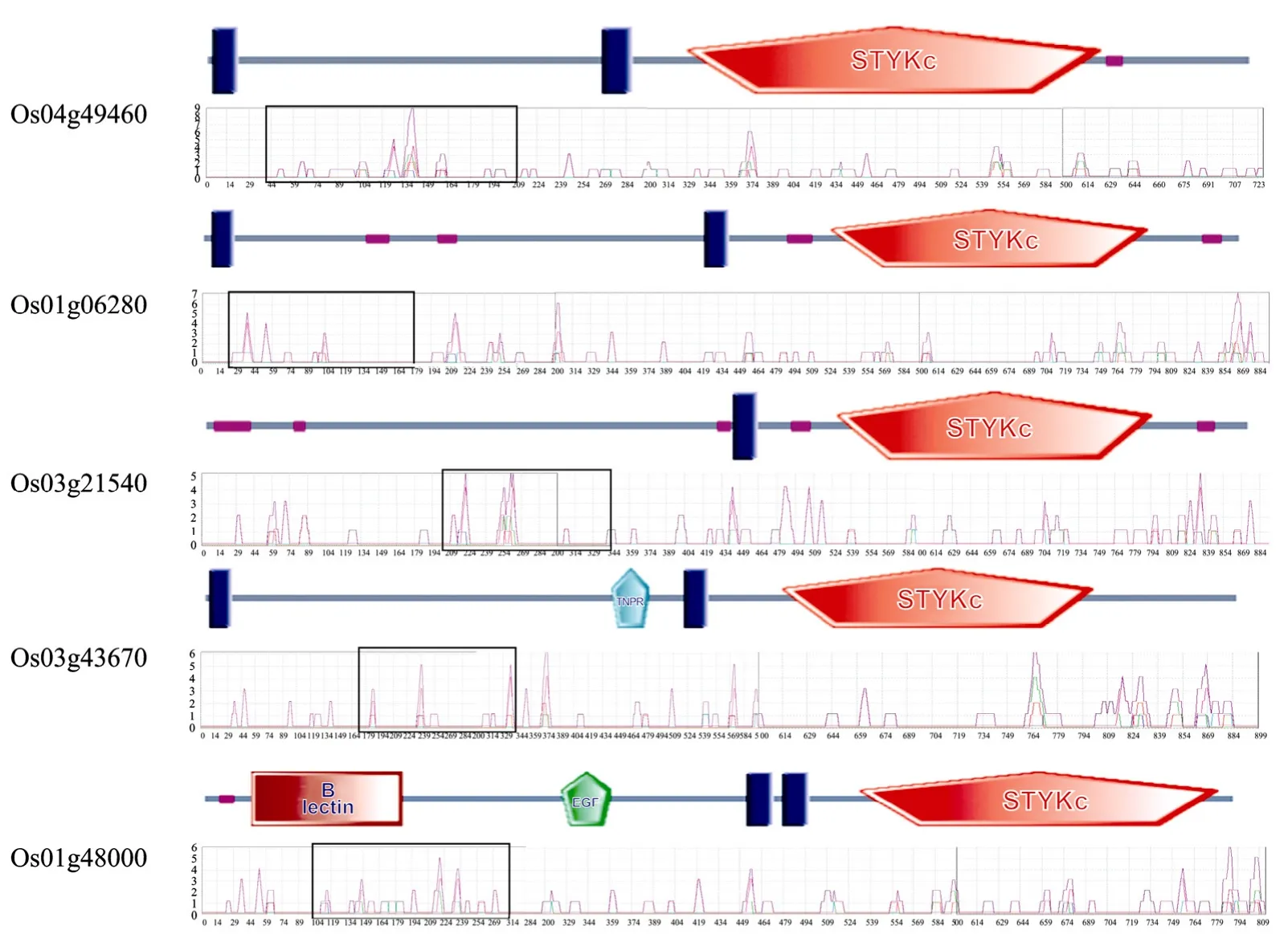
图1 五个类受体激酶的抗原表位分析及克隆片段的选择Fig.1 Epitope prediction and fragment selection ofRLKs.The domain structure predicted and analyzed by SMART(http://smart.emblheidelberg.de/)and BEPITOPE.
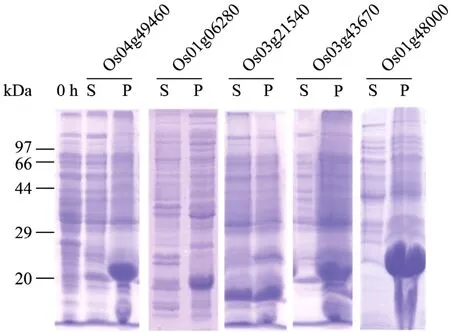
图2 融合蛋白质的体外诱导表达Fig.2 Expression of recombinant proteinsin vitro.0 h:control of without IPTG; S: supernatant by ultrasonic; P:pellet by ultrasonic.Os04g49460-P(22 kDa); Os01g06280-P(19 kDa); Os03g21540-S(P)(17 kDa); Os03g43670-P(22 kDa); Os01g48000-P(25 kDa).
2.4 RLKs抗体能识别重组抗原
使用制备的多克隆抗体按 1∶5 000的稀释倍数,对细菌表达的融合蛋白质进行免疫印迹检测。结果显示,抗体能够特异识别目标抗原(图4)。
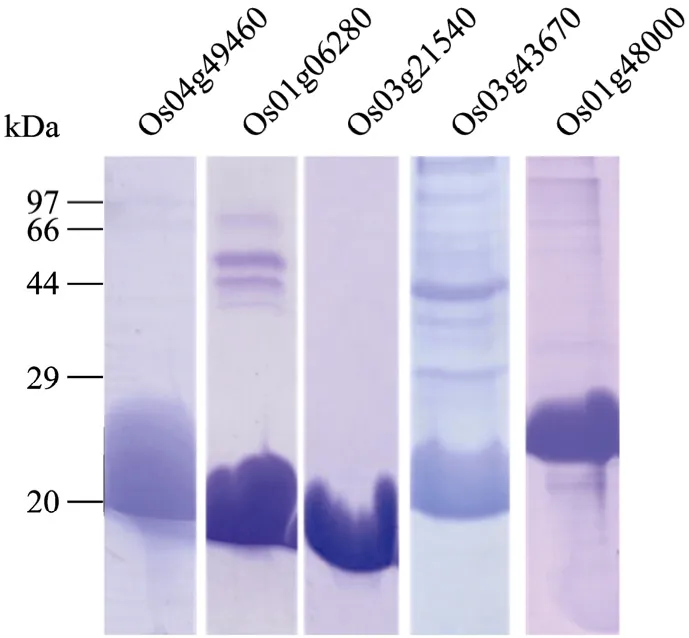
图3 融合蛋白质的大量纯化Fig.3 Purification of fusion proteinsin vitro.Os04g49460(22 kDa); Os01g06280(19 kDa); Os03g21540(17 kDa);Os03g43670(22 kDa); Os01g48000(25 kDa).
2.5 RLKs抗体在水稻叶片组织中的表达
使用RLKs抗体按1∶2 500的稀释倍数,对水稻苗期叶片中的蛋白质进行了检测。结果显示,5个抗体均可识别水稻中的蛋白质。其中,抗体Os04g49460可观察到清晰的主带,大小与全长蛋白质的预测值80 kDa基本相符,还有一条分子量稍大的弱带出现;抗体Os01g06280检测到单一的特异条带,大小略高于全长蛋白质的预测值97 kDa;抗体Os03g21540检测到单一的特异条带,大小约为60 kDa,低于全长蛋白质的预测值 97 kDa;抗体Os03g43670可见有3条清晰的条带,其中2条带分子量略大于全长蛋白质的预测值99 kDa,一条带分子量较小约为50 kDa;抗体Os01g48000检测到单一的特异条带,大小约为60 kDa,低于全长蛋白质的预测值89 kDa(图5)。
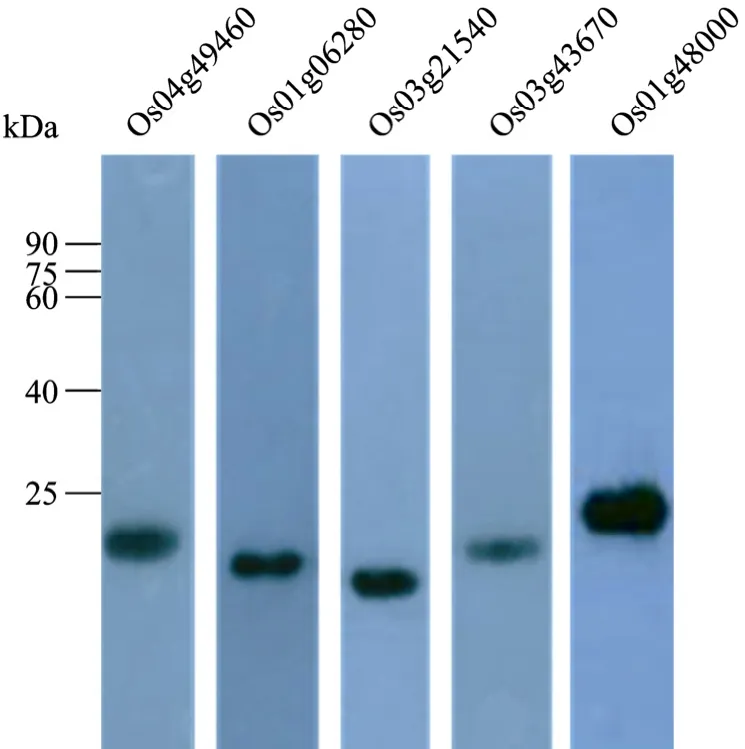
图4 RLKs抗体的重组抗原检测Fig.4 Western blotting ofRLKs antibodies with recombinant proteins.Os04g49460(22 kDa); Os01g06280(19 kDa);Os03g21540(17 kDa); Os03g43670(22 kDa); Os01g48000(25 kDa).
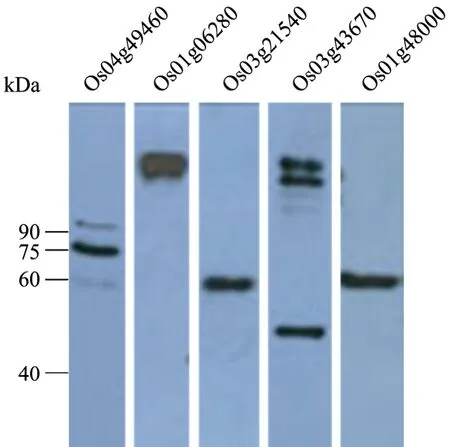
图5 RLKs抗体在水稻苗期叶片中的表达Fig.5 Expression ofRLKs in shoot of rice 93-11.Os04g49460(95 kDa, 80 kDa and 60 kDa); Os01g06280(130 kDa);Os03g21540(60 kDa); Os03g43670(130 kDa, 120 kDa and 50 kDa); Os01g48000(60 kDa).
造成抗体在水稻苗期叶片组织中检测结果与其全长蛋白质预测分子量不符这一结果的原因,很可能与蛋白质在植物体内不同的翻译后修饰[15]以及不同的剪切形式有关。当然,这其中也不能排除蛋白质降解的因素。
3 讨论
通常来讲,抗体制备可以用全长的蛋白质、片段蛋白或合成多肽作免疫原,若对全长蛋白质进行克隆,难度较大,甚至有些蛋白质很难在体外表达。因此,本实验从5个RLKs蛋白质出发,选取部分片段进行克隆表达,并获得了纯化的蛋白质。结果表明,采用这一方法可以获得足量的高纯度蛋白质用于动物免疫,得到具有较高特异性的抗体,证明了这一技术路线的可靠性[9-12]。本实验制备完成的 5个抗体,均能特异性识别水稻叶片中的蛋白质,其中Os03g43670与马云所做的抗体[12]一致,只是克隆的位置不同,马云等检测到水稻组织中的蛋白质分子量约120 kDa,与预测分子量约99 kDa存在一些差异,这主要是由于蛋白质的翻译后修饰造成的。
细胞壁在植物的生长过程以及在遭受病原菌侵染或其他胁迫处理时发挥着重要作用,然而目前对植物细胞壁与细胞质之间信号传递途径还知之甚少,WAK提供了一个研究此过程的很好的候选对象,相信深入解析 WAK的作用机制将有助于我们了解细胞壁信号的传递过程,也为我们了解植物细胞在生长发育和对环境刺激应答过程中的调控提供帮助[2]。SRK位于柱头表面乳突细胞的原生质膜上,是甘蓝等芸薹属作物柱头识别自花花粉、启动自交不亲和信号传导和最终导致自花花粉萌发受阻的核心关键酶[8,16]。已报告的 LRR-RLKs参与调节的发育过程有花器官的脱落(HAESA)、表皮细胞特化(CRINKLY4)、调控长角果的成熟发育(TMKL1)、雄性器官的发育(RPK1)等等[1]。
随着水稻基因组序列信息的阐释和转录谱数据的积累,基于抗体的蛋白质组学研究将成为现实。本研究以水稻为材料,克隆和表达蛋白激酶片段,纯化蛋白质并进行抗体的制备,为进一步研究激酶的生化特性和功能提供了实验依据。目前利用 5个抗体对水稻不同组织和发育时期的表达研究正在进行中。同时本实验体系的构建对于其他植物类受体激酶的抗体制备及其功能研究具有重要的意义。
REFERENCES
[1]Shiu SH, Karlowski WM, Pan R,et al.Comparative analysis of the receptor-like kinase family inArabidopsisand rice.Plant Cell, 2004, 16(5): 1220−1234.
[2]Lally D, Ingmire P, Tong HY,et al.Antisense expression of a cell wall-associated protein kinase, WAK4, inhibits cell elongation and alters morphology.Plant Cell, 2001,13(6): 1317−1331.
[3]Becraft PW, Stinard PS, McCarty DR.CRINKLY4: a TNFR-like receptor kinase involved in maize epidermal differentiation.Science, 1996, 273: 1406−1409.
[4]Nam KH, Li JM.BRI1/BAK1, a receptor kinase pair mediating brassinosteroid signaling.Cell, 2002, 110(2):203−209.
[5]Song WY, Wang GL, Chen LL,et al.A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21.Science, 1995, 270: 1084−1086.
[6]Sun XL, Cao YL, Yang ZF,et al.Xa26, a gene conferring resistance toXanthomonas oryzaein rice, encodes an LRR receptor kinase-like protein.Plant J, 2004, 37: 517−527.
[7]Chen XW, Shang JJ, Chen DX,et al.A B-lectin receptor kinase gene conferring rice blast resistance.Plant J, 2006,46(5): 794−804.
[8]Goring DR, Rothstein SJ.The S-locus receptor kinase gene in a self-incompatibleBrassica napusline encodes a functional serine/threonine kinase.Plant Cell, 1992, 4(10):1273−1280.
[9]Katou S, Kuroda K, Seo S,et al.A calmodulin-binding mitogen-activated protein kinase phosphatase is induced by wounding and regulates the activities of stress-related mitogen-activated protein kinases in rice.Plant Cell Physiol, 2007, 48(2): 332−344.
[10]Cheong YH, Moon BC, Kim JK,et al.BWMK1, a rice mitogen-activated protein kinase, locates in the nucleus and mediates pathogenesis-related gene expression by activation of a transcription factor.Plant Physiol, 2003,132(2): 1961−1972.
[11]Cheng YW, Li L, Shen R,et al.Prokaryotic expression and polyclonal antibody preparation of the extracellular domain about rice LRR receptor like protein kinase.Prog Biochem Biophys, 2008, 35(9): 1077−1083.程彦伟, 李亮, 沈嵘, 等.水稻 LRR型类受体蛋白激酶胞外区的原核表达及多克隆抗体制备.生物化学与生物物理进展, 2008, 35(9): 1077−1083.
[12]Ma Y, Sun DY, Sun Y.Preparation and identification of antibody against OsCR4, the receptor-like kinase from rice.Chin J Biochem Mol Bio, 2006, 22(11): 924−930.马云, 孙大业, 孙颖.水稻类受体激酶OsCR4的抗体制备及特异性检测.中国生物化学与分子生物学报, 2006,22(11): 924−930.
[13]Li LY, Sun J, Wang HJ.High throughput cloning,expression and autophosphorylation analysis of rice kinases.J Mol Cell Bio, 2007, 40(3): 245−250.李莉云, 孙健, 王海娇, 等.水稻蛋白激酶的规模化克隆、表达及活性研究.分子细胞生物学报, 2007, 40(3):245−250.
[14]Odorico M, Pellequer JL.BEPITOPE: predicting the location of continuous epitopes and patterns in proteins.J Mol Recognit, 2003, 16(1): 20−22.
[15]Kaothien P, Ok SH, Shuai B,et al.Kinase partner protein interacts with the LePRK1 and LePRK2 receptor kinases and plays a role in polarized pollen tube growth.Plant J,2005, 42(4): 492−503.
[16]Takasaki T, Hatakeyama K, Suzuki G,et al.The S receptor kinase determines self-incompatibility inBrassica stigma.Nature, 2000, 403: 913−916.
Journals.im.ac.cn
Preparation and verification of antibodies for five rice receptor-like kinases
Bo Wang, Liyun Li, Yinghao Cao, Ziguang Liu, and Guozhen Liu
College of Life Sciences, Agricultural University of Hebei, Baoding 071001, China
Received:December 18, 2009;Accepted:March 30, 2010
Supported by:National Natural Science Foundation of China(Nos.30670175, 30730007), National Basic Research Program of China(973 Program)(No.2006CB101705).
Corresponding author:Liyun Li.Tel/Fax: +86-312-7528271; E-mail: liliyun@hebau.edu.cn国家自然科学基金项目(Nos.30670175, 30730007),国家重点基础研究发展计划(973计划)(No.2006CB101705)资助。

