刺参养殖池塘中一株益生芽孢杆菌的分离及鉴定
宋爱环, 李成林, 朱 虎, 胡 炜, 李翘楚, 赵 斌, 张 豫
(1. 山东省海水养殖研究所, 山东 青岛 266002; 2. 中国石油大学(华东) 生物工程与技术中心, 山东 青岛266555)
刺参养殖池塘中一株益生芽孢杆菌的分离及鉴定
宋爱环1, 李成林1, 朱 虎2, 胡 炜1, 李翘楚1, 赵 斌1, 张 豫1
(1. 山东省海水养殖研究所, 山东 青岛 266002; 2. 中国石油大学(华东) 生物工程与技术中心, 山东 青岛266555)
针对目前刺参池塘养殖中微生态制剂施用混乱、标准不一以及效果不稳定性等现状, 本研究从刺参养殖池塘底泥中分离土著芽孢杆菌菌株, 并通过菌落形态特征、16s rDNA测序分析和生理生化试验对该菌株进行了鉴定, 确定该菌株为苏云金芽孢杆菌(Bacillus thuringiensis), 命名为XA-01, 该菌可为微生态制剂的制备提供优良的菌种来源, 并将在海水养殖生态环境的修复中得到利用。
刺参(Apostichopus japonicusSelenka); 养殖池塘; 芽孢杆菌(Bacillus); 分离鉴定
广阔的市场需求和极大的利润空间, 使刺参养殖成为继海带、对虾、扇贝、海水鱼养殖浪潮之后兴起的又一新的支柱产业品种, 刺参(Apostichopus japonicusSelenka)养殖产业已成为北方沿海渔民增收致富和捕捞渔民转产转业的新途径。山东刺参养殖发展速度之快, 规模之大更是前所未有, 据初步统计, 到2009年山东沿海刺参育苗场规模在1 000 m3以上水体的场家超过 1 000家, 育苗水体超过 8×105m3, 苗种生产能力达到100亿头, 养殖面积超过4.1×104hm2, 年产鲜参达到6.2万t, 产值达到111.8亿元, 约占全省海水养殖总产值的 1/3, 是山东省最大的海水养殖产业[1]。然而, 受巨大利润空间的驱使,刺参苗种繁育和养殖规模无序开发,尤其是刺参养殖池塘老化严重, 缺乏有效的池底改良与清池消毒处理, 加之多数刺参苗种生产场家设备简易、工艺粗糙,育苗用水量大, 育苗废水不经处理直接排放入海,严重污染海洋生态环境, 导致以“烂嘴”、“吐脏”、“摇头”、“化皮”等为主要特征的“刺参腐皮综合病症”频繁发生, 不同程度地波及并危害到各主要刺参养殖产区, 每年损失达十余亿元。
2006年, 欧盟全面禁止饲料中抗生素的使用,美国和日本等国家也对抗生素的使用作了严格的规定[2]。微生态制剂以其无毒、无残留、无抗药性、生态健康等诸多优点成为近几年来海水养殖中不可替代的改良剂[3]。而芽孢杆菌是第一种应用于水产养殖中的益生菌[4], Laurent等[5]将芽孢杆菌(Bacillus)应用于日本鳗养殖中, 减少了由病原菌Edwardsiellasp.引起的鳗鱼大量死亡。现代化的高效、生态、可持续发展的海水养殖新理念使芽孢杆菌等益生菌类应用得到了广泛的关注和研究。王亚南等[6]从近海养虾场不同深度的底泥中分离到芽孢杆菌; 安健等[7]从对虾池塘中筛选到好氧反硝化细菌——凝结芽孢杆菌(Bacillus coagulans),并研究了其亚硝酸盐氮降解性能。张国庆等[8]从鸡舍附近的土壤中成功分离到一株益生芽孢杆菌—巨大芽孢杆菌。目前尚未发现从刺参养殖池塘中分离微生态菌株的相关报道, 因此,本试验从刺参养殖池塘中分离筛选益生芽孢杆菌,以期为刺参池塘养殖的水质调控、底质改良和免疫系统调节提供可靠的基础材料和有力的技术支持。
1 材料与方法
1.1 材料
样品: 采集于山东东方海洋科技股份有限公司海阳分公司刺参养殖池塘中的泥样。
1.1.1 培养基
1.1.1.1 富集培养基
可溶性淀粉 10 g, 酵母提取物 25 g, 蛋白胨 2 g, NH4Cl 5 g, KH2PO41 g, Na2HPO4·12H2O 5 g,MnSO4·H2O 0.1 g, H2O 1 L, pH 7.2~7.4。
1.1.1.2 分离培养基
蛋白胨 10 g, 酵母提取物 5 g, NaCl 10 g, 琼脂20 g, H2O 1 L, pH7.2~7.4。
1.1.2 实验仪器与设备
冷冻高速离心机: T1/RT1, Thermo Scientific; 洁净工作台: SW-CJ-2F, 苏州安泰; 冷冻恒温振荡器:DHZ-DA, 培英; 全自动数码凝胶成像系统: 1600,Tanon; PCR 扩增仪: Mastercycle, eppendorf; 电泳仪:EPS 600, Tanon。
1.2 实验方法
1.2.1 菌株分离与纯化培养
将采集的泥样低温保存, 及时运至实验室处理。根据筛选的不同菌种的生理特点做不同的处理。将5~7 g底泥分别加入到100 mL无菌生理盐水的三角瓶中, 30℃下150~180 r /min振荡25 min。无菌条件下取菌悬液1 mL置于盛有9 mL无菌水的试管, 混合均匀制成稀释度为 10-1的菌悬液, 同样方法再做 5个稀释度, 即 10-2、10-3、10-4、10-5、10-6。将稀释度为 10-5、10-6的菌悬液各取 100 μL涂抹在不同菌种所需要的培养基上, 30℃培养3~7 d。挑选生长良好、菌落较大的菌落划线分离, 重复2~3次后挑选优势菌落接种于斜面保藏培养基中, 冰箱4℃保藏。
1.2.2 菌落形态特征
将分离得到的芽孢杆菌接种于培养基平板上,30℃活化培养1 d, 观察菌落形态特征。
1.2.3 细菌生理生化鉴定
主要进行菌株的 V-P测定、甲基红试验、明胶水解、淀粉水解、NaCl耐盐实验等。菌株的生理生化特性实验测定方法参考《农业微生物学及试验教程》[9]。
1.2.4 16S rDNA鉴定
1.2.4.1 细菌总DNA提取
用Genomic DNA purification kit (Biodev, Beijing)制备细菌基因组DNA。
1.2.4.2 16SrDNA的扩增
所用引物由上海生工生物有限公司合成, 序列为:
正 向 引 物 : fD1: 27F 5'-AGAGTTTGATCMTGGCTCAG-3'
反向引物: rD1: 1492R 5'-TACGGYTACCTTGTTACGACTT-3'
PCR 反应体系(48 μL): 1 μL 模板 DNA, 各1 μL fD1 和 rD1, 4 μL dNTP, 5 μL 10×Taq缓冲液,0.25 μLTaq聚合酶, 37.75 μL ddH2O。PCR 扩增条件:94℃预变性3min; 94℃变性30 s; 55℃退火1 min; 72℃延伸90 s, 循环30次, 72℃延伸10 min。
1.2.4.3 PCR产物的回收纯化
取 10 µL扩增产物于 1.0%琼脂糖凝胶上电泳,电压为5 V/cm, 电泳时间30 min, 电泳完毕, 于紫外灯下观察结果。用博大泰克公司柱式割胶回收试剂盒回收, 连接于上海生工公司 pUCm-T Vector载体上并转化大肠杆菌 DH5a。在氨苄青霉素(100 μg/mL)LB平板(含40 ng/mL的X-gal和0.1 mmol/L的IPTG)上进行蓝白斑筛选。
1.2.4.4 DNA序列测定与系统发育分析
序列测定由上海英骏生物技术公司完成。将16S rDNA所测序列通过BLAST检索程序与GenBank中已知的16S rDNA序列进行分析, 利用Clustal X1.8进行序列比对, 用MEGA4.0构建系统发育树。
2 结果与分析
2.1 细菌形态与菌落特征
XA-01菌株在培养基平板上 30℃培养 48 h后,菌落乳白色, 呈突起的圆形或近圆形。菌株 XA-01的菌落见图1。
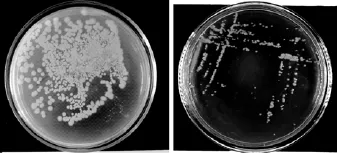
图1 芽孢杆菌的分离纯化Fig. 1 Isolation and purification of Bacillus thuringiensis.
2.2 细菌生理生化特征
根据《常见细菌系统鉴定手册》[10]和《伯杰氏细菌鉴定手册》(第八版)[11], 该菌株呈现芽孢杆菌属特征,所属菌种鉴定为苏云金芽孢杆菌 (Bacillus thuringiensis), 命名为 XA-01。常规生理生化特性见表1。
2.3 16S rDNA鉴定及系统发育树构建
XA-01菌株16S rDNA测序全长1 421 bp, 申请GenBank登录号为HQ710547。同时, 该菌株的16S rDNA序列经 BLAST检索程序分析, 通过 Clustal X1.8进行多重对比, 并用 MEGA4.0构建系统发育树, 结合上述生理生化特征分析, 确定该菌株为苏云金芽孢杆菌 (Bacillus thuringiensis)。结果见图2和图3。

表1 XA-01菌株的生理生化特征Tab. 1 Morphology and physiology characteristics of strain XA-01

图2 16SrDNA扩增的PCR图Fig. 2 PCR-amplification of 16S rDNA
图3 基于16S rDNA序列的NJ系统树Fig. 3 Phylogenetic tree based on 16S rDNA sequences
3 讨论
16S rDNA已经越来越广泛地应用于评价生物的遗传多样性和系统发生关系, 准确 、高效、灵敏、方便, 逐渐成为菌种鉴定的有效手段。潘康成等[12]从动物肠道分离得到三株益生芽孢杆菌, 并运用16S rDNA进行了种的鉴定。张国庆等[8]从鸡舍的土壤中分离到一株益生芽孢杆菌并进行了 16S rDNA鉴定。王彦波[13]从南美白对虾养殖池塘中分离得到芽孢杆菌菌株并从生理生化方面进行了鉴定。苏云金芽孢杆菌是一类能在代谢过程中产生芽孢和伴孢晶体的革兰氏阳性细菌, 其制剂是目前世界上产量最大的微生物杀虫剂[14]。苏云金芽孢杆菌在农业领域研究广泛而深入, 有关苏云金芽孢杆菌的杀菌活性的研究报道较多[15-17]。目前, 微生态制剂的市场需求非常大, 可是其种类和功能却参差不齐, 在一定程度上影响了其市场前景。以北方海水养殖环境作为来源的土著微生态制剂的开发和应用尚未发展起来, 因此, 分离培养并研制土著微生物制剂对于有效调控北方池塘海水养殖环境意义重大。苏云金芽孢杆菌在海水养殖中的应用研究还刚刚起步, 本试验首次从刺参养殖池塘的底泥中分离一株益生芽孢杆菌, 并从生理生化、分子生物学方面对其进行了系统的研究与分析, 确定为苏云金芽孢杆菌 (Bacillus thuringiensis), 并命名为 XA-01, 为以后刺参池塘养殖微生态环境调控技术研究提供了优良的土著菌种,具有广阔的开发应用前景。
[1]李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010,31(4): 126-133.
[2]吕桂霞, 李春蕾, 曹雁行, 等. 国内饲用抗生素替代品的研究简况[J]. 兽药与饲料添加剂, 2008, 13: (4):12-14.
[3]王亚敏, 王印庚. 微生态制剂在水产养殖中的作用机理及应用研究进展[J]. 动物医学进展, 2008, 29(6): 72-75.
[4]张艳, 李秋芬, 王印庚, 等. 益生菌的研究现状及其在海水养殖中的应用[J]. 海洋水产研究, 2005, 26(6):83-87.
[5]Laurant V,Geert R. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molscular Biology Reviews, 2000, 64(4): 655-671.
[6]王亚南, 王保军, 戴欣, 等. 近海养虾场底泥中产芽孢细菌的生态特征[J]. 应用与环境生物学报, 2004,10(4): 484-488.
[7]安健, 宋增福, 杨先乐, 等. 好氧反硝化细菌 YX-6特性及鉴定分析[J]. 中国水产科学, 2010, 17(3):561-569.
[8]张国庆, 董晓芳, 佟建明, 等. 一株益生芽孢杆菌的分离及鉴定[J]. 安徽农业科学, 2010, 38(13):7095-7097.
[9]袁红莉, 王贺祥.农业微生物学及实验教程[M]. 北京:中国农业出版社, 2009: 441-445.
[10]东秀珠, 蔡妙英.常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001: 62-65, 364-398.
[11]布坎南R E, 吉本斯N E. 伯杰氏细菌鉴定手册[M].北京: 科学出版社, 1984: 729-758.
[12]潘康成, 高传庆, 张钧利, 等. 三株益生芽孢杆菌的16S rDNA 测序鉴定[J]. 饲料工业, 2010, 31(8):24-27.
[13]王彦波. 池塘芽孢杆菌的筛选、鉴定和生产特性研究[J]. 水生态学杂志, 2009, 2(1): 91-94.
[14]喻子牛. 苏云金芽孢杆菌制剂的生产与应用[M]. 北京: 农业出版社, 1993.
[15]常明、孙启宏, 周顺桂, 等. 苏云金芽孢杆菌生物杀虫剂发酵生产的影响因素及其工艺选择[J]. 生态环境学报, 2010, 19(6): 1471-1477.
[16]崔云龙, 岡部宗一, 浅野昌司. 苏云金芽孢杆菌液体培养物上清液中杀虫活性物质的研究[J]. 微生物学报, 1993, 33(1): 62-68.
[17]徐华潮, 徐金华, 张立钦, 等. 苏云金芽孢杆菌对松材线虫的杀线活性[J]. 中国生物防治, 2010, 26(1):85-89.
Isolation and identification of a strain of probioticBacillusfrom maricultural pond ofApostichopus japonicusSelenka
SONG Ai-huan1,LI Cheng-lin1,ZHU Hu2,HU Wei1,LI Qiao-chu1,ZHAO Bin1,ZHANG Yu1
(1. Mari-culture Institute of Shandong Province, Qingdao 266002, China; 2. Bioengineering and Technology Center,China University of Petroleum (East China), Qingdao 266555, China)
Dec., 23, 2010
Apostichopus japonicusSelenka; maricultural pond;Bacillussp; isolation and identification
A probiotic strain of native bacillus has been isolated from maricultural pond of sea cucumber in this study. By observing its colony morphology, sequence analysis of its 16s rDNA, and physiological and biochemical experiments, the strain was identified to beBacillus thuringiensis,and was named XA-01. It can be used in developing microbial ecological agents for environmental remediation of mariculture.
Q93
A
1000-3096(2011)05-0038-04
2010-12-23;
2011-01-15
国家“863”计划重大项目(2006AA10A411); 山东省科技发展计划项目(2008GG10005004); 山东省农业良种工程重点项目(2005-2012年); 山东省农业重大应用技术创新课题(2009-2012年);山东省农业技术推广项目(2009-2012年); 山东省农业科技成果转化项目(2010-2013年)
宋爱环(1978-), 女, 山东即墨人, 助理研究员, 主要从事海洋微生物学及水产动物遗传学研究, E-mail: zjusah@163.com; 李成林,通信作者, 电话: 0532-82684701, E-mail: lcl_xh@hotmail.com
梁德海)

