宣木瓜多酚氧化酶酶学特性与抑制剂研究
张国庆,董 明,李 娜,俞雅琼,王旭东
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
宣木瓜多酚氧化酶酶学特性与抑制剂研究
张国庆,董 明*,李 娜,俞雅琼,王旭东
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
研究宣木瓜不同部位的多酚氧化酶(PPO)的活性及其温度、pH值、底物专一性等特性和抑制方法。结果表明:果心中的PPO活性明显高于果皮和果肉,宣木瓜组织的褐变主要是由多酚氧化酶引起;PPO最适底物为邻苯二酚;最适温度20℃,在80℃处理5min即可钝化PPO的活性;最适pH5.5,在酸性条件下稳定性优于碱性;抗坏血酸、L-半胱氨酸、亚硫酸氢钠、柠檬酸和氯化钠均能有效的抑制PPO的活性。
宣木瓜;多酚氧化酶;特性;抑制剂
宣木瓜(Chaenomeles speciosa S. Nakai),属蔷薇科贴梗海棠,是我国著名的四大“药食同源”植物之一,为安徽省著名地道果实,在我国四川、湖北和安徽等地均有种植,但以宣城产品质为最优[1]。宣木瓜中富含有齐墩果酸、熊果酸等有机酸、氨基酸、皂苷、维生素、黄酮类以及钾、钙、镁、锌、铁等多种微量元素和营养物质,具有极高的食用价值和保健作用[2-3]。但宣木瓜在生产加工过程中极易发生褐变,严重的影响了产品的感官品质和食用价值。
多酚氧化酶(Polyphenol oχidase,PPO,E.C.1.10.3.1)是广泛存在于植物中的一类含铜氧化还原酶,与酶促褐变的发生密切相关,是引起酶促褐变的3大条件之一[4]。虽然国内外关于果蔬多酚氧化酶性质和控制的报道很多,但是不同果蔬的褐变及其机理都有所不同[5-13]。目前,宣木瓜的研究主要在中药材、果酒、果脯以及有效成分的提取和利用,但是关于多酚氧化酶的特性及抑制剂的研究至今尚未有报道。本实验通过研究宣木瓜的PPO在不同环境体系中的活力变化,探索宣木瓜酶促褐变的机理,以期为控制宣木瓜贮藏和加工中酶促褐变的发生、筛选经济有效的褐变抑制剂提供理论基础和实践依据。
1 材料与方法
1.1 材料、试剂与仪器
宣木瓜:2009年7月中旬采自安徽宣城新田镇宣木瓜基地,经挑选、整理,用聚乙烯保鲜袋盛放,置于2~4℃冷库中贮藏备用。邻苯二酚、焦性没食子酸、愈创木酚、绿原酸、苯酚、没食子酸、抗坏血酸、L-半胱氨酸、NaHSO3、柠檬酸、NaCl等均为分析纯。
DK-S24型电热恒温水浴锅 上海精宏试验设备有限公司;UV-1800型紫外-可见分光光度计 上海美谱达仪器有限公司;TGL-16M台式高速冷冻离心机 长沙湘仪离心机有限公司;ZK型组合式冷库 常州银雪制冷设备有限公司;LA114型电子天平 常州市衡器厂。
1.2 方法
1.2.1 宣木瓜PPO粗酶液的制备[14]
取预冷的无病虫害、无机械伤的宣木瓜,经过去皮、去核后,称取20g宣木瓜果肉,置于研钵中,按1:1.5(g/mL)的比例加入预冷的pH5.5提取缓冲液(含1mmol PEG、4% PVPP和1% Triton X-100),冰浴条件下研磨成匀浆,放入4℃冰箱中提取20min,取出后用纱布过滤,4℃、8000r/min离心20min,所得上清液即为多酚氧化酶粗酶液。4℃冰箱中保存备用。
1.2.2 PPO活性的测定
根据参考文献[15]方法,略作修改。取1.9mL 0.05mol/L、pH5.5乙酸-乙酸钠缓冲液和1.0mL 0.05mol/L邻苯二酚溶液,最后加入0.5mL酶提取液,混匀后立即测定反应体系在420nm处吸光度。以蒸馏水为参照,每隔30s记录一次,共记录2min。酶活性定义为:每克果肉1min内吸光度(A420)增加0.001为1个活力单位(U)。酶的相对活性计算:在测定条件下,以酶的活性的最高值作为100%。
1.2.3 褐变强度的测定
新鲜样品按1:5(g/mL)加蒸馏水,低温下匀浆、过滤,滤液放置25℃水浴中保温5min,于420nm测定吸光度,褐变强度以A420表示。
1.2.4 PPO的活性
按照试验设计,调节反应的pH值和温度,再加入酶液和邻苯二酚溶液,测定不同条件和反应体系下宣木瓜多酚氧化酶的活性。
1.2.5 抑制剂对PPO酶活的影响
分别向反应体系中加入0.5mL不同浓度的抑制剂,再加入邻苯二酚溶液,测定反应体系中残余宣木瓜PPO的活性。
1.2.6 数据处理
每个测定平行两次,分别平均取样,结果取平均值计算,所有试验数据运用Microsoft Excel 数据处理系统进行统计分析。
2 结果与分析
2.1 宣木瓜PPO反应进程曲线的测定
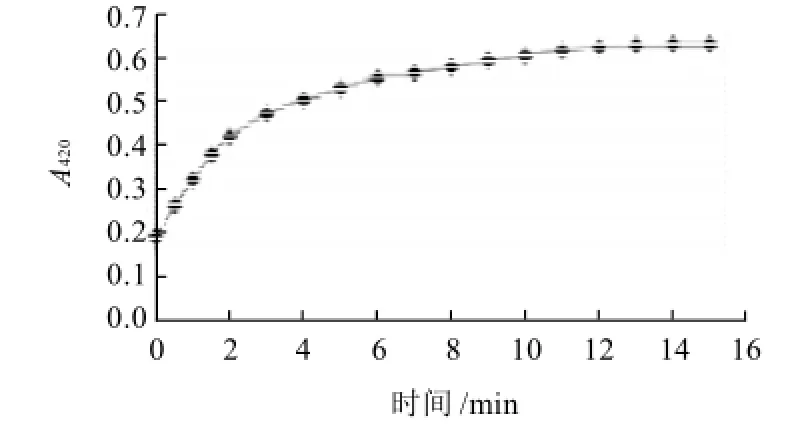
图1 宣木瓜PPO活力曲线Fig.1 Enzymatic reaction curve of PPO from C. speciosa fruit
由图1可见,宣木瓜中的PPO 反应速度在2min内几乎呈直线上升,随后反应速度逐渐变缓。为了正确测定酶促反应速度而避免各种因素的干扰,应该测定酶促反应的初速度。因此,研究酶活应首先以直线部分来确定测定时间,本试验在2min 内测定酶的活性有实际意义。
2.2 底物浓度对PPO活性的影响
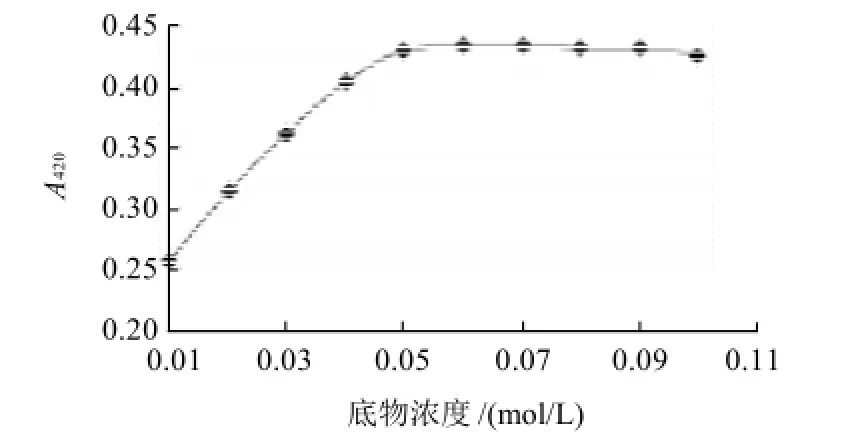
图2 底物浓度与酶活的关系Fig.2 Effect of catechol concentration on the PPO activity
以不同浓度邻苯二酚溶液为底物,研究底物浓度对PPO活性的影响。由图2可看出,当底物浓度小于0.05mol/L时,酶活几乎成直线上升,随后随着浓度的增大,酶活不但没有上升反而有下降的趋势,可能是因为反应产物的积累抑制了酶活。当浓度达到0.05mol/L时,酶的活性最大,所以本实验选择0.05mol/L的邻苯二酚溶液作为底物浓度。
2.3 宣木瓜不同部位的PPO活性和褐变程度
分别切取宣木瓜果皮、果肉和果心,按照1.2节方法提取测定PPO活性和褐变强度。测定结果见表1。

表1 宣木瓜不同部位PPO活性及褐变强度Table1 PPO activities in different part of C. speciosa fruit
表1数据表明,宣木瓜果心组织中的PPO活性均高于果皮和果肉,其中是果皮的4.12倍,是果肉的2.46倍;果心的褐变程度也明显高于其他组织,分别是果皮的1.70倍,果肉的1.34倍。

图3 褐变强度与PPO活性相关性分析Fig.3 Correlation analysis between PPO activity and browning degree
对宣木瓜各部位的PPO活性和褐变强度数据进行线性回归,得到一条直线,R2值为0.9719,可知宣木瓜组织中的PPO和褐变度呈显著正相关性,相关系数r=0.9859。这说明宣木瓜的褐变主要是由多酚氧化酶引起的。果心的褐变高于其他部位,主要是由于其中的多酚氧化酶活性较高。在宣木瓜生产加工过程中,应尽量去尽果心和果皮,以免影响产品的感官品质。
2.4 底物专一性

表2 不同底物对酶活的影响Table2 Effect of substrate on the activity of PPO from C. speciosa fruit
分别以0.05mol/L 邻苯二酚、焦性没食子酸、绿原酸、没食子酸、苯酚和愈创木酚为底物,测定宣木瓜PPO在不同底物条件下的活性。结果表明,邻苯二酚、焦性没食子酸、绿原酸、没食子酸都对PPO表现一定的活性,其中邻苯二酚的活性最大;苯酚和愈创木酚都对PPO不表现活性。
2.5 pH值对宣木瓜PPO活性的影响
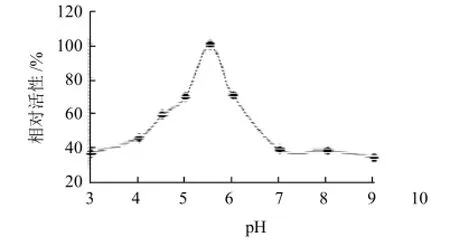
图4 pH值对PPO活性的影响Fig.4 Effect of pH on the activity of PPO from C. speciosa fruit
由图4可知,宣木瓜PPO对pH值较为敏感。在pH5.5时,PPO达到最大活性,随着pH值的上升和下降,酶活都迅速下降。当pH值在3.0和9.0时,PPO活性分别为最大酶活的36%和34%。PPO是含铜蛋白质,在酸性条件下酶中的铜易被解离出来,使酶失活;而在碱性条件下,铜会解离成氢氧化铜,使酶活性显著降低。所以在工业生产中,可以通过调节环境的pH值来抑制宣木瓜多酚氧化酶的活性。

图5 PPO的pH值稳定性Fig.5 pH stability of PPO from C. speciosa fruit
由图5可以看出,PPO在pH4.0~7.0的稳定性较好。在pH4.0和pH5.0体系中,随着时间的延长,酶的活性变化很小,这可能与宣木瓜本身酸度较大有一定的关系。当pH8.0时,对PPO的活性影响较大,随着时间的延长,活性不断下降,在体系中保持15min后,活性约为最大活性的42%。结果说明,宣木瓜PPO在酸性环境中稳定性较好,受碱性环境影响较大,稳定较差。
2.6 温度对PPO活性的影响

图6 温度对PPO活性的影响Fig.6 Effect of temperature on the activity of PPO from C. speciosa fruit
不同温度对PPO的活性影响如图6所示。在10~30℃,PPO都有较高的活性,在20℃时达到最大的活性。随着温度的上升,酶活逐渐下降,当达到80℃时,活性下降较大,可能是由于高温致使酶蛋白发生变性。相关报道表明不同果蔬或者不同品种的多酚氧化酶最适温度都不尽相同[6,8,15-17],本实验得到的最适温度为20℃。

图7 宣木瓜PPO 对温度的稳定性Fig.7 Temperature stability of PPO from C. speciosa fruit
由图7可知,在40℃和50℃时,宣木瓜的稳定性较好,随着时间的延长,活性几乎没有损失。随着温度的上升,PPO的稳定性越来越差,在70℃中保持20min,活性只有最大活性的18%,在80℃中保持5min,酶基本失去活性。说明宣木瓜PPO受温度的影响较大,稳定性较差,高温可达到灭活的目的,有效地抑制酶促褐变。
2.7 抑制剂对PPO活性的影响
本试验选取了食品中常见的抗坏血酸、L-半胱氨酸、氯化钠、柠檬酸和亚硫酸氢钠等酶活抑制剂,研究它们对宣木瓜酶活的抑制效果。不同质量浓度的抑制剂对PPO活性影响如图8、9所示。

图8 抑制剂对酶活的影响Fig.8 Effects of ascorbic acid, L-cysteine, sodium bisulfite on the activity of PPO from C. speciosa fruit
从图8可以看出,抗坏血酸、L-半胱氨酸、亚硫酸氢钠对宣木瓜PPO活性有较强的抑制效果。随着质量浓度的加大,PPO活性逐步下降。当抗坏血酸和L-半胱氨酸质量浓度达到0.025g/100mL时,酶的活性完全受到抑制,亚硫酸氢钠质量浓度在3g/100mL时,酶不表现出活性。
由于抗坏血酸在果蔬组织中还会与氨基酸反应,造成非酶褐变,此外,在高温条件下,抗坏血酸会氧化形成酮化合物,与胺化合物发生非酶褐变。所以在实际的生产过程中,抗坏血酸的加入量必须合适,以免加入不当,反而加剧了产品的褐变。亚硫酸氢钠虽有较好的抑制效果,但由于它破坏营养,使组织软化并产生异味,且有害健康,美国FDA已对其使用做出限制[18]。

图9 柠檬酸、氯化钠对PPO活性的影响Fig.9 Effect of citric acid and sodium chloride on the activity of PPO from C. speciosa fruit
由图9可知,柠檬酸和氯化钠对PPO都有一定的抑制效果,但是相对于以上3种抑制剂效果较差。随着浓度的加大,酶活抑制程度也逐步加大。当柠檬酸质量浓度在5g/100mL时,PPO的相对活性为82%;氯化钠在质量浓度5g/100mL时的相对活性为73%。相关报告表明,当柠檬酸、氯化钠与其他抑制剂组成复合抑制剂,可以起到较大的抑制作用[19-20]。
3 结 论
3.1 宣木瓜的褐变主要是由多酚氧化酶引起,且果心和果皮中多酚氧化酶活性较高,在加工中应注意去尽果心和果皮,避免影响产品的价值。
3.3 试验说明,宣木瓜PPO的最适底物为邻苯二酚,对焦性没食子酸、绿原酸、没食子酸都有一定的催化活性。通过试验结果可初步推断出宣木瓜PPO对多元酚表现一定的活性,而对一元酚不表现出活性。宣木瓜PPO的最适pH值为5.5,在酸性条件下PPO较为稳定,碱性条件下稳定较差;最适温度为20℃,耐热性较差,80℃处理5min活性基本丧失。在加工应用中,可采取调节环境pH和热烫灭酶的办法来防止酶促褐变的发生。
3.4 抗坏血酸、L-半胱氨酸、亚硫酸氢钠、柠檬酸和氯化钠都对宣木瓜PPO有抑制作用。其中抗坏血酸、L-半胱氨酸和亚硫酸氢钠对PPO的抑制效果较好,低浓度即可达到完全抑制。本实验还研究了不同浓度的EDTA-2Na对宣木瓜PPO活性的影响,但是发现EDTA-2Na对宣木瓜的PPO抑制效果不明显。目前,在加工过程中提倡多种抑制剂结合使用以提高防褐变效果,因此还需在对宣木瓜单一抑制剂研究的基础上,对不同抑制剂多因素协同作用机理和抑制效应做进一步的研究。
[1]姚宗凡. 常用中药种植技术[M]. 北京: 金盾出版社, 1989.
[2]徐怀德. 药食同源[M]. 北京: 中国农业出版社, 2002.
[3]徐衢. 蔬菜水果营养健美[M]. 天津: 南开大学出版社, 1992.
[4]ALFRED M M, EITAN H. Polyphenol oxidase in plants[J]. Phytochemistry, 1979, 18: 193-215.
[5]夏志华. 鲜切甘薯褐变机理及其控制技术的研究[D]. 南京: 南京农业大学, 2002.
[6]段玉权, 董维, 张明晶, 等. 中华寿桃多酚氧化酶的特性研究[J]. 中国农业科学, 2008, 41(3): 795-799.
[7]王向阳, 姜丽佳, 王忠英. 莲藕的酶促褐变及其贮藏中褐变的控制[J]. 农业工程学报, 2009, 25(4): 278-280.
[8]魏光锋, 李梅青, 于少梅, 等. 刺苦草根状茎多酚氧化酶的纯化及其特性的研究[J]. 食品与发酵工业, 2009, 35(12): 47-51.
[9]WU H C, CHU H L, KUO J M, et al. The biochemical characteristics of polyphenol oxidase from browning tissue-cultured bamboo (Dendrocalam uslatiflorus)[J]. Food Sci Agricul Chem, 1999, 1(4): 244-249.
[10]MANGANARIS G A, VASILAKAKIS M, DIAMANTIDIS G, et al. The effect of postharvest calciumapplication on tissue calcium concentration, quality attributes, incidence of flesh browning and cell wall physicochemical aspects of peach fruits[J]. Food Chemistry, 2007, 100(4): 1385-1392.
[11]WALISZEWSKI K N, PARDIO V T, OVANDO S L. Control of polyphenol oxidase activity in banana slices during osmotic dehydration[J]. Drying Technology, 2007, 25(2): 375-378.
[12]GAWLIK-DZIKI U, ZOTEK U,WIECAM. Characterization of polyphenol oxidase from butter lettuce (Lactuca sativa var. capitata L.) [J]. Food Chemistry, 2008, 107(1): 129-135.
[13]MARRERO A, ADEL A K. Optimal temperature and modified atmosphere for keeping quality of fresh-cut pineapples[J]. Postharvest Biology and Technology, 2006, 39(2): 163-168.
[14]曹建康, 姜微波, 赵玉海. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[15]姜绍通, 罗志刚, 潘丽军. 甘薯中多酚氧化酶活性的测定及褐变控制[J]. 食品科学, 2001, 22(3): 19-22.
[16]李延清, 张艳芬, 姜 丽, 等. 溧阳白芪PPO特性的研究[J]. 食品工业科技, 2008, 29(2): 155-160.
[17]汤凤霞, 陈发河, 郭进文. 枇杷果浆多酚氧化酶活性抑制的研究[J].食品工业科技, 2004, 25(4): 54-57.
[18]刘红锦, 徐为民, 王静, 等. 果蔬的褐变及其控制方法[J]. 食品研究与开发, 2008, 29(4): 159-162.
[19]魏好程, 汤凤霞, 沈塞群. 茄子多酚氧化酶特性及控制研究[J]. 食品研究与开发, 2009, 30(6): 48-52.
[20]杨政水, 罗显华. 菊芋酶促褐变抑制剂的筛选[J]. 食品科技, 2006(4): 82-84.
Enzymatic Characteristics and Inhibitors of Polyphenol Oxidase from Chaenomeles speciosa Nakai Fruits
ZHANG Guo-qing,DONG Ming*,LI Na, YU Ya-qiong,WANG Xu-dong
(College of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China)
Effects of temperature, pH, substrate, ascorbic acid, L-cysteine, sodium bisulfite, citric acid and sodium chloride on the activity of polyphenol oxidase (PPO) from Chaenomeles speciosa Nakai were studied. Results showed that PPO activity was obviously higher in core than in the peel and flesh. The browning of C. speciosa fruit was significantly correlated to PPO activity. The PPO from C. speciosa fruit had the optimum substrate of catechol, with the optimum temperature 20 ℃ and pH 5.5. The enzyme lost its activity substantially after exposure to 80 ℃ for 5 min. Its activity was suppressed effectively by ascorbic acid, L-cysteine, sodium bisulfite, citric acid and sodium chloride.
Chaenomeles speciosa Nakai;polyphenol oxidase;characteristic;inhibitor
TS255.1
A
1002-6630(2011)10-0288-04
2010-09-05
张国庆(1987—),男,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:nanlingzhang@gmail.com
*通信作者:董明(1958—),男,副教授,硕士,研究方向为果蔬加工与贮运技术。E-mail:dongm58@163.com

