54Q53紫花苜蓿愈伤组织诱导及再生初探
李 顺,王国良,贾春林,盛亦兵,孙 娟
(1.青岛农业大学动物科技学院,山东 青岛 266109; 2.山东省农业可持续发展研究所,山东 济南 250110)
素有“牧草之王”、“维他命饲料”美誉的紫花苜蓿(Medicagosativa)作为当今世界范围种植最广泛、畜牧业利用最普遍的苜蓿栽培种之一,以其高植物蛋白含量、多矿物微量元素和全维生素种类等优良动物营养特性,确立了其作为优质草畜饲料独一无二的地位[1-6]。为了应对当今畜牧业发展对优质紫花苜蓿品种的育种需求,单纯依靠传统的大田混合杂交、集团选育等异花植物育种方法,无论在种质遗传资源创新还是品种改良方面,都面临日益捉襟见肘的境地。此外,紫花苜蓿异花授粉的特性,使其难于直接利用杂种优势,加之国内现有综合品种群体遗传特性差异潜力有限,唯有大力寻找具有显著差异的育种资源群体进而结合细胞、分子等现代生物技术手段的辅助,才能有效开拓出一条紫花苜蓿品种改良和创新的有效路径。
先锋种业在英国、澳洲、新西兰和北美地区主打的紫花苜蓿综合品种54Q53(54Q53 Lucerne)具有高病虫害抗性,中等抗寒(类似‘漫游者’)和中等秋眠(类似‘传奇’)等级,可适于多种用途(干草、青饲和青贮等),以及高饲用价值等特性[7-9]。此外,该品种是由225个随机亲本植株经混合隔离杂交(cage isolation)选育而成的品种,具有广泛多样的遗传资源基础,并适宜于北美北方大平原农、牧区,以及寒冷山区广泛种植[8]。本研究利用组织培养的基本技术手段,尝试建立来自54Q53紫花苜蓿的再生体系,重点研究影响苜蓿愈伤组织诱导的若干主要因子,进而建立该品种高效愈伤组织诱导体系,并进行初步再生分化试验,为今后紫花苜蓿新品种的选育,遗传资源丰富以及利用细胞融合等生物技术手段更深一步研究提供基础研究材料[6]。
1 材料与方法
1.1试验材料 54Q53紫花苜蓿种子由山东省农业科学院可持续发展研究所提供。
1.2试验方法
1.2.1无菌苗及外植体获取 用70%~75%乙醇和0.1%升汞对54Q53紫花苜蓿种子进行消毒后,接种到MS无激素培养基上获取无菌苗。接种3~5 d,将下胚轴切取3 mm左右小段;接种7 d,将子叶去叶尖和尾部并横向切成宽2~4 mm左右小条;接种20 d,将初生成真叶叶片去叶尖和叶尾横向切成宽2~4 mm左右小条。
1.2.2细胞分裂素KT和6-BA对诱导54Q53紫花苜蓿愈伤组织的影响 以下胚轴为外植体,在MS基本培养基上,分别附加2.0 mg/L的2,4-D和0.1、0.5、2.0 mg/L的6-BA;2.0 mg/L 的2,4-D和0.1、0.5、2.0 mg/L的KT,一共6个处理,每个处理5个重复(5瓶),每瓶接种外植体10块,并于恒温培养箱(25℃,光照16 h)中培养21 d,期间将意外染菌重复除去。最后,观察不同细胞分裂素对诱导愈伤组织的不同反应。
1.2.3不同培养基和不同外植体对54Q53紫花苜蓿愈伤组织诱导的影响 固定附加2.0 mg/L 2,4-D+0.5 mg/L 6-BA的4种基本培养基(MS、MSO、B5,改良SH)中,接种下胚轴,子叶,叶片3种外植体,共12个处理,每个处理5个重复(5瓶),每个重复接种外植体10块,然后,恒温培养箱培养(25℃,光照16 h)。第1周,每3 d观察1次,以后每周观察1次,记录愈伤组织生长状况。由于不同外植体材料差异,下胚轴、子叶和叶片分别于21、28 和32 d后,分别进行观察、统计和分析。
1.2.4不同质量浓度组合的2,4-D与6-BA对诱导54Q53紫花苜蓿愈伤组织的影响 固定外植体为下胚轴,培养基为MS基本培养基(附加30 g/L蔗糖,8 g/L琼脂,pH值为5.8),设计紫花苜蓿愈伤诱导的2,4-D+6-BA质量浓度试验组合:(A1-A2)0.5 mg/L+0.1、0.5 mg/L,(A3-A5)1.0 mg/L+0.1、0.5、1.0 mg/L;(A6-A9)1.5 mg/L+0.1、0.5、1.0、1.5 mg/L;(A10-A13)2.0 mg/L+0.1、0.5、1.0、2.0 mg/L;(A14-A17)3.0 mg/L+0.1、0.5、1.0、2.0 mg/L。共17个处理,每个处理4个重复(4瓶),每瓶接种外植体10个,恒温培养箱(25℃,光照16 h)培养21 d后统计。
1.2.5愈伤组织分化试验 分别验证细胞分裂素KT(0.1、0.2、0.4、0.6 mg/L)和添加了0.1 mg/L NAA的KT(0.2、0.5、1.0、1.5 mg/L)组合在以MS、B5基本培养基为分化培养基(附加30 g/L蔗糖)上产生的分化效应。
1.3计数和统计方法
1.3.1计数方法
出愈愈伤块判断:外植体发生明显膨大,且超过2/3的部分发生明显脱分化的出愈愈伤块为出愈愈伤。
褐化(坏死)愈伤块判断:超过整体愈伤块1/2以上发生明显褐化或黑坏死为褐化(坏死)愈伤。
愈伤块总体大小判断:设定直径d>5.0 mm的愈伤组织为大愈伤;中愈伤为d=2.5~5.0 mm;小愈伤为d<2.5 mm。每个重复(每瓶)的大愈伤组织块数占全部块数超过2/3认为该重复愈伤组织表现的总体效应为“大”,若在1/2到2/3之间则为“中”,低于1/2为“小”;同理,一个处理所含所有重复数量占总数目超过2/3,1/2到2/3之间,低于1/2则认为该处理愈伤组织表现的总体效应为“大、中和小”,以此类推进行计数统计。
1.3.2统计方法
利用SPSS软件对试验数据结果进行分析:a)试验采用SPSS软件中t值配对测验,分析(2.0 mg/L)2,4-D+(0.1、0.5、2.0 mg/L)KT或(0.1、0.5、2.0 mg/L)6-BA两组愈伤组织诱导率数据。b)采用SPSS软件方差分析中S-N-K方法,对试验数据进行多重比较分析。
2 结果与分析
2.1细胞分裂素KT、6-BA对54Q53紫花苜蓿愈伤组织的诱导效应 培养21 d后发现,KT诱导愈伤组织的整体愈伤诱导率低于6-BA(图1),将KT与BA两种不同细胞分裂素处理的愈伤组织诱导率结果进行独立样本t测验,SPSS软件分析结果显示P<0.05,认为同质量浓度下KT和BA愈伤组织诱导率存在显著差异,但未达到极显著(P<0.01)水平。此外,KT诱导54Q53紫花苜蓿愈伤组织会引起特异性的白褐色稀软愈伤,以及水渍化现象。所以,6-BA较KT更适合54Q53紫花苜蓿愈伤组织的诱导。

图1 不同浓度KT和6-BA对愈伤组织诱导率的影响
2.2不同培养基和不同外植体对54Q53紫花苜蓿愈伤组织的诱导效应
2.2.154Q53紫花苜蓿最佳培养基和外植体组合 将下胚轴、子叶和叶片3种外植体(W)分别接种到MS、MSO、B5和改良SH四种基本培养基(P)上(固定附加2.0 mg/L 2,4-D+0.5 mg/L 6-BA)进行愈伤诱导试验,诱导愈伤组织统计结果表明(表1):W1P1处理愈伤组织诱导率91.67%,相较W2P1处理愈伤组织诱导率无差异,但前者愈伤组织褐化率为6.67%较后者低,差异显著(P<0.05);较愈伤组织褐化率最低的W3P1处理,W1P1处理的愈伤组织诱导率更高,且差异也显著。所以,最佳的外植体+培养基组合是下胚轴+MS。

表1 不同培养基和不同外植体诱导愈伤组织结果
2.2.2不同培养基对54Q53紫花苜蓿愈伤组织的诱导效应 不同的3种外植体接种到4种培养基上,发现愈伤组织诱导率都在MS培养基上最高(表1),较适合作为愈伤组织诱导阶段培养基。实际观察中也发现B5和MSO培养基较MS更多出现各种异常愈伤组织,尤其是B5培养基上出现了紫色或深绿色的松脆颗粒,或墨绿硬壳片层,而进一步进行两因素无重复方差分析的S-N-K多重比较发现MS同B5和MSO存在显著性差异(P<0.05),而改良SH与三者差异都不显著,且MSO=B5微量+MS,可以推测微量元素对54Q53紫花苜蓿愈伤组织的诱导起到一定的作用。
2.2.3不同外植体对54Q53紫花苜蓿愈伤组织的诱导效应 3种外植体中脱分化最快的是下胚轴,大概3 d后发生且整个圆柱体膨大,诱导愈伤组织阶段3周就必须继代否则诱导过度愈伤整体质量急剧下降;而子叶大概需要5 d边缘才明显膨大,诱导阶段可以持续到第4周;叶片最慢至少要7 d才会出现明显的边缘膨大,需要32 d才能完成诱导阶段且其中外植体脱分化常发生中途终止。另外,下胚轴愈伤组织诱导阶段发生异常分化情况最少,而子叶和叶片明显增多,出现深绿或紫色愈伤,浓绿颗粒核心等。
3种外植体中下胚轴(W1)较子叶(W2)和叶片(W3)的愈伤组织诱导率高,而愈伤组织褐化率较子叶低(表1),而进一步对3种外植体进行两因素无重复方差分析的S-N-K多重比较也发现下胚轴同子叶和无菌苗真叶存在显著性差异(P<0.05),可见下胚轴是最佳外植体。
2.3优化诱导54Q53紫花苜蓿愈伤组织2,4-D和6-BA的浓度组合 诱导培养21 d后,各处理中愈伤组织诱导率大于90.00%的有A6、A7、A11、A16、A17(表2),而愈伤组织褐化坏死率低于10.00%的只有A11,可见A11(愈伤诱导率达到91.67%,愈伤组织褐化坏死率仅2.78%,正常愈伤组织诱导率88.89%)是最优激素组合(表2)。
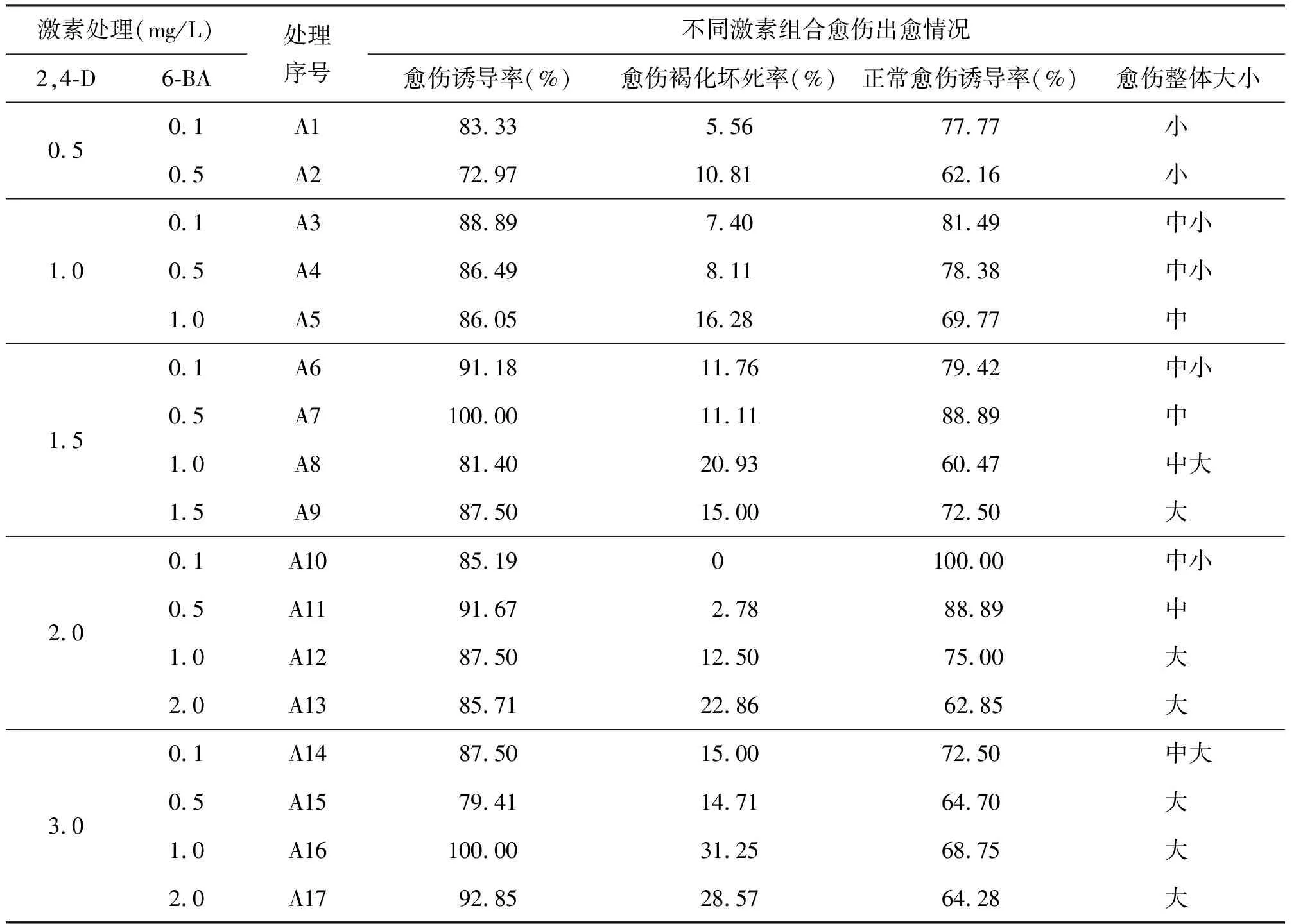
表2 2,4-D和6-BA浓度组合对愈伤诱导的影响
2.454Q53紫花苜蓿愈伤组织分化尝试
2.4.1分化尝试试验结果 将前期嫩黄绿色的愈伤组织转移到分化培养基中,在恒温培养箱中(25℃,光照16 h)分化培养30 d,结果都未出现小芽但发生出根,并伴有愈伤组织异常分化现象(不同程度的浓绿愈伤组织,球形松脆愈伤带绿核,晶体球状愈伤,以及灰白色愈伤和褐化坏死等)。出根越多,根生长越强壮,这些异常分化发生程度就越轻、越少,可能存在一定的相关性。
2.4.2不同培养基、不同KT及NAA浓度对愈伤分化出不定根的影响 单独使用KT或KT(0.1、0.2、0.4、0.6 mg/L)+NAA(0.1 mg/L)的MS培养基较B5培养基出根率更高,说明MS更适合54Q53的分化(图2、3)。MS培养基上单独添加KT或KT+NAA都出现KT在0.5 mg/L左右时有最高的出根率,本试验中最高的出根率为40.00%,出现在MS+0.4 mg/L KT(图2),而添加NAA降低了MS上的出根率,并且单独使用KT得到的根生长状况也较好。

图2 MS和B5培养基上不同KT质量浓度对出根率影响

图3 附加0.1 mg/L NAA的不同培养基(MS和B5培养基)上不同KT质量浓度对出根率影响
3 讨论与结论
3.1不同细胞分裂素对54Q53紫花苜蓿愈伤组织诱导的影响 参考以往紫花苜蓿愈伤组织诱导研究发现[10],生长素2,4-D起关键作用为必须因子,而起次要辅助作用的常用细胞分裂素有2种:KT和6-BA,其主要作用是促进细胞分裂及引起芽分化等[11]。很多研究都支持不同品种苜蓿可能对不同细胞分裂素产生不同效应,当然其中也有很多没有差异的报道[12-13]。黄远新等[3]同时使用以上2种细胞分裂素诱导南方紫花苜蓿也得到较好的诱导效果,可见不同细胞分裂素本身对紫花苜蓿愈伤诱导可能既存在各自的特异性,也存在互相增减的复杂效应。本研究针对54Q53紫花苜蓿愈伤诱导的特异性试验发现,该品种对两者的确存在差异且6-BA较KT在3个浓度下都呈现诱导愈伤组织较佳的表现,尤其是KT诱导54Q53紫花苜蓿愈伤组织时会普遍造成愈伤的白褐色水渍化。
3.2不同培养基和不同外植体对愈伤组织诱导的影响 本研究分别对4种培养基和3种外植体进行组合处理试验,结果表明,培养基MS与B5(或MSO)存在显著差异(P<0.05),比较培养基组成发现B5微量+MS基本培养基=MSO,而MSO同B5没有显著差异,说明MS同B5由于微量元素存在而足以影响愈伤诱导效果。之前很多报道指出铵离子对愈伤组织以及胚状体诱导有明显作用[14],但在本研究中作用有限;此外,虽然有机成分也存在一定差异,但SPSS软件统计显示MSO与B5之间未达到显著差异。
植物不同组织器官和部位的细胞生理状态和再生能力等都存在明显差异[13]。一般比较下胚轴,子叶和叶片3种外植体中无论是在愈伤组织诱导速率还是质量上都是下胚轴最优[12-16],本试验与前人报道一致。
3.3不同2,4-D和6-BA激素浓度组合对愈伤组织诱导的影响 紫花苜蓿愈伤诱导中生长素2,4-D起主要作用[14-16],而6-BA起一定的辅助作用。而在参考以往研究文献基础上,发现最佳激素组合一般都是生长素浓度高于细胞分裂素浓度,本研究组合将生长素质量浓度设定为4个水平,即过高(3.0 mg/L),高(2.0 mg/L)、中(1.0~1.5 mg/L)、低(0.5 mg/L),而细胞分裂素也设定为过高(2.0 mg/L)、高(1.0 mg/L)、中(0.5 mg/L)、低(0.1 mg/L)4个水平。结果发现,高水平生长素+中水平细胞分裂素为最优化组合。
其他报道研究[17-20]也证明在高质量浓度生长素水平与中(低)质量浓度细胞分裂素水平搭配能得到较理想的愈伤组织。过高的2,4-D会造成愈伤过度脱分化,过低则脱分化无力;过高的6-BA会造成异常分化,过低则起不到稳定生长素效应,促进细胞分裂和帮助愈伤组织适当分化的作用。
3.4异常分化生根的影响因子 针对B5和MS培养基对诱导愈伤组织的不同效果,分别使用单独KT或添加NAA(0.1 mg/L)进行分化尝试,虽然没能得到再生苗,但发现不同培养基,不同KT浓度,以及是否添加NAA对出根率和根的生长都产生一定的影响,其中MS较B5更适合,而KT在0.5 mg/L时较好,并且高出根率伴随着较佳的再生根生长状况,说明存在一定的再分化作用,可以进一步细化激素种类组合、培养基蔗糖含量、有机添加物、培养条件优化等进行进一步的再生分化试验[21-22]。
[1] 谢从华,柳俊.植物细胞工程[M].北京:高等教育出版社,2004:86.
[2] 钱瑾,刘发央,谢小冬,等.紫花苜蓿高频再生体系的建立[J].甘肃农业大学学报,2007,42(1):77-81.
[3] 黄远新,玉永雄,胡艳.南方紫花苜蓿不同外植体离体培养的研究[J].中国草地,2003,25(3):42-47.
[4] 马晖玲,卢欣石,曹致中,等.紫花苜蓿不同栽培品种植株再生的研究[J].草业学报,2004,13(6):99-105.
[5] 张丽妍,杨恒山,张宏宇,等.灌溉条件下不同生长年限紫花苜蓿生长及生产能力的研究[J].草业科学,2010,27(1):85-91.
[6] 李捷,张清斌,杨刚.中国苜蓿属植物与新疆苜蓿种质资源的优势[J].草地学报,1997,5(4):286-291.
[7] Irving L J,Sheng Y B,Woolley D,etal.Physiological effects of waterlogging on two lucerne varieties grown under glasshouse conditions[J].Journal of Agronomy and Crop Science,2007,193(5):345-356.
[8] Mackie J M,Musial J M,O’Neill N R,etal.Pathogenic specialization within colletotrichum trifolii in Austrialia,and lucerne cultivar reactions to all known Australian pathotypes[J].Austrialian Journal of Agricultural Research,2003,54(9):829-838.
[9] Harris R H,Crawford M C,Bellotti W D,etal.Companion crop performance in relation to annual biomass production, resource supply,and subsoil drying[J].Crop & Pasture Science,2007,59(1):1-12.
[10] Saunders J W,Bingham E T.Production of alfalfa plants from tissue culture[J].Crop Science,1972,12:804-808.
[11] 刘艳芝,王玉民,邢少辰,等.苜蓿组织培养细胞胚发生体系的建立[J].草业科学,2005,23(1):34-36.
[12] 祝建波,朱先灿,崔燕,等.杂花苜蓿高效再生体系的建立[J].作物杂志,2006(5):14-17.
[13] 苏玉春,韩微微,陈光.紫花苜蓿组织培养再生体系的建立[J].中国草地学报,2008,30(2):43-46.
[14] 李望丰,吕德扬,刘艳芝.诱导苜蓿胚性愈伤组织分化和再生[J].吉林农业科学,2002,27(2):15-16.
[15] 杨起简,周禾,孙彦,等.紫花苜蓿的愈伤组织诱导及组织培养[J].北京农学院学报,2004,19(2):27-30.
[16] Skokut T A,Manchester J,Schaefer J.Regeneration in alfalfa tissue culture[J].Plant Physiology,1985,79(3):579-583.
[17] 王涌鑫,关宁,李聪.高效的苜蓿组织培养再生体系的建立[J].东北师大学报(自然科学版),2008,40(3):112-117.
[18] 张元新.2,4-D浓度对苜蓿愈伤组织分化和再生的研究[J].吉林化工学院学报,2007,24(4):14-16.
[19] 马菊兰,张博.培养基、蔗糖和激素对苜蓿花药愈伤组织诱导的影响[J].新疆农业科学,2007,44(6):839-844.
[20] 肖燕,张博,范永刚,等.6-BA、NAA对苜蓿不同外植体愈伤组织培养的影响[J].新疆农业科学,2007,44(5):658-662.
[21] 毛雅妮,孙娟,张德罡,等.苜蓿组织培养研究进展[J].草业科学,2009,26(9):146-150.
[22] 赵桂琴,慕平,张勃.紫花苜蓿基因工程研究进展[J].草业学报,2006,15(6):9-18.

