糖尿病合并肺结核患者外周血的免疫功能探讨
621100 四川省三台县人民医院 杨勇琼
310002 南京军区杭州疗养院海勤疗养区 周晓明
310015 杭州师范大学附属医院 王建军
结核病仍然是危害全球公众健康问题的主要原因之一,全球每年有新发结核病人800万,200万人因结核病死亡[1-2]。在过去几十年里,结核病与糖尿病的相关性受到广泛关注,大量的回顾性研究表明糖尿病患者对结核病具有高度易感倾向,糖尿病是结核发生及耐多药的重要危险因素之一[3]。
尽管有众多证据显示糖尿病会引起患者显著增加对肺结核的易感性,但是目前关于糖尿病患者易感肺结核的免疫机制的报道尚少。有研究者发现糖尿病合并肺结核患者PBMC分泌细胞因子水平发生改变,表现为Th1/Th2比例下降[4]。在宿主抗结核免疫中,Th1细胞能介导巨噬细胞活化来抑制结核杆菌感染。糖尿病合并肺结核患者PBMC是否存在一定的免疫功能缺陷,目前国内尚无相关报道。本实验通过检测糖尿病合并肺结核患者体内巨噬细胞活化程度及巨噬细胞杀灭结核杆菌能力等来明确上述问题。
1 材料和方法
1.1 人外周血标本 研究对象均来自2009-02—2010-02重庆医科大学附属第一医院肺科收治的新发和复发确诊为肺结核的病人、糖尿病合并肺结核病人各20例及健康志愿者20例。研究者年龄<50岁。HBsAg阴性,HIV抗体阴性,并签署知情同意书的志愿者。
1.2 主要试剂 胎牛血清购自杭州四季青;Ficoll淋巴细胞分离液购自天津灏阳生物;NO检测试剂盒、TNF-α ELISA试剂盒均购于南京建成公司;改良罗氏培养基购于杭州创新生物公司;结核杆菌株由重庆医科大学附属第一医院呼吸内科P2实验室提供。
1.3 巨噬细胞的分离培养及成熟诱导 取健康组、结核病组、糖尿病合并肺结核组肝素抗凝外周全血20 mL,经密度梯度离心法(2 500 r/min×20 min)分离单个核细胞。生理盐水洗3次,用完全培养基 (10%胎牛血清的1640培养液)调整细胞浓度为2×106/mL,加入6孔培养板,37℃ 5%CO2孵箱培养2 h。去除悬浮细胞,贴壁细胞即为单核细胞。每孔加完全培养基2 mL诱导分化成巨噬细胞,隔2 d换液,培养第9天收集培养上清液及巨噬细胞。
1.4 巨噬细胞电镜观察 收集巨噬细胞用多聚甲醛-戊二醛4℃固定90 min后,将细胞移入离心管中,用PBS洗涤2次,离心(3 000 r/min×5 min)后再4℃保存于PBS中。1%锇酸固定,梯度乙醇脱水,环氧树脂包埋,超薄切片,电子染色,透射电镜观察巨噬细胞形态学超微结构。
1.5 检测巨噬细胞培养上清液中TNF-α、NO水平 收集第9天巨噬细胞培养上清液,用ELISA试剂盒检测TNF-α水平,用硝酸还原酶法检测NO水平,操作步骤按说明书进行,显色后用酶标仪检测450 nm波长的吸光度值,根据标准曲线确定TNF-α和NO水平。
1.6 结核杆菌的培养及计数 用改良罗氏培养基培养结核杆菌2周后挑取菌落研磨,麦氏比浊法测定菌液浓度,调整为1 mg/mL(相当于菌量为3×108个/mL)。用生理盐水稀释后感染巨噬细胞,感染按细菌∶细胞=10∶1比例进行。
1.7 巨噬细胞杀灭结核杆菌能力检测 收集并裂解感染结核杆菌24 h的各组巨噬细胞(方法同参考文献[5]):先用生理盐水洗涤3次,然后每孔加4℃保存的灭菌双蒸水0.5 mL,室温放置10 min,再加0.5 mL/孔细胞裂解液,观察细胞完全裂解后,收集孔内全部液体离心(10 000 r/min×10 min)。离心弃上清液,每管加20%BSA 0.5 mL,涡旋振荡30 s,制成菌悬液。用生理盐水将悬液按10×梯度逐级稀释,去不同稀释度的菌液0.1 mL,接种在罗氏培养基上,培养10 d后观察菌落数量。
1.8 统计学处理 采用SPSS 17.0统计软件进行统计分析,实验数据用柱形图表示,多个组比较采用方差分析,两个组比较采用t检验,以P<0.05为差异有统计学意义。
2 实验结果
2.1 巨噬细胞形态学观察 细胞培养第9天透射电镜观察显示,巨噬细胞胞质内含大量特征性标志物溶酶体,吞饮小泡、吞噬体,线粒体丰富,胞浆颗粒明显,细胞膜内侧有许多微丝和微管(图1~2)。
2.2 TNF-α及NO的检测 ELISA检测各组间TNF-α水平均有差异,其中TB+DM组(597.5±69.1)pg/mL较TB组(688.2±64.8)pg/mL、健康组(839.3±74.5)pg/mL显著降低,差异有统计学意义(F=18.48,P<0.05),TB组低于健康组,差异有统计学意义 (P<0.05,图3);NO水平各组间均有差异TB+DM组(57.3±14.6)μmol/L较TB组(83.5±23.3)μmol/L、健康组(108.9±22.3)μmol/L显著降低,差异有统计学意义(F=9.522,P<0.05),TB组低于健康组,差异有统计学意义(P<0.05,图4)。
图1 培养第9天巨噬细胞
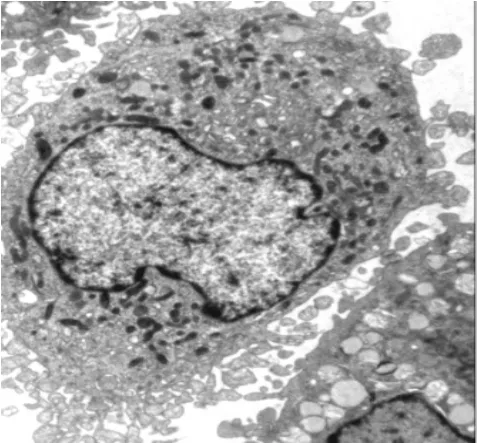
图2 巨噬细胞电镜图
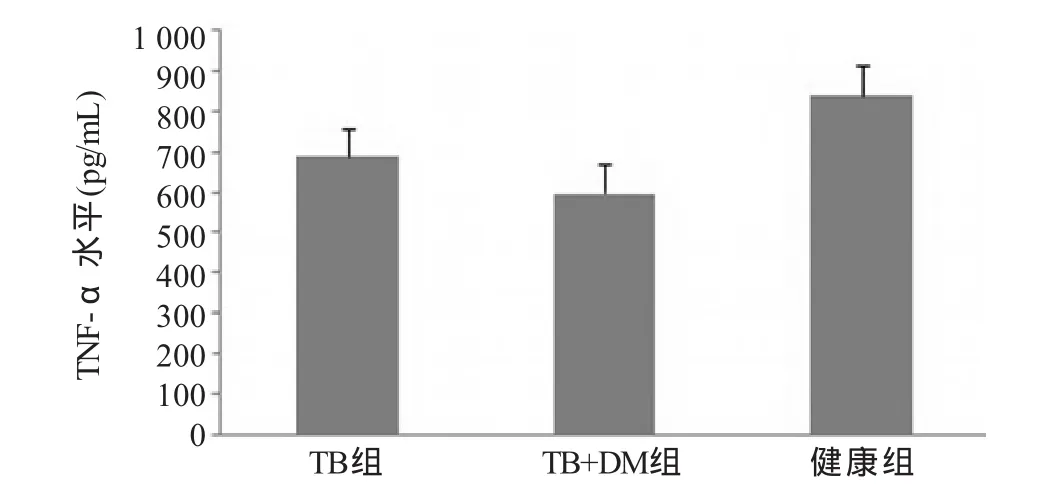
图3 各组巨噬细胞上清液中TNF-α水平比较
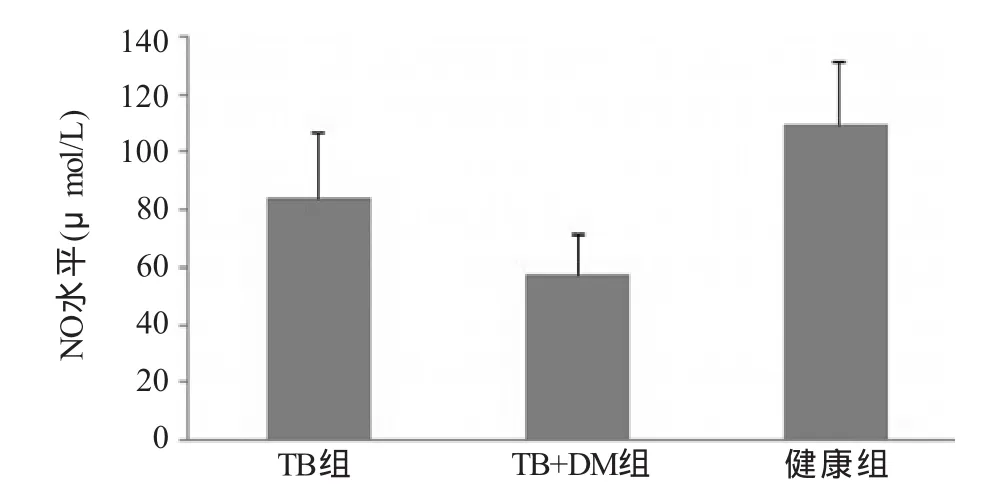
图4 各组巨噬细胞上清液中NO水平比较
2.3 巨噬细胞内活菌计数的比较 将接种的细菌计数取10的对数值(lg CFU)表示。感染巨噬细胞前计数接种的活菌数为6.7。裂解巨噬细胞培养被巨噬细胞吞噬的MTB,10 d后计数菌落,各组间均有差异。TB+DM组(6.14±0.154)较TB组(5.97±0.132)、健康组(5.77±0.127)显著升高,差异有统计学意义(F=11.165,P<0.05),TB组高于健康组,差异有统计学意义(P<0.05,图5)。
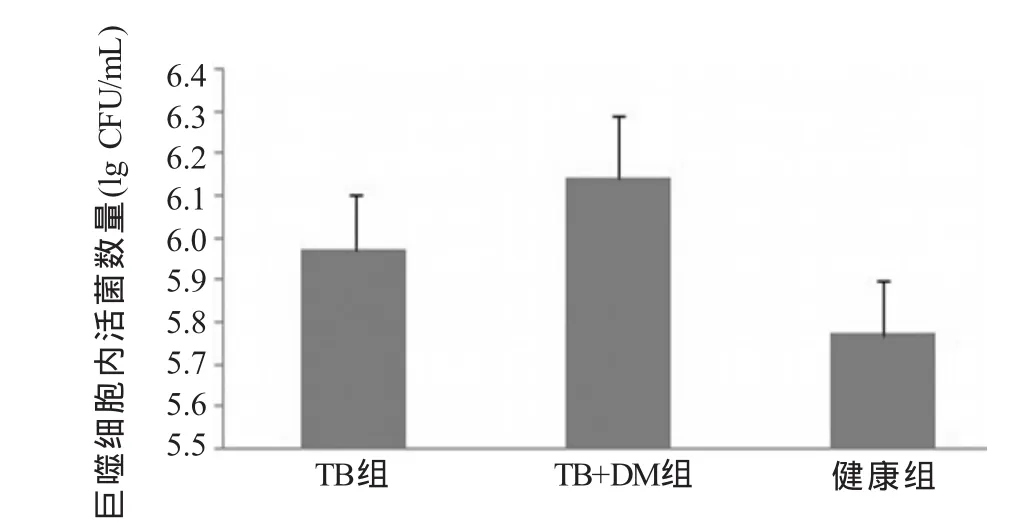
图5 各组巨噬细胞内活菌计数比较
3 讨论
糖尿病作为结核病发生发展的一个重要危险因素,已经越来越受到关注。动物实验研究显示,糖尿病大鼠对结核杆菌具有高度的易感性可能与其抗结核免疫功能下降有关[4,6]。在宿主抗结核免疫中,巨噬细胞是主要效应细胞,受结核杆菌感染后首先是巨噬细胞作出反应,分泌大量TNF-α、IL-6、IL-1等细胞因子使淋巴细胞和单核细胞聚集到结核杆菌入侵部位,限制其扩散并杀灭结核杆菌[1,6-7]。在结核病发病机制中,结核杆菌通过多种途径逃避免疫攻击,但最终都是通过影响或利用巨噬细胞来躲避宿主抗结核免疫应答的。
本研究发现,糖尿病合并肺结核患者外周血单核细胞诱导分化的巨噬细胞分泌的TNF-α水平较单纯肺结核组和健康组相比显著降低,TNF-α主要由巨噬细胞分泌,在宿主抗结核病中起着重要的作用。它能促进淋巴细胞和单核细胞聚集到感染部位,促进宿主细胞对结核杆菌的杀灭作用。同时还能促进受感染发生的巨噬细胞凋亡,从而释放出未被彻底杀灭的结核杆菌,使之重新受到活化后的免疫细胞的吞噬和杀灭,以防止结核杆菌慢性反复感染和复发[8]。TNF-α水平降低,表明糖尿病合并肺结核患者体内的巨噬细胞抗结核免疫功能受损。研究还发现,糖尿病合并肺结核患者巨噬细胞分泌的NO水平也显著低于单纯肺结核组和健康组。NO由巨噬细胞分泌产生,能显著增强巨噬细胞杀灭结核杆菌的能力,并作为巨噬细胞活化的一个重要标志。其水平降低,表明糖尿病患者巨噬细胞活化及杀灭结核杆菌能力降低[9]。这也可能是糖尿病患者易感肺结核的重要原因之一。
在活化后的3组巨噬细胞吞噬杀灭结核杆菌的研究中发现,糖尿病合并肺结核患者的巨噬细胞吞噬结核杆菌后,其未杀灭的结核杆菌菌落数显著高于单纯肺结核组和健康组。表明糖尿病合并肺结核组巨噬细胞杀灭结核杆菌的能力降低,这可能也是糖尿病合并肺结核患者容易导致结核病反复感染、复发及产生耐多药的重要因素之一[3]。
综上所述,本研究通过检测糖尿病合并肺结核患者巨噬细胞活化及吞噬能力,从细胞层面研究糖尿病易感肺结核的发病机制,为糖尿病与肺结核相关性的免疫学研究奠定基础。
[1]王建军,郭述良,李兰,等.ManLAM对树突状细胞成熟及下游免疫的影响[J].中国免疫学杂志,2010,26(7):587-590.
[2]Stevenson CR,Critchley JA,Forouhi NG,et al.Diabetes and the risk of tuberculosis:a neglected threat to public health[J].Chronic Illn,2007,3(3):228-245.
[3]Singla R,Khan N.Does diabetes predispose to the development of multidrug-resistant tuberculosis?[J].Chest,2003,123(1):308-309.
[4]Sugawara I,Mizuno S.Higher susceptibility of type 1 diabetic rats to Mycobacterium tuberculosis infection[J].Tohoku J Exp Med,2008,216(4):363-370.
[5]Broxmeyer L,Sosnowska D,Miltner E,et al.Killing of Mycobacterium avium and Mycobacterium tuberculosis by a mycobacteriophage delivered by a nonvirulentmycobacterium:a model for phage therapy of intracellular bacterial pathogens[J].J Infect Dis,2002,186(8):1155-1160.
[6]Sugawara I,Yamada H,Mizuno S.Pulmonary tuberculosis in spontaneously diabeticgoto kakizakirats[J].Tohoku JExp Med,2004,204(2):135-145.
[7]Vallerskog T,MartensGW,KornfeldH.Diabeticmicedisplay adelayed adaptiveimmuneresponseto Mycobacterium tuberculosis[J].J Immunol,2010,184(11):6275-6282.
[8]Loeuillet C,Martinon F,Perez C,et al.Mycobacterium tuberculosis subverts innate immunity to evade specific effectors[J].J Immunol,2006,177(9):6245-6255.
[9]王建军,郭述良,罗永艾.C型凝集素在结核病发病机制中的作用[J].中华结核和呼吸杂志,2010,33(3):214-216.

