青蒿琥酯纳米粒的制备及其体外细胞抑制试验
邢贞建,李 祥,陶 涛(广州市胸科医院,广州市 510095)
青蒿琥酯纳米粒的制备及其体外细胞抑制试验
邢贞建*,李 祥,陶 涛(广州市胸科医院,广州市 510095)
目的:制备青蒿琥酯纳米粒,并对其性质及体外细胞抑制作用进行研究。方法:以聚乳酸-羟基乙酸共聚物(PLGA)为载体,采用自乳化方法制备青蒿琥酯纳米粒。扫描电镜观察纳米粒的形态,激光粒度仪测定纳米粒的粒径及其分布;考察纳米粒的载药量、包封率、体外释放情况;MTT法考察纳米粒对人白血病细胞株K562在不同时间(24、48、72h)的体外细胞抑制率,并与青蒿琥酯(原料药)比较。结果:所制青蒿琥酯纳米粒为圆球形,表面光滑,平均粒径为(144±3.0)nm,Zeta电位是-31.5mV,平均载药量和包封率分别为14%、84%;体外释放试验前期有明显突释现象,前24h累积释放度为46%,其后释放均匀,120h累积释放度达65%,具有缓释作用;其在72h时对细胞抑制率高于青蒿琥酯组(76.4%vs.59.1%),有较强抑制作用(P<0.05)。结论:所制青蒿琥酯纳米粒在体外具有较好的缓释性,对K562细胞有较强的抑制作用。
青蒿琥酯;纳米粒;聚乳酸-羟基乙酸共聚物;制备;K562细胞;抑制作用
青蒿琥酯(Artesunate,ART)是具有倍半萜结构的抗疟药,化学名为二氢青蒿素-1,2-α-琥珀酸单酯。较之青蒿素,青蒿琥酯水溶性更好,效价更高,不易产生耐药性,且其代谢产物二氢青蒿素(Dihydroartemisinin,DHA)抗疟活性高,毒性小[1]。另有研究[2]发现,青蒿琥酯还具有抗肿瘤的作用。但是,青蒿琥酯同时也具有诱导肝药酶的作用,首关效应明显,且在体内代谢快,因此,现有的片剂、注射剂都具有上述缺点,故改进青蒿琥酯给药方式、维持其体内浓度成为临床需要。纳米制剂具有提高药物稳定性、延长作用时间及对肝、脾等部位有靶向性等优点[3];而聚乳酸-羟基乙酸共聚物(PLGA)具有生物降解性,最终降解为水和二氧化碳,生物安全性高,是理想的药物载体[4]。因此,笔者选用PLGA为载体制备青蒿琥酯纳米粒,同时考察其性质,探讨青蒿琥酯纳米制剂的可行性。
1 仪器与材料
Rotavapor R-114旋转蒸发仪(瑞士Buchi公司);Zeta-sizer 3000HS激光粒度仪(英国马尔文仪器有限公司);TMP电子天平(德国Sartorius公司);JSM-6330F型扫描电镜(日本电子株式会社);Waters 2487型高效液相色谱(HPLC)系统(美国Waters公司)。
PLGA(50/50,山东岱罡生物材料有限公司,相对分子量:15000);青蒿琥酯原料药(广西桂林南药有限公司,批号:070519,纯度:>98%);青蒿琥酯、二氢青蒿素标准品(中国药品生物制品检定所,批号:100200-200202、100184-200401,纯度:均>98%);泊洛沙姆(型号:188)、MTT、二甲基亚砜(DMSO)均由美国Sigma公司提供;小牛血清(杭州四季青生物工程材料有限公司);RPMI-1640培养基(美国Gibco公司);青蒿琥酯纳米粒(自制,规格:每100mg含青蒿琥酯14mg);乙腈为色谱纯,其他试剂均为分析纯。
人白血病细胞株K562(购自中国医学科学院血液学研究所)。
2 方法与结果
2.1 青蒿琥酯纳米粒的制备
采用自乳化方法制备纳米粒[5]。精密称取24mg青蒿琥酯和120mg PLGA共溶于10mL油相中(丙酮-无水乙醇=9∶1),将油相缓慢滴加到中速搅拌的0.1%泊洛沙姆水溶液60mL中。搅拌一段时间后,将上述溶液减压旋转蒸发至无丙酮气味,然后于0.22μm滤膜过滤,得到纳米胶体溶液。将该溶液于4℃超速离心(20000r·min-1)0.5h,沉淀加蒸馏水洗涤,同法再离心、洗涤3次,冷冻干燥得到青蒿琥酯纳米粒。空白纳米粒除不加药物外,其余同法制备。
2.2 纳米粒的形态学及粒径考察
使用激光粒度仪测定纳米粒的粒径分布及Zeta电位,扫描电镜下观察纳米粒的形态。
测定结果表明,纳米粒表面带负电荷,Zeta电位是-31.5mV。粒径分布较窄,且基本呈正态分布,平均粒径是(144±3.0)nm,多分散指数为0.155。扫描电镜显示,纳米粒为类球形,表面光滑,大小均匀,粒子间基本无黏连。粒径分布和纳米粒形态分别见图1、图2。
2.3 药物含量测定
2.3.1 色谱条件与系统适用性试验色谱图。色谱柱:Ecosil C18(150mm×4.6mm,5μm);流动相:乙腈-0.02mol·L-1硫酸铵溶液-12%三乙胺溶液(60∶40∶0.2,稀氨水调pH至4.5);流速:1.0mL·min-1;进样体积:20μL;柱温:室温;检测波长:210nm。
取空白纳米粒、青蒿琥酯标准品、二氢青蒿素标准品和样品制备成溶液后进样分析,色谱见图3。

图1 青蒿琥酯纳米粒的粒径分布Fig 1 The particle size distribution of Artesunate nanoparticles

图2 青蒿琥酯纳米粒扫描电镜照片(×400000)Fig 2 Scanning electron micrographs of Artesunate nanoparticles(×400000)
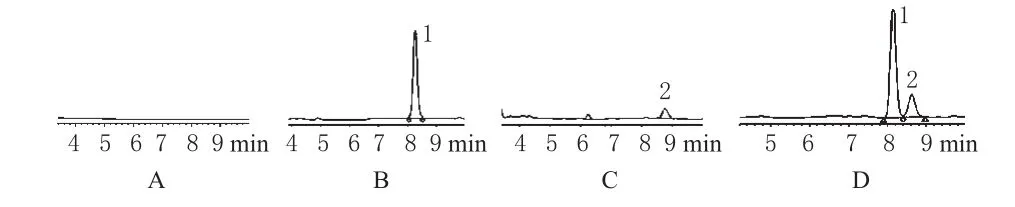
图3 高效液相色谱图A.空白纳米粒;B.青蒿琥酯标准品;C.二氢青蒿素标准品;D.供试品;1.青蒿琥酯;2.二氢青蒿素Fig 3 HPLC chromatograms A.blank nanoparticles;B.artesunate standard substance;C.dihydroartemisinin standard substance;D.test sample;1.artesunate;2.dihydroartemisinin
2.3.2 标准品溶液。精密称取青蒿琥酯和二氢青蒿素标准品,加入乙腈溶解成一定浓度,作为标准品贮备液。再分别取该贮备液适量,用乙腈稀释制成含青蒿琥酯分别为25、50、100、200、300、400、500μg·mL-1和含二氢青蒿素分别为10、20、30、40、50、100μg·mL-1的系列标准品溶液,备用。
2.3.3 线性关系考察。分别精密取“2.3.2”项下标准品溶液20μL进样,以色谱峰面积(A)对标准品浓度(c)进行线性回归。结果,青蒿琥酯的线性方程为c=0.0018A+22.03(r=0.997),线性范围为25~500μg·mL-1,保留时间是8.268min;二氢青蒿素的线性方程为c=0.0014A+23.6(r=0.998),线性范围为10~100μg·mL-1,保留时间是8.764min,见图3。
2.3.4 精密度试验。取“2.3.2”项下标准品溶液(含青蒿琥酯和二氢青蒿素分别为200、30μg·mL-1),连续进样6次。结果,青蒿琥酯和二氢青蒿素峰面积的RSD分别为1.6%(n=6)和1.5%(n=6),表明本方法精密度良好。
2.3.5 重复性试验。取一定量青蒿琥酯按“2.1”项下方法操作制备纳米粒,测定其中青蒿琥酯和二氢青蒿素的浓度。结果,二者RSD分别为2.8%(n=6)和2.5%(n=6),表明本方法重复性较好。
2.3.6 回收率试验。精密量取1mL空白纳米粒溶液9份,置于5mL容量瓶中,分别加入适量青蒿琥酯和二氢青蒿素标准品溶液,乙腈定容,使青蒿琥酯的浓度为200、300、400μg·mL-1,二氢青蒿素的浓度为40、50、60μg·mL-1,每个浓度3份样品。高速离心,进样20μL。结果,青蒿琥酯和二氢青蒿素的平均回收率分别为99.4%(n=9)和101.4%(n=9),RSD分别为0.81%(n=9)和2.07%(n=9),表明本方法的准确度高。
2.4 纳米粒的载药量、包封率测定
收集“2.1”项下超速离心后的纳米胶体溶液的上清液及洗液,采用HPLC法检测其中药物含量。精密称取适量冻干的纳米粒,加入少量二氯甲烷使纳米粒完全溶解,挥干有机相,乙腈溶解残渣,高速离心后进样检测。载药量=(纳米粒中药物量/纳米粒重量)×100%;包封率=[(加入总药量-上清液中游离药量)/加入总药量]×100%。
结果,纳米粒平均载药量为14%(n=3),平均包封率为84%(n=3)。
2.5 纳米粒的体外释放
采用动态透析法测定纳米粒的体外释放情况[6]。精密称取一定量纳米粒,置于10mL磷酸盐缓冲液(PBS,pH7.4)中,超声分散,37℃、100r·min-1恒温搅拌。分别在0.5、1、2、3、4、6、8、10、24、36、48、72、96、120h时各取1mL,超速离心取上清液;同时补加等量新鲜PBS。HPLC法检测上清液中的药物含量,计算累积释放度,将累积释放度与时间作图得体外释放曲线,见图4。
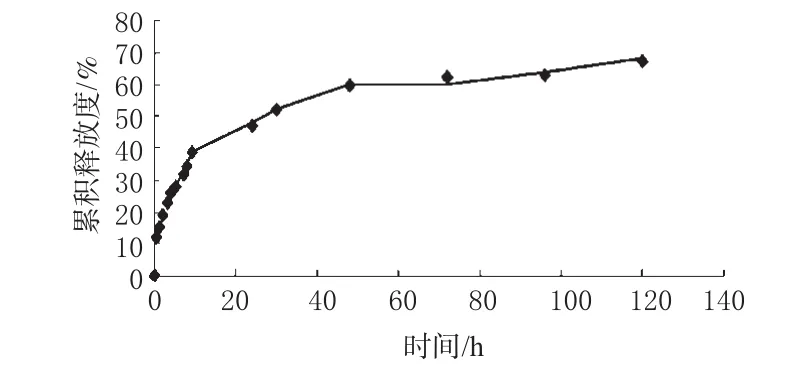
图4 青蒿琥酯纳米粒体外释放曲线Fig 4 In vitro drug release curves of Artesunate nanoparticles
由图4可见,纳米粒在体外有较好的缓释性,前期有明显突释现象,前24h累积释放度为46%,其后释放均匀,120h累积释放度达65%。
2.6 纳米粒的体外细胞抑制作用
采用MTT法检测细胞存活率。将人白血病细胞株K562置于含10%小牛血清的RPMI-1640培养基中,37℃、5%CO2常规培养。选择对数生长期细胞,调整细胞数为5×105个/mL接种于96孔培养板中,置于37℃、5%CO2培养箱中培养,每孔200μL。试验组分为3组,青蒿琥酯纳米粒组、青蒿琥酯(原料药)组和空白纳米粒组,对照组为未加任何物质的培养基。根据资料[7],设定青蒿琥酯纳米粒组和青蒿琥酯组的浓度均为0、5、10、20、40μmol·L-1,每个浓度设8个复孔,分别于24、48、72h每孔加入5g·L-1MTT溶液20μL,孵育4h,弃上清液,加入DMSO终止反应,微振荡后,用酶标度光度计在波长570nm测定每孔的吸光度,并计算各组的细胞增殖抑制率,重复3次。细胞增殖抑制率=(1-A试验组/A对照组)×100%(A为吸光度)。即吸光度越大,抑制率越小。
试验所得数据以均数±标准差(x ±s)表示,应用SPSS 13.0软件进行t检验,P<0.05为差异具有统计学意义。
结果表明,不同浓度青蒿琥酯纳米粒与K562细胞共同孵育后,细胞生长受到抑制,并呈剂量依赖性。在3个不同的时间段,各浓度的抑制率都在72h达到最高峰,其中20μmol·L-1浓度的青蒿琥酯纳米粒与其他浓度相比,抑制率具有显著性差异(P<0.01)。青蒿琥酯纳米粒组与空白纳米粒组、青蒿琥酯组在24、48、72h的吸光度相比,均有显著性差异(P<0.05),其中24、48h青蒿琥酯纳米粒组抑制率小于青蒿琥酯组,而在72h抑制率则高于青蒿琥酯组,呈时间依赖性。结果详见表1、表2。
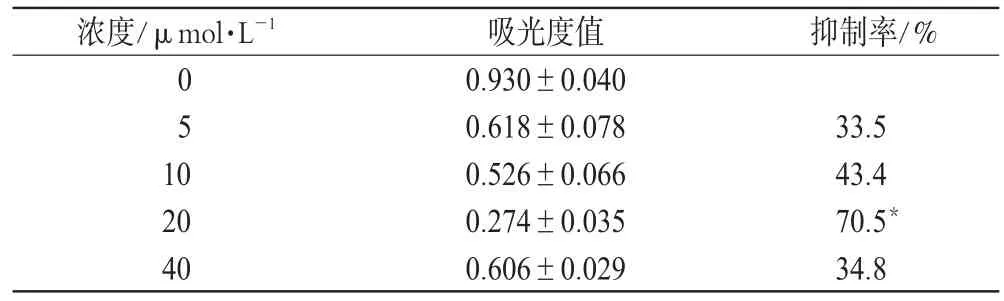
表1 72h时不同浓度青蒿琥酯纳米粒组吸光度值和抑制率比较(x ±s,n=8)Tab 1 Comparison of absorbance and inhibition rate of different concentrations of Artesunate nanoparticles at 72h(x±s,n=8)
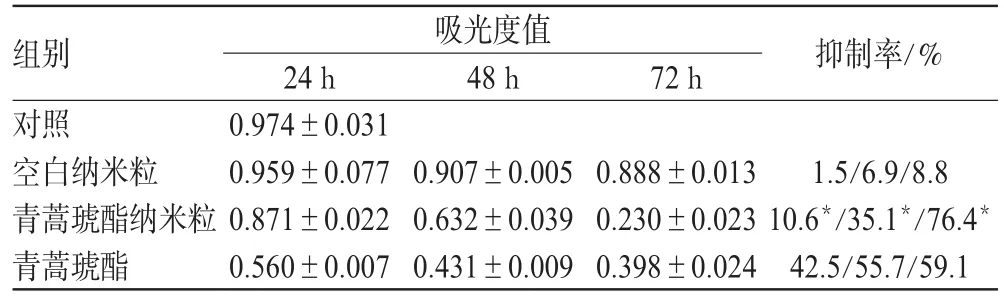
表2 20μmol·L-1浓度时各组不同时间点吸光度值和抑制率比较(x ±s,n=8)Tab 2 Comparison of absorbance and inhibition rate of different group of 20μmol·L-1at different tim(ex ±s,n=8)
3 讨论
青蒿琥酯在水中很快水解成二氢青蒿素,而发挥药理作用的也是二氢青蒿素,因此青蒿琥酯可以说是一个前药[8]。纳米粒形成后青蒿琥酯包封在PLGA载体里,可减少酯键的水解,保持稳定;同时,青蒿琥酯被聚酯类载体包裹后其降解产物绝大多数是二氢青蒿素;另PLGA作为载体本身对细胞毒性很小,用其制备的纳米粒,后期可能因降解出乳酸使细胞生长的微环境pH值降低,从而抑制细胞生长。因此,青蒿琥酯采用PLGA为载体制备纳米制剂有利于药效的发挥[9]。
有研究[10]发现,青蒿琥酯单药对白血病和结肠癌细胞株作用最强,对非小细胞肺癌细胞株作用最弱。因此,青蒿琥酯在抗白血病方面可能具有较大潜力,故本试验选择K562细胞,该细胞是慢性粒细胞白血病细胞系中的一种。青蒿琥酯纳米粒在体外对其有抑制作用,提示青蒿琥酯纳米粒可能对白血病的治疗有益。
关于青蒿琥酯的含量测定方法,已有许多文献报道,如RP-HPLC法[11]、HPLC-碱水解-UV法[12]等。其中,HPLC-UV是最常用的方法,但青蒿琥酯本身紫外吸收波长在近紫外区(210nm左右),一般直接测定比较困难,有研究者先把青蒿琥酯水解后再进行测定[13]。由于水解受温度、pH、时间等因素影响,因此,对各因素控制要求严格,操作条件的不同可致稳定产物的量有明显差异。本试验参考以上文献,经多次试验后采用本文所述色谱条件,结果表明有较好的效果。
自乳化方法制备的纳米粒粒径较小,表面带负电荷,适合静脉给药。在体外,青蒿琥酯纳米粒具有较好的缓释性,由此推测其在体内可能也具有较好的缓释性,从而延长青蒿琥酯的作用时间,克服其半衰期短的缺点。本文中的细胞试验表明,青蒿琥酯纳米粒对K562细胞有较强的抑制作用,且此作用呈剂量和时间依赖性。青蒿琥酯纳米粒组在24、48h的抑制效果不如青蒿琥酯组,可能是由于开始时青蒿琥酯浓度较高,对细胞有显著作用,但随着时间的增加,青蒿琥酯逐渐被代谢消失,而青蒿琥酯纳米粒则始终保持一定的浓度释放,如青蒿琥酯纳米粒组72h时抑制率高于青蒿琥酯组。在体内,青蒿琥酯或二氢青蒿素的半衰期只有几十分钟,因此,青蒿琥酯会很快被代谢,很难像体外一样保持稳定浓度。而青蒿琥酯经PLGA包裹成纳米粒后,可以防止药物被迅速代谢,从而控制药物释放,延长作用时间。
[1] 严虹霞,张丽锋,张淑秋.青蒿素类抗疟药的药物代谢动力学与药物相互作用[J].中国药物与临床,2006,6(9):645.
[2] 杨小平,张 星.青蒿酯钠诱导人肿瘤细胞凋亡及其分子机制的探讨[J].中草药,2002,33(9):819.
[3] 梅之南,杨祥良,徐辉碧.生物降解聚合物长循环纳米粒[J].中国医院药学杂志,2002,22(7):433.
[4] 张 蜀,谭载友,陈济民.聚乳酸类缓释、控释注射剂的研究进展[J].中国药学杂志,2002,37(11):810.
[5] Yang AS,Yang L,Liu W,et al.Tumor necrosis factor alpha blocking peptide loaded PEG-PLGA nanoparticles:Preparation and in vitro evaluation[J].International Journal of Pharmaceutics,2007,331(1):123.
[6] 陈国广,徐元龙,李学明.5-氟尿嘧啶纳米粒的制备及其体外释药的研究[J].华西药学杂志,2006,21(5):436.
[7] 叶宝东,朱宁西,虞荣喜,等.青蒿琥酯诱导人白血病细胞K562凋亡的实验研究[J].浙江医学,2005,27(12):899.
[8] 陈立军,靳秋月,于利人,等.青蒿素及其衍生物抗肿瘤研究进展[J].中草药,2005,36(11):1754.
[9] Gaudin K,Langlois MH,Barbaud A,et al.Stability of artesunate in pharmaceutical solvents[J].Journal of Pharmaceutical and Biomedical Analysis,2007,43(3):1019.[10] Efferth T,Dunstan H,Sauerbrey A,et al.The anti-malarial artesunate is also active against cancer[J].Int J Oncol,2001,18(4):767.
[11] 崔志平,陆培康,孙月琴,等.反相高效液相色谱法测定青蒿琥酯脂质体含量[J].现代应用药学,1999,7(1):31.
[12] Batty KT,Davis TM,Thu LT,et al.Selective high-performance liquid chromatographic determination of artesunate and alpha-and beta-dihydroartemisinin in patients with falciparum malaria[J].J Chromatogr B Biomed Appl,1996,677(2):345.
[13] 侯海霞,周莉玲,李 锐.青蒿琥酯紫外分析法的研究[J].中药新药与临床药理,2000,11(2):113.
Preparation of Artesunate Nanoparticles and Its in Vitro Cell Inhibition Test
XING Zhen-jian,LI Xiang,TAO Tao(Guangzhou Municipal Chest Hospital,Guangzhou 510095,China)
OBJECTIVE:To prepare Artesunate nanoparticles,and to investigate their characteristics and inhibitory effect on cell in vitro.METHODS:Spontaneous emulsion solvent diffusion method was used to prepare Artesunate nanoparticles using poly(lactide-co-glycolide)(PLGA)as carrier.Then their morphology was detected by scanning electron microscorpe.The particle size and its distribution of nanoparticles were determined by laser particle measurer.The drug-loading amount,encapsulation rate and drug released characteristics were identified.The inhibition effects of nanoparticles on K562cells at different time(24h,48h,72h)were determined by MTT assay and compared with that of artesunate raw material.RESULTS:Prepared Artesunate nanoparticles were spherical and uniform with mean diameter of(144±3.0)nm.Zeta potential was -31.5mV.Their mean drug-loading amount and encapsulation rate were 14%and 84%,respectively.At early period of in vitro release test,Artesunate nanoparticles released suddenly.At first 24h,accumulative drug release rate was 46%and showed significant sustained release.Accumulative drug release rate was 65%at 120h.At 72h,cell inhibition rate of Artesunate nanoparticles was higher than that of artesunate raw material(76.4%vs.59.1%).The inhibitory effect on K562cells of Artesunate nanoparticles was significant(P<0.05).CONCLUSION:Prepared Artesunate nanoparticles are characterized with sustained-release property.Artesunate nanoparticles can inhibit K562cells proliferation efficiently in vitro.
Artesunate;Nanoparticles;PLGA;Preparation;K562cells;Inhibition effect
R943;R979.1
A
1001-0408(2011)25-2357-04
2010-12-04
2011-04-08)
——青蒿素

