溶剂热法制备球状Cu2ZnSnS4纳米晶及其表征
蔡 倩 梁晓娟,* 钟家松 邵明国 王 芸 赵肖为 向卫东,,*
(1温州大学化学与材料工程学院,浙江温州325035;2同济大学材料科学与工程学院,上海200092)
溶剂热法制备球状Cu2ZnSnS4纳米晶及其表征
蔡 倩1梁晓娟1,*钟家松2邵明国1王 芸1赵肖为1向卫东1,2,*
(1温州大学化学与材料工程学院,浙江温州325035;2同济大学材料科学与工程学院,上海200092)
通过简单的溶剂热法合成了锌黄锡矿结构的Cu2ZnSnS4(CZTS)纳米晶,使用L-半胱氨酸作硫源和络合剂,以金属氯化物作前驱体,在180°C下反应16 h成功获得了CZTS微球.使用X射线衍射(XRD)仪,场发射扫描电子显微镜(FESEM)、能量色散谱(EDS)、高分辨透射电子显微镜(HRTEM)、多功能X射线光电子能谱仪(XPS)、紫外-可见(UV-Vis)分光光度计对产物的物相、结构、形貌及光学性能进行表征.结果表明:所得的产物为纯相锌黄锡矿结构的CZTS纳米颗粒,CZTS微球直径为400-800 nm,并可观察到微球是由大量厚度约20 nm的纳米片构成;将CZTS颗粒均匀分散在异丙醇中,测试后估算其禁带宽度约1.58 eV,与薄膜太阳能电池所需的最佳禁带宽度相近.并对其形成机理进行了初步探讨.
Cu2ZnSnS4纳米晶;溶剂热法;L-半胱氨酸;太阳能电池
1 引言
近半个世纪以来,CIGS薄膜太阳能电池受到了广泛研究并取得迅速发展.2008年,Repins等1首次制成了光电转化率达19.9%的CIGS薄膜太阳能电池,是目前转化率最高的CIGS电池,但由于In、Ga资源的稀缺,成本较高,从而限制了CIGS薄膜太阳能电池的大规模应用,目前仅处于实验室研究阶段并未进行工业化生产.近年来,研究者发现锌黄锡矿结构的CZTS晶体与黄铜矿结构的CIGS晶体结构相似,且具有较高的光吸收系数(>104cm-1),禁带宽度约1.50 eV,与太阳能电池所需要的最佳禁带宽度相匹配,而且锌和锡在地壳中含量丰富,从而可以大大降低生产成本,且其中不含有毒成分,是一种绿色、廉价、安全、适合大规模生产的薄膜太阳能电池材料.21996年,Katagiri等3在PVSEC-9上首次报道了使用真空蒸发法制得了ZnO:Al/CdS/CZTS/ Mo/SLG结构的CZTS薄膜太阳能电池,其转化效率只有0.66%,随后又逐步改进方案使转化率达到5.45%;42008年,Katagiri等5首次通过射频磁控溅射法制得了转化率高于6.7%的CZTS薄膜太阳能电池.2009年,美国普渡大学科学家6利用一种以溶液为基础的非真空薄膜沉积法制备了CZTS太阳能电池,这种电池易于大规模生产且性能非常稳定,其全域转化效率高达7.2%,而CZTS薄膜电池的理论光电转化率可达32.2%,可以通过改进技术提高转化率.CZTS薄膜太阳能电池在将来必然成为研究的热点.
目前制备CZTS薄膜的方法有很多,如电沉积法、7喷涂热解法、8溅射后硫化法、9溶胶-凝胶法、10化学沉积法、11脉冲激光沉积法12等.然而,至今对CZTS粉体制备的报道还很少,据报道,6制备出的CZTS粉体可以分散在有机溶剂中制成“纳米墨水”,再使用旋涂等方法涂布在衬底上制成薄膜电池,这种电池制备方法可以大大降低生产成本,可尝试用于工业化生产,因此直接制备CZTS纳米颗粒也具有重要意义.2009年,Riha等13采用热注入法制备了CZTS纳米晶,2011年他们14又将制备的粉体分散在己烷/甲苯混合液中得到CZTS悬浮液,再浸铸到掺氟二氧化锡(FTO)衬底上制成了CZTS薄膜电池;溶剂热工艺在湿化学合成纳米材料方面也具有其独特的优势,Cao等15使用简单温和的溶剂热法成功合成了锌黄锡矿结构的CZTS纳米粉体; 2011年,Zhou等16以金属氯化物作前驱体,硫脲作硫源,聚乙烯比咯烷酮(PVP)作表面活性剂,使用溶剂热法制备了球形的CZTS纳米晶.
近年来,人们通过尝试使用各种生物分子作为硫源合成了金属硫化物的纳米材料,且已经取得了突破性的进展.17生物分子作为硫源,在反应过程中不直接产生H2S气体,从而避免了环境污染,是一种绿色、安全、环保的硫源.据我们所知,目前尚未有使用生物分子L-半胱氨酸制备CZTS纳米粉体的报道,L-半胱氨酸还可以作为模板和络合剂指导合成特定形貌的产物,本文将尝试使用廉价和环保型生物分子L-半胱氨酸作为硫源和络合剂,通过溶剂热法制备CZTS纳米粉体,并对其结构、形貌及光学性能进行表征.
2 实验部分
2.1 样品的制备
实验所用试剂均为分析纯.以CuCl2作铜源, SnCl2·2H2O作锡源,ZnCl2·2H2O作锌源,L-半胱氨酸作硫源,N,N-二甲基甲酰胺(DMF)作溶剂,称取2 mmol CuCl2,1 mmol SnCl2·2H2O,1 mmol ZnCl2· 2H2O溶解在20 mL N,N-二甲基甲酰胺中,再将溶有5 mmol L-半胱氨酸的DMF溶液缓缓倒入金属前驱体溶液中,搅拌直至溶液至透明后转移入50 mL不锈钢高压反应釜中,在180°C条件下反应16 h,得到黑色沉淀物,用蒸馏水和无水乙醇洗涤若干次后,放入干燥箱中60°C干燥10 h,收集黑色粉体进行表征测试.
2.2 测试及表征
所有的测试均在室温下进行.实验使用德国Bruker D8型X射线衍射仪(铜靶,λ=0.15406 nm,加速电压40 kV,扫描范围10°-80°),英国VG科学仪器公司ESCALAB MKII型X射线光电子能谱仪(加速电压15 kV)和英国牛津公司OXFORD INCA型能量色散谱仪(加速电压20 kV)测定样品的晶型结构及物相组成.用日本电子株式会社JEOL-6700F型场发射扫描电子显微(加速电压为10 kV)和JEM-2010型高分辨透射电子显微镜(加速电压200 kV)观察样品的形貌,使用岛津UV-2501PC型紫外-可见分光光度计测试样品的光学性能.
3 结果与讨论

图1 不同温度下反应16 h获得样品的XRD谱图Fig.1 XRD patterns of products obtained at different temperatures for 16 hT/°C:(a)140;(b)180;(c)220

图2180 °C下反应不同时间获得样品的XRD谱图Fig.2 XRD patterns of products obtained at 180°C fordifferent time t/h:(a)8;(b)16;(c)24
为确定所制备样品的物相组成,我们对其进行了XRD分析.图1曲线b为180°C条件下反应16 h所得产物的XRD谱图.由谱图可知,所有衍射峰均与锌黄锡矿结构的CZTS标准卡片(PDF No. 26-0575)一致,三个主要的衍射峰分别对应其(112)、(220)和(312)晶面,并无其他二元或三元化合物的杂峰出现,结果表明在此条件下可获得纯相的CZTS纳米晶.为了探讨反应时间和温度对产物物相和形貌的影响,分别在前驱体和溶剂不变的条件下,改变时间和温度对所得的产物进行了表征.图1曲线a和曲线c分别为在140和220°C反应温度下16 h制得样品的XRD谱图.由图1可知,随着反应温度的升高,衍射峰强度逐渐增强,半峰宽逐渐减小,说明产物的结晶性变好,颗粒尺寸变大.图2为180°C条件下反应不同时间所得产物的XRD谱图.由图可知,随着反应时间的延长,均可得到锌黄锡矿结构的CZTS,峰的强度有所增强,但变化不明显.
图3a为180°C下反应16 h后所得样品的低倍FESEM图片.由图片可知,所得的CZTS样品由大量直径约400-800 nm的微球构成,由高倍FESEM图片(图3b)可以明显观察到微球上有大量厚度约10-20 nm的纳米片,图3c为任选一点的EDS图.由图知,样品中只含有Cu、Zn、Sn、S四种元素而没有其他杂质,与XRD测试的结果一致.通过EDS峰的量子化学计算得出四种元素的Cu:Zn:Sn:S原子比为 23.49:13.19:12.37:50.94,约为 2:1:1:4,这与Cu2ZnSnS4中各元素的化学计量比相一致.
为探讨反应温度和时间对CZTS纳米晶形貌及尺寸的影响,对不同温度和时间所获得的产物进行了FESEM表征,见图4(a,b).当反应温度为140°C时,产物由大量直径约200-400 nm微球和少量直径约5 μm的花状物构成,而当温度升至220°C时,产物全部由直径约1.5-2.0 μm的微球构成,且可以看到微球的表面有粒状物,随着温度的升高,CZTS纳米晶尺寸逐渐增大,结晶性变好,这与XRD谱图的结果一致.图4(c,d)为不同时间获得CZTS样品的FESEM图片,由图可知,反应时间在8-24 h内产物都是由均一的球状物构成,随着时间的延长,微球表面的片状物已不存在,表面变光滑,微球也有变大趋势.

图3 Cu2ZnSnS4纳米晶的低倍FESEM图片(a)和高倍FESEM图片(b)及Cu2ZnSnS4(CZTS)纳米晶的EDS谱图(c)Fig.3 FESEM images of Cu2ZnSnS4(CZTS)nanocrystals at low(a)and high(b)magnifications,and EDS spectrum of Cu2ZnSnS4nanocrystals(c)

图4 不同温度下反应16 h获得的产物(a,b)和180°C下反应不同时间所得的产物(c,d)的FESEM图片Fig.4 FESEM images of the products obtained at different temperatures for 16 h(a,b)and at 180°C for different time(c,d) (a)140°C,(b)220°C;(c)8 h,(d)24 h
为进一步观察产物的微观结构和形貌,对其进行了HRTEM分析.图5a为180°C条件下反应16 h所得CZTS样品在乙醇中超声分散后测得的TEM图片.由图知产物是由大量直径约几百纳米的微球构成,这与扫描电镜的结果一致;由图5b可以明显看到单个微球周边有较薄的片状结构,这也与图3b的扫描电镜结果相符合.图5c为纳米微球边缘的HRTEM,从图中可清晰地看出晶体的晶格结构,并选择两个区域计算了晶格条纹间距,分别为0.309和0.313 nm,与锌黄锡矿结构的Cu2ZnSnS4的(112)晶面所对应的晶格间距(d=0.312 nm)相符,且主要沿(112)晶面生长,这与XRD谱图中所得的晶面生长方向一致.图5d为CZTS微球的选区电子衍射图,从图中可以明显看到晶体的三个环状晶面,即
(112)、(220)和(312)晶面,分别与X射线衍射谱图中的衍射峰相符.
为了确定元素的价态,我们又对CZTS纳米晶做了X射线光电子能谱(XPS)分析.图6(a)为样品的XPS全谱图,由图可知,样品中除Cu、Zn、Sn、S、C和O元素外,无其他杂质元素.为确定Cu、Zn、Sn、S四种元素的价态,分别对这四种元素做了XPS分析.位于931.7和950.6 eV处的结合能(图6(b))分别对应一价铜的Cu 2p3/2和Cu 2p1/2处的电子结合能,18而二价铜的Cu 2p3/2在942 eV处的特征峰并未出现,说明样品中仅含有Cu+,反应物中的Cu2+全部被还原.位于1020.35 eV与1042.98 eV处的结合能(图6(c))分别对应Zn2+的Zn 2p3/2和Zn 2p1/2处的电子结合能; Sn 3d分裂成的两峰Sn 3d5/2和Sn 3d3/2的结合能分别是485.85和494.85 eV(图6(d)),与文献19中报道Sn4+的结合能一致;S 2p通过轨道的自旋耦合分成两个峰S 2p3/2和S 2p1/2,他们的电子结合能分别为161.1和162.15 eV(图6(e)),在Cu2ZnSnS4晶体中S的价态为-2价.20
为测试CZTS纳米晶的光学性能,将CZTS粉末均匀分散在异丙醇溶液中,测试了其紫外吸收光谱(图7(a)),结果表明CZTS晶体在紫外-可见区域有很强的吸收,并根据紫外吸收谱图估算了其禁带宽度13(图7(b)),其禁带宽度约1.58 eV,与太阳能电池所需的最佳禁带宽度(1.5 eV)相近,因此非常适用于薄膜太阳能电池的光电吸收层.
4 机理分析

图5 制备的CZTS纳米晶的透射电镜图片(a,b),高分辨透射电镜图(c)和选区电子衍射图像(d)Fig.5 TEM images(a,b),HRTEM image(c),and selected area electron diffraction(SAED) pattern(d)of the as-obtained CZTS nanocrystals

图6 CZTS样品的XPS谱Fig.6 XPS spectra of CZTS samples(a)survey spectrum;(b)Cu 2p;(c)Zn 2p;(d)Sn 3d;(e)S 2p
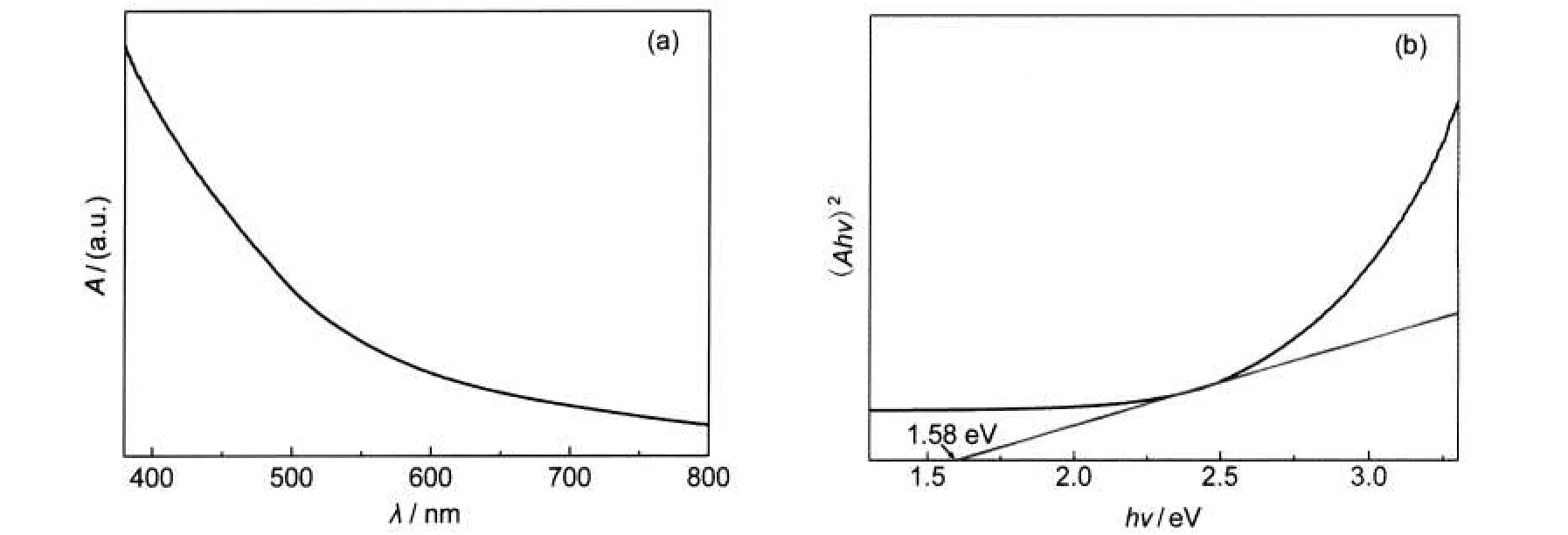
图7 分散在异丙醇中的CZTS纳米晶的紫外-可见吸收光谱(a)及其(Ahν)2-hν图(b)Fig.7 UV-Vis absorption spectrum of the CZTS nanocrystals dispersed in isopropanol(a)and its(Ahν)2-hν spectrum(b) A:absorbance
为了探讨L-半胱氨酸在球状CZTS形成过程中所起的作用及微球的形成机理,讨论了硫源对CZTS晶体形貌和结构的影响.分别使用L-胱氨酸、硫脲、硫粉、硫代乙酰胺作硫源,在相同的反应条件下制备了CZTS粉体,并对所得的产物进行XRD和FESEM表征.由图8的XRD谱图可知,不同硫源所得产物的衍射峰强度存在差异,但其组成和衍射峰的强度都与CZTS标准卡片.图9为不同硫源所得产物的FESEM图.当以L-胱氨酸作硫源时(图9a),得到的产物为大量球状CZTS晶体,直径约几百纳米,但颗粒分散性不好;而以硫脲作硫源时(图9b),硫脲与被还原的Cu+结合形成[Cu(Tu)n]+络合物,既可以防止二元硫化物的生成,又可以合成花状CZTS纳米晶,其直径约2-10 μm,且花瓣的厚度仅为几十纳米;以硫粉作硫源时(图9c),产物为少量片层堆积的花状物和大量块状结构,可能是反应不完全致使产物形貌不均匀;以硫代乙酰胺做硫源时(图9d),获得的CZTS由大量团聚的球形颗粒和少量不规则颗粒构成.因此,不同的硫源对CZTS晶体的形貌有重大影响,说明L-半胱氨酸作硫源对球状CZTS晶体的形成起重要作用.

图8 不同硫源制得CZTS纳米晶体的XRD谱图Fig.8 XRD spectra of CZTS nanocrystals obtained with different sulfur sources(a)L-cystine;(b)thiourea;(c)S powder;(d)thioacetamide

图9 不同硫源制得CZTS纳米晶体的FESEM图片Fig.9 FESEM images of CZTS nanocrystals obtained with different sulfur sources(a)L-cystine;(b)thiourea;(c)S powder;(d)thioacetamide
生物分子L-半胱氨酸分子式为H2N-CHCH2(SH)-COOH,结构如图10所示,分子中含有许多能与无机金属离子有很强结合能力的官能团,如NH2、―COOH,特别是分子中的硫醇基(HS―CH2)起到桥梁作用.21-23L-半胱氨酸在整个反应过程中既可以作硫源又可以作络合剂,而且它也是一种还原剂,更有利于在反应过程中将Cu2+还原成Cu+.所以,当L-半胱氨酸与金属前驱体溶液混合后,不断搅拌可以得到浅黄色溶液最后变成透明,表明Zn2+、Sn4+、Cu+与L-半胱氨酸络合形成前驱体络合物,其可能的形成机理20,24可描述如下:


图10 L-半胱氨酸分子结构Fig.10 Molecule structure of L-cysteine
当金属前驱体溶液与L-半胱氨酸溶液混合后,首先一部分Cu2+在L-半胱氨酸和溶剂DMF的作用下被还原成Cu+,根据标准电极电势数据,24ECu2+/Cu+= 0.17 eV,ESn4+/Sn2+=0.15 eV,Sn2+可以被Cu+缓慢氧化为Sn4+.搅拌后溶液变透明说明形成了络合物,即Cu+、Zn2+、Sn4+分别与L-半胱氨酸络合形成[Cu(L-cysteine)n]+、[Zn(L-cysteine)n]2+、[Sn(L-cysteine)n]4+络合物,随着反应温度和时间的增加,巯基与金属离子之间的配位键使S―H键变弱,直至断裂形成了初始Cu2ZnSnS4晶核,在DMF溶液中,为了降低整个系统的能量,小颗粒的CZTS纳米晶汇聚形成微球,球形结构的表面由于以L-半胱氨酸为模板的分子定向生长和Ostwald成熟过程形成了许多纳米片.
5 结论
报道了以CuCl2,SnCl2·2H2O,ZnCl2·2H2O为金属前体,生物分子L-半胱氨酸作硫源和络合剂, DMF为溶剂,通过溶剂热法在180°C下反应16 h成功制得了由纳米片构成的直径几百纳米的锌黄锡矿结构CZTS微球.对CZTS微球的物相组成、结构、形貌及光学性能进行了表征,结果表明锌黄锡矿结构的CZTS纳米材料非常适用于薄膜太阳能电池的光电吸收层,在今后将会得到更加广泛深入的研究和应用;并通过改变反应温度和时间,探讨了温度和时间对产物形貌和物相的影响,结果表明随着温度和时间的增加,颗粒尺寸逐渐增大,且对形貌有一定影响;又通过改变硫源说明L-半胱氨酸对球状CZTS晶体的形成至关重要,不同硫源所获得的CZTS晶体形貌都有差异,最后对L-半胱氨酸作硫源形成CZTS微球的机理进行了初步探索,并提出了可能的生长机理.
(1) Repins,I.;Contreras,M.A.;Egaas,B.Progress in Photovoltaics:Research and Applications 2008,16(3),235.
(2) Habas,S.E.;Platt,H.A.S.;Hest,M.F.A.;Ginley,D.S.Chem. Rev.2010,110,6571.
(3) Katagiri,H.;Sasaguchi,N.;Hando,S.;Hoshino,S.;Yokota,T. Preparation and Evaluation of Cu2ZnSnS4Thin Films by Sulfurization of E-B Evaporated Precursor.In Technical Digest of the 9th International Photovoltaic Science and Engineering Conference,9th International Conference of Photovoltaic Science and Engineering Conference,Miyazaki,Nov.11-15, 1996;Yang,L.,Willing,F.,Rajan,K.Eds.;Elsevier: Amsterdam.1996;p 745.
(4) Katagiri,H.Thin Solid Films 2005,480-481,426.
(5)Katagiri,H.;Jimbo,K.;Yamada,S.;Kamiura,T.;Maw,W.S.; Fukano,T.;Motohiro,T.Appl.Phys.Exp.2008,1,041201.
(6) Guo,Q.J.;Hillhouse,H.W.;Agrawal,R.J.Am.Chem.Soc. 2009,131,11672.
(7) Ennaouia,A.;Lux-Steiner,M.;Weber,A.;Abou-Ras,D.; Kötschau,I.;Schock,H.W.;Schurr,R.;Hölzing,A.;Jost,S.; Hock,R.;Voß,T.;Schulze,J.;Kirbs,A.Thin Solid Films 2009, 517,2511.
(8) Yoo,H.;Kim,J.H.Sol.Energy Mater.Sol.Cells 2011,95,239.
(9) Liu,F.Y.;Li,Y.;Zhang,K.;Wang,B.;Yan,C.;Lai,Y.Q.; Zhang,Z.;Li,J.;Liu,Y.X.Sol.Energy Mater.Sol.Cells 2010, 94,2431.
(10)Yusuke,M.;Kunihiko,T.;Masatoshi,O.;Noriko,M.;Hisao,U. Jpn.J.Appl.Phys.2008,47(1),596.
(11) Chan,C.P.;Lam,H.;Surya,C.Sol.Energy Mater.Sol.Cells 2010,94,207.
(12)Araki,H.;Kubo,Y.Sol.Energy Mater.Sol.Cells 2009,93,996.
(13) Riha,S.C.;Parkinson,B.A.;Prieto,A.L.J.Am.Chem.Soc. 2009,131,12054.
(14) Riha,S.C.;Fredrick,S.J.;Sambur,J.B.;Liu,Y.J.;Prieto,A. L.;Parkinson,B.A.Appl.Mater.Interfaces 2011,3(1),58.
(15) Cao,M.;Shen,Y.J.Cryst.Growth 2011,318(1),1117.
(16)Zhou,Y.L.;Zhou,W.H.;Du,Y.F.;Mei,L.;Wu,S.X.Mater Lett.2011,65(11),1535.
(17)Guo,P.Z.;Han,G.T.;Wang,B.Y.;Zhao,X.S.Acta Phys.-Chim.Sin.2010,26(9),2557.[郭培志,韩光亭,王宝燕,赵修松.物理化学学报,2010,26(9),2557.]
(18) Lanosa,J;Buljana,A.;Mujica,C.J.Alloy.Compd.1996,234, 40.
(19) Ettema,A.;Haas,C.J.Phys.Condens.Matter 1993,5,3817.
(20)Hu,H.M.;Deng,C.H.;Sun,M.;Zhang,K.H.Chin.J.Inorg. Chem.2010,26(7),1189.[胡寒梅,邓崇海,孙 梅,张克华.无机化学学报,2010,26(7),1189.]
(21) Zhang,B.;Ye,X.C.;Hou,W.Y.;Zhao,Y.;Xie,Y.J.Phys. Chem.B 2006,110(18),243.
(22) Gao,F.;Lu,Q.Y.;Meng,X.K.;Komarneni,S.J.Mater.Sci. 2008,43,2377.
(23)Chen,X.Y.;Zhang,X.F.;Shi,C.W.Solid State Commun. 2005,134,613.
(24) Zhong,J.S.;Hu,J.;Cai,W.;Yang,F.;Liu,L.J.;Liu,H.T.; Yang,X.Y.;Liang,X.J.;Xiang,W.D.J.Alloy.Compd.2010, 501,15.
July 12,2011;Revised:September 13,2011;Published on Web:September 27,2011.
Synthesis and Characterization of Sphere-Like Cu2ZnSnS4Nanocrystals by Solvothermal Method
CAI Qian1LIANG Xiao-Juan1,ZHONG Jia-Song2SHAO Ming-Guo1WANG Yun1ZHAO Xiao-Wei1XIANG Wei-Dong1,2,*
(1College of Chemistry and Materials Engineering,Wenzhou University,Wenzhou 325035,Zhejiang Province,P.R.China;2School of Material Science and Engineering,Tongji University,Shanghai 200092,P.R.China)
A simple solvothermal route has been successfully used to prepare Cu2ZnSnS4nanocrystals using metal chloride and L-cysteine as precursors at 180°C for 16 h.L-cysteine was used as the sulfide source and complexing agent.The phase,structure,morphology,and optical properties of the assynthesized products were characterized by powder X-ray diffraction(XRD),field-emission scan electron microscopy(FESEM),energy dispersive spectrometry(EDS),high-resolution electron transmission microscopy (HRTEM),X-ray photoelectron spectroscopy (XPS),and ultraviolet-visible (UV-Vis) spectrophotometer.The results showed that pure kesterite-type Cu2ZnSnS4nanocrystals were prepared under this condition and the diameters of the microspheres were about 400-800 nm while the microspheres consisted of nanoflakes with thickness of 20 nm.The band gap of CZTS nanoparticles was about 1.58 eV,which was close to the optimum band gap of thin film solar cells.A possible formation mechanism was also discussed.
Cu2ZnSnS4nanocrystal;Solvothermal method;L-cysteine;Solar cell
10.3866/PKU.WHXB20112920
O648;O613.51
*Corresponding authors.LIANG Xiao-Juan,Email:lxj6126@126.com.XIANG Wei-Dong,
Email:xiangweidong001@126.com;Tel:+86-577-86596013.
The project was supported by the National Natural Science Foundation of China(50772075,50972107)and Key Scientific and Technological Innovation Teams of Zhejiang Province,China(2009R50010).
国家自然科学基金(50772075,50972107)和浙江省纳米材料与器件重点科技创新团队(2009R50010)资助项目

