硫酸水解法提取薯蓣皂苷元的工艺*
刘树兴,侯屹,李祥,刘禹呈
1(陕西科技大学生命科学与工程学院,陕西西安,710021)2(陕西科技大学化学与化工学院,陕西西安,710021)
硫酸水解法提取薯蓣皂苷元的工艺*
刘树兴1,侯屹1,李祥2,刘禹呈2
1(陕西科技大学生命科学与工程学院,陕西西安,710021)2(陕西科技大学化学与化工学院,陕西西安,710021)
以 盾叶薯蓣为原料,研究了硫酸水解法生产薯蓣皂苷元的工艺。考察了硫酸水解时间、硫酸用量、索氏提取时间和硫酸浓度对薯蓣皂苷硫酸水解的影响,通过正交实验优化了工艺。结果表明,硫酸水解的最佳条件为:硫酸水解时间为4 h,硫酸用量为20 mL,索氏提取时间为6 h,硫酸浓度为1.5 mol/L。该工艺能获得皂苷元得率为3.762%,且酸污染少。
盾 叶薯蓣,薯蓣皂苷,薯蓣皂苷元,水解条件
盾叶薯蓣(Dioscorea zingiberensis.C.H.Wright)俗称黄姜,为我国特有的薯蓣科薯蓣属植物。其根茎含有薯蓣皂苷(dioscin),它既是心血管疾病药物的主要药源,又能得到用于合成甾体激素和口服避孕药的薯蓣皂苷元(diosgenin),有着十分广泛的应用[1]。
目前,工业上生产薯蓣皂苷元,主要采用直接酸水解法,该法收率较低,且废水和废渣多,易造成环境污染[2-5]。为了解决上述问题,众多学者提出了许多解决方案,其中之一就是预分离法。先将薯蓣皂苷从黄姜中提取出来,然后再进行酸水解[6]。这样不但减少了酸用量、降低了污染,而且可将废水和废渣加以利用,变废为宝,得到鼠李糖、酒精等副产品[7-8]。
基于这种思路,本工作采用超声波和表面活性剂2种处理方法,辅助乙醇提取皂苷。在得到皂苷后,探索合适的酸水解条件,使皂苷尽可能的转化为皂苷元,并采用正交实验设计的方法,对皂苷转化为皂苷元过程中的重要条件进行了优化。
1 实验部分
1.1 材料与试剂
盾叶薯蓣,陕西省安康市采购;薯蓣皂苷元标准品,上海融禾医药科技发展有限公司(批号:100312);石油醚,天津化学试剂有限公司(沸程:60~90℃);乙腈,色谱纯;以及实验室常用化学试剂。
1.2 仪器与设备
SC-Ⅲ型多频声化学发生器,成都市九洲机电工程研究所;BS2202S型电子天平,北京赛多利斯仪器系统有限公司;旋转蒸发器,上海申生科技有限公司;高效液相色谱仪,美国Waters公司。
1.3 盾叶薯蓣总皂苷的提取[9]
干黄姜经粉碎研磨(粗粉40~60目),准确称取10 g,以体积分数30%的乙醇为萃取剂,与用量为17.408×10-3mol/L的十二烷基硫酸钠混匀。在黄姜与乙醇的质量比为1∶10,超声波频率为25.8 kHz,超声时间为40 min的条件下,进行总皂苷的提取,完毕后抽滤,保留滤液备用。
1.4 薯蓣皂苷元的提取
将得到的总皂苷滤液于旋转蒸发仪中浓缩,残液中加入硫酸后,于电热套上进行水解。抽滤,用蒸馏水水洗滤渣至中性,加入适量活性炭和滤渣一起包好,放入烘箱中烘干,于索氏提取器内加入80 mL石油醚进行薯蓣皂苷元的提取,提取完毕后,烘干,可得薯蓣皂苷元粗品并计算得率。
薯蓣皂苷元的得率为提取得到的薯蓣皂苷元质量占盾叶薯蓣原料的质量分数。
1.5 薯蓣皂苷元的鉴定
1.5.1 薄层色谱分析
薄层色谱条件为:展开剂V(三氯甲烷)∶V(甲醇)=5∶1;显色剂:10%硫酸;Rf值=0.62。喷湿润后于110℃烘烤10 min,得薯蓣皂苷元斑点,与标准品的斑点一致[10]。
1.5.2 熔点测定
在工业上,熔点的测定是衡量产品质量的重要标准。纯薯蓣皂苷元的熔点为204~207℃,工业合格标准为:熔点≥195℃,熔程≤10℃[11]。对3次重结晶后的薯蓣皂苷元样品进行熔点测定,熔点为200~204℃,熔程为4℃,符合相关标准。
1.5.3 高效液相色谱分析[12]
色谱条件:色谱柱为Diamonsil®C18柱(250 mm×4.6 mm,5 μm);流动相为 V(乙腈)∶V(水)=90∶10;流速为1.0 mL/min;柱温为室温;检测波长为210 nm。
3次重结晶样品经过高效液相色谱测定,样品出峰时间和标准品出峰时间相近,通过标准曲线计算,样品纯度>95%。
2 结果与分析
2.1 活性炭脱色效果的影响
在硫酸浓度为2 mol/L,硫酸用量为30 mL,水解时间为4 h,索氏提取时间为4 h的条件下,分别改变活性炭的用量,按1.4进行皂苷元的提取并计算得率。由图1可知,皂苷元的得率随着活性炭用量的增加而呈现出下降的趋势,这是由于活性炭不仅吸附了色素,还能吸附部分皂苷元的结果。但是从表1中可以发现,活性炭用量增大,皂苷元的损失固然增大,但脱色效果却在不断变好。当用量在5%时,已经能得到乳白色的产品且皂苷元损失不多,综合考虑这两个因素,故选择5%为活性炭用量。

表1 活性炭脱色效果

图1 活性炭用量对得率的影响
2.2 单因素条件的确定
2.2.1 硫酸水解时间的影响
在硫酸浓度为2 mol/L,硫酸用量为30 mL,索氏提取时间为4h的条件下,分别改变水解时间,按1.4进行皂苷元的提取并计算得率。由图2可知,随着水解时间的增加,皂苷元的得率是逐渐增加的。当水解时间小于4 h时,由于水解的不完全,得率偏低;当水解时间大于4 h时,皂苷元得率处于一种平稳趋势,证明反应已经基本完全。考虑到时间与收益的关系,选择5 h为最佳硫酸水解时间。

图2 硫酸水解时间对得率的影响
2.2.2 硫酸用量的影响
在硫酸浓度为2 mol/L,水解时间为5 h,索氏提取时间为4h的条件下,分别改变硫酸的用量,按1.4进行皂苷元的提取并计算得率。从图3可知,在硫酸用量为30 mL时,皂苷元的得率最高。继续增加硫酸用量,皂苷元得率呈现下降的趋势。这可能是因为,当硫酸用量为30 mL时,水解最为充分和适度。超过这个适度值,则造成H+浓度加大,逆向反应加快,反而使皂苷元得率降低[13]。故选择30 mL为最适硫酸用量。

图3 硫酸用量对得率的影响
2.2.3 索氏提取时间的影响
在硫酸浓度为2 mol/L,硫酸用量为30 mL,水解时间为5h的条件下,分别改变索氏提取时间,按1.4进行皂苷元的提取并计算得率。由图4可知,皂苷元的得率随着索氏提取时间的增加而显著增加,当索氏提取时间达到6 h后趋于稳定。表明在索氏提取6h后,皂苷元已基本提取完全,继续延长时间,虽然得率也略有增加,考虑到时间与收益的关系,故选择6 h为最适索氏提取时间。
2.2.4 硫酸浓度的影响
在硫酸用量为30 mL,水解5 h,索氏提取时间为6 h的条件下,分别改变硫酸浓度,按1.4进行皂苷元的提取并计算得率。由图5可知,随着硫酸浓度的增加,皂苷元得率呈现出一种先增加后减少的趋势,在酸浓度为1.5 mol/L时达到最大得率。发生这种现象的原因是,当酸浓度不够大时,其催化能力较弱,会使水解不够完全;而当酸浓度过大时,生成的皂苷元会发生分解,反而时得率降低[14]。

图4 索氏提取时间对得率的影响
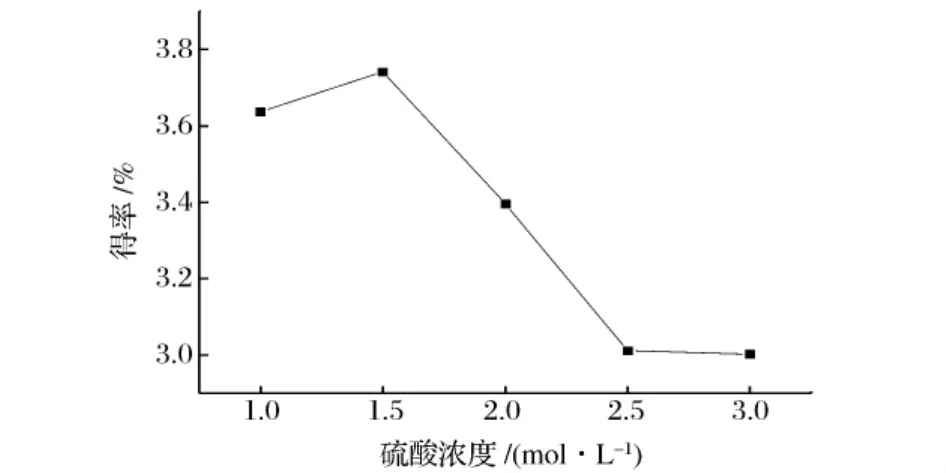
图5 硫酸浓度对得率的影响
2.3 提取工艺的优化
2.3.1 正交实验
对于皂苷元的提取来说,硫酸水解时间、硫酸用量、索氏提取时间和硫酸浓度4个因素都能影响其结果。本工作采用正交设计的方法,对以上4个因素安排L9(34)正交实验,找出它们的影响次序以及最优的工艺。
正交试验的各因素和水平选择如表2所示。

表2 正交实验的因素与水平
正交试验结果与极差分析如表3所示。
各因素的影响次序为C>D>B>A,即对于薯蓣皂苷元提取影响最大的因素是索氏提取时间,然后依次是硫酸浓度,硫酸用量和硫酸水解时间;根据正交试验结果与极差分析,得到的优化条件为A1B1C2D2,即硫酸水解时间为4 h,硫酸用量为20 mL,索氏提取时间为6 h,硫酸浓度为1.5 mol/L。

表3 正交实验结果
2.3.2 验证实验
根据优化工艺条件,对3批样品进行皂苷元提取,其得率分别为3.741%,3.744%,3.801%,
平均得率为3.762%。表明工艺稳定可靠。
2.3.3 与直接酸水解法的对比实验
将黄姜直接置于200 mL 1.5 mol/L硫酸中水解4h,抽滤,烘干后,于索氏提取器内进行皂苷元的提取并计算得率。得到的皂苷元得率为2.741%。证明本工艺较传统方法而言,得率有显著提高。
3 结论
(1)本实验研究了盾叶薯蓣总皂苷硫酸水解的工艺,通过单因素实验及正交试验确定了最佳优化方案:硫酸水解时间为4 h,硫酸用量为20 mL,索氏提取时间为6 h,硫酸浓度为1.5 mol/L。
(2)与传统的直接酸水解法相比,本实验采用的工艺能较好的提高皂苷元得率。通过对比实验,薯蓣皂苷元的得率提高了约37%。
(3)采用预分离法提取薯蓣皂苷元。硫酸的用量只有传统工艺的1/10,能够大大减少酸的污染。
(4)本工艺在生产中也面临一些问题。比如提取过程复杂,能耗和成本相对较高等。需要在后续的工作中进一步研究。
[1] 都述虎,夏重道,付铁军,等.穿龙薯蓣总皂甙水解条件的优化[J].中成药,2000,22(9):608 -610.
[2] 吴成昌,田杰,戴军发.黄姜产业可持续发展对策研究[J].环境科学与技术,2005,28(2):95 -97.
[3] 汤兴利,徐增莱,夏冰,等.用盾叶薯蓣生产薯蓣皂苷元预发酵与水解条件优化[J].植物资源与环境学报,2004,13(3):35 -37.
[4] 向纪明,李金灿.黄姜中提取薯蓣皂素的新工艺研究[J].安康师专学报,2003(15):56 -59.
[5] Rothrock J W,Hammes P A,McAlccr W J.Isolation of diosgenin by acid hydrolysis of saponin[J].Ind Eng Chem,1957,49:186-188.
[6] 李谦,高向涛,任玉珍,等.表面活性剂强化提取黄姜中薯蓣皂苷的研究[J].精细化工,2009,26(2):122-125.
[7] 陈合,李庆娟.黄姜副产物综合利用的研究进展[J].食品与药品,2007,9(12):60 -62.
[8] 潘鹤林,陈晨.黄姜资源清洁高效利用研究进展[J].上海化工,2009,34(6):22 -29.
[9] 刘树兴,侯屹,李祥.超声波-表面活性剂协同提取盾叶薯蓣总皂苷[J].精细化工,2010,27(6):562 -566.
[10] 于武江.黄姜中薯蓣皂苷元的提取研究[D].南京:南京工业大学硕士论文,2006:05.
[11] 韩枫,李稳宏,李冬,等.响应面法优化超声波提取薯蓣皂素工艺研究[J].食品科学,2007,28(7):96 -100.
[12] 李萍,何筱毅,周佳,等.HPLC测定穿龙骨刺片中薯蓣皂苷元的含量[J].中国药品标准,2009,10(6):469-471.
[13] 宋子言,刘秉钺,王井,等.硫酸法提取黄姜中皂苷元的清洁生产研究[J].大连轻工业学院学报,2007,26(1):53-55.
[14] Sanjay P Mishra,Vilas G Gaikar.Recovery of diosgenin from dioscorea rhizomes using aqueous hydrotropic solutions of Sodium cumene sulfonate[J].Ind Eng Chem Res,2004,43:5 339 -5 346.
Study on the Process of Diosgenin Extraction by Sulfuric Acid Hydrolysis
Liu Shu-xing1,Hou Yi1,Li Xiang2,Liu Yu-cheng2
1(College of life science and engineering,Shaanxi university of science& technology,Xian 710021,China)2(College of chemistry& chemical engineering,Shaanxi university of science& technology,Xian 710021,China)
The produce technology of diosgenin extraction by sulfuric acid hydrolysis was studied with Dioscorea zingiberensis C H Wright as the raw material.Effects of sulfuric acid hydrolysis time,usage of sulfuric acid,Soxhlet extraction time and concentration of sulfuric acid on the sulfuric acid hydrolysis of dioscin were investigated.Optimized process by orthogonal experiments was obtained as:sulfuric acid hydrolysis 20mL for 4h,Soxhlet extraction 6h,sulfuric acid concentration at 1.5mol/L.Under the above conditions,the yield of diosgenin was up to 3.762%,acid pollution was reduced.The result provides a method to solve the existing problems in the diosgenin industrial.
Dioscorea zingiberensis C H Wright,dioscin,diosgenin,hydrolysis conditions
硕士,教授(侯屹为通讯作者)。
*陕西省自然科学基金资助(2007C125);陕西省科技厅重点实验室建设项目
2010-08-13,改回日期:2010-11-25

