光合细菌对2,4,6-三氯苯酚的降解特性研究
姚 斌,金赞芳,胡忠策,金 琼,潘志彦 (浙江工业大学生物与环境工程学院,浙江 杭州 310032)
光合细菌对2,4,6-三氯苯酚的降解特性研究
姚 斌,金赞芳,胡忠策,金 琼,潘志彦*(浙江工业大学生物与环境工程学院,浙江 杭州 310032)
研究了混合光合细菌PSB-DR在不同光照、接种量和pH值下对2,4,6-三氯苯酚(2,4,6-TCP)的生物降解特性,确定了PSB-DR生物降解 2,4,6-TCP的优化控制条件.结果表明,光照培养下,接种量 30%,初始 pH值 7.0时 2,4,6-TCP降解效率最高.在此条件下,50mg/L的2,4,6-TCP经5d后降解率达到82.3%.培养基中醋酸钠的加入对2,4,6-TCP降解有明显的抑制作用.PSB-DR静息细胞对2,4,6-TCP的降解符合高浓度底物抑制的酶促反应类型,其降解动力学参数rmax=1.746h-1,Km=38.333mg/L,Ki=260.87mg/L.
光合细菌;生物降解;2,4,6-三氯苯酚;降解动力学
氯酚类化合物广泛存在于石油化工、农药、造纸等行业的废水中.2,4,6-三氯苯酚(2,4,6-TCP)由于酚环结构上连有 3个氯原子而成为毒性最强的氯酚类化合物之一,具有较强的“三致”作用,能够以水为载体广泛地扩散,已被美国环境保护局列为“优先控制污染物”,我国也将其列入68种优先污染物的“黑名单”[1].
2,4,6-TCP的生物降解一直是国内外研究的一个重要课题,已有学者从受其污染的水体、土壤中发现并分离出了能够降解 2,4,6-TCP的微生物[2-6],但却鲜有关于光合细菌(Photosynthetic Bacteria,简称 PSB)降解 2,4,6-TCP的报道.PSB是具有原始光能合成体系的原核生物,在不同的环境中,PSB会表现出多种代谢途径,能在厌氧光照、好氧光照、好氧黑暗等条件下利用低分子有机物.因此,PSB在有机废水的处理及生物修复中得到广泛的应用[7-10].
近年来,随着人类活动范围的扩大,受2,4,6-TCP污染的贫营养水体可能会存在微生物生长所需的氮、磷及生长因子不足等问题,从而使细胞难以增殖.本文采用混合光合细菌静息细胞(即不生长的细胞)在低营养条件下降解2,4,6-TCP,研究生化反应的影响因素,寻求快速降解 2,4,6-TCP的工艺条件,以期为工程上降解2,4,6-TCP及其生物修复提供一定的理论依据.
1 材料与方法
1.1 实验材料
混合光合细菌PSB-DR种子液购自浙江鼎龙集团已产业化的商品菌种,其优势菌群为红假单胞菌.
基础培养基:以光合细菌典型的生长氮源氯化铵作为培养的氮源,以醋酸钠作为培养的碳源.具体成分如下:CH3COONa 2.4g,NH4Cl 0.65g, K2HPO41.55g, KH2PO40.65g,大量金属元素MgSO4·7H2O 0.2g, CaCl20.059g, FeSO4·7H2O 0.012g,微量元素混合液[Cu(NO3)240mg/L, Na2MoO476mg/L,MnSO4160mg/L,Zn(NO3)224mg/L]1mL,生长因子包括泛酸1.0×10-3g, 维生素B1 1.0×10-3g,生物素1.0×10-5g,蒸馏水1L, pH值6.8~7.0.降解培养基:只含有基础培养基中的3种大量金属元素,以维持静息细胞的生存和能量代谢,2,4,6-TCP含量根据实验需要而变化.
试剂:2,4,6-TCP(分析纯,98%),购自上海晶纯试剂有限公司;甲醇(色谱纯);其他试剂未经特别说明,均为分析纯.
1.2 实验方法
菌体培养:PSB-DR种子液以50%的接种量(体积比)接种至含有200mg/L 2,4,6-TCP的基础培养基中,将装有200mL培养液的锥形瓶置于光照培养箱中(4800lx、30℃)培养5d至生长平稳期后,再按 50%的接种量转接至新鲜培养基中继续培养5d左右,如此连续进行3次转接培养,以获得大量的光合细菌菌体细胞.将转接培养后的菌悬液在12000r/min下离心10min,用无菌生理盐水洗涤 2次后重新悬浮于一定体积的磷酸缓冲液中,调节OD510=3.0左右,作为降解实验的原菌液待用.
静息细胞对2,4,6-TCP的降解:取60mL原菌液接种至含有140mL降解培养基的锥形烧瓶中.溶液中2,4,6-TCP浓度为50mg/L,在光照培养箱中(光照度 4800lx、30℃)培养 7d,每隔 1d取样测定溶液中 2,4,6-TCP的残余量并测定菌悬液浓度.
静息和生长细胞对 2,4,6-TCP的降解:取一定量原菌液分别接种于含50mg/L 2,4,6-TCP的基础培养基中(基础培养基中醋酸钠浓度分别为0,0.4,0.8,1.2,1.6g/L),光照培养7d后取样测定2,4, 6-TCP的浓度,每组实验设2个平行,重复2次.
2,4,6-TCP降解性能影响因素实验:取一定体积的原菌液接种于含50mg/L 2,4,6-TCP的降解培养基中,分别考察光照、接种量、初始pH值对 2,4,6-TCP降解率的影响.条件:光照培养(250mL锥形瓶装一定量培养物,敞口静置;光照度为4800lx,温度为30℃),接种量为30%,pH值7.0.实验中,改变 1个影响因素,固定其他条件,从而确定最优降解条件.培养7d后取2mL菌悬液,样品在12000r/min下离心10min,上清液经微孔滤膜(0.45μm)过滤后用高效液相色谱通过外标法定量测定2,4,6-TCP浓度,每组实验设2个平行,重复2次.
降解过程的动力学参数:将原菌液以 30%的接种量分别接种至2,4,6-TCP浓度为10,20,50,80, 100,140mg/L的降解培养基中进行反应,测定底物浓度对反应速率的影响.
1.3 分析方法
菌悬液浓度:菌悬液浓度用UV-759S紫外-可见分光光度计测定,检测波长为510nm,并以光密度值(OD510)表示.
活细胞吸收光谱的测定:菌悬液以转速12000r/min离心 10min,用质量分数为 60%蔗糖水溶液洗涤处理3次,将离心后的菌体细胞悬浮于蔗糖水溶液中,用紫外-可见分光光度计在波长200~900nm扫描.
2,4,6-TCP浓度的测定采用高效液相色谱仪(Jasco LC2000).分离柱为 ODS-C18反相色谱柱(250mm×4.6mm, 5μm);流速为 1mL/min;紫外检测波长为 210nm;流动相为甲醇/水=90:10;柱温为室温;进样体积为20μL.
2,4,6-TCP降解率的计算:降解率E(%)=[(模拟废水中初始2,4,6-TCP质量浓度-培养7d后模拟废水中2,4,6-TCP质量浓度)/模拟废水中初始2,4,6-TCP质量浓度]×100%
2 结果与讨论
2.1 PSB-DR的显微特征
图1为转培后混合光合细菌PSB-DR扫描电镜图.从细胞外形上看,PSB-DR主要为短杆形、卵形和球形混杂,大小差异显著.革兰氏染色表明,PSB-DR为革兰氏阴性菌,菌体活细胞吸收光谱测定结果显示,最大吸收峰在375、525、590、803、850nm处,表明存在菌叶绿素和类胡萝卜素,菌体活细胞吸收光谱具有光合细菌的典型吸收特征.目前,关于光合细菌降解环境污染物的研究大多是以纯菌种为对象[11-16],但由于纯菌种在培养过程中培养基需要灭菌,易受杂菌污染,因此较难在实际废水处理工程中应用.此外,有研究表明,与纯菌种相比,混合菌对氯酚类化合物的降解效率更高[17].因此,后续实验均采用该混合光合细菌PSB-DR.

图1 PSB-DR电镜扫描照片(×10000)Fig.1 Scanning electron micrograph of PSB-DR(×10000)
2.2 PSB-DR静息细胞对2,4,6-TCP的降解
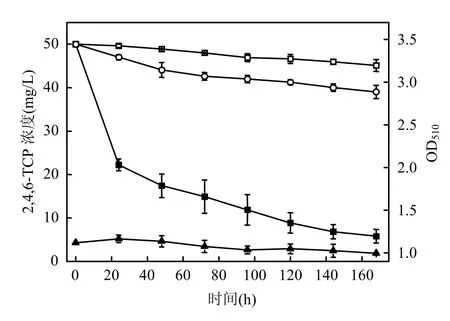
图2 PSB-DR的生长曲线和2,4,6-TCP降解曲线Fig.2 Growth curve of PSB-DR and biodegradation curve of 2,4,6-TCP
由图2可见,实验过程中OD510基本无明显变化,表明在整个降解过程中,细胞浓度没有增加,也说明本实验选择的 2,4,6-TCP降解培养基体系不适于细胞大量增殖,细胞基本处于静息状态,但7d后PSB-DR对2,4,6-TCP的降解率达到85%以上,同时,灭活细胞实验中 2,4,6-TCP浓度变化较小,说明实验中 2,4,6-TCP的减少并不是由细胞的吸附作用引起的,这表明PSB-DR降解2,4,6-TCP是通过现有细胞里的酶起作用,PSBDR静息细胞中可能存在高活性降解酶(系).此外,从图2中可知,未接种的空白组2,4,6-TCP损耗仅为9%,对分析2,4,6-TCP降解效果的干扰并不大,故在后续实验中忽略其损耗.
2.3 静息和生长细胞对2,4,6-TCP降解率的影响
为考察静息和生长细胞对 2,4,6-TCP的降解效果,以期寻求 2,4,6-TCP降解的较优工艺条件.在实验中设置了一系列醋酸钠浓度不同的基础培养基(醋酸钠是光合细菌能较好利用的典型碳源,具有显著的促生长作用),将原菌液接种至这一系列培养基中,除醋酸钠浓度外,其余条件均一致,光照培养 7d取样测定 2,4,6-TCP的浓度,比较静息细胞和生长细胞对 2,4,6-TCP的降解效果,实验结果见图3.
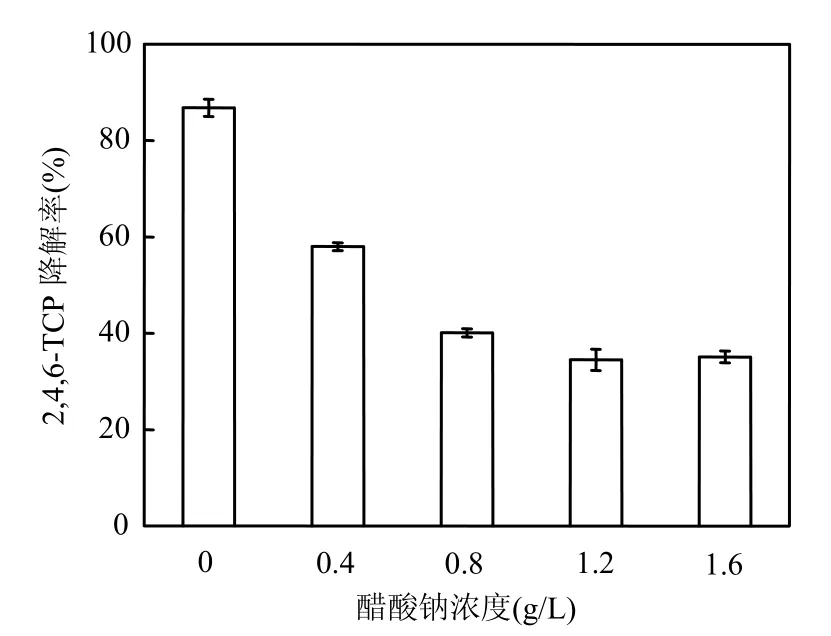
图3 醋酸钠浓度对2,4,6-TCP降解率的影响Fig.3 Effect of sodium acetate concentration on 2,4,6-TCP degradation
结果显示,2,4,6-TCP的降解率受培养基中醋酸钠浓度的影响,在不加入醋酸钠时,整个降解过程细胞浓度基本维持不变,细胞处于静息状态,但对2,4,6-TCP的降解率却最高(86.8%);在醋酸钠浓度为0.4~1.6g/L时,细胞处于生长状态(菌悬液浓度 OD510快速上升,数值未在图中列出), 2,4,6-TCP的降解率却随醋酸钠浓度的升高而降低且明显低于静息细胞的降解率.分析原因,可能是醋酸钠的加入对底物的酶促反应产生了非竞争性抑制作用,降低了酶的活性,导致降解率的下降.实验结果表明,对于PSB-DR采用静息细胞法降解2,4,6-TCP是较佳的选择.
2.4 光照对2,4,6-TCP降解率的影响
将PSB-DR原菌液接种至2,4,6-TCP浓度为50mg/L的降解培养基中,分别在黑暗、光照(敞口静置)条件下培养7d并取样测定2,4,6-TCP的浓度,实验结果见图4.
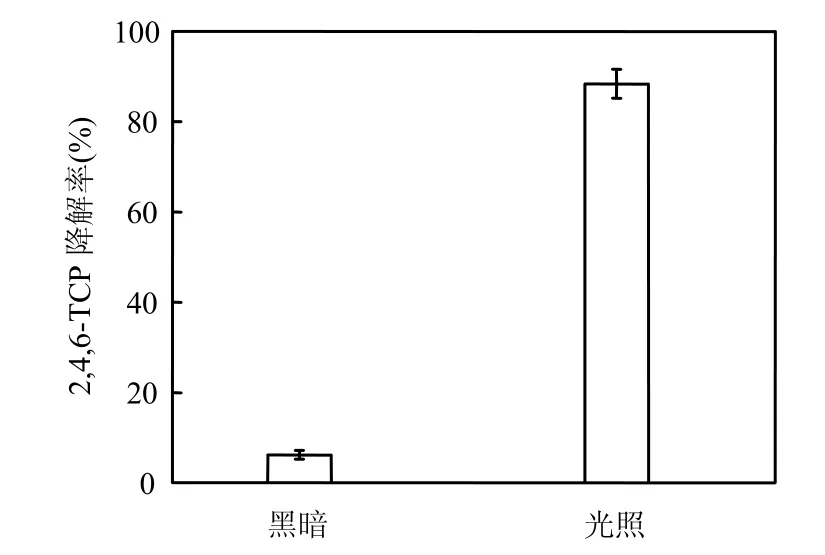
图4 光照对2,4,6-TCP降解率的影响Fig.4 Effect of illumination on 2,4,6-TCP degradation
由图4可知,PSB-DR在黑暗、光照条件下对2,4,6-TCP的降解能力存在明显差异,7d后对2,4,6-TCP的降解率分别为6.2%、88.4%,即在黑暗条件下 2,4,6-TCP基本没有被降解,光照成为2,4,6-TCP降解的关键限制因子.Blasco等[18]研究发现Rhodobacter capsulatus ElF1对2,4-DNP的降解是严格光依赖的,光照是其降解的限制因子.Thies等[19]发现小球藻对 metfurazon(一种除草剂)的N-位脱甲基作用由细胞色素P450羟化酶介导,而P450羟化酶催化底物需要分子氧以及还原辅酶 Ⅱ(NADPH)的参与,在黑暗条件下, NADPH 产生量严重不足,因此小球藻对metfurazon的脱甲基活性依赖于光照条件.Liu等[20]在研究Alcaligenes eutrophus JMP134细胞中由质粒pJP4编码的羟化酶对二氯苯酚的羟基化作用时,也发现需要分子氧和NADPH的参与.本实验中 2,4,6-TCP的降解需要在光照条件下进行,推测PSB-DR对2,4,6-TCP的降解机制可能是一种酶促反应,该催化反应的进行需要由光合作用产生的NADPH参与,这与2.2中的结果(降解是通过现有细胞里的酶起作用)相符.综上,后续实验均选择在光照条件下进行.
2.5 接种量对2,4,6-TCP降解率的影响
将PSB-DR原菌液接种至2,4,6-TCP浓度为50mg/L的降解培养基中,接种量分别为 10%、20%、30%、40%和50%,光照培养7d后取样测定2,4,6-TCP的降解率,实验结果见图5.
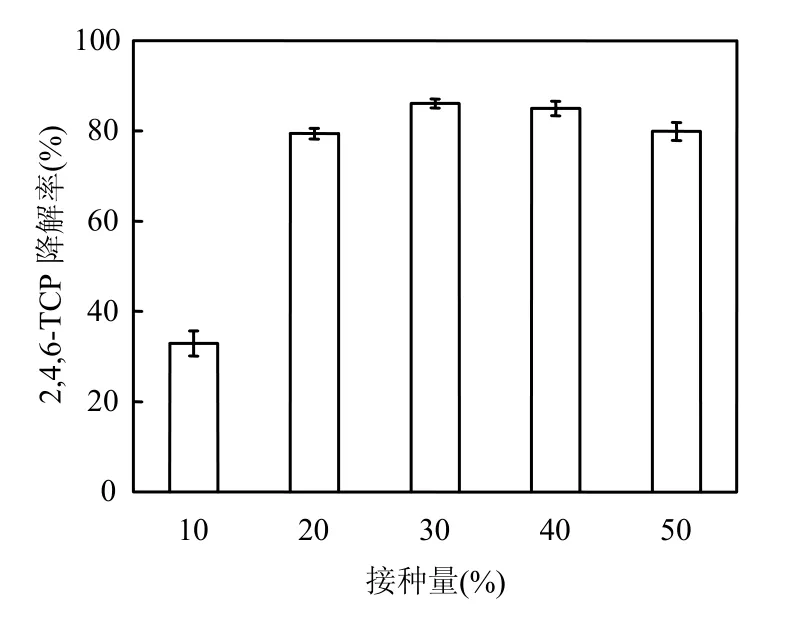
图5 接种量对2,4,6-TCP降解率的影响Fig.5 Effect of inoculum density on 2,4,6-TCP degradation
结果表明,在相同的培养条件下,PSB-DR的接种量不同,2,4,6-TCP的降解也呈现出不同的结果.接种量为 10%时,由于菌体浓度较低(降解酶浓度较低),2,4,6-TCP的降解率只有32.9%;当接种量小于 30%时,2,4,6-TCP的降解率与接种量成正相关关系,继续增加接种量,降解率反而略有下降(猜测传质阻力和代谢环境恶化成为限制因素).可见30%的接种量为该条件下的最适投菌量,故后续实验中PSB-DR的接种量均定为30%.
2.6 初始pH值对2,4,6-TCP降解率的影响
将PSB-DR原菌液以30%的接种量接种至2,4,6-TCP浓度为50mg/L的降解培养基中,用盐酸和氢氧化钠调节初始pH值,使其分别为6.0、7.0、8.0、9.0、10.0,光照培养 7d后取样测定2,4,6-TCP的降解率,实验结果见图6.
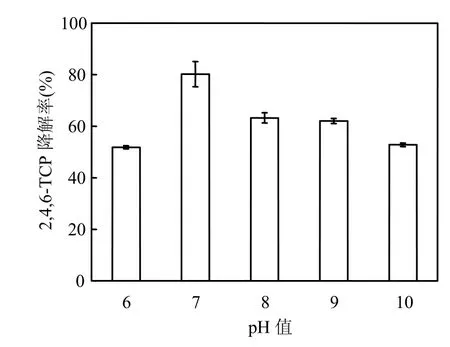
图6 初始pH值对2,4,6-TCP降解率的影响Fig.6 Effect of initial pH value on 2,4,6-TCP degradation
结果表明,体系在pH值为6.0~10.0之间时, PSB-DR对2,4,6-TCP的降解率均大于50%,说明PSB-DR有较强的pH适应性,PSB-DR静息细胞对2,4,6-TCP的降解率随初始pH的递增先增大后减小,其中以pH值为7.0时为最佳,过高或过低的pH值对2,4,6-TCP的降解都有不同程度的抑制作用.故在本实验条件下,选择 2,4,6-TCP的较优降解条件为pH值为7.0的中性条件.胡筱敏等[21]在研究光合细菌PSB-1D对2-氯苯酚的降解特性时发现当pH值为7.0时,菌株PSB-1D对2-CP的降解率最大,7d后对50mg/L的2-CP降解率达 60.99%;王玉芬等[22]在研究光合细菌球形红细菌厌氧降解氯代苯时也得到类似的结论.虽然本实验中所用为完整细胞,细胞本身会对外界氢离子浓度的改变有一定的缓冲作用,但反应体系pH值的变化仍可能对细胞内酶的电离情况和酶蛋白的空间构象有所影响[23],从而改变酶的催化活性.
2.7 2,4,6-TCP最佳降解时间的确定
图7为生化反应时间对2,4,6-TCP降解率的影响(最佳降解条件下).从图7可以看出,反应1d后2,4,6-TCP的降解率为55.5%,随着反应时间的增加,5d后的降解率达到了82.3%,虽然7d后的降解率(88.5%)高于 5d后的降解率,但在实际工程应用中考虑到经济性方面的原因,故选择时间相对更短的5d作为2,4,6-TCP降解的最佳反应时间.本实验中2,4,6-TCP降解需要光照,但光照是实际工程中需要考虑的不利因素之一,PSBDR静息细胞降解2,4,6-TCP的成功为工程上固定化细胞大规模降解 2,4,6-TCP提供了良好的应用前景.

图7 反应时间对2,4,6-TCP降解率的影响Fig.7 Effect of retention time on 2,4,6-TCP degradation
2.8 2,4,6-TCP降解动力学分析
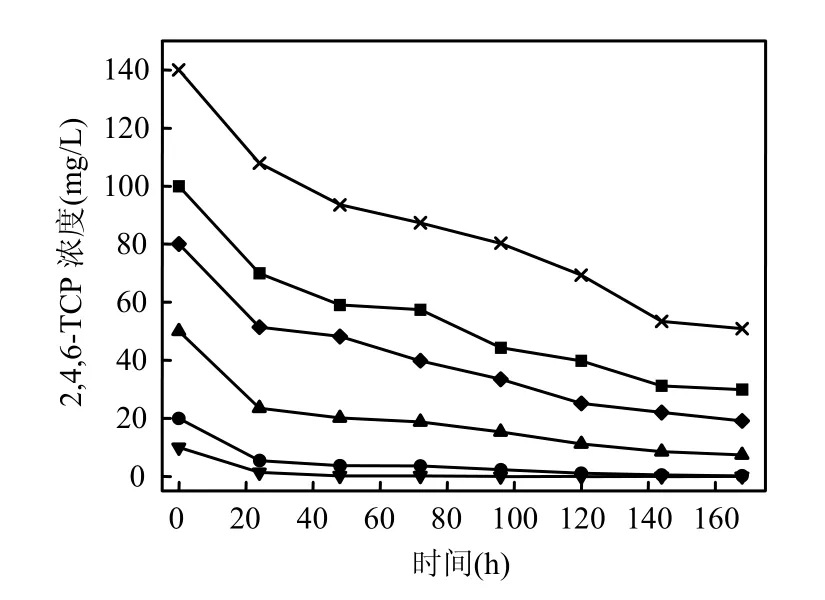
图8 不同初始浓度下2,4,6-TCP的降解情况Fig.8 Degradation of 2,4,6-TCP under different initial concentrations
通过降解动力学模型的建立可以预测微生物降解污染物的趋势并对生化反应的工艺条件进行优化,为工程应用提供指导.本实验设置了不同初始浓度的 2,4,6-TCP在最佳降解条件下进行底物浓度的酶动力学反应.
由图8可见,2,4,6-TCP的降解率随着其初始浓度的升高而降低,当 2,4,6-TCP初始浓度为10mg/L时,7d后2,4,6-TCP能够被完全降解,随着其浓度升高到 100mg/L,7d后降解率下降为70.2%,当2,4,6-TCP浓度为140mg/L时,7d后降解率已经下降到 63%,可见随着浓度的升高2,4,6-TCP对菌体的毒性逐渐增强.图9显示了在不同初始浓度下 2,4,6-TCP降解的初始反应速率(最初24h内).
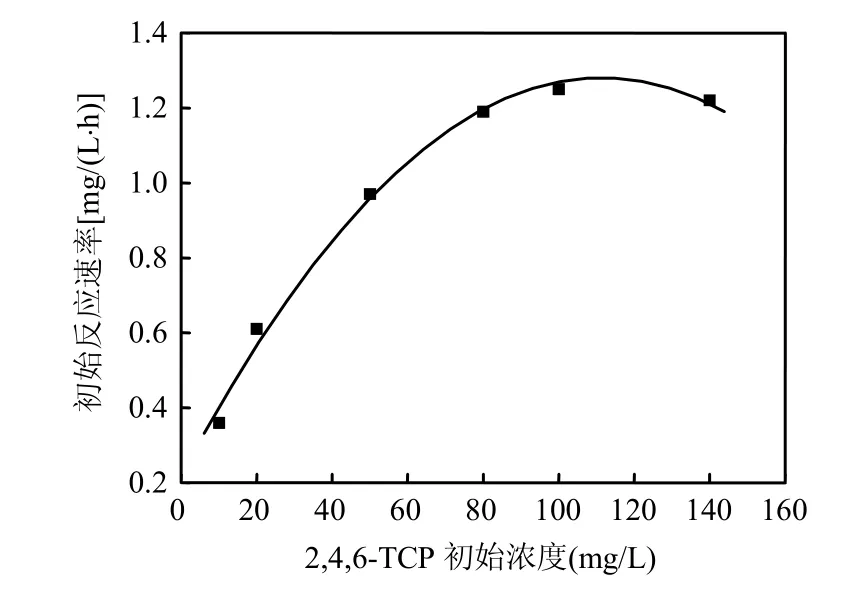
图9 不同初始浓度下2,4,6-TCP的初始反应速率Fig.9 Variation of the initial rate of 2,4,6-TCP degradation with initial 2,4,6-TCP concentration
从图9中可以看出,初始浓度小于100mg/L时,初始降解速率随着 2,4,6-TCP浓度的升高而升高,而后达到某一极大值后会有所下降,表明2,4,6-TCP的降解(基于初始反应速率)符合高浓度底物抑制的酶促反应类型,故采用Andrews方程模拟其降解动力学过程.
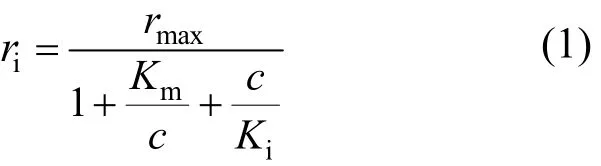
式中: ri为存在抑制剂时的酶促反应速率, h-1; c为底物浓度, mg/L; Km为米氏常数, mg/L; Ki为抑制常数, mg/L; rmax为不存在抑制剂时的最大酶促反应速率常数,h-1.
当底物浓度较低时(小于100mg/L),以1/ri对1/c作图(图10),从直线的斜率和截距求得动力学参数 rmax=1.746h-1,Km=38.333mg/L.当初始反应速率达到最大,即当 c=100mg/L时, Ki=c2/Km= 260.87mg/L,因而得到 PSB-DR降解 2,4,6-TCP的动力学方程为:
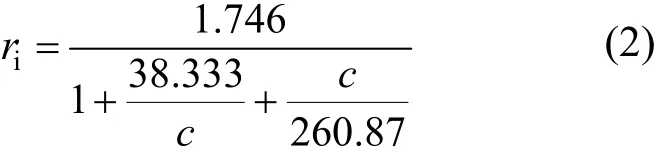
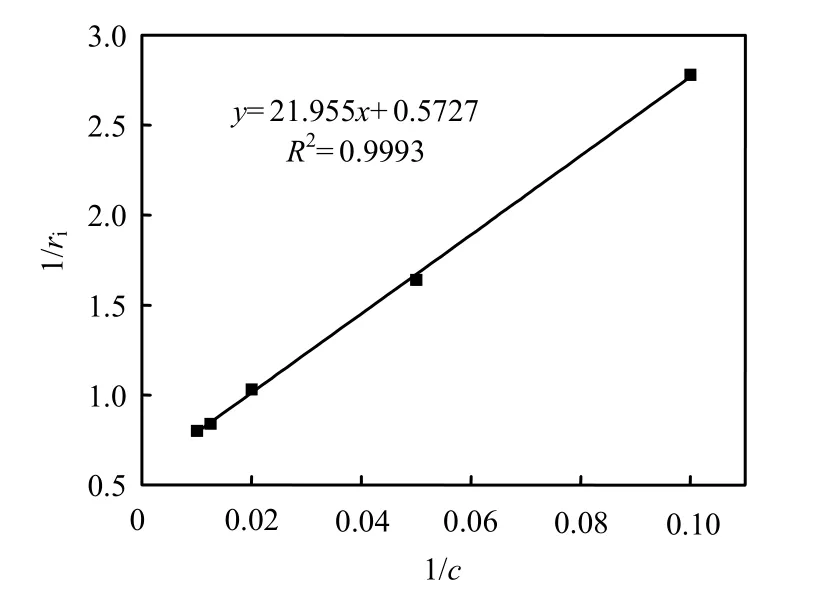
图10 低2,4,6-TCP浓度下1/c和1/ri之间的关系Fig.10 Relationship between 1/c and 1/ri during low initial 2,4,6-TCP concentrations
3 结论
3.1 本实验中,静息细胞法对2,4,6-TCP的降解作用优于生长细胞法,培养液中添加醋酸钠会对2,4,6-TCP的降解产生抑制作用.PSB-DR静息细胞对 2,4,6-TCP的最佳降解条件为:光照培养(30℃、4800lx),接种量30%,初始pH值为7.0.在最佳条件下,50mg/L的2,4,6-TCP经5d降解率达82.3%.
3.2 在2,4,6-TCP初始浓度为10~140mg/L时,静息细胞对 2,4,6-TCP的降解符合高浓度底物抑制的酶促反应类型,最大酶促反应速率常数rmax=1.746h-1,米氏常数 Km=38.333mg/L,抑制常数 Ki=260.87mg/L.米氏常数能够反映酶与底物之间亲和力的大小,本实验中 Km值较小,说明细胞对底物的催化效果较好.
[1] Haigler B E, Pettigrew C A, Spain J C. Biodegradation of mixtures of substituted benzenes by Pseudomonas sp. strain JSl50 [J]. Appl. Environ. Microbiol., 1992,58(7):2237-2244.
[2] Wang C C, Lee C M, Lu C J, et al. Biodegradation of 2,4,6-trichlorophenol in the presence of primary substrate by immobilized pure culture bacteria [J]. Chemosphere, 2000,41: 1873-1879.
[3] Kharoune L, Kharoune M, Lebeault J M. Aerobic degradation of 2,4,6-trichlorophenol by a microbial consortium–selection and characterization of microbial consortium [J]. Appl. Microbiol. Biotechnol., 2002,59:112-117.
[4] Padilla L, Matus V, Zenteno P, et al. Degradation of 2,4,6-trichlorophenol via chlorohydroxyquinol in Ralstonia eutropha JMP134 and JMP222 [J]. J. Basic Microbiol., 2000, 40(4):243-249.
[5] Gomez-De Jesus A, Romano-Baez F J, Leyva-Amezcua L, et al. Biodegradation of 2,4,6-trichlorophenol in a packed-bed bioflm reactor equipped with an internal net draft tube riser for aeration and liquid circulation [J]. J. Hazard. Mater., 2009,161:1140-1149.
[6] Aguayo J, Barra R, Becerra J, et al. Degradation of 2,4,6-tribromophenol and 2,4,6-trichlorophenol by aerobic heterotrophic bacteria present in psychrophilic lakes [J]. World J. Microbiol. Biotechnol., 2009,25:553-560.
[7] Madukasi E I, Dai X, He C, et al. Potentials of phototrophic bacteria in treating pharmaceutical wastewater [J]. Int. J. Environ. Sci. Tech., 2010,7(1):165-174.
[8] 孔秀琴,赵 详.光合细菌强化二级流化床工艺处理焦化废水的研究 [J]. 环境工程学报, 2009,3(2):263-267.
[9] 杨云龙,薛 嵘,吴国庆.固定化PSB处理亚硫酸钠造纸废水 [J].中国环境科学, 2001,21(4):351-354.
[10] 杨素萍,张德咏,张肇铭,等.利用光合细菌处理糖蜜酒精发酵废液中试研究 [J]. 中国环境科学, 1998,18(1):173-175.
[11] 张松柏,张德咏,罗香文,等.一株降解苄嘧磺隆光合细菌的分离鉴定及其降解特性 [J]. 生态环境, 2008,17(5):1774-1777.
[12] 张松柏,张德咏,罗香文,等.降解甲氰菊酯光合细菌的分离鉴定及其降解特性研究 [J]. 农业环境科学学报, 2009,28(1):140-144.
[13] 张德咏,谭新球,罗香文,等.一株能降解有机磷农药甲胺磷的光合细菌HP-1的分离及生物学特性的研究 [J]. 生命科学研究, 2005,9(3):247-253.
[14] 李 可,张肇铭,曹养宪.沼泽红假单胞菌对活性紫KBR脱色的研究 [J]. 中国环境科学, 2004,24(3):299-302.
[15] Oda Y, De Vries Y P, Forney L J, et al. Acquisition of the ability for Rhodopseudomonas palustris to degrade chlorinated benzoic acids as the sole carbon source [J]. FEMS Microbiol. Ecol., 2001, 38:133-139.
[16] Blasco R, Castillo F. Characterization of 2,4-dinitrophenol uptake by Rhodobacter capsulatus [J]. Pestic. Biochem. Phys., 1997,58: 1-6.
[17] Farrell A, Quilty B. Degradation of monochlorophenols by a mixed microbial community via a meta cleavage pathway [J]. Biodegradation, 1999,10:353-362.
[18] Blasco R, Castillo F. Light-dependent degradation of nitrophenols by the phototrophic bacterium Rhodobacter capsulatus E1F1 [J]. Appl. Environ. Microbiol., 1992,58(2):690-695.
[19] Thies F, Backhaus T, Bossmann B, et al. Xenobiotic biotransformation in unicellular green algae [J]. Plant Physiol., 1996,112:361-370.
[20] Liu T, Chapman P J. Purifcation and properties of a plasmidencoded 2,4-dichlorophenol hydroxylase [J]. FEBS Lett., 1984, 173:314-318.
[21] 胡筱敏,董怡华,李 亮,等.光合细菌PSB-1D对2-氯苯酚的降解特性研究 [J]. 环境科学, 2010,31(7):1672-1678.
[22] 王玉芬,张肇铭,胡筱敏,等.光合细菌球形红细菌厌氧降解氯代苯 [J]. 中国环境科学, 2007,27(1):111-115.
[23] 陈东之,陈建孟,章晓晶,等.环境因素对甲基叔丁基醚生物降解的影响研究 [J]. 环境科学学报, 2007,27(9):1463-1468.
Biodegradation characteristics of 2,4,6-trichlorophenol by photosynthetic bacteria.
YAO Bin, JIN Zan-fang, HU Zhong-ce, JIN Qiong, PAN Zhi-yan*(College of Biological and Environmental Engineering, Zhejiang University of Technology, Hangzhou 310032, China). China Environmental Science, 2011,31(10):1669~1675
Degradation of 2,4,6-trichlorophenol (2,4,6-TCP) by mixed cultures photosynthetic bacteria PSB-DR at different illumination, inoculum density and initial pH were investigated. The degradation conditions were optimized to be incubation with an inoculum density of 30% and initial pH 7.0 under light. About 82.3% of 2,4,6-TCP with initial concentration of 50mg/L was removed after 5d incubation under the condition. The addition of sodium acetate into the substrate greatly suppressed 2,4,6-TCP biodegradation. The degradation of 2,4,6-TCP could be well described by the enzymatic reaction of high concentration inhibition, with the maximum substrate utilization rate 1.746h-1, Michaelis-Menten constant 38.333mg/L and inhibitory constant 260.87mg/L, respectively.
photosynthetic bacteria;biodegradation;2,4,6-trichlorophenol;biodegradation kinetics
X172
A
1000-6923(2011)10-1669-07
2011-01-07
国家科技重大专项(2008ZX07101-006);国家自然科学基金资助项目(40803027);浙江省环境污染控制技术研究重点实验室项目(2010-09)
* 责任作者, 教授, panzhiyan@zjut.edu.cn
姚 斌(1985-),男,浙江萧山人,浙江工业大学生物与环境工程学院硕士研究生,主要从事工业废水微生物处理法方面的研究.发表论文1篇.

