应用低氧运动时动脉血症和通气反应指标预测急性高原反应的探索研究
徐 飞,胡 扬
应用低氧运动时动脉血症和通气反应指标预测急性高原反应的探索研究
徐 飞1,胡 扬2
目的:通过测试运动时低氧血症和低氧通气指标的变化来探索预测急性高原反应(actue mountain sickness,AMS)的可行性指标,为降低高原旅居人群罹患AMS的风险和提高其生活质量提供参考。方法:23名普通男性大学生于低氧舱(~4 400m,FIO211.8%~11.6%)暴露6h,分别于低氧暴露第0.5h、2h、4h和6h评测受试者急性高原反应(LLS量表),有头痛症状且LLS评分≥3者,定为AMS组。受试者进舱休息30min后进行30min运动心肺功能测试:于卧式功率车上安静5min后以80W恒定负荷(60rpm)仰卧蹬车20 min,恢复5min。每5min末记录RPE、HR、SpO2、BP和低氧通气反应相关指标。据测试指标计算AMS组和nonAMS组低氧通气指数和低氧心功能指数差异。取有显著性差异的指标作为自变量与LLS评分拟合得出预测方程。结果:急性低氧暴露结束时AMS发生率为27%。低氧安静时AMS组与nonAMS组RPE、HR、SpO2、˙VE、VT和fR无显著性差异。低氧运动时AMS组SpO2显著低于nonAMS组(P<0.05),运动5min时达最低点。低氧运动5min时AMS组˙VE显著低于nonAMS组(分别为41.4±4.6 1/min和46.7±4.6l/min,P<0.05)。低氧运动时SpO2和˙VE预测LLS评分的非线性方程分别为:LLS=0.0295(SpO2)2-4.5269(SpO2)+174.34(R2=0.7473,P<0.001)和LLS=0.0352(˙VE)2-3.4987(˙VE)+87.729(R2=0.307,P=0.053);SpO2与˙VE呈中度相关(R=0.394,P<0.05)。结论:低氧运动时动脉血症指标SpO2和通气指标˙VE可作为预测AMS的有效指标,SpO2的预测准确性高于˙VE,运动时SpO2与˙VE呈中度相关。从测试的简便、可靠角度考虑,运动时SpO2的变化具有较好的应用前景。
急性高原反应;低氧运动;低氧血症;动脉血氧饱和度;低氧通气反应
随着中国经济的发展,到高原地区旅游的人日益增多,急性高原反应(acute mountain sickness,AMS)的防治成为重要的研究课题。AMS指高原低氧暴露时机体在数小时至数天内出现的多种临床症候群,严重时会造成急性肺水肿和急性脑水肿而危及生命,所以,准确预测和诊断AMS就显得尤为重要[6,13]。但由于AMS的发病机理较为复杂,涉及人体多个系统,迄今尚无可靠的预测和诊断指标[3,6,13,38]。
目前已确认高原低氧是造成AMS的根本原因[3,32,38]。高原低氧下机体遵循“低氧→动脉血症(hypoxemia)→诱发化学感受器活性和→自主神经系统活性改变→高原反应或高原习服”的动态适应过程[1,38]。而低氧血症诱发外周化学感受器活性改变会导致低氧通气反应(hypoxic ventilatory response,HVR),所以有学者观察到罹患AMS的登山队员在初抵高原、安静状态下的SpO2和HVR指标异常,进而提出高原安静时动脉血症和低氧通气反应指标来预测和判别AMS的设想[7,17,31],但结果并不一致[8,16]。因高原旅居人群并非静止不动,而是常进行一定强度的运动(徒步、登山科考等)[4,33],所以,运动时的低氧血症和低氧通气指标更接近高原旅居人群的实际活动情况,理论上而言也更能反映机体真实的耐缺氧能力。但迄今为止相关研究甚少,只有Rathat等[27]开展了低氧通气指数和低氧心功能指数作为预测AMS指标的初步研究,但其研究因实验控制方面存在不足而受到质疑[4]。所以,本研究拟通过测试运动时低氧血症和低氧通气指标的变化来探索预测AMS的可行性指标,从而为降低高原旅居人群罹患AMS的风险和提高其生活质量提供参考。
1 研究对象与方法
1.1 研究对象
有偿招募23名普通男性大学生参与本实验(1名受试者为体重超重者,但其数据不纳入本研究结果[2]),最终受试者为22人。均为世居平原(海拔<800m)、实验前6个月未经高原或低氧暴露(海拔≥1 500m)者,其身体健康,无神经、心肺、心血管系统疾病史(表1)。受试者被明确告知低氧实验可能带来的机体低氧不适反应,正式实验前填写PAR-Q问卷(排除心脏疾病、确认日常锻炼和体力活动情况)[29,36]并签署知情同意书。本研究符合芬兰赫尔辛基宣言(2008)[39]医学伦理学有关规定,受试者可在实验任何阶段据其身体情况或自身感觉选择退出本实验。
表1 本研究受试者安静时生理指标一览表()Table 1 The Physical Characteristics of Participants
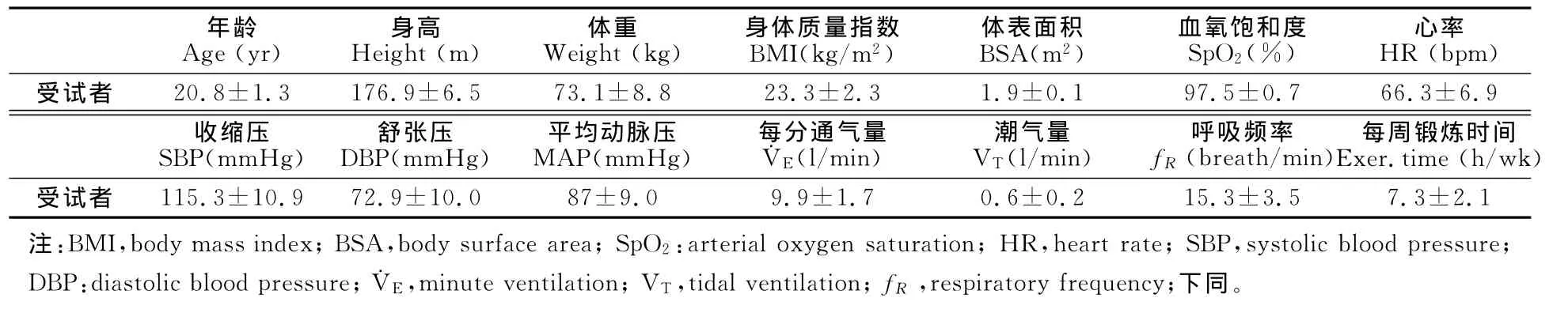
表1 本研究受试者安静时生理指标一览表()Table 1 The Physical Characteristics of Participants
年龄Age(yr) 身高Height(m) 体重Weight(kg) 身体质量指数BMI(kg/m2) 体表面积BSA(m2) 血氧饱和度SpO2(%) 心率HR(bpm)受试者 20.8±1.3 176.9±6.5 73.1±8.8 23.3±2.3 1.9±0.1 97.5±0.7 66.3±6.9收缩压SBP(mmHg) 舒张压DBP(mmHg) 平均动脉压MAP(mmHg) 每分通气量˙VE(l/min) 潮气量VT(l/min) 呼吸频率fR(breath/min)每周锻炼时间Exer.time(h/wk)受试者 115.3±10.9 72.9±10.0 87±9.0 9.9±1.7 0.6±0.215.3±3.5 7.3±2.1注:BMI,body mass index;BSA,body surface area;SpO2:arterial oxygen saturation;HR,heart rate;SBP,systolic blood pressure;DBP:diastolic blood pressure;˙VE,minute ventilation;VT,tidal ventilation;fR,respiratory frequency;下同。
1.2 研究方法
1.2.1 研究设计
本研究采用前瞻性研究(prospective study)设计,即首先观察受试者低氧暴露后AMS的发生情况,然后通过研究低氧血症与低氧通气指标的变化与AMS的关系探索可用于预测AMS的指标。
研究对象的同质性(homogeneity):本研究招募了同质性较强,基本生理情况和每周锻炼时间及生活方式都较为相似的受试者(表1、表2),以确保研究结果的可靠性。这不同于以往多数研究所采用的回顾性研究设计(retrospective study)研究时纳入不同性别、年龄、体力活动水平和登山经历的受试者[7,27,31],这对研究结果的可靠性有较大影响。
低氧暴露剂量的确定:1)低氧暴露高度:预期将AMS发生率控制在~50%,尽量满足均衡设计,以较好地控制数据偏倚(data bias)和统计效力(statistical power)。但目前不同海拔高度对应的AMS发生率并无定论:O’Connor等[26]发现3 080m高原普通人AMS的发生率为27%,Mairer等[19]发现3 817m高原登山队员AMS发生率为34.9%~38%;我国的普通人飞抵拉萨急进~4 000m高原时AMS发生率为57.2%[28],而西雅图的雷尼尔锋(Mt.Rainier,4 394m)AMS发生率为67%~77%[3]。流行病学研究证实,登山队员AMS发生率低于普通人[38],而实地高原AMS发生率要高于模拟低氧环境[3,32],故本研究将模拟高度初定为~4 400m(FIO2:11.8%~11.6%)。2)低氧暴露时间:低氧暴露时间越长AMS症状越明显,所以实地研究(field research)的暴露时间都≥3d,实验室研究(laboratory research)暴露时间普遍≥12h。但暴露时间越长,受试者应激症状和低氧不适反应越严重。Roach等(1996)[32]的小样本研究(n=9)发现,受试者在4 564m低氧舱内暴露6~9h就能区分出AMS易感者(AMS发生率56%),这为在较短时间内利用模拟低氧环境研究AMS提供了重要证据。所以,基于应用目的本研究初步拟定低氧暴露时间为6h。
实验流程及测试指标[1,2]:受试者正式实验前熟悉测试仪器及流程至少2次。在常氧环境中安静30min测试常氧安静值,次日于低氧舱(~4 400m,FIO211.8%~11.6%,温度20℃~24℃,相对湿度49%~70%,气压992~1 002hpa)内暴露6h,全部实验过程如图1A所示。受试者进舱休息30min后进行30min运动心肺功能测试(图1B、C):于卧式功率车(GE Ergoselect 1000LP,USA)上安静5min后以80W恒定负荷(60rpm)仰卧蹬车20 min,恢复5min。每5min末记录RPE(Borg RPE量表)、HR(polar RS800,Finland)、SpO2(Nonin 3100,USA)、BP(GE Ergoselect 1000LP车载配套测试硬件,USA)和低氧通气反应相关指标(Cortex Metalyzer RII,Germany),即每分通气量(˙VE)、潮气量(VT)和呼吸频率(fR)。同时监控动态心电图(Cardiocollect 12,UK),当ST段下降超过2mm、SBP>220mmHg或不能坚持运动时终止测试[9,11],临床监护医师据现场情况认为受试者若坚持运动有危险时也可终止实验[11]。测试前所有仪器都严格按照说明书校准。分别于低氧暴露第0.5h、2h、4h和6h用LLS量表[30,38]评测受试者急性高原反应(图1A),当有头痛症状且LLS评分≥3时,被评定为出现AMS[30]。
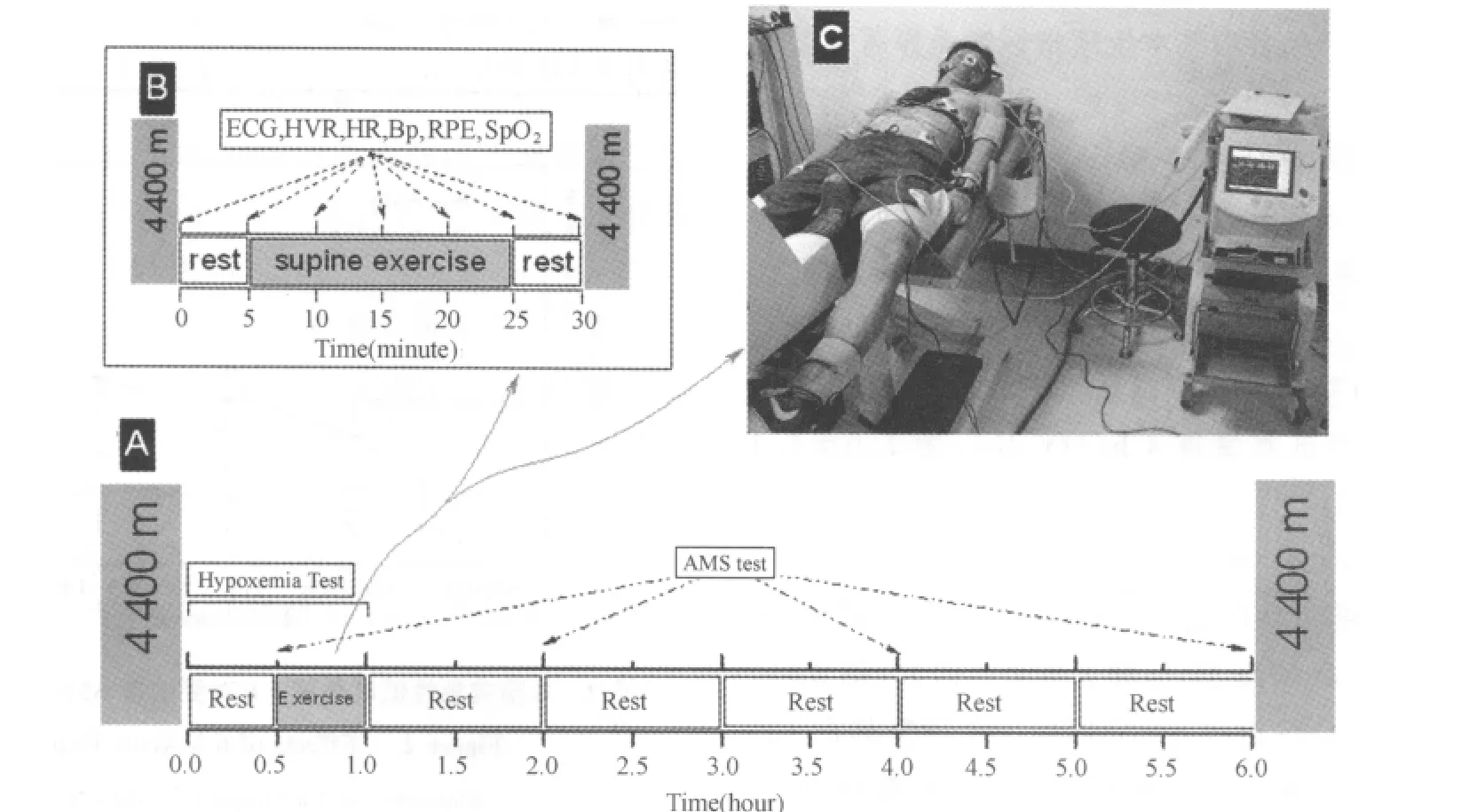
图1 研究设计及实验流程示意图Figure 1. Study Design and Experiment Protocol
低氧指数:据Rathat等(1992)[27]提出的方法分别计算低氧安静、运动时的低氧通气反应指数(HVRrest、HVRexercise)和低氧心功能指数(HCRrest、HCRexercise)。Rathat报道低氧适应能力差者至少有一个指标异常。
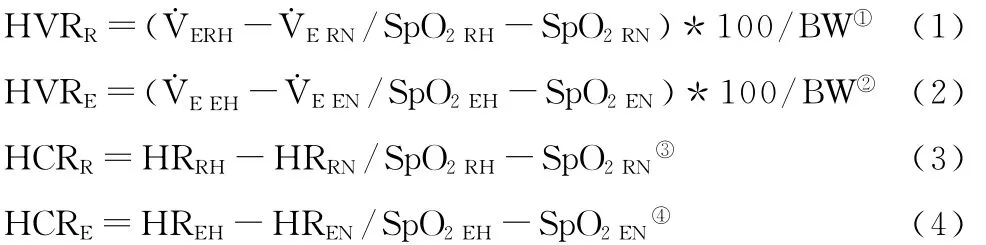
1.2.2 统计处理
用Stata 10.0对数据(均数±标准差,)进行分析。对AMS组和nonAMS组的LLS评分采用描述性统计(descriptive statistics),安静时基本生理指标的比较采用t检验(t-test);RPE、HR、SpO2和HVR相关指标的数据符合正态分布并具方差齐性时,采用双因素(组别×测试时间点)重复测量方差分析(two-way analysis of variance with repeated measures),后续比较(post-hoc)采用Holm-Sidak检验;若数据不符合正态分布,组内比较采用Kruskal-Wallis检验,组间比较采用Mann-Whitney秩和检验;AMS组与nonAMS组不同测试时间点的低氧通气指数、低氧心功能指数组间比较采用t检验;采用2阶多项式拟合(hyperbolic decay拟合)运动时SpO2、˙VE与LLS评分的非线性方程,用决定系数(R2)评价方程的拟合优度。SpO2与˙VE采用皮尔逊相关分析(Pearson correlation)。统计显著性水平置为P<0.05。
2 研究结果
2.1 AMS组和nonAMS组基本情况及急性暴露后AMS的发生率
6h急性低氧暴露结束时出现头痛症状且LLS得分超过3分者判定为AMS组(n=6)。据此分组情况,AMS组与nonAMS组(n=16)各项基本生理指标皆无显著性差异(表2)。
6h急性低氧暴露结束时AMS发生率为27%。AMS组LLS评分为5.8±2.7分(最高者为10分,1人),而nonAMS组LLS评分为0.7±0.8分(最高者为3分但无头痛症状,1人)。AMS组LLS评分随低氧暴露时间的延长而增加,在6h结束时达到高点;而nonAMS组LLS评分高点出现于急性低氧暴露4h(HY 4h),为1.0±1.1分,随后下降(图2)。
2.2 主观疲劳感觉、心率和低氧血症指标的变化
急性低氧暴露和急性低氧运动时,AMS组RPE在各测试点都稍高于nonAMS组,但并无显著性差异(图3A)。低氧运动过程中AMS组与nonAMS组HR均值都在129~139bpm区间内,两组HR最大值出现在低氧运动15 min,但无显著性差异(分别为138±10.3bpm和136± 14.2bpm,P>0.05;图3B)。AMS组SpO2在低氧安静时有显著低于nonAMS组的趋势(分别为74.2%±3.9%和78.5%±7.3%,P=0.063)。在低氧运动阶段,AMS组SpO2皆显著低于nonAMS组,在低氧运动5min时达到最低点(分别为66.7%±3.9%和72.5%±5.2%,P<0.05;图3C)。
表2 本研究受试者安静时基本生理指标一览表()Table 2 The Physical Characteristics of Participants
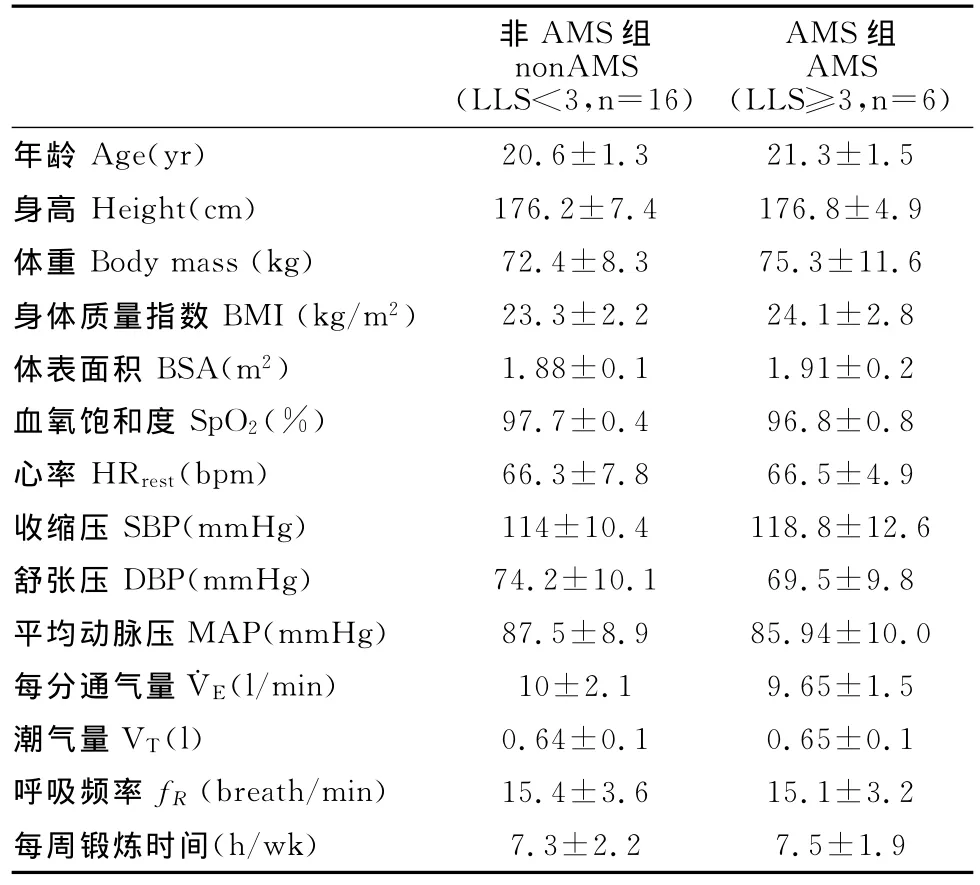
表2 本研究受试者安静时基本生理指标一览表()Table 2 The Physical Characteristics of Participants
非AMS组nonAMS(LLS<3,n=16)AMS组AMS(LLS≥3,n=6)年龄Age(yr)20.6±1.3 21.3±1.5身高Height(cm) 176.2±7.4 176.8±4.9体重Body mass(kg) 72.4±8.3 75.3±11.6身体质量指数BMI(kg/m2) 23.3±2.2 24.1±2.8体表面积BSA(m2) 1.88±0.1 1.91±0.2血氧饱和度SpO2(%) 97.7±0.4 96.8±0.8心率HRrest(bpm) 66.3±7.8 66.5±4.9收缩压SBP(mmHg) 114±10.4 118.8±12.6舒张压DBP(mmHg) 74.2±10.1 69.5±9.8平均动脉压MAP(mmHg) 87.5±8.9 85.94±10.0每分通气量˙VE(l/min) 10±2.1 9.65±1.5潮气量VT(l) 0.64±0.1 0.65±0.1呼吸频率fR(breath/min) 15.4±3.6 15.1±3.2每周锻炼时间(h/wk)7.3±2.2 7.5±1.9
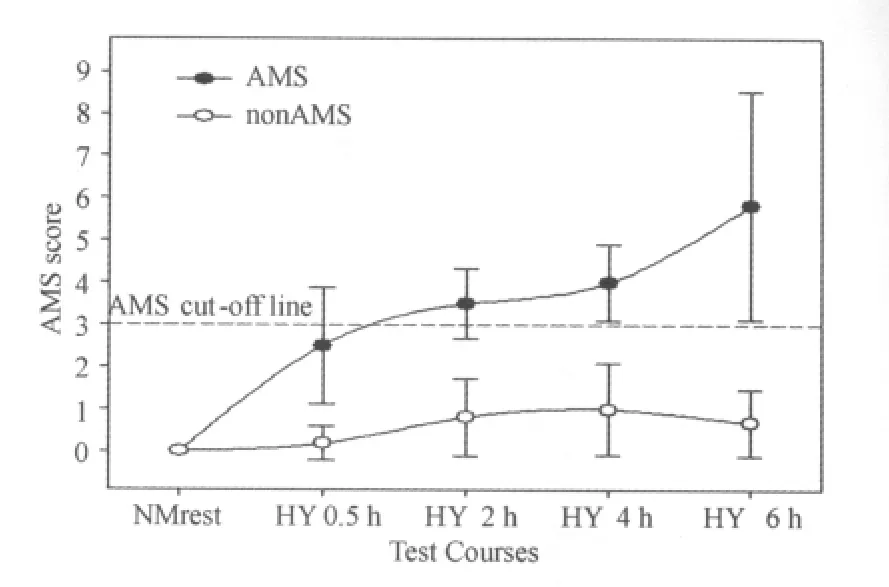
图2 本研究急性低氧暴露6h对受试者AMS的影响示意图Figure 2. Effects of 6hAcute Hypoxia Exposure on Participants’AMS Score
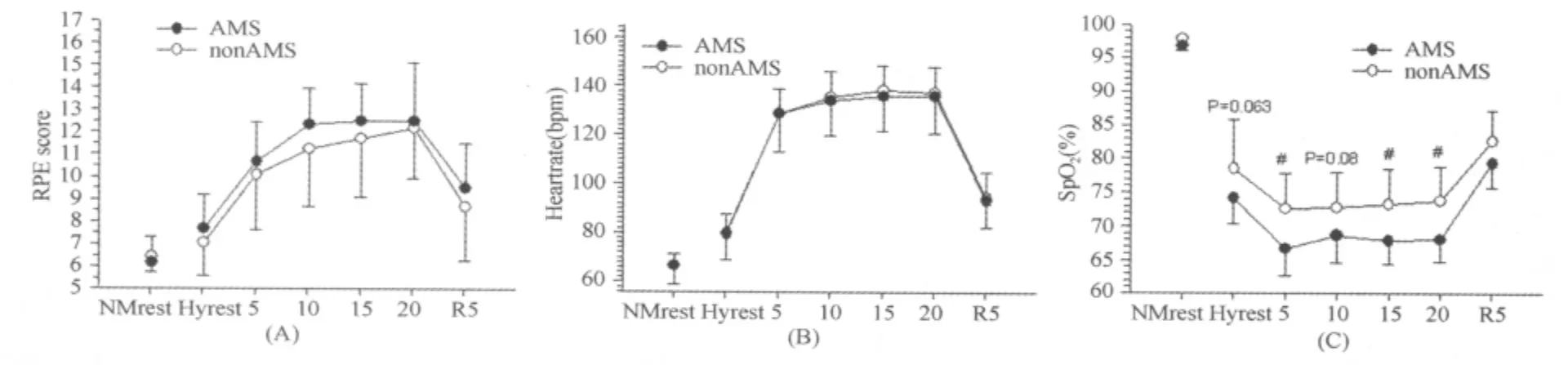
图3 本研究急性低氧暴露和低氧运动时AMS组和nonAMS组RPE、HR和SpO2的变化示意图Figure 3. The Changes of RPE,HR and SpO2in AMS and nonAMS Group during Hypoxic Exposure and Exercise
2.3 低氧通气指标的变化
低氧运动5min时,AMS组˙VE显著低于nonAMS组(分别为41.4±4.6l/min和46.7±4.6l/min,P<0.05);在运动15min和20min时,AMS组˙VE有显著低于nonAMS组的趋势(P值分别为0.09和0.06;图4A)。而在低氧安静和低氧运动过程中,AMS组VT都略低于、fR略高于nonAMS组,但都不具有显著性差异(图4B、C)。
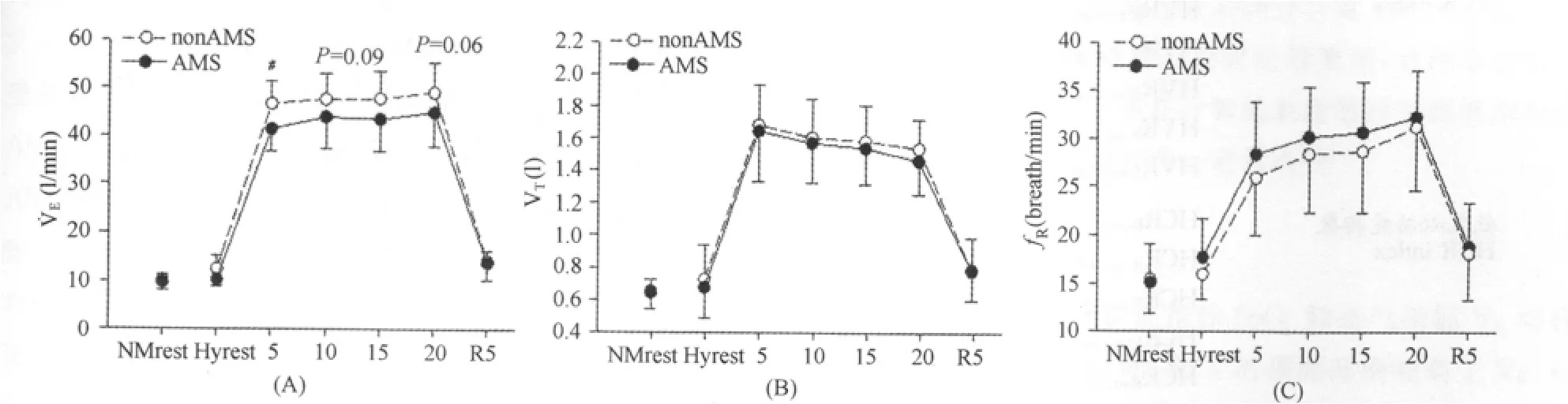
图4 本研究急性低氧暴露和低氧运动时AMS组和nonAMS组HVR相关指标的变化示意图Figure 4. The Changes of HVR Markers in AMS and nonAMS Group during Hypoxic Exposure and Exercises
2.4 SpO2与˙VE预测AMS
分别取低氧运动过程中受试者SpO2和˙VE作为自变量(X),LLS评分作为因变量拟合非线性方程,得到SpO2预测LLS评分的方程:Y=0.0295X2-4.5269X+174.34(R2=0.7473,P<0.001;图5A);˙VE预测LLS评分的方程:Y=0.0352X2-3.4987X+87.729(R2=0.307,P=0.053;图5B)。然后将22名受试者数据回代入方程,发现低氧血症指标SpO2预测AMS的准确性优于低氧通气反应指标˙VE(分别为86%和55%),SpO2与˙VE呈中度相关(R=0.394,P<0.05;图5C)。
2.5 低氧通气指数和低氧心功能指数的变化
计算低氧通气指数发现,低氧安静时AMS组低氧通气指数(HVRR)显著高于nonAMS组(t=-2.435,P=0.024);低氧运动5min时,AMS组低氧心功能指数(HCRE)显著高于nonAMS组(t=-2.219,P=0.038)。其他测试时间点两组HVR指数和HCR指数无显著性差异(表3)。
3 讨论
3.1 AMS发生率及AMS与nonAMS组RPE、HR的变化
虽然AMS的发病机理目前尚无定论,但已明确高原低氧而非高原低压是造成AMS的根本原因[38],而AMS发生率与暴露形式(常压低氧、低压低氧与真实高原)、暴露高度和时间有关。迄今为止有关模拟低氧环境下AMS发生率的报道较少,本研究发现,在既定低氧暴露剂量下AMS发生率为27%(AMS者6人,nonAMS者16人),为后续相关研究提供了参考,但低于预期~50%的发生率。本研究发现,安静和运动时AMS组、nonAMS组的RPE和HR并无显著性差异(图3A、B)。虽然RPE与运动时的心率相关,但其反映的主要是运动耐受性有关的主观疲劳感觉[11],而AMS涉及疲劳在内的多症状因素[35],所以,RPE的结果不能辨别AMS。O’Connor等(2004)[26]研究发现,HR可作为诊断AMS的有效指标,但本研究在控制受试者同质性的基础上发现HR不能作为辨别AMS的有效指标,这也印证了Dyer等(2008)[10]的研究结果。因为性别、年龄、体力活动水平、交感和副交感神经活性变化、体内儿茶酚胺等应激激素的变化对HR的影响都很大[6,13],而O’Connor等的研究中对于受试者年龄、性别、体力活动水平和低氧暴露经验等多方面都未加控制,这可能是导致研究结果不一致的重要原因。
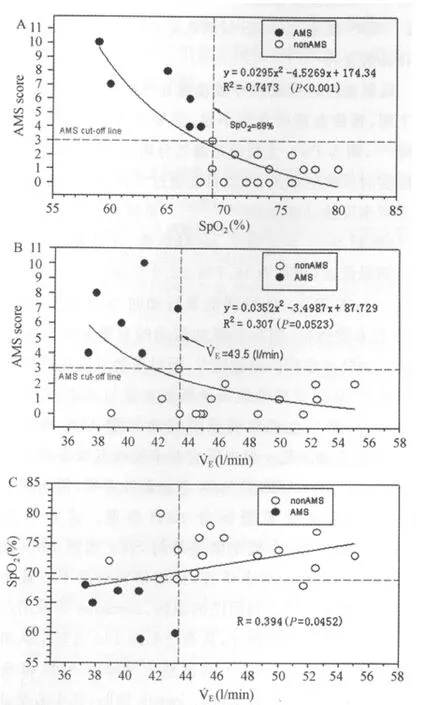
图5 SpO2、˙VE与LLS评分的非线性拟合方程Figure 5. The Nonlinear Fitting Equation of SpO2,˙VEand LLS Score
表3 本研究受试者低氧暴露、低氧运动时的低氧通气指数和低氧心功能指数一览表Table 3 The HVR and HCR Index of Participants during Hypoxia Exposure and Exercise()
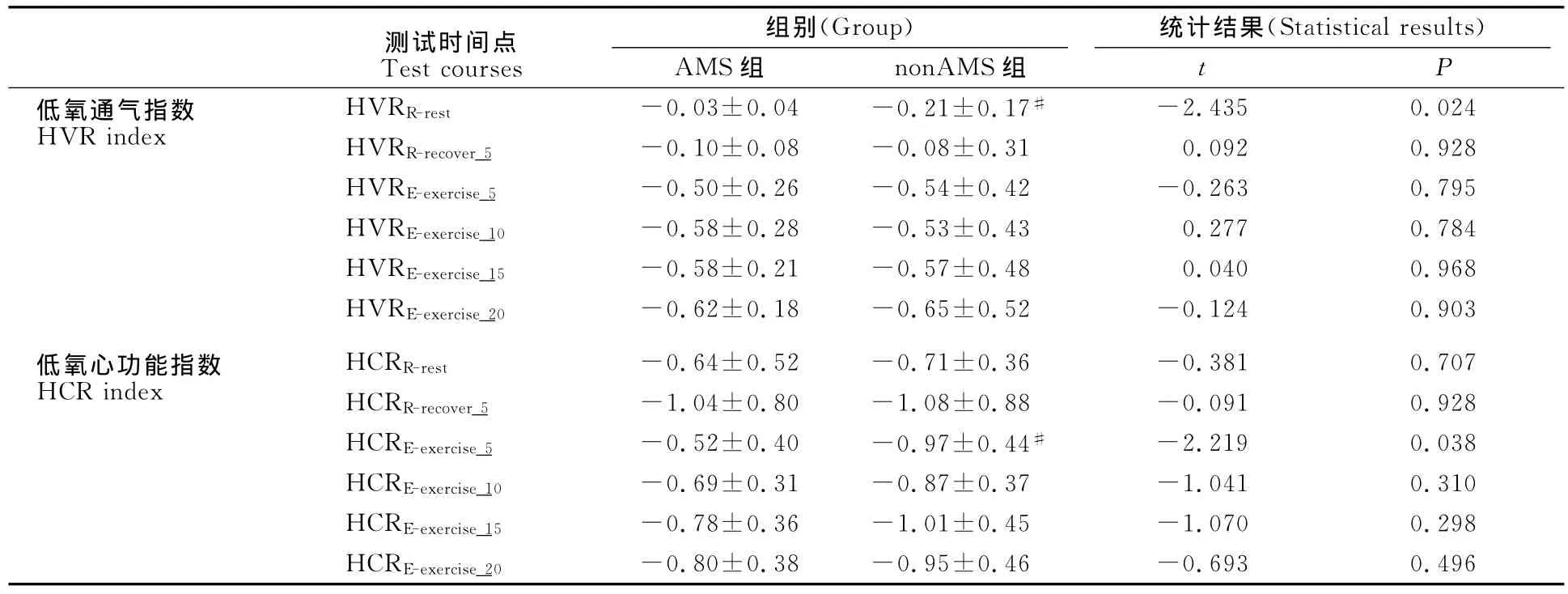
表3 本研究受试者低氧暴露、低氧运动时的低氧通气指数和低氧心功能指数一览表Table 3 The HVR and HCR Index of Participants during Hypoxia Exposure and Exercise()
注:HVRR-rest,低氧安静通气指数;HVRE-exercise,低氧运动通气指数;HVRR-recover,低氧运动后通气指数;HCRR-rest,低氧安静心功指数;HCRE-exercise,低氧运动心功指数;HVRR-recover,低氧运动后心功指数;#,AMS与nonAMS组相比有显著性差异。
测试时间点 组别(Group)Test courses统计结果(Statistical results)AMS组 nonAMS组 t P低氧通气指数HVR index HVRR-rest -0.03±0.04 -0.21±0.17# -2.435 0.024 HVRR-recover_5 -0.10±0.08 -0.08±0.31 0.092 0.928 HVRE-exercise_5 -0.50±0.26 -0.54±0.42 -0.263 0.795 HVRE-exercise_10 -0.58±0.28 -0.53±0.43 0.277 0.784 HVRE-exercise_15 -0.58±0.21 -0.57±0.48 0.040 0.968 HVRE-exercise_20 -0.62±0.18 -0.65±0.52 -0.124 0.903低氧心功能指数HCR index HCRR-rest -0.64±0.52 -0.71±0.36 -0.381 0.707 HCRR-recover_5 -1.04±0.80 -1.08±0.88 -0.091 0.928 HCRE-exercise_5 -0.52±0.40 -0.97±0.44# -2.219 0.038 HCRE-exercise_10 -0.69±0.31 -0.87±0.37 -1.041 0.310 HCRE-exercise_15 -0.78±0.36 -1.01±0.45 -1.070 0.298 HCRE-exercise_20-0.80±0.38 -0.95±0.46 -0.693 0.496
3.2 AMS组与nonAMS组低氧安静和低氧运动时动脉血症指标的差异
低氧血症是指低氧导致动脉血氧分压(PaO2)低于正常下限,致使血液中含氧不足,主要表现为PaO2与SpO2下降[20],因为PaO2主要通过血气分析来测试,存在有创和不能实时反映的缺点,所以目前通过无损测试的动脉血氧饱和度来反映动脉血症[7,8,16-18,31]。本研究发现,低氧运动时AMS组SpO2显著低于nonAMS组,在低氧运动5min时达到最低点(分别为66.7%±3.9%和72.5%±5.2%,P<0.05;图3C)。这说明低氧运动时SpO2可作为辨别AMS的有效指标,因为低氧加运动的双重刺激在短期内加剧了动脉血症的严重程度[4],所以更能反映出机体的耐缺氧能力,从而更准确地揭示低氧血症与AMS之间的关系。Roach等[33]也观察到低氧运动加剧AMS的发生和SpO2更显著地降低。但本研究并未发现低氧安静30min时AMS组与nonAMS组SpO2有显著性差异,说明低氧安静时的动脉血症不能区分AMS患者。这并不支持Burtscher等(2004)[7]提出的安静时SpO2预测AMS准确率达86%的结论。笔者认为,造成研究结果不一致主要是实验控制和受试者同质性的原因,Burtscher等采用的是流行病学回顾性研究设计,其通过汇总150名登山队员过去5年在2 000~6 000m高原登山过程中AMS和SpO2等多个自变量的相关数据进行logistic回归,其实验受试者性别混杂(男114人、女36人)、年龄跨度大(29~55岁)。研究已证实,不同性别和年龄的人群AMS发病率和SpO2都有较大差异[6,13,24],所以有多项研究结果并不支持其结论[8,10,16]。而本研究虽然样本量相对较小(n=22),但在受试者同质性、低氧暴露剂量(暴露时间和高度相同)等控制方面更为严格,所以笔者认为本研究结果更为可靠,也与新近的研究结果一致[8,10,16]。不过,本研究也观察到AMS组和nonAMS组低氧安静时的SpO2分别为74.2%±3.9 %和78.5%±7.3%,呈现有显著性差异的趋势(P=0.063),且AMS组与nonAMS组SpO2差值(4.3%)与Burtscher等汇报的差值(4.9%)较为接近,所以笔者认为Burtscher等的研究结果具有一定价值,但究竟低氧安静时的动脉血症指标是否能预测和判别AMS,尚需在扩大样本量和严格控制实验条件的基础上进一步研究证实。
3.3 AMS组与nonAMS组低氧安静和低氧运动时通气指标的差异
早期研究发现,低氧暴露提高优秀登山运动员的低氧通气反应(HVR,急性低氧暴露使肺通气量增加的现象)与登山成绩有关[15,22,23,34]。因为 HVR这种代偿机制能促进肺泡气体交换,防止肺泡氧分压过度下降[38]。所以有人认为,可将HVR作为判别AMS的指标[25],但目前尚无可靠的研究证据表明HVR能有效预测AMS。本研究并未发现AMS组和nonAMS组安静时的HVR相关指标有显著性差异,只发现低氧运动5min时AMS组˙VE显著高于nonAMS组;低氧运动20min时,AMS组˙VE有显著低于nonAMS组的趋势(P=0.06;图4)。说明低氧运动而非低氧安静时HVR指标可作为判别AMS的有效指标。分析原因认为,以往有关优秀登山队员HVR的研究成果[15,22,23,34]并未明确指向AMS者与nonAMS者的差异,且优秀登山队员在极限高度所获得的数据未必适用于普通人,且因受实地高原测试条件所限,以往研究[15,22,23,34]多是在安静状态测得的HVR数据。而Milledge等[21]针对性地研究登山运动员急进高原4 300m和5 200m后并未发现AMS与安静时HVR相关,认为HVR不能作为预测AMS的指标。Bärtsch等[5]也发现,3天4 559m高原暴露导致的AMS症状与HVR不存在关联。本研究未发现安静时AMS组HVR和nonAMS组有显著性差异,与Milledge等和Bärtsch等的研究结果较为一致,分析原因认为除上述讨论的受试者差异外,本研究所采用的急性低氧暴露安静30min的低氧剂量对机体的刺激可能尚在受试者所能承受和调节的范围之内,所以本研究仅观察到运动5min时AMS组HVR的˙VE指标低于nonAMS组。综上,虽然AMS者的HVR低于nonAMS者,但在基本生理情况一致、同质性较高的受试者中,短期急性低氧暴露时HVR与常氧安静值差别并不大[4],所以用运动时HVR和SpO2预测AMS易感者更为准确。
3.4 低氧运动时低氧血症和低氧通气反应指标预测AMS
结合低氧运动时低氧血症和低氧通气反应指标的研究结果,笔者将SpO2和˙VE作为自变量,LLS评分作为因变量拟合非线性方程(图5A、B),发现低氧运动时SpO2和˙VE可作为预测AMS的有效指标,而SpO2预测AMS的准确性优于低氧通气反应指标˙VE(R2分别为0.7473和0.307),˙VE预测方程拟合优度显著性检验的结果仅为P=0.053(图5),且SpO2与˙VE呈中度相关(R=0.394,P=0.0452)。这与Erba等(2004)[12]的研究结果较为一致,其发现21名世居平原的登山队员急进4 559m高原后有11名受试者罹患AMS,AMS组SpO2、˙VE显著低于nonAMS组。有报道认为,低氧造成的动脉血症与低氧通气反应时˙VE降低有关,但机制并不明确[14]。分析认为,可能是低氧动脉血症通过改变外周化学感受器活性(颈动脉体化学感受器)影响HVR,但˙VE主要受VT和fR的影响[37],动物实验证实低氧下˙VE增加是因低氧诱发外周化学感受器产生的传入冲动对抗低氧对中枢的抑制作用而引起的呼吸兴奋而实现的[38]。而低氧动脉血症指标的影响因素较HVR少,这可能是本研究发现低氧运动时SpO2预测AMS的准确性优于˙VE,二者仅为中度相关的主要原因。所以,在实践应用中综合考虑SpO2与˙VE的变化更有利于提高预测AMS的准确性(图5C)。
3.5 AMS组与nonAMS组低氧通气指数和低氧心功能指数的差异
因AMS者可能出现因低氧导致的通气不足、呼吸性碱中毒和心肺系统功能紊乱,故Rathat等(1992)[27]提出低氧通气指数(HVR index)和低氧心指数(HCR index)来预测和诊断AMS。本研究发现,低氧安静时AMS组HVRR显著高于nonAMS组(P<0.05);低氧运动5min时,AMS组低氧心功能指数(HCRE)显著高于nonAMS组(P<0.05;表3)。说明Rathat等提出的低氧通气指数和低氧心功能指数对于预测和判别AMS有一定的价值。但笔者认为,本研究有关SpO2的结果在应用性方面要优于Rathat等提出的低氧指数指标。主要是因为Rathat等提出的预测和判别AMS的指标是在回顾性研究基础上所得出的,其实验控制并不严密、受试者同质性较差(年龄、性别、健康水平等差异较大),而且还需要测试˙VE。Bärtsch等也认为,其提出的低氧指数是综合计算HR、˙VE、SpO2等指标的变化,但在实施和应用时比较繁琐;且因实验控制的问题存在,有研究人员在计算低氧指数时发现其指标误差过大,在应用性方面存在一定的局限[4]。
4 结论与研究局限
低氧运动时动脉血症指标SpO2和通气指标˙VE可作为预测AMS的有效指标,SpO2的预测准确性高于˙VE,运动时SpO2与˙VE呈中度相关。Rathat等研究的低氧指数相关指标有一定的局限性,从测试的简便、可靠角度考虑,运动时SpO2的变化具有更好的应用前景。
研究局限:须说明的是本研究未达到预期AMS发生率为~50%的均衡设计,这有可能导致数据统计时出现一定的偏误(bias)及统计效力(statistical power)受影响,所以需要在扩大样本量的基础上考虑适当提高低氧暴露的高度或延长低氧暴露时间以完善实验设计;本研究较严格地控制了受试者的同质性,提高了预测方程的准确度,但这也造成了本研究所得之拟合方程在不同性别、年龄段的人群中的外推应用可能受限。
[1]徐飞.低氧训练减缓急性高原反应效果的研究[M].北京:北京体育大学出版社,2010:51-61.
[2]徐飞,胡扬.低氧血症导致肥胖者急性高原反应:个案分析[J].中国运动医学杂志,2011,30(5):471-474.
[3]BARRY P W,POLLARD A J.Altitude illness[J].BMJ,2003,326(7395):915-919.
[4]BARTSCH P,GRUNIG E,HOHENHAUS E,et al.Assessment of high altitude tolerance in healthy individuals[J].High Alt Med Biol,2001,2(2):287-296.
[5]BÄRTSCH P,SWENSON E R,PAUL A,et al.Hypoxic ventilatory response,ventilation,gas exchange,and fluid balance in acute mountain sickness[J].High Alt Med Biol,2002,3(4):361-376.
[6]BASNYAT B,MURDOCH D R.High-altitude illness[J].Lancet,2003,361(9373):1967-1974.
[7]BURTSCHER M,FLATZ M,FAULHABER M.Prediction of susceptibility to acute mountain sickness by SaO2values during short-term exposure to hypoxia[J].High Alt Med Biol,2004,5(3):335-340.
[8]CHEN Y C,LIN F C,SHIAO G M,et al.Effect of rapid ascent to high altitude on autonomic cardiovascular modulation[J].Am J Med Sci,2008,336(3):248-253.
[9]DAGIANTI A,PENCO M,BANDIERA A,et al.Clinical appli-cation of exercise stress echocardiography:supine bicycle or treadmill?[J].Am J Cardiol,1998,81(12A):62G-67G.
[10]DYER E A,HOPKINS S R,PERTHEN J E,et al.Regional cerebral blood flow during acute hypoxia in individuals susceptible to acute mountain sickness[J].Respir Physiol Neurobiol,2008,160(3):267-276.
[11]EHRMAN J K,DEJON A,SANDERSON B,et al.ACSM’s resourse manual for guidelines for exercise testing and prescription.6th Edition[M].Philadelphia:Lippincott Williams &Wilkins,2010:476-488.
[12]ERBA P,ANASTASI S,SENN O,et al.Acute mountain sickness is related to nocturnal hypoxemia but not to hypoventilation[J].Eur Respir J,2004,24(2):303-308.
[13]HACKETT P H,ROACH R C.High-altitude illness[J].N Engl J Med,2001,345(2):107-114.
[14]HAINSWORTH R,DRINKHILL M J,RIVERA-CHIRA M.The autonomic nervous system at high altitude[J].Clin Auton Res,2007,17(1):13-19.
[15]HOHENHAUS E,PAUL A,MCCULLOUGH R E,et al.Ventilatory and pulmonary vascular response to hypoxia and susceptibility to high altitude pulmonary oedema[J].Eur Respir J,1995,8(11):1825-1833.
[16]KOEHLE M S,GUENETTE J A,WARBURTON D E.Oximetry,heart rate variability,and the diagnosis of mild-to-moderate acute mountain sickness[J].Eur J Emerg Med,2010,17(2):119-122.
[17]LOEPPKY J A,ICENOGLE M V,CHARLTON G A,et al.Hypoxemia and acute mountain sickness:which comes first?[J].High Alt Med Biol,2008,9(4):271-279.
[18]LUKS A M,SWENSON E R.Pulse oximetry at high altitude[J].High Alt Med Biol,2011,12(2):109-119.
[19]MAIRER K,WILLE M,BUCHER T,et al.Prevalence of acute mountain sickness in the Eastern Alps[J].High Alt Med Biol,2009,10(3):239-245.
[20]MAKE B.Diagnosis and management of hypoxemia[J].Compr Ther,1978,4(4):42-49.
[21]MILLEDGE J S,THOMAS P S,BEELEY J M,et al.Hypoxic ventilatory response and acute mountain sickness[J].Eur Respir J,1988,1(10):948-951.
[22]MOORE L G.Comparative human ventilatory adaptation to high altitude[J].Respir Physiol,2000,121(2-3):257-276.
[23]MOORE L G,HARRISON G L,MCCULLOUGH R E,et al.Low acute hypoxic ventilatory response and hypoxic depression in acute altitude sickness[J].J Appl Physiol,1986,60(4):1407-1412.
[24]MUHM J M,ROCK P B,MCMULLIN D L,et al.Effect of aircraft-cabin altitude on passenger discomfort[J].N Engl J Med, 2007,357(1):18-27.
[25]MUZA S R,YOUNG A J,SAWKA M N,et al.Ventilation after supplemental oxygen administration at high altitude[J].Wilderness Environ Med,2004,15(1):18-24.
[26]O’CONNOR T,DUBOWITZ G,BICKLER P E.Pulse oximetry in the diagnosis of acute mountain sickness[J].High Alt Med Biol,2004,5(3):341-348.
[27]RATHAT C,RICHALET J P,HERRY J P,et al.Detection of high-risk subjects for high altitude diseases[J].Int J Sports Med,1992,13(Suppl 1):S76-78.
[28]REN Y,FU Z,SHEN W,et al.Incidence of high altitude illnesses among unacclimatized persons who acutely ascended to Tibet[J].High Alt Med Biol,2010,11(1):39-42.
[29]RINNE M,PASANEN M,MIILUNPALO S,et al.Is generic physical activity or specific exercise associated with motor abilities?[J].Med Sci Sports Exe,2010,42(9):1678-1688.
[30]ROACH R C,B RTSCH P,HACKETT P H,et al.The Lake Louise acute mountain sickness scoring system.In:Sutton JR,Houston CS,Coates G.Hypoxia and Moutain Medicine[M].Burlington:Queen City Printers,1993:146-158.
[31]ROACH R C,GREENE E R,SCHOENE R B,et al.Arterial oxygen saturation for prediction of acute mountain sickness[J].Aviat Space Environ Med,1998,69(12):1182-1185.
[32]ROACH R C,LOEPPKY J A,ICENOGLE M V.Acute mountain sickness:increased severity during simulated altitude compared with normobaric hypoxia[J].J Appl Physiol,1996,81(5):1908-1910.
[33]ROACH R C,MAES D,SANDOVAL D,et al.Exercise exacerbates acute mountain sickness at simulated high altitude[J].J Appl Physiol,2000,88(2):581-585.
[34]SCHOENE R B,LAHIRI S,HACKETT P H,et al.Relationship of hypoxic ventilatory response to exercise performance on Mount Everest[J].J Appl Physiol,1984,56(6):1478-1483.
[35]SCHOREDER S.Acute Mountain Sickness and Rating of Perceived Exertion on Denali(Alaska)[M].California:San Jose State Univerisity,2006:7-16.
[36]THOMAS S,READING J,SHEPHARD R J.Revision of the physical activity readiness questionnaire(PAR-Q)[J].Can J Sport Sci,1992,17(4):338-345.
[37]WEST J B.Respiratory Physiology:The Essentials.8th Edition[M].Baltimore,MD:Lippincott Williams &Wilkins,2008:13-14.
[38]WEST J B,SCHOENE R B,MILLEDGE J S.High altitude medicine and physiology.4th Edition[M].London:Hodder Arnold,2007:215-231.
[39]WILLIAMS J R.Revising the declaration of helsinki[J].World Med J,2008,54(4):120-125.
Prediction of Susceptible to Acute Mountain Sickness by Hypoxemia and Ventilatory Response during Hypoxic Exercise
XU Fei1,HU Yang2
Objective:To explore predictable of parameters of acute mountain sickness(AMS)by hypoxemia and hypoxic ventilatory response during hypoxic exercise,so as to supply some references to reduce the risks of AMS and improve life quality of altitude travelers.Methods:Recruit 23male students in hypoxia chamber(~4400m,FIO211.8%~11.6%)exposure 6 hours,and record the participants’AMS(LLS score)in 0.5,2,4and 6h.When participants’LLS≥3and with headache symptom defined as AMS group.After rest 30min in hypoxia chamber,participants experienced 30min cardiopulmonary test(supine exercise with 80 W,60rpm),record RPE,HR,SpO2,BP and hypoxic ventilatory response every 5min,and calculate the hypoxic ventilatory and cardio-function response indexes according aforementioned parameters.After test procedure,take the significant difference indexes as independent variables fit non-linear predictable equations.Results:After 6hexposure,the incidence of AMS is 27%.There is no significant difference in RPE,HR,SpO2,˙VE,VTandfRbetween the AMS and non AMS group when participants rest in hypoxic chamber.However,the SpO2of AMS group is significant lower than non AMS group(P<0.05),the lowest value observed in exercise 5min.In addition,the˙VEof AMS group is significant lower than non AMS group(41.4 ±4.6and 46.7±4.6l/min,P<0.05,respectively).The predictable equations are LLS=0.0295(SpO2)2-4.5269(SpO2)+174.34(R2=0.7473,P<0.001)and LLS=0.0352(˙VE)2-3.4987(˙VE)+87.729(R2=0.307,P=0.053),respectively.And SpO2is moderately correlated with˙VE(R=0.394,P<0.05).Conclusions:The changes of hypoxemia(SpO2)and hypoxic ventilatory response(˙VE)during hypoxic exercise can be use as effective indicators of AMS.The predictable accuracy of SpO2is better than˙VE,and there is a moderately correlation between SpO2and˙VE.From the perspective of test simple and reliable,thechange of SpO2during exercise has a good application prospect in predicting AMS.
acutemountainsickness;hypoxicexercise;hypoxemia;arterialoxygensaturation;hypoxicventiltoryresponse
G804.2
A
1000-677X(2011)10-0059-08
2011-08-22;
2011-09-22
北京市教委重点实验室开放性课题。
徐飞(1981-),男,重庆人,讲师,博士,主要研究方向为低氧生理学及运动机能评定,Tel:(0571)85290185,E-mail:yangt1193@gmail.com;胡扬(1958-),男,江苏人,教授,博士,博士研究生导师,主要研究方向为低氧训练及运动分子生物学。
1.浙江工业大学体育科学研究所,浙江杭州310023;2.北京体育大学,北京100084
1.Institute of Sports Science Research,Zhejiang University of Technology,Hangzhou 310023,China;2.Beijing Sport University,Beijing 100084,China.
①HVRR:rest hypoxic ventilentory response,安静时低氧通气反应指数;˙VERH:minute ventilation in hypoxic rest,低氧静息时的每分通气量;SpO2RH:SpO2in hypoxic rest,低氧静息时血氧饱和度;SpO2RN:SpO2in normoxia rest,常氧安静时血氧饱和度;BW:body weight,体重。
②HVRE:exercise hypoxic ventilentory response,运动时低氧通气反应指数;˙VEEH:minute ventilation in hypoxic exercise,低氧运动时每分通气量;SpO2EH:SpO2in hypoxic exercise,低氧运动时血氧饱和度:SpO2EN:SpO2in normobaria exercise,常氧运动时SpO2。
③HCRR:rest hypoxic cardiac response,休息时低氧心指数;HRRH:heart rate in rest hypoxia,低氧静息时心率;HRRN:heart rate in rest normoxia,常氧安静时心率。
④HCRE:exercise hypoxic cardiac response,运动时低氧心指数;HREH:heart rate in hypoxic exercise,低氧运动时心率;HREN:heart rate in normoxia exercise,常氧运动时心率。

