不同降温速率对肾细胞内、外冰形成温度的影响
王雅博 诸 凯 安 娜 王艳娇
(1天津大学环境科学与工程学院 天津 300072)
(2天津商业大学天津市制冷技术重点实验室 天津 300134)
1 引言
在常温下细胞与周围的溶液处于平衡状态,细胞内、外的温度和浓度都是相同的。在冷却过程中,当细胞外的溶液先被冷却到溶液的凝固点以下时,由于细胞外溶液的水分浓度增加,形成高渗透压,促使细胞内水分外流。当降温速率较慢时,细胞不断脱水,皱缩。同时,胞外冰晶的形成,使细胞受到一定的挤压,细胞骨架变形。当降温速率不足以使细胞内水分外渗时,细胞浆会降温过度,产生胞内冰。这就是Mazur提出的“双因素假说”[1-2]。因此降温速率对细胞及组织的保存效果有很大的影响。通过控制降温速率能够延长细胞和组织的保存时间[3]。但不同细胞对温度的敏感程度不尽相同,研究特定细胞或组织冻结过程中的损伤机理对于低温延时保存具有重要意义。
低温保存过程中,细胞损伤与胞内冰的形成(IIF)具有必然联系。对于细胞和组织保存,其胞内冰的形成将直接导致细胞死亡。了解细胞胞内冰晶的形成过程对于低温保存方法的研究非常重要[4-5],因此胞内外冰晶形成温度的测定是进行低温保存机理研究的基础。本文采用差示扫描量热仪和低温显微镜观察和分析小鼠肾细胞的胞内、外冰晶形成过程。旨在了解小鼠肾细胞胞内外冰晶的形成与降温速率的关系。
2 实验研究
2.1 肾活细胞悬液的制备
将BALB/C鼠脱臼处死,取出肾脏剪碎,用200目尼龙网研磨。然后用生理盐水缓慢冲洗,收集细胞悬液,台盼蓝染色活细胞数在80%以上[6]。
2.2 差示扫描量热仪
采用TA-Q1000型差示扫描量热仪记录样品冻结过程中的热流曲线。使用前用高纯铟对仪器进行温度校准得到炉子常数为1.19。实验扫描温度范围为25—-60℃。
2.3 低温显微系统
低温显微系统包括光学显微镜和BCS-196冷热台及其温度控制系统。显微镜上装有CCD,图像经计算机上的图像采集卡转换后予以存储。冷热台可实现-196—125℃内升降温速率的精确控温,精度为0.01℃。
在进行显微观察时,样品的准备尤其重要。研究采用的方法是:将一片载玻片置于另一片石英载玻片之上,利用表面张力将细胞悬液吸入至两载玻片之间。由此得到的试样有利于观察胞内冰的单层细胞(monolayer),并且可以防止观察过程中细胞悬液的蒸发和泄漏。
2.4 降温程序
胞内冰的形成是造成细胞损伤的致命原因,为了避免胞内冰的形成,必须在细胞达到结晶温度前,通过细胞脱水来避免胞内过冷。降温速度越快,胞内溶质的过冷度越大,当达到成核温度时,过冷的细胞质就会结冰。为了研究胞内冰形成温度和胞外冰形成温度与降温速率的关系。实验采用 2、5、10、20、30、50、100℃/min的降温速率对肾细胞悬液进行冷却。每个温度程序重复5次实验,所得结果非常相似,取平均值作为最终的结果。
3 DSC测试胞内冰温度的验证
DSC实验中,在没有胞内冰产生的情况下,热流曲线只有一个“大放热峰”,代表胞外介质冰晶形成;如果还将出现第二个“小放热峰”则代表胞内冰的产生。为了证实第二个“小放热峰”即为胞内冰产生的热流曲线,设计了一个独立的实验。第一步,将样品以5℃/min降温至出现第一个放热峰;第二步,将样品升温至0℃,并快速降温至-50℃;第三步,重复第二步。图1是验证试验的放热曲线曲线。慢速(5℃/min)降温至结晶温度,又迅速升温,意味着样品中只产生了胞外冰晶,会有一个大的放热峰出现。将同一样品快速降温,在该过程中,第一个大放热峰出现之后,又产生一个小的放热峰)。再次升温-降温,这时仅会有一个放热峰出现,说明经过快速降温后,胞内冰形成,细胞死亡,(低温显微观察也证实:经过快速降温,细胞膜消失,细胞与外界基质溶为一体,如图2。图2中的小圆圈即为具有活性的肾细胞,经冻结后该“小圆圈”在视野中基本消失,说明细胞结构已被破坏,细胞质、细胞膜碎片与基质溶为一体,即不再出现第二个“放热峰”。所以当快速降温时,所出现的第二个“小放热峰”即为胞内冰的形成过程。
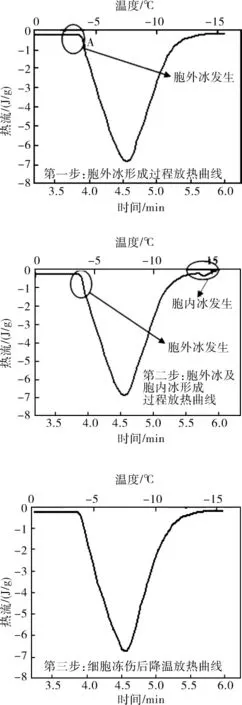
图1 不同降温速率DSC热流曲线Fig.1 DSC thermograms of different cooling rate for same sample

图2 快速降温前后的细胞状态Fig.2 Cell status before and after cooling at 200℃/min from cryomicroscope
4 结果和分析
4.1 胞外冰(EIF)的产生
由DSC得到的热流-温度曲线上,放热峰发生的起始点,即为胞外冰产生的时刻,如图1中的点A。图3显示了胞外冰晶的形成过程及胞外冰对细胞结构的影响。在低温显微观察中,随着温度的降低,在视野中会突然出现分散的冰晶,继而冰晶会像树枝状生长。胞外冰生长的过程类似于玻璃破裂的过程。起初胞外冰对细胞结构只产生微小的影响-细胞微小变形和旋转。随着胞外冰晶的增多,细胞外浓度增大,细胞内的水分流失,细胞皱缩。但细胞内始终没有冰晶的产生。采用Image-Pro Plus软件测量了细胞冻结脱水过程中的细胞直径变化。未冻结时,细胞直径为4.66 μm。随着胞外冰的出现,细胞皱缩,在-10.11℃时,细胞直径逐渐减少到3.5 μm。

图3 2℃/min降温情况下,细胞外基质及细胞的变化情况Fig.3 Ice crystal process in renal cell suspensions at cooling rate 2℃/min
图4是分别通过DSC和低温显微系统获得的不同降温速率下,胞外冰形成温度。随着降温速率的增大,细胞外溶液过冷度逐渐增大,胞外冰形成温度降低。当降温速率小于50℃/min时,降温速率对胞外冰的形成温度有明显的影响。降温速率的增大,EIF温度显著下降。当降温速率大于50℃/min,降温速率对EIF温度的影响并不显著。
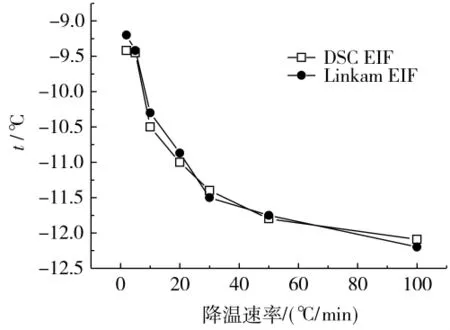
图4 DSC和低温显微镜测定的胞外冰形成温度比较Fig.4 Comparison of DSC and linkam cryomicroscopy EIF temperature
4.2 胞内冰(IIF)的产生
在DSC中,快速降温将导致胞内冰(第二个放热峰)的出现。实验显示,以较小的速率进行降温,不会出现第二个放热峰。由DSC实验可知,在降温速率小于10℃/min的情况下,肾细胞内没有冰晶的产生,低温显微观察也证实了这一结论。图5为DSC实验得到的不同降温速率,胞内冰形成温度。同样的,随着降温速率的增大,胞内冰的形成温度逐渐降低。这是由于降温速率越大,细胞内留存水分的渗透压不平衡性越大,导致细胞浆的过冷度越大。
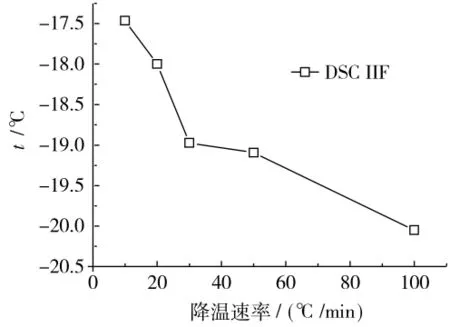
图5 DSC测得的胞内冰温度Fig.5 DSC IIF temperature at different cooling rate
众多研究者已证实,细胞结冰后显微镜内细胞的亮度明显发生变化。在普通光学显微镜下,细胞区域将突然或逐步变黑(darkening)[7]。图5显示了降温速率为100℃/min时的观察结果。在图5中,由于降温速率较大,细胞内的水份来不及渗出。在-23.05℃时,形成胞内冰。胞内冰的形成破坏了细胞膜结构,细胞逐渐消失。表1列出了不同降温速率下,肾细胞悬液胞内冰和胞外冰形成温度的差值tEIF-tIIF。tEIF-tIIF随降温速率的增大而增大。
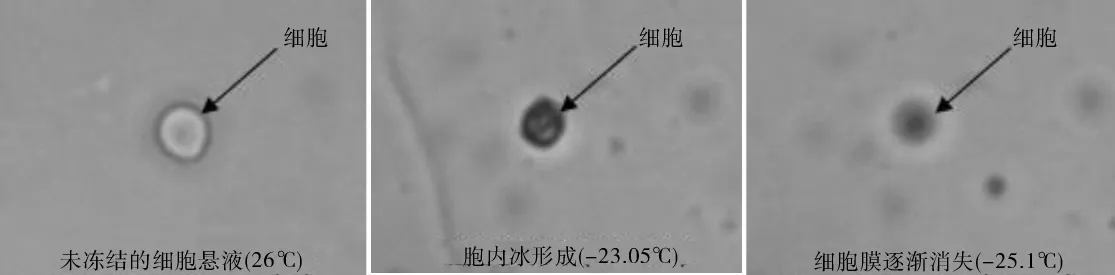
图5 100℃/min降温情况下,细胞外基质及细胞的变化情况Fig.5 Ice crystal process in renal cell suspensions at cooling rate100℃/min
5 总结与讨论
通过可视化观察分析可知,细胞在冻结过程中,当胞外冰形成时,视野会突然明亮并迅速出现树枝状冰晶,L Li等人[8]也证明了这一过程。胞外冰出现后,视野内细胞逐渐“变黑”,代表着胞内冰晶的形成。
DSC是观察测试材料相变过程(热流变化)非常灵敏的仪器,用于对胞内冰的探测也具有足够的灵敏度。快速降温时,DSC降温曲线会出现两个“放热峰”。但是有些降温过程并没有出现第二个“小放热峰”,可能是由于代表胞外冰产生的“大放热峰”将(代表胞内冰产生的)小放热峰吸收了。
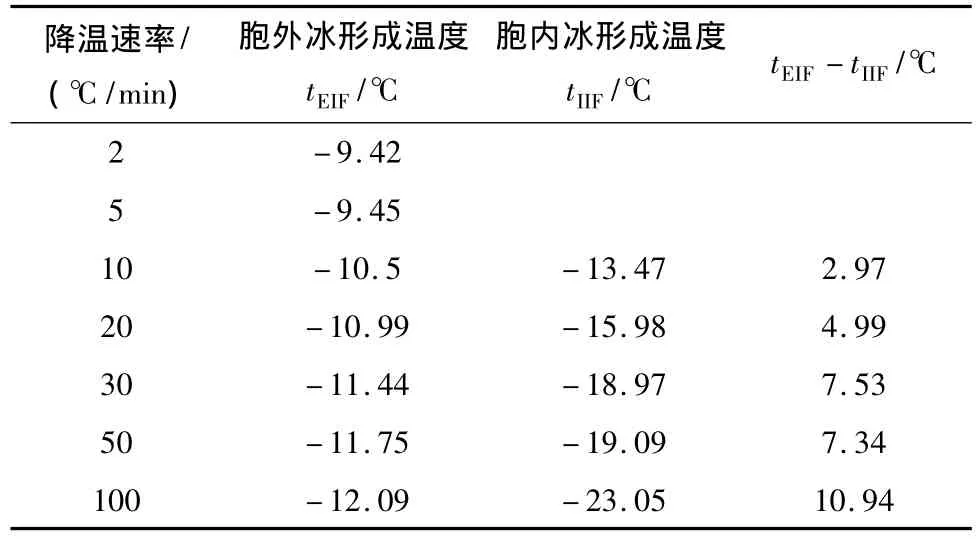
表1 不同降温速率下tEIF,tIIF,tEIF-tIIF Table 1 tEIF,tIIF,tEIF-tIIFof different cooling rate
本文分别利用差示扫描量热仪和低温显微系统,获得了胞内、外冰的形成温度,分析了降温速率对胞内冰形成温度、胞外冰形成温度以及对这两个温度差值的影响。快速降温能够使结冰温度(包括胞内冰,胞外冰)降低,并能提高两种结冰温度的温差。这一结论说明在细胞及组织的保存过程中,提高降温速率,有助于获得更低的保存温度。研究结果对理解冰晶的形成过程和优化保存方法具有指导意义。
1 Mazur P.Freezing of living cells:Mechanisms and implications[J].American Journal of Physiology,1984,247:125-142
2 赵 刚,杨基明,何立群,等,离子水合对胞内冰成核与生长的影响[J].自然科学进展,2005,15(3):372-374
3 Nerem R M.Tissue engineering:confronting the transplantation crisis,Proceedings of Institution of Mechanical Engineers,Part H:Journal of Engineering in Medicine,2000,214:95-99.
4 Mazur P.Kinetics of water loss from cells at subzero temperatures and likelihood of intracellular freezing[J].The Journal of General Physiology,1963,47:347-369.
5 刘宝林,John McGranth,华泽钊.低温保存过程中老鼠成骨细胞胞内冰的研究[J].制冷学报,2007,28(1):22-25
6 彭 宇,郑清莲,李信民等,胎肾细胞悬液对卵巢大鼠自由基的影响[J].中国中西医结合杂志,2010,30(4):416-418
7 张绍志,王 葳,陈光明,等.低温显微装置及其对细胞胞内冰晶形成现象的观察[J].细胞生物学杂志,2003(4):231-234
8 Li J,Zhang L L,Liu Q H,et al.Extra and intra-cellular ice formation of red seabream(Pagrus major)embryos at different cooling rates[J].Cryobiology ,2009,59:48-53

