淹水胁迫下枫杨叶片对不同氮素水平的光合生理响应
苏守香,徐 凯,孙启祥,彭镇华,方建民
(1. 国际竹藤中心,北京 100102;2. 浙江农林大学农业与食品科学学院,浙江 临安 311300;3. 中国林业科学研究院林业研究所,北京 100091;4. 安徽省林业科学研究院,安徽 合肥 230031)
淹水胁迫下枫杨叶片对不同氮素水平的光合生理响应
苏守香1,3,徐 凯2*,孙启祥3,彭镇华3,方建民4
(1. 国际竹藤中心,北京 100102;2. 浙江农林大学农业与食品科学学院,浙江 临安 311300;3. 中国林业科学研究院林业研究所,北京 100091;4. 安徽省林业科学研究院,安徽 合肥 230031)
研究了不同氮素水平(16.0、6.0、0.5、0 mg/kg)没顶全淹、冠层半淹和根部渍水对枫杨光合作用的影响,结果表明,淹水使枫杨叶片的净光合速率(Pn)显著下降,但高氮(16.0 mg/kg)和中氮(6.0 mg/kg)淹水胁迫下枫杨叶片净光合速率的降幅明显低于低氮(0.5 mg/kg)和对照(0 mg/kg);淹水胁迫下,枫杨叶片的非光化学淬灭系数(qN)随氮水平的提高而降低,而光化学荧光淬灭系数(qP或qL)则相反。试验结果说明富氮可缓解淹水对枫杨叶片光合作用的胁迫损害。
枫杨;淹水;氮;光合作用
水体富营养化已成为世界范围内水环境保护中的重大环境问题[1],是当今世界面临的一个严峻的环境问题。我国的水体富营养化情况也很严重,其中湖泊富营养化是我国目前面临的最为严重的水环境问题之一[2]。长江中下游地区大面积滩地具有独特的季节性淹水特征。水淹不仅带来了大量水分,同时带来了不同水平的氮素等养分,形成富氮(N)淹水。氮素是水体富营养化中的一个很重要的污染因子。在水淹条件下,水分与氮素的共同作用,对水生植物的生长及生理代谢等方面都具有不同程度的特定影响[2]。国内外有关淹水胁迫下植物响应富营养化水体的研究对象主要包括藻类等浮游植物[3]、水稻[4~6]等草本。富N淹水胁迫对林木光合作用等生理代谢的影响尚缺少研究[7]。
叶绿素荧光与光合作用中各个反应过程紧密相关,与传统的“表观性”的气体交换指标相比,其更能反映植物的“内在性”特征,可以用它快速、灵敏和非破坏性地分析光合作用的内在机理。因此,作为光合作用研究的探针,叶绿素荧光技术在植物生理研究上、特别是逆境胁迫机理分析方面已经得到了广泛的应用[8~9]。
枫杨(Pterocarya stenoptera)是我国亚热带地区的乡土树种,分布于海拔1 500 m以下的沿溪涧河滩、阴湿山坡地的林中,常见于河岸带和消落区。过去对枫杨的研究集中在淹水后生长形态和代谢生理方面,研究表明[10],枫杨具有很强的耐水湿特性,在季节性淹水的长江滩地的生态防护林建设中发挥了重要作用。近10多年来,关于植物对淹水适应性的研究逐渐成为植物逆境研究的热点之一。但淹水胁迫下富营养(富N)水对乔木的影响研究则鲜有报道。本试验选择以我国广泛分布于南北方10多个省区的乡土树种枫杨为试材,通过不同氮水平淹水胁迫下叶绿素荧光及相关光合参数的测定分析,探索滩地季节性富氮水平淹水胁迫对枫杨林木的光合生理影响机制,以进一步探明滩地季节性淹水下林木光合产物积累的影响,从而为滩地枫杨林的科学经营提供实践指导和理论依据。
1 材料与方法
1.1 试验时间、地点
试验于2010年7月至2011年12月在浙江农林大学东湖校区内(杭州临安市)进行。临安地处浙江省西北部、属中亚热带季风气候区南缘,年平均气温为16℃,绝对最低温-8.1℃,绝对最高温39.9℃。
1.2 试验材料
试验材料枫杨来自安徽安庆桐城的安徽省环艺生态有限责任公司,2010年4月下旬选取120株生长基本一致、健壮的三叶一心的1年生实生幼苗盆栽于安徽省林业科学研究院内,每盆1株,盆高18 cm,盆口直径23 cm。盆栽基质采用黄心土:河沙:泥炭:蛭石 = 4.5:2.5:2.0:1.0(体积比)的比例混合,晒干去除杂质后装盆,每盆基质重3.5 kg。测得田间持水量为28.3%,基质饱和持水量51.7%。生长期间保证水分供应充足,其他管理同常规。7月上旬将全部实验材料连盆运至浙江农林大学温室大棚内进行试验前缓苗。
2010年7月20日将所有盆栽苗连盆放入高68 cm、口部直径96 cm、底部直径92 cm的塑料桶中进行套盆淹水处理,隔天调整各处理在玻璃温室中位置,以消除温室内不同位置的环境差异。2011年试验材料培养和处理方法与上述相同。
1.3 试验方法
1.3.1 处理设计 将实验植株随机按照供N水平分成4组,分别为对照ck(不加N,即N含量0 mg/kg,下同)、低N(N含量0.5 mg/kg,下同)、中N(N含量6 mg/kg,下同)和高N(N含量16 mg/kg,下同)。每组根据淹水深度设3个处理水平,盆土表面以上5 cm的根部渍水(简称根渍,下同)、盆土表面以上25 cm的冠层半淹(简称半淹,下同)以及盆土表面以上50 cm的冠层没顶全淹(简称全淹,下同)。
实验期间,ck和加N分别保持常规管理和淹水状态,水淹处理为淹水至土壤表面以上5、25、50 cm,并及时补充水分和尿素来控制水位和N浓度保持在一固定值。实验从7月19日始,到8月31日止。
实验设12个处理,测定时每3株为1个处理,光合参数每株测3片叶,每片测3次,计9次重复;荧光参数每株测4片叶,每片测2次,计8次重复。测定时间为处理前(0 d)和处理后1、3、7、13、20、30和40 d。
1.3.2 测定方法 在温室进行处理后,每处理选取室中不同方位的3盆试验材料,移至光照培养室中继续同等处理,同时在测定前预照光2 h以上。之后进行光合生理参数测定,光照培养室每天照光12 h(8:00-20:00),光强为(600±10)µmol·m-2·s-1,光源为植物生长镝灯,室温为(25±1)℃。实验时选完全展开的第4片功能叶放在经流动水层滤热的灯光下进行。叶片表面光强(445±10)µmol·m-2·s-1,测定时光合参数重复9次,荧光参数重复6次。
1.3.2.1 叶片光合参数的测定 在室内镝灯下,GFS-3000(Walz,Germany)光合测定系统进行连体叶片测定,灯与材料间用水槽(流动水)隔热,测定前卸下叶室前端的红蓝光源,在叶室上不加盖任何不同透光率的中性滤光罩并保持叶室与光源的距离不变。
1.3.2.2 叶片叶绿素荧光参数的测定 盆栽苗暗适应0.5 h以上后,每隔一段时间用PAM-2500(Walz,Germany)便携式叶绿素荧光仪,测定Fo(初始荧光)、Fm(最大荧光)、Fv/Fm(光系统Ⅱ最大光化学效率)、Fm’(光下的最大荧光)和Fo’。测定时,打开检测光(< 0.1 µmol·m-2·s-1,频率为600 Hz)测定Fo,再打开一次饱和脉冲光 [光量子通量密度(Photon flux density,简写为PFD,下同)为8 000 µmol·m-2·s-1,频率为20 kHz,0.8 s,1个脉冲],测定Fm以及Fv/Fm。然后打开作用光(PFD为336 µmol·m-2·s-1,白光),Ft(光下稳态荧光)稳定后,再打一次饱和脉冲光测定Fm’,关闭作用光,继以一次远红外光(PFD为5 µmol·m-2·s-1,频率为20 kHz,3 s)测定Fo’。光化学淬灭系数(qP、qL)、非光化学淬灭系数(qN)、PSⅡ的量子产额ΦPSII和电子传递速率ETR按下列公式计算:
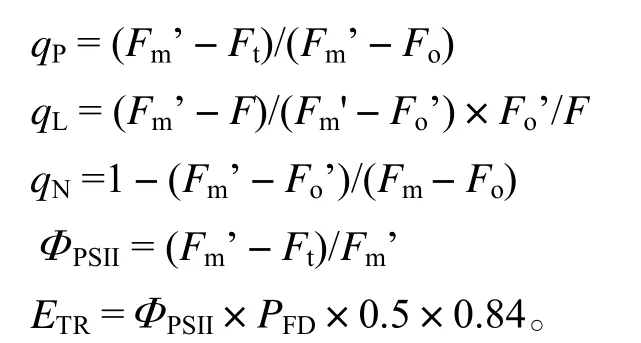
数据处理软件为PAMWin(Walz,Germany),利用Excel软件进行原始数据整理,统计分析利用SPSS统计分析软件完成,采用OriginPro画图软件绘图。
2 结果与分析
2.1 富氮对不同淹水深度下枫杨叶片净光合速率的影响
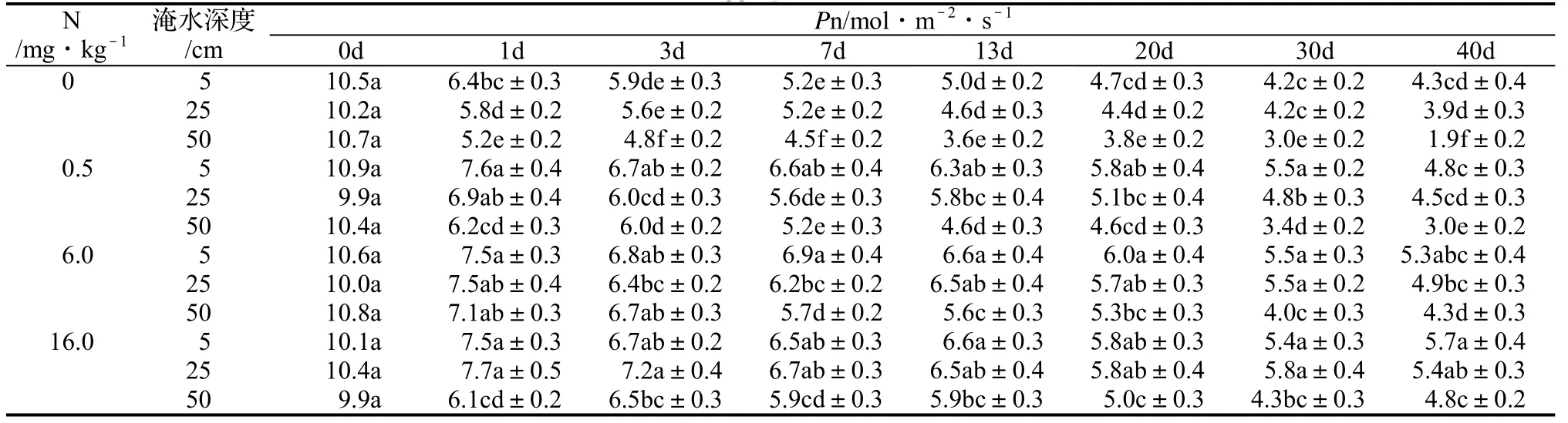
表1 富氮对不同淹水深度下枫杨叶片净光合速率的影响Table 1 Effect of different waterlogging treatments with different N content on Pn
由表1可知,在高、中N水平下,根部渍水和没顶全淹1 ~ 40 d,枫杨叶片的净光合速率下降幅度均小于相同淹水时间的对照,除中N水平根部渍水处理40 d外均差异显著(P < 0.05)。这表明高、中N水平明显减缓了淹水下枫杨叶片净光合速率的下降。
在低N水平下,枫杨叶片的净光合速率,除根部渍水40 d和冠层半淹7、40 d时,与对照的差异不显著(P≥0.05)外,其它差异均显著(P < 0.05),但其下降幅度与对照相当(图1)。这说明低N水平减缓淹水下枫杨叶片净光合速率下降的效果没有高、中N水平明显。
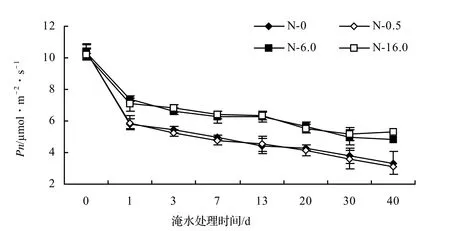
图1 淹水期间不同N浓度对枫杨叶片Pn变化的影响Figure 1 Effect of different N contents on Pn under waterlogging stress
2.2 富氮对淹水下枫杨叶片光合电子传递速率和光化学淬灭系数的影响
如图2,根部渍水时,高、中和低富氮水平下枫杨叶片的ETR较对照的分别增加了43.7%、21.4%和8.5%,除中氮水平和低氮水平、对照间差异不显著(P≥0.05)外,其它差异均显著(P <0.05);冠层半淹时,高氮、中氮和低富水平下枫杨叶片的ETR较对照分别增加了41.1%、21.7%和8.3%,但除中氮水平和低氮水平、对照间差异不显著(P ≥0.05)外,其它差异均显著(P < 0.05);没顶全淹时,高氮、中氮和低氮水平下枫杨叶片的ETR较对照分别增加了39.8%、21.8%和8.2%,除低氮水平和对照间的差异不显著(P≥0.05)外,其它差异均显著(P < 0.05)。

图2 淹水对不同氮素水平下枫杨叶片ETR的影响Figure 2 Effect of different N contents on ETRunder waterlogging stress
不同富氮水平下枫杨叶片的qL较对照低,0.5、6.0和16 mg/kg处理分别比对照平均上升14.9%、22.9%和29.5%(图3);淹水处理对光系统PSⅡ的qP的影响与qL一致,0.5、6.0和16 mg/kg处理分别比对照平均上升14.4%、23.3%和31.0%。不同氮素水平下枫杨叶片qN与不淹水对照相比亦降低,0.5、6.0和16 mg/kg分别较对照平均下降了5.5%、13.5%和20.3%(表2)。

图3 不同氮素水平下对枫杨叶片光合系统Ⅱ两种光化学淬灭系数的影响Figure 3 Effect of different N content on qPand qLunder waterlogging stress

表2 淹水对不同氮素水平下枫杨叶片的qL、qN、Fs/Fo和ΦPSII的影响Table 2 Effect of different N contents on qL, qN, Fs/Fo and ΦPSIIunder waterlogging stress
2.3 淹水对不同氮素水平下枫杨叶片qL、qN、Fs/Fo和qP的影响
光化学淬灭系数(qP或qL)反映了PSII原初电子受体QA的还原状态,Karamer等提出的基于“湖泊”模型的qL,用于替代传统的qP,同样反映了PSII原初电子受体QA的还原状态,它由QA-重新氧化形成,qP愈大,QA-重新氧化形成QA的量愈大,即PSII的电子传递活性愈大。qN反映的是PSII天线色素吸收的光能未用于光合电子传递而以热的形式耗散掉的光能部分,它是植物的一种自我保护机制,对光合机构起一定的保护作用。
类似于最大光化学效率(Fv/Fm)常被用作表明环境胁迫程度的探针[11],Fv/Fm下降可能伴随着Fo的上升或Fm的下降,而除有个别胁迫下Fo降低外[12],胁迫下Fo一般会上升,稳态荧光Fs会下降,同时Fo的变化程度可用来鉴别植物的不同抵抗能力,隆小华等[11]用稳态荧光Fs与初始荧光的差值ΔFo来比较海水处理对不同产地菊芋幼苗叶绿素荧光特性的影响。这里作者认为,不同产地的同种植物,Fo会因为产地不同而产生差异,会影响我们比较不同产地菊芋幼苗叶绿素荧光特性,而用ΔFo这个指标并不能减小这种差异。基于Fs/Fo分数中Fs> Fo,分子Fs变化对分数值的影响大于分母Fo等值,因而作者认为可用稳态荧光和初始荧光的比值Fs/Fo来替代ΔFo,减少因同种试材的产地不同所导致的Fo的差异对由Fs和Fo的组合参数值的影响,来表征植物PSII受环境胁迫伤害的程度,并建议将此叶绿素荧光参数Fs/Fo命名为PSII的稳态活性。
由表2可知各N水平淹水下的枫杨叶片的qL。根部渍水时较对照分别上升了27.2%、16.5%和9.1%,冠层半淹时较对照分别上升了27.0%、23.7%和14.7%,没顶全淹时较对照分别上升了34.8%、29.5%和21.8%;而除根部渍水、冠层半淹时高氮水平与对照,以及没顶全淹时高氮水平、中氮水平与对照的差异显著(P < 0.05)外,其它差异均不显著(P≥0.05)。总体来看,随着淹水深度的增加呈下降趋势,但没顶全淹与根部渍水间的差异除在对照处理差异显著(P < 0.05)外,其它差异均不显著(P≥0.05)。
淹水下不同富氮水平对枫杨叶片qN的影响与qP相反。由表2可知,各N水平淹水下的枫杨叶片qN,根部渍水时较对照分别下降了30.1%、13.7%和7.4%;冠层半淹时较对照分别下降了15.9%、14.5%和7.3%;没顶全淹时较对照分别下降了15.1%、12.2%和1.8%;而除根部渍水时中氮水平与低氮水平间,冠层半淹时中氮水平与高氮水平、低氮水平间,以及没顶全淹时高氮水平与中氮水平、低氮水平与对照间差异不显著(P≥0.05)外,其它差异均显著(P < 0.05)。总体来看,随着淹水深度的增加呈上升趋势,但除没顶全淹与根部渍水间的差异在高氮水平、低氮水平下,没顶全淹与冠层半淹间的差异在低氮水平下,冠层半淹与根部渍水间的差异在高氮水平下差异显著(P < 0.05)外,其它差异均不显著(P≥0.05)。
由表2可知,各N水平淹水下的枫杨叶片的Fs/Fo,根部渍水时较对照分别上升了10.2%、6.4%和5.3%,冠层半淹时较对照分别上升了8.9%、7.9%和6.5%,没顶全淹时较对照分别上升了10.1%、8.8%和6.5%;除根部渍水、冠层半淹和没顶全淹时高氮水平、中氮水平与对照差异显著(P < 0.05)外,其它差异均不显著(P≥0.05)。总体来看,随着淹水深度的增加呈下降趋势,但没顶全淹、冠层半淹和根部渍水间的差异在各氮(16.0、6.0、0.5 mg/kg)水平和对照差异均不显著(P≥0.05)。
3 结论
本试验系统研究了富氮淹水对枫杨叶片光合生理的影响,试验结果表明:
淹水胁迫下枫杨叶片的净光合速率(Pn)均显著下降,但相同淹水深度下较高富氮水平(16.0 mg/kg,6.0 mg/kg)净光合速率的下降幅度较低富氮水平和对照的明显减小。
相同淹水深度下,枫杨叶片PSⅡ的ETR、光化学淬灭系数(qP或qL)和Fs/Fo随富氮水平的增加均有所升高,而qN则相反。
4 讨论
植物的光合作用对淹水胁迫十分敏感。本试验中枫杨叶片净光合速率在淹水过程中出现明显下降,这是木本植物对淹水的正常生理反应,与乌桕[13]的研究结果基本一致。淹水初期光合作用下降的原因主要是气孔关闭,CO2扩散的气孔阻力增加[14],随着淹水时间的延长,光合羧化酶活性逐渐降低[15],叶绿素含量下降,叶片早衰和脱落。土壤淹水不仅降低净光合速率,光合产物的运输也有所下降[16]。而氮是植物合成蛋白质、核酸及各种生理活性物质的重要成分,施氮能增加叶片叶绿素含量、光合酶活性和抗氧化能力[17]。本试验是研究滩地季节性淹水对枫杨的淹水胁迫影响,在滩地淹水过程中必然带来大量的氮,使得滩地上的植物实际处于季节性的富氮淹水中。所以本试验在模拟枫杨淹水胁迫的基础上,设计了高、中、低3个氮水平和对照,结果显示,淹水1 ~ 40 d,高、中氮水平的净光合速率的降幅明显小于低氮水平和对照。这说明富氮可能通过延缓枫杨叶片羧化酶的降低来减缓其净光合速率的下降。
叶绿素荧光作为植物体内发出的天然探针,可用于评价光合机构的功能和环境胁迫对其的影响。在本试验中,枫杨叶片的Fv/Fm在淹水胁迫下出现下降,这与卢雪琴等[18]的研究结果基本相符。另外,本研究发现淹水处理枫杨20 ~ 40 d,较高氮水平(16.0 mg/kg,6.0 mg/kg)枫杨叶片Fv/Fm的下降幅度明显小于低氮水平和对照;相同淹水深度下qP随富氮水平的增加而升高,说明富氮处理能减缓淹水下qP的下降趋势。这与王闯等[19]的研究结果基本一致。而本研究关于qN随富氮水平的变化趋势与王闯等[19]相反,可能是由于甜樱桃的光合生理特性与枫杨不同有关。笔者认为,较高富氮水平在淹水一段时间后可缓解PSⅡ反应中心光能转化效率的下降,将更多的光能用于推动光合电子传递,从而提高光合电子传递能力(这在图2 ETR随富氮水平的增加而上升中有所印证),同时减少光能以热的形式耗散。
叶绿素荧光也可反映许多植物发育和营养状况。张旺锋等[20]研究发现,富氮对植物叶片叶绿素荧光具有明显的影响,适度增施氮肥可改善植物叶片叶绿素荧光参数中的PSII潜在活性(Fv/Fo)、提高Fv/Fm和qP,降低qN,使叶片所吸收的光能较充分地用于光合作用,增加PSⅡ天线色素对光能的捕获量及捕获效率,积累更多的同化物,利于植株的生长发育、干物质积累并改善作物性状和提高产量。
因此,在生产实践中,深入研究氮素营养对枫杨叶片叶绿素荧光参数的影响特征,探求叶绿素荧光参数变化作为检测枫杨生育期间氮素营养丰缺状况的指标,为今后滩地枫杨林的科学经营提供参考,将具有重要的理论指导意义。
同时,Huang等[4]研究发现水稻在缺氮情况下会对其叶片的叶绿素荧光特性造成影响,从而引起生物学产量的降低,这时通过及时的补救措施将会减少损失。那么,如何利用氮素水平和荧光动力学变化的关系,逐步建立荧光技术诊断指标,将叶绿素荧光分析技术应用于植物的氮素营养状况的诊断,有待进一步的研究。最后,笔者认为科学经营滩地枫杨林,需结合枫杨林栽培区季节性淹水的一般规律,因地制宜地充分利用水淹带来的水、氮,以期最大化滩地的经济、生态价值。
[1] 马经安,李红清. 浅谈国内外江河湖库水体富营养化状况[J]. 长江流域资源与环境,2002,11(6):575-578.
[2] 吴月燕,吴秋峰,曾华军. 富营养化水体中水生植物的生态和生理生化效应[J]. 浙江大学学报(农业与生命科学版),2009,35(3):337-344.
[3] Fang Y Y, Babourina O, Rengel Z, et al. Ammonium and Nitrate Uptake by the Floating Plant Landoltia punctata[J]. Ann Bot, 2007,(99):365-370.
[4] Huang Z A, Jiang D A, Yang Y. Effect of nitrogen deficiency on gas exchange,chlorophyⅡfluorescence and antioxidant enzymes in leaves of rice plant[J]. Photosynthetica, 2004, 42(3):357-364.
[5] Lu C M, Zhang J H. Modification of photosystemⅡ photochemistry in nitrogen deficient mazie and wheat plants[J]. Plant Physiol, 2001, 158 (11):1 423-1 430.
[6] Sepheri A, Sam M S. Water and nitrogen stress on maize photosynthesis[J]. J Biol Sci,2003,3(6):578-584.
[7] 郭卫东,桑丹,郑建树,等. 缺氮对佛手气体交换、叶绿素荧光及叶绿体超微结构的影响[J]. 浙江大学学报,2009,35(3):307-314.
[8] 徐凯. 草莓的光抑制特征及光质对其结果的影响[D]. 杭州:浙江大学,2005.
[9] 孙启祥. 竹子光抑制特征研究[D]. 北京:中国林业科学研究院,2004.
[10] 李纪元,饶龙兵,潘德寿,等. 人工淹水胁迫下枫杨种源MDA含量的地理变异[J]. 浙江林业科技,1999,19(4):22-27.
[11] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.
[12] 隆小华,刘兆普,蒋云芳,等. 海水处理对不同产地菊芋幼苗光合作用及叶绿素荧光特性的影响[J]. 植物生态学报,2006,30(5):827-834.
[13] 曹福亮,蔡金峰,汪贵斌,等. 淹水胁迫对乌桕生长及光合作用的影响[J]. 林业科学,2010,46(10):57-61.
[14] Mckevlin M R, Hook D D, Rozelle A A. Adaption of plants to flooding and soil waterlogging[A]. Messina M G, Conner W H. Southern forested wetlands:Ecology and Management[M]. Michigan: Lewis publishers, 1998. 173-204.
[15] 魏凤珍,李金才,董琦. 孕穗期至抽穗期湿害对耐湿性不同品种冬小麦光合特性的影响[J]. 植物生理学通讯,2000,36:1695-1699. [16] 吕军. 渍水对冬小麦生长的危害及其生理效应[J]. 植物生理学通讯,1994,20:221.
[17] 李合生. 植物生物化学实验理论与技术[M]. 北京:高等教育出版社,2000. 220-223.
[18] 卢雪琴,夏汉平,彭长连. 淹水对5种禾本科植物光合特性的影响[J]. 福建林学院院报,2004,24(4):367-368.
[19] 王闯,李中勇,刘敏,等. 不同浓度的硝酸盐对淹水条件下甜樱桃叶绿素荧光的影响[J]. 中国农学通报,2009,25(19):142-146.
[20] 张旺锋,勾玲,王振林,等. 氮肥对新疆高产棉花叶片叶绿素荧光动力学参数的影响[J]. 中国农业科学,2003,36(8):893-898.
Photosynthetic Physiological Response of Pterocarya stenoptera Leaves to Different Waterlogging Stress with Different Nitrogen Content
SU Shou-xiang1,3,XU Kai2,SUN Qi-xiang3,PENG Zhen-hua3,FANG Jian-min4
(1. International Center for Bamboo and Rattan, Beijing 100102, China; 2. School of Agriculture and Food Sciences, Zhejiang A & F University, Lin’an 311300, China; 3. Chinese Academy of Forestry, Beijing 100091, China; 4. Anhui Forestry Academy, Hefei 230031, China)
Experiments were made on Pterocarya stenoptera under fully flooded, canopy semi-submerged and roots waterlogging with different nitrogen contents (16 mg/kg, 6 mg/kg, 0.5 mg/kg,0 mg/kg). The results showed that net photosynthetic rate(Pn)in leaves of P. stenoptera decreased significantly under any flooding treatment, and that decreased much lower with high and medium nitrogen content (16mg/kg, 6mg/kg)than with low content (0.5mg/kg) and control. (0 mg/kg). Under flooding stress, non-photo chemical quenching coefficient(qN) decreased with the increase of nitrogen content, while photo chemical quenching coefficient (qP) was the opposite. The experiment demonstrated that higher nitrogen content could decrease the damage of waterlogging to photosynthesis in leaves of P. stenoptera.
Pterocarya stenoptera; waterlogging; nitrogen; photosynthesis
S718.5
A
1001-3776(2012)03-0009-06
2012-02-11;
2012-04-18
“十二五”国家科技支撑项目“林业血防生态安全技术体系构建技术研究与示范”(No. 2011BAD38B07)资助。
苏守香(1980-),男,安徽六安人,博士研究生,从事逆境植物生理生态研究;*通讯作者。
——一种分层模拟的方法

