神经肽Y和5-羟色胺在腹泻型肠易激综合征模型大鼠中表达的研究
唐洪梅,房财富,廖小红,李得堂,姚 楠,何嘉仑
(1.广州中医药大学第一附属医院药学部,2.广州中医药大学,广东 广州510405;3.广东省中医研究所 广东广州 510095)
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹痛或腹部不适伴排便习惯改变为特征的功能性肠病,腹泻型肠易激综合征(D-IBS)患者以腹痛腹泻为主,同时多伴有头昏、心烦、失眠、焦虑、抑郁等植物神经功能失调的症状,发病易受精神等因素影响,关于D-IBS的病因和发病机制目前尚不明确。近年来随着神经胃肠病学和分子生物学研究的发展,人们认为D-IBS的发病与慢性心理应激引起的脑肠轴功能紊乱密切相关,D-IBS患者易出现脑肠互动失调或环节障碍[1]。脑肠轴异常可能是导致D-IBS患者对各种应激的运动反应增强和内脏敏感性增加的主要因素,是D-IBS病理生理机制的共同通路。脑肠轴的变化和影响在D-IBS的发病中起重要作用,而脑肠肽作为一类具有神经递质和激素双重功能的小分子多肽,在调节内脏感觉、分泌和运动中起重要作用。这些神经递质主要有五羟色胺(5-hydroxy tryptamine,5-HT)、P物质、降钙素基因相关肽、神经肽Y(neuropeptide Y,NPY)等。这些神经递质和D-IBS有着密切的联系。本课题组前期的实验已经对P物质和降钙素基因相关肽开展研究,研究结果表明模型组结肠黏膜降钙素基因相关肽和P物质的表达分别较正常组及给药组高[2]。NPY广泛分布于哺乳动物的中枢神经系统、周围神经系统以及许多器官中,而且含量丰富。NPY在情感及应激行为发生的机制中均发挥重要功能。作为一种重要的神经递质,NPY在D-IBS的病理机制中如何发挥传递作用尚未见报道。本文通过免疫组化法检测D-IBS模型大鼠结肠组织5-HT的表达,采用荧光定量RT-PCR技术检测模型大鼠下丘脑和结肠组织NPY mRNA的表达,同时旨在通过脑肠肽和神经递质的研究为D-IBS的脑肠轴异常调控机制提供一定的依据。
1 材料与方法
1.1实验动物SPF级SD大鼠乳鼠2窝,出生2 d。购自广东省医学实验中心,实验动物中心动物合格证号:0088139。
1.2实验试剂和仪器TRIzol Reagent(美国 Invitrogen公司),Bio-Rad iQTM5 Multicolor Real-time PCR(美国 Bio-Rad公司),Bio-Rad SmartSpecTMPlus Spectrophotometer(美国 Bio-Rad公司),AlphaImager HP凝胶成像系统(美国ProteinSimple公司),DNase I(美国Fermentas公司),RevertAidTMFirst Strand cDNA Synthesis Kit(美国 Fermentas公司),MaximaTMSYBR Green/Fluorescein qPCR Master Mix(美国 Fermentas公司)。
1.3模型的制备将新生大鼠分为正常组和模型组。出生2 d后的大鼠乳鼠,模型组从乳鼠出生后2~14 d每天与母鼠分隔开180 min,在d 15~27的两周内,模型组将石蜡油润滑后的输液导管经肛门插入 2 cm,注入 0.087 mol·L-1的醋酸 0.5 ml[3],每天给予直肠内醋酸刺激1次,在醋酸刺激之后,立即用纸袋束缚大鼠的前后肢。限制前上肢搔抓头面部,但不限制其活动,束缚时间1 h。正常组给予直肠注入0.5 ml生理盐水。d 29在冰块上迅速取下大鼠的下丘脑和结肠组织,用液氮冷冻后置于-80℃冰箱保存。
1.4免疫组化法检测大鼠下丘脑和结肠组织5-HT石蜡切片常规脱蜡至水,3%H2O2室温20 min以灭活内源性过氧化物酶。蒸馏水洗涤3次。0.01mol·L-1枸橼酸盐缓冲溶液抗原热修复。PBS洗涤2次。滴加5%BSA封闭液,室温20 min。甩去多余液体,滴加1∶100稀释的一抗(羊抗多克隆抗体,大鼠),4℃过夜。PBS洗2 min×3次。滴加生物素化山羊抗大鼠IgG,37℃ 20 min。PBS洗2 min×3次。滴加试剂SABC,37℃ 30 min。PBS洗5 min×4次。DAB显色剂室温显色,镜下控制反应时间,苏木精轻度复染,脱水,透明,封片,400倍显微镜观察。
1.5实时荧光定量RT-PCR检测NPY mRNA表达
1.5.1总RNA提取和cDNA合成取冻存组织,经过液氮研磨后按每100 mg加入1 ml TRIzol试剂,总RNA的提取按TRIzol试剂说明书进行。提取的总RNA用DNaseⅠ处理,以去除DNA污染。用1%的琼脂糖凝胶电泳检测总RNA的完整性。用紫外分光光度计检测总RNA的纯度和含量。按照反转录试剂盒要求,用Oligo(dT)18合成cDNA,在-20℃ 保存备用。
1.5.2引物设计与合成查 NCBI GenBank里的基因序列,用Primer premier 5.0软件进行引物设计,设计的引物由上海英潍捷基贸易有限公司合成。
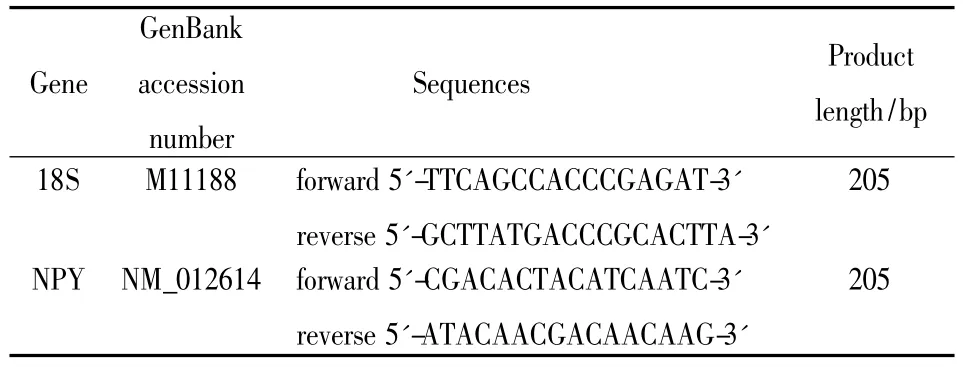
Tab 1 Primer sequences used for NPY mRNA detection with real time RT-PCR
1.6荧光定量PCR扩增效率检测进行相对基因表达分析普遍采用 Livak(2-△△Ct)法,条件是目标基因和参照基因扩增效率都接近100% ,且相互间效率偏差在5%以内。使用Livak法之前,必须验证目标基因和参照基因的扩增效率,制备荧光定量PCR标准曲线。稀释样品cDNA成5个梯度(105、104、103、102、10),分别进行靶基因 NPY 及内参基因18S的PCR反应,制备两基因的标准曲线并检测扩增效率。
1.7实时荧光定量PCR每个样品均进行 NPY基因和内参18S基因的荧光定量 PCR,每个样品均设两个平行管。总反应体积 25 μl,反应体系为:12.5 μl SYBR Green/Fluorescein qPCR Master Mix,上下游引物各 1 μl,1 μl cDNA,9.5 μl ddH2O。反应条件:94℃ 5 min;94℃ 30 s,55℃ 40 s,72℃ 50 s,共40个循环;最后 72℃ 7 min结束反应。PCR扩增结束后,从55℃至94℃ 每隔10 s上升0.5℃,并收集一次荧光信号获得熔解曲线,以确定扩增产物的特异性。最终结果根据样品 Ct值,按照 Livak(2-△△Ct)方法计算。
1.8统计学分析结果用±s表示,用SPSS 15.0统计学软件对所得数据进行t检验。
2 结果
2.1HE染色和免疫组化法在大鼠的下丘脑组织HE染色中,模型组无病理改变(Fig 1)。在大鼠的结肠组织中,在400倍光镜下连续观察肠腺腔200个细胞,均可见5-HT免疫染色阳性细胞,此类细胞多分布在肠腺腔基底部,以肠腺隐窝部位较多。模型组免疫组化染色阳性细胞体积较大,大多为锥形或圆形,染色强度较强;正常组免疫组化染色阳性细胞体积较小,多为圆形,染色强度较弱(Fig 2)。与正常组比较,模型组5-HT阳性细胞数增多,免疫组化染色强度增强(均P<0.01)。
Fig 1 Hypothalamus tissue of model group(A)and control group(B)(HE×200)
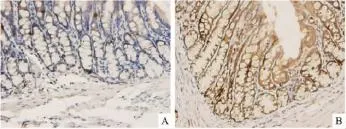
Fig 2 Protein distribution of 5-HT in IBS-D rats colon tissue by immunohistochemistry(×400)
2.2实时荧光定量PCR扩增曲线及基因扩增效率从Fig 3中可以计算得出NPY和18S的扩增效率分别为98%和95%。

Fig 3 Quantitative real-time PCR standard curve of NPY(A)and 18S(B)standard templates
2.3PCR产物分析NPY和18S基因PCR产物经琼脂糖凝胶电泳证实PCR产物为单一目的条带。扩增产物大小分别为280 bp及205 bp(Fig 4)。
熔解曲线分析显示NPY和18S的基因PCR产物的熔解曲线峰值分别为81.5℃及86℃,熔解温度均一,为单一锐利主峰,说明无引物二聚体及非特异性扩增(Fig 5)。
2.4NPY mRNA在下丘脑和结肠组织中的相对表达量分析为了校正标本之间RNA的质量和反转录效率的差异,将每一标本检测所得NPY基因的拷贝数均和相对应的18S基因的拷贝数相比来进行标准化。结果表明,在下丘脑组织中,与正常组相比,模型组NPY基因表达明显下降,差异具有统计学意义(P<0.05),模型组可将NPY mRNA表达下调约1.66倍(Fig 6);在结肠组织中,与正常组相比,模型组NPY基因表达明显下降,差异具有统计学意义(P<0.05),模型组可将NPY mRNA表达下调约1.20倍(Fig 7)。
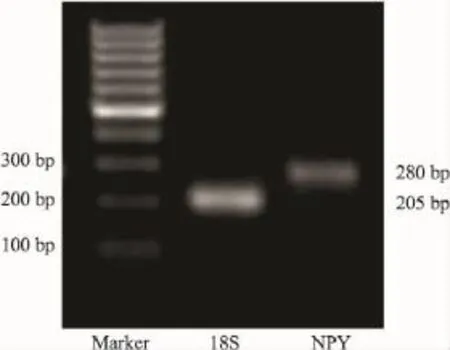
Fig 4 Agarose gel electrophoresis results
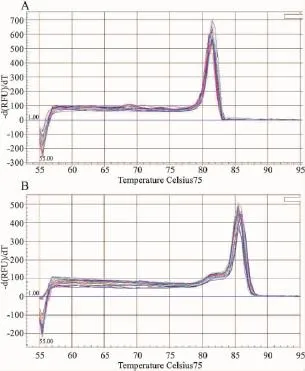
Fig 5 Dissociation curve of NPY and 18S
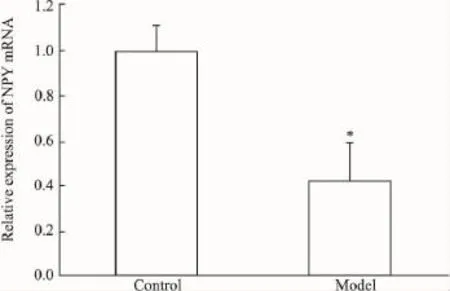
Fig 6 Relative expression of NPY mRNA in hypothalamus tissues
3 讨论
现代医学研究认为,IBS的发病与慢性心理应激引起的脑肠轴功能紊乱密切相关。脑肠轴是将认知和情感中枢与神经内分泌、肠神经系统、免疫系统相联系的双向交通通路,在人的肠肌间神经丛内存在着神经系统,它分泌的神经递质同时存在于大脑皮层-神经系统内。这些神经递质不但存在于ENS,也存在于CNS,在调节内脏感觉、分泌和运动中起重要作用。国外研究学者研究表明,脑内许多区域和核团均参与了胃肠道运动的调节,但主要集中在边缘系统。包括围绕中脑室周围的结构——下丘脑、穹窿、杏仁及扣带回[4]。IBS患者与健康人群的性格存在较大差异,患者焦虑、抑郁、神经质和负性生活事件评分明显高于健康人群。美国一项大规模社区人群调查表明[5],抑郁状态等心理因素易导致IBS患者产生腹痛感觉,并且抑郁的程度与直肠痛觉阈值呈反比关系。
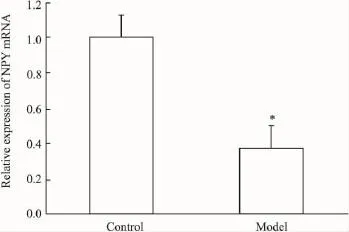
Fig 7 Relative expression of NPY mRNA in colon tissues
NPY广泛分布于中枢神经系统和肠道交感神经丛中。研究认为[6],NPY通过G蛋白结合受体(NPY-Rs)与配体结合而发挥其作用。肠神经丛中的NPY可与肠黏膜下神经节中周围性胆碱乙酰转移酶(pChAT)相结合而发挥其效能,或在中枢通过作用于海马和下丘脑而发挥其拮抗应激、稳定情绪的作用。
本研究表明,与对照组相比,模型组大鼠下丘脑和结肠组织 NPY mRNA的表达明显下调,表明DIBS的腹痛和焦虑情绪与NPY表达下调有一定的关联性。关于腹痛的调节机制,NPY及其受体在中枢神经系统的痛觉调制中起重要作用,其作用机制或直接通过Y1受体,或间接通过阿片受体。抑制性神经递质NPY主要通过Y1受体抑制脊髓背角SP、CGRP和其它致痛性神经递质的释放起镇痛作用。关于焦虑情绪的调节机制,NPY是人类及哺乳动物体内分布最为广泛及含量最为丰富的肽类物质。主要分布于与情感调节有关的脑区(如下丘脑、杏仁核、海马、蓝斑、伏核等)及交感神经末梢,参与情感行为的调节及应激反应[7]。研究证实这些效应主要是通过 NPY-Y1受体介导的[8]。
5-HT是一种广泛存在于神经系统和胃肠道的神经递质,参与了心理和神经功能的调节。5-HT的生理作用包括激活肠道分泌功能、对传入神经元的激活及直接对平滑肌的作用,从而参与了胃肠运动、感觉、分泌等过程。研究证实5-HT与D-IBS的病有一定的关系,在D-IBS患者中,患者血浆及结肠黏膜中的5-HT均明显升高。Drossman[9]认为 D-IBS患者肠道EC细胞分泌的5-HT通过脑肠轴,参与胃肠道动力和内脏感觉的调控。整个调节过程复杂,可能在脑肠轴的不同传导水平有异常。当外周组织损伤或炎症时,损伤或者炎症部位的血小板和肥大细胞都可以释放5-HT,活化初级传入感应器,并提高伤害性感应器的敏感性,从而引起伤害性反应和痛觉过敏[10]。生理性刺激(进餐、扩张)及病理性刺激(缺血、应激)促使5-HT释放,导致内脏传入神经及肠神经系统高敏感而激活多种神经活性物质,使参与脑-肠调节的化学信号异常。本实验表明,模型组5-HT明显升高,5-HT的异常升高会导致肠道动力异常和内脏感觉过敏,也是引起腹泻的重要物质,提示5-HT和D-IBS患病关系密切。
由于D-IBS的病理机制还尚且不明确,基于以上实验结果,脑肠轴异常机制在D-IBS的发病机制中起着重要的作用,D-IBS与NPY的表达下调和5-HT的升高有密切的关系,脑肠轴异常机制的研究为明确D-IBS的机制提供了重要的参考依据,但DIBS具体调节机制还有待进一步研究。
[1]Mathew P,Bhatia S J.Pathogenesis and management of irritable bowel syndrome[J].Trop Gastroenterol,2009,30(1):19.
[2]唐洪梅,丘振文,李得堂,等.肠激安方干预腹泻型IBS模型大鼠 SP、CGRP 的机制研究[J].今日药学,2008,18(5):1-4.
[2]Tang H M,Qiu Z W,Li D T,et al.Mechanism research of chang jian fang intervention on SP and CGRP in model rats of diarrhea-irritable bowel syndrome[J].Pharm Today,2008,18(5):1 -4.
[3]唐洪梅.李得堂.黄樱华,等.腹泻型肠易激综合征大鼠模型的建立及敏感性评估的实验研究[J].中国药理学通报,2009,25(5):693-4.
[3]Tang H M,Li D T,Huang Y H,et al.Establishment of the diarrhepredominant IBS SD rat model and appraisal of its sensitivity[J].Chin Pharmacol Bull,2009,25(5):693 -4.
[4]Yuan Y Z,Tao R J,Xu B,et al.Functional brain imaging in irritable bowel syndrome with rectal balloon-distention by using fMRI[J].World J Gastronterol,2003,9:1356.
[5]Choung R S,Locke G R,Zinsmeister A R,et al.Psychosocial distress and somatic symptoms in community subjects with irritable bowel syndrome:a psychological component is the rule[J].Am J Gastroenterol,2009,104:1772 -9.
[6]MA G P.Hormonal control of the neuropeptide Y system[J].Curr Protein Pept Sci,2003,4:45 -57.
[7]Morales-Medina J C,Dumont Y,Quirion R.A possible role of neuropeptide Y in depression and stress[J].Brain Res,2010,13(14):194-205.
[8]Luo D D,An S C,Zhang X.Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Brain Res Bull,2008,77(1):8 - 12.
[9]Drossman D A.The function gastrointestinal disorders and the RomeⅡ Proeess[J].Gut,1999,45(suppl 2):111 -5.
[10]吴饶平,熊 伟,高 云.三叉神经痛的分子发病机制的研究进展[J].中国药理学通报,2011,27(11):1487 -8.
[10]Wu R P,Xiong W,Gao Y.Progress on molecular pathogenesis of trigeminal neuralgia[J].Chin Pharmacol Bull,2011,27(11):1487-8.

