调节性B细胞在炎症免疫相关疾病的调控作用及机制
张玲玲,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药理学教育部重点实验室,抗炎免疫药物安徽省工程技术研究中心,安徽合肥 230032)
近年来,随着对炎症免疫相关疾病病理机制认识的不断深入,负性调节性免疫细胞在炎症免疫相关疾病中的调控作用越来越受到重视,如早期发现的调节性T细胞(regulatory T cell,Treg)和耐受性树突细胞(tolerogenic dendritic cells,TDC)。这些负性调节性免疫细胞在自身免疫病中控制炎症应答、抑制效应T细胞功能、降低炎症细胞因子产生等方面发挥重要作用[1-3]。1974年B细胞抑制免疫应答被首次报道,豚鼠脾脏B细胞被发现可减弱迟发型超敏反应(delayed type hypersensitivity,DTH)[4]。提示机体也存在一个特殊功能的B细胞亚群,即调节性B细胞(regulatory B cell,Breg),直到近年来对Breg的研究才得以迅速发展。本文将对调节性免疫细胞概念的界定、Breg近年来在炎症免疫相关疾病中调控作用及机制研究作一综述。
1 调节性免疫细胞存在广义和狭义两种概念
调节性免疫细胞广义上是指机体免疫系统存在的正性调节性免疫细胞和负性调节性免疫细胞。正性调节性免疫细胞上调机体免疫应答,如反应性B细胞通过呈递抗原参与CD4+T细胞扩增、记忆形成和细胞因子产生,特异表达共刺激分子,活化T细胞等上调机体免疫应答。具有免疫原性成熟树突细胞(dendritic cells,DCs)能够激活初始T淋巴细胞,启动、调控和维持免疫应答。狭义上,调节性免疫细胞是指具有负性调节作用的免疫细胞。该负性调节细胞参与了机体免疫应答下调,不仅在调节免疫应答和维持免疫系统稳态平衡起到关键作用,在自身免疫、肿瘤免疫、神经免疫和器官移植等中也发挥重要作用。如Treg通过产生抑制性细胞因子、抑制效应T细胞功能、降低炎症细胞因子产生等机制控制自身免疫病炎症应答[2]。调节性树突细胞(regulatory dendritic cell,DCreg)又称TDC,在维持免疫中枢和外周耐受中有重要作用。DCreg低表达或不表达共刺激分子,但表达吲哚胺 2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)和抑制性免疫球蛋白样转录物(inhibitory immunoglobulinlike transcript,ILT),能促进CD4+CD25-T细胞分化为产生IL-10的Tregs,抑制自身反应性 T细胞的增殖[5-6]。DCreg通过分泌IL-10和TGF-β,消除抗原呈递细胞(antigen-presenting cells,APC)抗原提呈功能,下调共刺激分子表达,抑制抗原特异性T细胞活化,从而诱导免疫耐受[7]。狭义上的Breg同样通过产生抑制性细胞因子IL-10和TGF-β等机制参与调节免疫应答和介导免疫耐受。
2 Breg在控制炎症免疫相关疾病免疫应答、介导免疫耐受中可能发挥重要作用
2.1IL-10和TGF-β是Breg发挥负性调节功能的重要细胞因子Breg是抑制性细胞因子IL-10和TGF-β来源的重要细胞[8],在调节免疫应答、介导免疫耐受中可能发挥重要作用[9]。多种B细胞亚群都具有Breg功能或产生IL-10的能力,包括CD5+B-1a、CD21+/CD23-边缘区 B细胞或 IL-10 CD1d+/CD21+/CD23+T2-边缘区前 B 细胞[10]。Breg在不同种属可能存在不同表型,不同小鼠模型Breg也呈现不同的特征性表面标志分子。CD19+CD25+B细胞是第1个被发现有调节功能的Breg,不仅表达高水平共刺激分子,且分泌高水平 IL-10。小鼠脾脏 CD19+IL-10+CD1dhiCD5+CD21hiCD23+IgD+IgMhiB细胞被定义为Breg,此表型的Breg能够通过诱导Foxp3+Treg扩增,预防和逆转呼吸道过敏。CD25hiCD27hiCD86hiCD1dhiIL-10hiTGF-βhiB细胞被定义为人Breg,此表型的Breg能够剂量依赖性降低CD4+T细胞增殖,通过细胞间接触和分泌TGF-β提高Treg细胞表达Foxp3和CTLA-4[11]。
IL-10是Breg发挥调节功能所必需的,从IL-10敲除小鼠分离的B细胞则失去其保护功能。从关节炎小鼠脾细胞分离的B细胞体外用anti-IL-10/anti-IL-10R处理后,失去了阻止受体小鼠关节炎发展的作用[12]。在正常和自身免疫小鼠脾脏中,具有产生IL-10能力的CD1dhiCD5+CD19hiBreg,又称为B10细胞,占成年小鼠脾脏 B细胞的1% ~3%。LPS、佛波醇-12-肉豆蔻酯-13-乙酯(phorbol 12-myristate 13-acetate,PMA)加上离子霉素(ionomycin)体外刺激5h可诱导B10表达IL-10。B10调节免疫应答多个细胞,通过IL-10,B10负性调节T细胞、巨噬细胞和DC活化,从而影响细胞免疫和体液免疫[13](图1)。
2.2Breg负性调控炎症免疫相关疾病的病理过程Breg的负性调控作用在一些炎症免疫相关疾病小鼠模型中被证明,包括胶原性关节炎(collagen-induced arthritis,CIA)、实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)和系统性红斑狼疮(systemic lupus erythematosus,SLE)等。缺乏或丢失Breg,自身免疫病动物模型的症状加重[14]。人外周血Breg体外刺激5h后,可表达IL-10,并负性调节单核细胞因子产生[15]。在多发性硬化症等自身免疫病中,Breg细胞比健康对照明显减少,在病情恶化时,幼稚/记忆Breg比例降低[16]。内源或获得转移的B10直接可影响EAE病理过程。髓磷脂少突细胞糖蛋白敏感的B10过继转移到野生小鼠体内,可明显降低EAE的发生,但不能阻止EAE的进程。B10在抑制异常T细胞应答中起到重要作用。体外分析,B10并不调节Treg增殖,但明显改变CD4+T细胞IFN-γ和TNF-α的产生,且B10细胞下调DC细胞功能,而间接调节T细胞增殖[17]。在疾病进展期,中枢神经系统Treg数量明显扩增,与晚期病程的负性调节平行,消除Treg可增强晚期病程。在疾病启动阶段预先消除B10可增强EAE病理过程,提示B细胞优先控制疾病的启动,而Tregs主要是协同抑制疾病晚期阶段[18]。
3 TLRs信号转导在介导Breg负性调控中具有关键作用
3.1TLR信号转导是连接天然免疫和适应性免疫的关键环节Toll样受体(Toll-like receptors,TLRs)主要表达在B细胞、DCs和巨噬细胞等APC上,是天然免疫细胞识别病原体的一类重要的模式识别受体(Pattern recognition receptor,PRR)。目前已在哺乳类动物细胞发现了14个家族成员,每种TLRs在细胞结构中的分布也与它所识别的病原体相关分子模式(Pathogen associated molecular pattern,PAMP)相关联。如TLR1、TLR2、TLR4、TLR5和TLR6通常表达在细胞表面,能识别暴露于细菌表面或是隐蔽于内环境中的肽聚糖、脂多糖、鞭毛蛋白等分子;而 TLR3、TLR7、TLR9等与抗病毒相关的TLRs则位于核内,识别病毒和细菌DNA[19-20]。
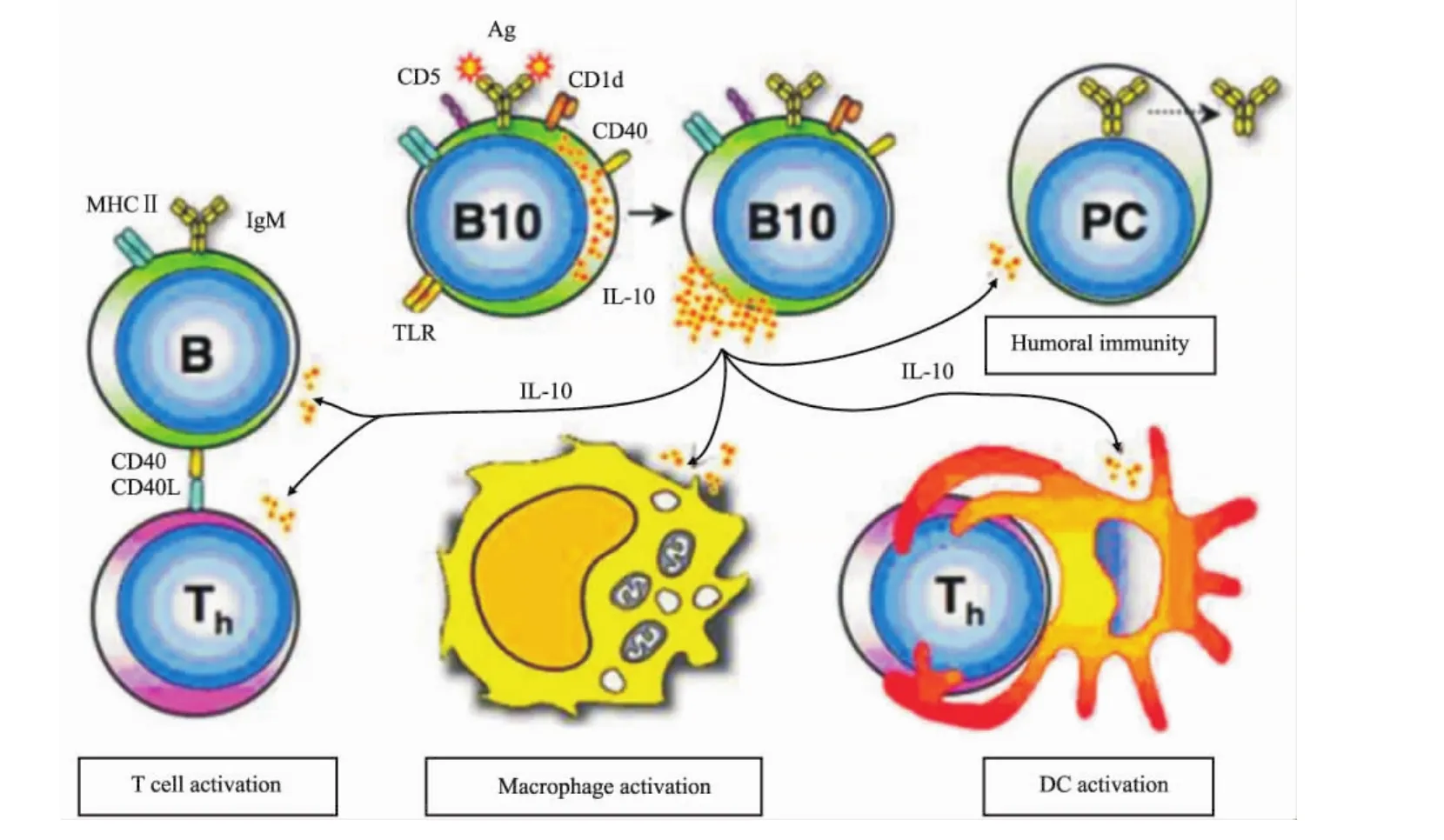
Fig 1 B10 negatively regulates T cell,macrophage and DC activation through secreting IL-10〔From Ann N Y Acad Sci,2010,1183(1):38-57〕
TLRs通过对PAMP进行识别,促进抗炎细胞因子释放,并通过APC最终诱导T细胞的适应性免疫发生,是连接天然免疫和适应性免疫的关键环节。TLRs靶向活化两条信号通路:一个是导致促炎症细胞因子产生的髓样分化抗原88(myeloid differentiation antigen 88,MyD88)依赖路径;一个是与诱导IFN-I基因、上调DC表达MHC II和共刺激分子相关的MyD88非依赖路径。MyD88是一个编辑蛋白,包含与TLRs同源结构域结合的羧基末端和死亡结构域(death domain)氨基末端两个结构域。MyD88死亡结构域与IL-1受体相关激酶(IL-1R-associated kinase,IRAK)的死亡结构域相互作用引起IRAK的磷酸化。磷酸化的IRAK与肿瘤坏死因子受体相关因子6(TNF-α receptor association factor-6,TRAF6)形成复合物,进一步激活TGF-β活化激酶1(TGF-β activated kinase 1,TAK-1),TAK-1 在活化 NF-κB 路径和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应中起到关键作用[21]。TLRs通过上述信号转导通路调节着B细胞抗原呈递、抗体应答、类别转换和记忆应答[22]。随着T细胞依赖的免疫应答触发,TLR与BCR联姻协同为固有免疫和适应性免疫提供了一个桥梁作用。
3.2TLR/MyD88信号转导通路在炎症免疫相关疾病炎症发生发展中发挥重要作用TLR/MyD88信号转导通路在炎症免疫相关疾病炎症发生发展中发挥重要作用。TLR激动剂刺激天然免疫和适应性免疫,结果打破了免疫耐受,而诱导炎症免疫相关疾病,如 RA、SLE、EAE和糖尿病等[23]。TLR信号参与了RA的发病过程。RA滑膜组织高表达TLRs,通过TLR配体激活滑膜成纤维细胞,并趋化吸引免疫细胞。TLR4被认为是促进关节炎症的一个突出的固有免疫受体。TLR4缺陷小鼠比较野生型小鼠CIA发病率低,关节炎的严重度轻,软骨破坏减轻,炎症细胞浸润减少[24]。MyD88是参与狼疮倾向小鼠自发SLE所必需的TLR信号分子,MYD88-依赖的信号转导参与SLE自身抗体产生有两个不同机制,第一,通过BCR和TLR二者共同活化介导细胞固有信号直接诱导自身抗体产生;第二,TLR和免疫复合物介导活化浆树突细胞的间接作用。这些细胞活化产生高水平I型 IFN,参与 SLE的病理过程[25]。
3.3TLRs/MyD88信号转导通路在介导Breg功能中起到关键作用BCR配体和或固有TLR刺激对B10细胞的活性具有关键调节作用,通过MyD88信号转导依赖路径促进B10细胞发育、分化和克隆扩增,诱导IL-10分泌。体外TLR9刺激小鼠脾细胞,可产生高水平IL-10。在小鼠脾脏边缘区和边缘区前B细胞中,TLR4或TLR9可触发IL-10的产生。TLR4配体LPS诱导CD1dhiCD5+B细胞表达浆IL-10和克隆扩增[26]。
3.3.1某些TLR激动剂优先触发了Breg细胞的抑制功能有些TLR对B细胞识别自身免疫病是需要的,而对疾病的启动不是必需,提示TLR激动剂的类别优先触发了Breg细胞的抑制功能,而限制了炎症免疫相关疾病发生。Breg细胞识别的微生物产物通过TLR抑制T细胞介导的自身免疫疾病。体外,灭活的结核分枝杆菌刺激B细胞,可通过TLR-2/4-和MyD88-依赖方式产生IL-10。这样Breg细胞中TLR/MyD88信号转导拮抗其他细胞中促进Th17分化、诱导自身免疫病所需要的MyD88信号转导。微生物产物通过TLR和MyD88活化诱导Breg细胞产生IL-10。体内,MyD88对B10细胞的发育和扩增并非必需,但对LPS刺激的产生和分泌一定量的IL-10是必需的,LPS刺激48h后,MyD88-/-B细胞中IL-10表达明显低于野生型B细胞中的IL-10表达[27]。
3.3.2TLRs/MyD88活化的Breg细胞通过产生的IL-10可抑制T细胞活化及IFN-γ分泌B细胞分别用LPS或CpG寡核苷酸刺激后,可活化TLR-4或TLR-9,提供MyD88依赖的信号,并产生IL-10。而同样的刺激条件下,DC和巨噬细胞不能产生IL-10。TLR刺激后,DC和B细胞对T细胞应答具有相反作用。LPS或CpG活化的B细胞培养上清抑制CD4+T细胞增殖反应,抑制程度与LPS或CpG活化的B细胞数量和活化时间成比例。而LPS活化的DC上清可上调T细胞增殖反应,可见TLRs/MyD88介导的信号是细胞特异性的,DC促进T细胞活化,而B细胞通过提供一个富含IL-10的周围环境而抑制 T细胞增殖和分化[26,28]。B细胞MyD88-/-小鼠显示强烈的自身反应T细胞增殖应答,并产生高水平IL-17[28]。提示B细胞中MyD88信号抑制自身反应T细胞应答。
3.3.3不同的TLR介导Breg功能控制炎症免疫相关疾病的启动和恢复TLR信号转导触发Breg细胞调节功能,可抑制Th1和Th17,并促使T细胞介导的炎症转变为自限性。B细胞外的其他细胞如DC和巨噬细胞中MyD88信号能够启动EAE的发生,而B细胞中MyD88信号可促使EAE的恢复[29]。在EAE小鼠模型,B细胞固有TLR信号可抑制Th1和Th17细胞介导的炎症应答,利于疾病恢复[30]。TLR-4或TLR-9的激动剂可抑制小鼠 EAE、CIA和 SLE等发生[31]。消除tlr-9基因可加重狼疮倾向小鼠的SLE症状,tlr-9基因多态性导致TLR-9低表达时,也能增加人SLE发病倾向[32]。B-TLR-2/4-/-小鼠能够发展为慢性EAE,与对照组比较,B细胞MyD88-/-小鼠和B-TLR-2/4-/-小鼠产生大量IL-17和IFN-γ,提示从病程中恢复,限制病理性Th1和Th17应答需要通过TLR-2和或TLR-4的B细胞活化。但是TLR-2/4双重缺陷的小鼠易感EAE,提示不同的TLR激动剂控制着EAE 的发生和恢复[26,28]。
另外,Breg的调节功能也需要BCR信号参与。体内,Breg的调节功能是抗原限制性的,提示需要一个抗原特异性的BCR信号。传输抗原孵育的B10细胞可减轻接触性过敏反应(contact hypersensitivity)炎症和EAE发生的严重度[33]。体外单独用胶原或胶原加上CD40 mAb活化关节炎动物脾脏B细胞,可使B细胞产生高水平IL-10,而抑制关节炎。输注BCR活化的B细胞也阻止NOD发生1型糖尿病。在CIA、SLE和EAE模型中,BCR和CD40协同作用对Breg的功能是需要的[34]。
4 展望
总之,Breg等负性调节细胞不仅在维持免疫系统平衡,而且在自身免疫病的病理机制调控中起着十分重要作用。TLR信号在自身免疫病中具有双重作用,TLR通过启动天然免疫和适应性免疫,打破了免疫耐受,而诱导自身免疫病,参与自身免疫病炎症发生发展病理过程。TLR信号转导通过触发Breg细胞调节功能,也参与自身免疫病病理的负性调控。微生物产物通过TLR活化诱导Breg细胞产生IL-10。TLRs介导的信号是细胞特异性的,DC中TLRs/MyD88信号促进T细胞活化,而Breg细胞中TLRs/MyD88信号通过产生IL-10而抑制T细胞增殖和分化,并促使T细胞介导的炎症转变为自限性,而抑制自身免疫病理变化,促进炎症免疫相关疾病的恢复。提示TLR激动剂不仅可促进免疫,对抗微生物和肿瘤,也可用于抑制自身免疫。因此,运用优先触发Breg细胞调节功能的TLR激动剂,分离TLRs的相反作用,对控制免疫反应,制定合理的炎症免疫相关疾病的治疗策略具有重要的意义。
[1]Miyara M,Yoshioka Y,Kitoh A,et al.Functional delineation and differentiation dynamics of human CD4+T cells expressing the FoxP3 transcription factor[J].Immunity,2009,30(6):899-911.
[2]Chinen T,Volchkov P Y,Chervonsky AV,Rudensky AY.A critical role for regulatory T cell-mediated control of inflammation in the absence of commensal microbiota[J].J Exp Med,2010,207(11):2323-30.
[3]Stoop J N,Harry R A,von Delwig A,et al.Therapeutic effect of tolerogenic dendritic cells in established collagen-induced arthritis is associated with a reduction in Th17 responses[J].Arthritis Rheum,2010,62(12):3656-65.
[4]Katz S I,Parker D,Turk J L.B-cell suppression of delayed hypersensitivity reactions[J].Nature,1974,251(5475):550-1.
[5]Merims S,Dokouhaki P,Joe B,Zhang L.Human Vδ1-T cells regulate immune responses by targeting autologous immature dendritic cells[J].Hum Immunol,2011,72(1):32-6.
[6]Frick J S,Grünebach F,Autenrieth I B.Immunomodulation by semi-mature dendritic cells:a novel role of Toll-like receptors and interleukin-6[J].Int J Med Microbiol,2010,300(1):19-24.
[7]Vlad G,Chang C C,Colovai A I,et al.Membrane and soluble ILT3 are critical to the generation of T suppressor cells and induction of immunological tolerance[J].Int Rev Immunol,2010,29(2):119-32.
[8]Cantaert T,Doorenspleet M E,Francosalinas G,et al.Increase of CD5(+)B lymphocytes with a regulatory phenotype in spondyloarthritis[J].Arthritis Rheum,2012:22231660
[9]Kessel A,Haj T,Peri R,et al.Human CD19(+)CD25(high)B regulatory cells suppress proliferation of CD4(+)T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells[J].Autoimmun Rev,2012;in pressed.
[10]Evans J G,Chavez-Rueda K A,Eddaoudi A,et al.Novel suppressive function of transitional 2 B cells in experimental arthritis[J].J Immunol,2007,178(12):7868-78.
[11]Mauri C,Ehrenstein M R.The“short”history of regulatory B cells[J].Trends Immunol,2008,29(1):34-40.
[12]Mauri C,Gray D,Mushtaq N,Londei M.Prevention of arthritis by interleukin 10-producing B cells[J].J Exp Med,2003,197(4):489-501.
[13]DiLillo D J,Matsushita T,Tedder T F.B10 cells and regulatory B cells balance immune responses during inflammation,autoimmunity,and cancer[J].Ann N Y Acad Sci,2010,1183(1):38-57.
[14]Rieger A,Bar-Or A.B-cell-derived interleukin-10 in autoimmune disease:regulating the regulators[J].Nat Rev Immunol,2008,8(6):486-7.
[15]Iwata Y,Matsushita T,Horikawa M,et al.Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J].Blood,2011,117(2):530-41.
[16]Knippenberg S,Peelen E,Smolders J,et al.Reduction in IL-10 producing B cells(Breg)in multiple sclerosis is accompanied by a reduced naïve/memory Breg ratio during a relapse but not in remission[J].J Neuroimmunol,2011,239(1-2):80-6.
[17]Gray M,Miles K,Salter D,et al.Apoptotic cells protect mice from autoimmune inflammation by the induction of regulatory B cells[J].Proc Natl Acad Sci USA,2007,104(35):14080-5.
[18]Matsushita T,Horikawa M,Iwata Y,Tedder T F.Regulatory B Cells(B10 Cells)and Regulatory T cells Have independent roles in controlling experimental autoimmune encephalomyelitis initiation and Late-Phase Immunopathogenesis[J].J Immunol,2010,185(4):2240-52.
[19]Derbigny W A,Shobe L R,Kamran J C,et al.Identifying a role for Toll-like receptor 3 in the innateimmuneresponseto Chlamydia muridarum infection in murine oviduct epithelial cells[J].Infect Immun,2012,80(1):254-65.
[20]Triantafilou K,Triantafilou M.Visualising PAMP-PRR interactions using nanoscale imaging[J].Methods Mol Biol,2012,799(2):253-66.
[21]Minematsu H,Shin M J,Celil Aydemir A B,et al.Nuclear presence of nuclear factor of activated T cells(NFAT)c3 and c4 is required for Toll-like receptor-activated innate inflammatory response of monocytes/macrophages[J].Cell Signal,2011,23(11):1785-93.
[22]Pone E J,Zan H,Zhang J,et al.Toll-like receptors and B-cell receptors synergize to induce immunoglobulin class-switch DNA recombination:relevance to microbial antibody responses[J].Crit Rev Immunol,2010,30(1):1-29.
[23]Lang K S,Recher M,Junt T,et al.Toll-like receptor engagement converts T-cell autoreactivity into overt autoimmune disease[J].Nat Med,2005,11(2):138-45.
[24]Pierer M,Wagner U,Rossol M,Ibrahim S.Toll-like receptor 4 is involved in inflammatory and joint destructive pathways in collagen-induced arthritis in DBA1J mice[J].PLoS One,2011,6(8):e23539.
[25]Sadanaga A,Nakashima H,Akahoshi M,et al.Protection against autoimmune nephritis in MyD88-deficient MRL/lpr mice[J].Arthritis Rheum,2007,56(5):1618-28.
[26]Yanaba K,Bouaziz J D,Matsushita T,et al.The development and function of regulatory B cells expressing IL-10(B10 cells)requires antigen receptor diversity and TLR signals[J].J Immunol,2009,182(12):7459-72.
[27]Simmons D P,Canaday D H,Liu Y,et al.Mycobacterium tuberculosis and TLR2 agonists inhibit induction of typeⅠIFN and class Ⅰ MHC antigen cross processing by TLR9[J].J Immunol,2010,185(4):2405-15.
[28]Lampropoulou V,Hoehlig K,Roch T,et al.TLR-activated B cells suppress T cell-mediated autoimmunity[J].J Immunol,2008,180(7):4763-73.
[29]Kirkland D,Benson A,Mirpuri J,et al.B cell-intrinsic MyD88 signaling prevents the lethal dissemination of commensal bacteria during colonic damage[J].Immunity,2012,36(2):228-38.
[30]Lampropoulou V,Hoehlig K,Roch T,et al.TLR-activated B cells suppress T cell-mediated autoimmunity[J].J Immunol,2008,180(7):4763-73.
[31]Buenafe A C,Bourdette D N.Lipopolysaccharide pretreatment modulates the disease course in experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2007,182(1-2):32-40.
[32]Tao K,Fujii M,Tsukumo S,et al.Genetic variations of Toll-like receptor 9 predispose to systemic lupus erythematosus in Japanese population[J].Ann Rheum Dis,2007,66(7):905-9.
[33]Yanaba K,Bouaziz J D,Haas K M,et al.A regulatory B cell subset with a unique CD1dhiCD5+phenotype controls T cell-dependent inflammatory responses[J].Immunity,2008,28(5):639-50.
[34]Matsushita T,Horikawa M,Iwata Y,Tedder T F.Regulatory B cells(B10 cells)and regulatory T cells have independent roles in controlling experimental autoimmune encephalomyelitis initiation and late-phase immunopathogenesis[J].J Immunol,2010,185(4):2240-52.

