补体旁路激活导致内皮细胞活化和损伤
孙黔云,李 敏,叶巧玲,李红玲
(1.贵州省中国科学院天然产物化学重点实验室,2.贵州省人民医院呼吸疾病研究所,贵州贵阳 550002)
补体是免疫系统的重要组成部分,在机体天然防御、免疫调控中发挥重要作用[1-2]。但补体的过度激活会引发炎症和组织损伤[2-4],尤其是补体替代途径的过度激活在一系列疾病和病征的发生发展中扮演了重要角色[5-6]。而补体引发炎症和组织损伤的关键在于其激活后对血管内皮细胞所产生的作用。以往报道的补体作用内皮细胞相关研究多为关注单一补体活化成分影响脐静脉内皮细胞的作用,而对病理生理条件下补体激活产物作用和影响微血管内皮细胞的研究报道极少。为进一步认识和理解补体过度激活对血管内皮细胞的影响及在相关病理中的作用,为相关新药的筛选和评价提供参考依据以及合适的细胞模型,本文报道了补体替代途径的激活对人微血管内皮细胞产生的活化和损伤作用。
1 材料与方法
1.1材料人微血管内皮细胞株HMEC由本实验室传代培养,DMEM细胞培养基和胎牛血清为美国Hyclone公司产品;人 P-selectin、E-selectin、ICAM-1、MCP-1、IL-8测定ELISA试剂盒购自武汉博士德生物工程有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自南京建成生物工程研究所;一氧化氮(nitric oxide,NO)检测试剂盒为江苏碧云天生物技术研究所产品;caspase-8萤光检测试剂盒为美国Promega公司产品;健康人混合血清(normal human serum,NHS)由本实验室健康志愿者献血制备,分装保存于-80℃,经补体活性检测后备用;灭活人血清(inactivated normal human serum,INHS)采用标准方法制备;眼镜蛇毒因子(cobra venom factor,CVF)的制备和活力单位测定同已发表文献[7]。其它试剂均为符合实验要求的国产或进口试剂。
1.2主要仪器设备Forma 3111 CO2培养箱和Revco超低温冰箱(美国Thermo公司);Nikon TS100倒置相差显微镜(日本Nikon公司);GloMax化学发光检测仪(美国Promega公司);Bio-Rad 550酶标仪(美国 Bio-Rad公司)。5810R冷冻离心机(德国Eppendorf公司);Elix纯水系统和Milli Q超纯水系统(美国Millipore公司)。
1.3方法
1.3.1补体激活物的制备将NHS与CVF(6.5×104U·L-1)等体积混合,37℃水浴孵育 30 min,将孵育物(CVF-activated complement,以下简称CAC)分装,冻存于 -80℃备用。实验中采用 INHS与CVF的孵育混合物作为CAC的对照。
1.3.2补体激活诱导内皮细胞表达P-selectin的作用
1.3.2.1量效作用测定 将HMEC细胞以4.5×103cells·well-1接种于 96 孔板,培养 24 h,弃培养液,加入含体积分数分别为5%、10%、20%、30%、40%CAC 的无血清DMEM 培养基200 μl,37℃ 培养20 min,取培养上清,2 000 r·min-1离心 10 min,取上清液,按试剂盒推荐步骤进行P-selectin测定。
1.3.2.2时效作用测定 将HMEC细胞以4.5×103cells·well-1接种于 96 孔板,培养 24 h,弃培养液,加入含30%CAC的无血清DMEM培养基200 μl,37℃分别培养 5、10、20、30、60 min,取培养上清,2 000 r·min-1离心 10 min,取上清液,测定 P-selectin。
1.3.3补体激活对HMEC表达E-selectin、ICAM-1、MCP-1和IL-8的影响将HMEC细胞以4.5×103cells·well-1接种于 96 孔板,培养 24 h,弃培养液,加入含30%CAC的无血清DMEM培养基200 μl,37℃培养不同时间,取培养上清,按试剂盒推荐步骤进行E-selectin、ICAM-1、MCP-1和IL-8测定。
1.3.4补体激活对HMEC的损伤情况将HMEC细胞以4.5×103cells·well-1接种于96孔板,培养24 h,弃培养液,加入含30%CAC的无血清DMEM培养基200 μl,各组别分别培养不同时间,按试剂盒推荐步骤分别检测细胞释放LDH、NO和caspase-8活化的情况,并采用MTT法测定细胞增殖活性。
1.4统计学分析实验数据以±s表示。采用SPSS 16.0软件进行单因素方差分析。
2 结果
2.1补体激活诱导内皮细胞表达P-selectin补体激活产物能刺激内皮细胞瞬时释放P-selectin。在血清体积分数为15%、作用时间为20 min时,这种释放作用达到最大(Fig 1)。
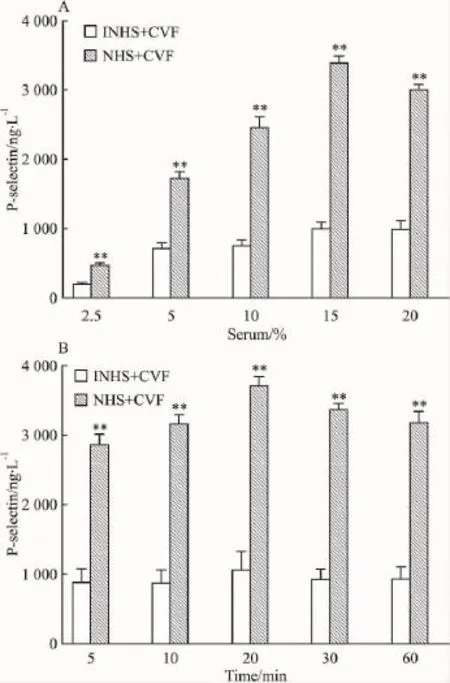
Fig 1 P-selectin expressed by endothelial cells after exposure to activated complement(n=3)
2.2补体激活诱导HMEC表达E-selectin、ICAM-1、MCP-1和IL-8的作用补体激活产物能刺激内皮细胞上调表达 E-selectin、ICAM-1、MCP-1和IL-8(Fig 2)。
2.3补体激活对内皮细胞的损伤作用补体旁路激活能导致内皮细胞释放LDH增加(Fig 3),凋亡信号caspase-8的活化出现上调,在6~12 h有明显的增强(Fig 4)。同时,NO释放下调(Fig 5)。经激活的补体作用后,内皮细胞的生长受到一定程度的抑制(Fig 6)。
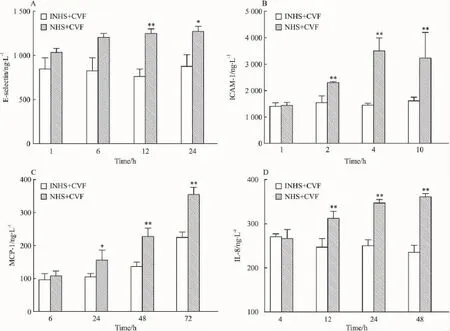
Fig 2 Expression of proinflammatory molecules in endothelial cells after exposure to activated complement(n=3)

Fig 3 LDH released from endothelial cells after exposure to activated complement(n=4)
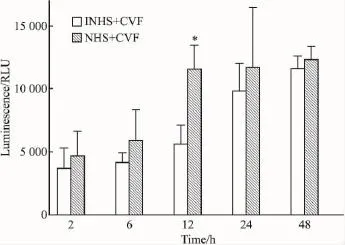
Fig 4 Activation of caspase-8 in endothelial cells after exposure to activated complement(n=4)
3 讨论
补体的激活分为经典、替代和凝集素途径,而不同的活化途径均有共同的活化末端路径(C5-C9)。因此,获得补体替代途径激活所产生的所有特异性产物是本研究目标达成的关键。为此,我们采用了CVF来激活血清补体。CVF是来源于眼镜蛇毒的一种高度特异的补体替代途径激活蛋白。在血清环境中,CVF与补体B因子特异结合,形成CVFB复合物,CVFB经D因子的特异识别和酶切,形成替代途径C3/C5转化酶CVFBb,CVFBb可持续激活补体替代途径。这种激活模式与病理生理条件下体内补体替代途径的过度激活高度一致,其产物对血管内皮细胞的作用和影响可以很好地模拟体内补体旁路过度激活对血管内皮细胞产生的效应。因此,这个组合的实验体系也为开展与补体相关的内皮细胞保护及活性物质筛选研究提供了一个合适的细胞模型。同时,通过该细胞模型的研究,也有助于认识CVF高效激活补体导致血管内皮损伤和炎症的作用在眼镜蛇蛇伤毒性机制中所扮演的角色。
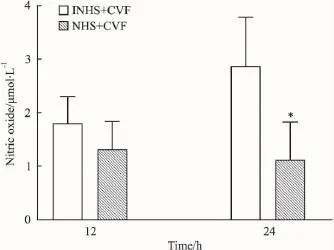
Fig 5 Effect of complement activation on production of NO by endothelial cells(n=4)

Fig 6 Effect of complement activation on cell proliferation(n=3)
据此,本研究观察了补体旁路激活对内皮细胞的影响和作用。结果表明,补体旁路激活导致内皮细胞瞬时释放P-selectin,并上调表达黏附分子E-selectin、ICAM-1和趋化因子 MCP-1、IL-8,使内皮细胞释放LDH增加,caspase-8活化上调,NO表达下调,细胞生长受到抑制。补体作为机体天然防御系统的重要一员,其正常可控的活化是实现免疫防御和调控作用的前提。但在诸多病理生理情况下,补体的活化会失控,从而引发炎症和损伤。补体的激活,尤其是旁路激活,在一系列疾病和病理损伤中扮演了重要角色。而血管内皮细胞无疑会成为补体激活后的重要靶标。在本研究中可以看到,补体旁路激活后首先会导致内皮细胞瞬时表达P-selectin,这种表达在数分钟内即有明显的变化,在20 min时升至高峰。随后数小时内,内皮细胞开始上调表达E-selectin、ICAM-1、MCP-1、IL-8 这类通过转录调控表达的黏附分子和炎症介质。补体替代途径的激活,会产生C3a、C3b、C5a以及攻膜复合物(membrane attack complex,MAC)等多种活化产物。C5a不仅能刺激脐静脉内皮细胞快速表达P-selectin,而且还能使多种黏附分子、细胞因子和趋化因子上调表达[8]。亚溶胞剂量的攻膜复合物 MAC能诱导 E-selectin、ICAM-1、MCP-1、IL-8 的表达上调[9-10],而没有溶胞活性的iTCC(inactive terminal complement complex)也具有同样的作用[11]。P-selectin、E-selectin、ICAM-1是顺序介导中性粒细胞与内皮细胞黏附及跨膜迁移的重要分子,MCP-1和IL-8则具有促进中性粒细胞、巨噬细胞向内皮细胞聚集和黏附的功能。本研究结果显示,在受到补体旁路激活产物的刺激后,人微血管内皮细胞顺序出现了典型的内皮细胞I型和II型活化[12]。血管内皮细胞不仅构成了血管平滑肌组织与血液间的物理性屏障,而且还是具有诸多重要生理调节活性的功能细胞。上述的活化刺激会导致内皮细胞形态与功能的变化,而这种活化一旦持续,就会使内皮细胞出现损伤和凋亡,从而破坏血管内皮的完整性,引发后续的炎症和损伤。
激活的补体旁路产物不仅刺激内皮细胞活化,而且也对内皮细胞产生损伤。从本实验看到,内皮细胞经CAC作用后,LDH释放增加,提示内皮细胞膜出现损伤和泄漏。这可能是CAC与内皮细胞接触后在细胞膜上生成了少量具有溶胞活性的MAC所致。而caspase-8的活化上调,表明CAC对内皮细胞的刺激和作用会导致一定程度的凋亡,使内皮细胞的增殖受到一定程度抑制。同时,内皮细胞分泌NO明显减少。NO是体内重要的信号分子,具有多种重要的生理或病理生理作用[13]。血管内皮细胞功能的紊乱,会导致NO的合成障碍[13]。以上结果提示,补体旁路激活会影响和损伤内皮细胞的正常功能,进而产生相关的病理生理效应。而在相关疾病和病理损伤中,采用合适有效的补体抑制剂阻断补体相关激活产物的形成,从而抑制或减轻内皮细胞的活化和损伤,则成为干预和治疗的关键。因此,本实验结果有助于进一步加深对补体激活引发炎症和损伤效应的认识和理解,为补体相关疾病及病理损伤的机制和干预治疗新策略以及相关新药的研究提供有益的参考和依据。
[1]Dunkelberger J R,Song W C.Complement and its role in innate and adaptive immune responses[J].Cell Res,2010,20(1):34-50.
[2]Sarma J V,Ward P A.The complement system[J].Cell Tissue Res,2011,343(1):227 -35.
[3]Wagner E,Frank M M.Therapeutic potential of complement modulation[J].Nat Rev Drug Discov,2010,9(1):43 - 56.
[4]Ricklin D,Hajishengallis G,Yang K,Lambris J D.Complement:a key system for immune surveillance and homeostasis[J].Nat Immunol,2010,11(9):785 -97.
[5]Thurman J M,Holers V M.The central role of the alternative complement pathway in human disease[J].J Immunol,2006,176(3):1305-10.
[6]Holers V M.The spectrum of complement alternative pathway-mediated diseases[J].Immunol Rev,2008,223(1):300 -16.
[7]孙黔云,叶巧玲,闫银萍.小鼠血清补体替代途径溶血活性测定的新方法[J].中国药理学通报,2011,27(11):1619 -22.
[7]Sun Q Y,Ye Q L,Yan Y P.A new method for measurement of the alternative pathway activity of mouse serum complement[J].Chin Pharma Bull,2011,27(11):1619 -22.
[8]Albrecht E A,Chinnaiyan A M,Varambally S,et al.C5a-induced gene expression in human umbilical vein endothelial cells[J].Am J Pathol,2004,164(3):849 -59.
[9]Kilgore K S,Shen J P,Miller B F,et al.Enhancement by the complement membrane attack complex of tumor necrosis factor-alpha-induced endothelial cell expression of E-selectin and ICAM-1[J].J Immunol,1995,155(3):1434 -41.
[10]Kilgore K S,Flory C M,Miller B F,et al.The membrane attack complex of complement induces interleukin-8 and monocyte chemoattractant protein-1 secretion from human umbilical vein endothelial cells[J].Am J Pathol,1996,149(3):953 -61.
[11]Bossi F,Bulla R,Tedesco F.Endothelial cells are a target of both complement and kinin system[J].Int Immunopharmacol,2008,8(2):143-7.
[12]Zhang J,Defelice A F,Hanig J P,Colatsky T.Biomarkers of endothelial cell activation serve as potential surrogate markers for drug-induced vascular injury[J].Toxicol Pathol,2010,38(6):856-71.
[13]Gkaliagkousi E,Ferro A.Nitric oxide signalling in the regulation of cardiovascular and platelet function[J].Front Biosci,2011,16:1873-97.

