eNOS:糖尿病内皮祖细胞功能失调的一个关键因素
邓亚萍,赵 婷,倪 敏,谢和辉,沈甫明
(1.第二军医大学药学院药理学教研室,上海 200433;2.长征医院药材科,上海 200433)
糖尿病是由遗传和环境因素共同作用而引起的一组以慢性高血糖为主要特征的临床综合征,它的危害不仅在于以糖代谢为主的一系列代谢紊乱,还包括长期高血糖所引起的糖尿病血管病变,如冠心病、脑血管疾病、周围血管疾病、肾病、神经病变及视网膜病变等。研究表明,氧化应激所致的细胞损伤能够导致糖尿病并发症的发生,但机制仍不清楚。内皮祖细胞(endothelial progenitor cells,EPCs)概念最早见于1997年,是一类循环的未成熟细胞,具有维持血管稳态和进行代偿性血管新生作用。10余年研究表明,EPCs在慢性疾病如糖尿病和高血压等的发生发展过程具有重要作用[1-3]。本文我们以eNOS为中心探讨糖尿病患者EPCs减少和功能失调的机制。
1 EPCs概述
目前研究已证实EPCs是一种来源于骨髓,能在体外扩增并分化为内皮细胞,在体内缺血组织中与原有的成熟内皮细胞融合形成新生血管的前体细胞[4]。能够表达Flk-1(fetal liver kinase-1)、CD34、CD146、von Willebrand factor(vWF),并且能够摄取ac-LDL(acetylated lowdensitylipoprotein)的细胞被认为是EPCs[5]。实验室通常以流式细胞仪将具有干细胞特征(表达Sca-1)和内皮细胞特征(表达Flk-1)的细胞确定为EPCs,以免疫组织化学ac-LDL和lectin呈双阳性予以进一步确认。
EPCs是血管内皮细胞的前体细胞。正常情况下,EPCs主要定居于骨髓;外周血中EPCs数量较少,外周血EPCs能够替代凋亡、缺失的内皮细胞维持血管完整性。在组织损伤、缺血缺氧等特定条件下,EPCs可从骨髓动员至外周,归巢至血管损伤部位,增殖分化为成熟内皮细胞,促进损伤内皮修复并参与新生血管形成。此外,EPCs可以分泌多种生长因子,如血管内皮细胞生长因子、肝细胞生长因子、粒细胞集落刺激因子等[6],这些因子又能够增强EPCs新血管形成和组织再生能力。
2 糖尿病引起的EPCs功能失调
2.1体外高糖对EPCs的影响糖尿病时高血糖及胰岛素抵抗使内皮功能受损,EPCs数量和功能明显降低,不能对受损内皮有效修复。研究显示正常人EPCs体外高糖处理时功能受损,主要表现为NO产生减少、EPCs迁移能力和新血管生成能力受损[7];高糖环境中培养时可致EPCs衰老率明显增加和数量减少,且与葡萄糖浓度正相关[8]。
2.2糖尿病时EPCs的改变大量动物实验和临床研究证明糖尿病时EPCs数量减少、功能降低,EPCs这些变化可能是糖尿病血管并发症的发病机制之一。在链脲佐菌素(streptozotocin,STZ)诱导糖尿病7 d后,小鼠外周血EPCs比对照组减少约50%,EPCs从外周血归巢到局部组织的能力受损。研究也发现,与对照组相比STZ糖尿病小鼠EPCs动员、归巢、迁移和黏附能力明显下降,下肢缺血后血流恢复速度明显延迟[9]。Tepper等[10]发现,糖尿病患者循环血中EPCs的数量较正常人减少48%,而且其增殖、迁移、黏附、分化、新血管生成等功能均发生了改变,不能有效维持血管的完整性,提出EPCs功能障碍导致的血管形成能力受损可能与糖尿病微血管并发症的发生密切相关。此外,糖尿病患者EPCs分泌细胞因子和生长因子的能力受损[11]。
3 EPCs功能失调机制
3.1氧化应激大量的基础及临床研究证实,糖尿病时氧化应激(oxidative stress)增强,EPCs功能受损。高糖处理的体外EPCs,其ROS(reactive oxygen species)生成量增加高达3倍,超氧阴离子生成增加,NO合成减少[12]。2型糖尿病患者EPCs的ROS生成量明显增加,EPCs数量减少和功能受损[13]。研究显示,抑制氧化应激具有防治糖尿病血管病变的作用[14]。另一个致超氧阴离子生成增加的主要原因是eNOS脱耦联。Leo等发现[15]抑制eNOS脱耦联、减少超氧阴离子产生或提高NO的活性均能改善内皮功能。并且,有研究表明eNOS脱耦联在高糖诱导的EPCs功能受损中起着主导性作用。
3.2eNOS脱耦联所谓eNOS脱耦联是指:eNOS不能催化L-精氨酸氧化生成L-胍氨酸和NO,但是eNOS仍然能够接受来自NADPH(nicotinamide adenine dinucleotide 2’-phosphate)氧化酶的电子并将电子储存在与其相结合的四羟酮醇中,然后将电子传递给另一底物O2,导致主要的终产物是,而不是NO这一过程[16]。2型糖尿病患者,eNOS脱耦联,EPCs功能降低[13]。Serizawa 等[17]发现抑制 NADPH 氧化酶活性和eNOS脱耦联能改善糖尿病诱导的内皮功能损伤。增强eNOS活性能够改善EPCs的功能[18]。现有的文献资料表明,导致eNOS脱耦联的原因主要涉及以下3个方面:
3.2.1BH4水平不足糖尿病时BH4下降,eNOS脱耦联,NO合成减少,EPCs功能受损。研究表明,高糖处理的正常人EPCs,细胞内BH4浓度明显减少59%,增加外源性BH4能减少的产生或完全恢复受损的EPCs功能[19]。BH4恢复能使eNOS“复耦联”和增强其酶活性。
生理状况下,GTPCH I(GTP cyclohydrolase I)是BH4从头合成的限速酶[20]。有研究显示,高血糖通过减少GTPCH I和BH4的量使得eNOS脱耦联[21]。体外实验显示GTPCH I基因转移可以改善糖尿病诱导的BH4不足,并改善内皮细胞产生NO的能力。体内实验显示使用内皮细胞特异性高表达GTPCH I的转基因小鼠(Tg-GCH小鼠),BH4水平的增加可以明显抑制糖尿病诱导的氧化应激,并改善其受损的eNOS活性[20]。Wang等[22]发现抑制 GTPCH I降解能改善糖尿病血管内皮功能。
3.2.2Akt(protein kinase B)的抑制目前的研究认为PI 3K(phosphatidylinositol-3 kinase)/Akt通路对EPCs的招募、迁移和增殖有很重要的作用[23]。正常情况下,活化的Akt磷酸化eNOS,从而激活eNOS,增加eNOS活性,使得 NO合成增加。此外,eNOS对促进干细胞从骨髓动员是必不可少的,激活PI 3K/Akt通路能激活 eNOS[24]。推测 eNOS磷酸化受损可引起骨髓动员到外周的EPCs减少,这可能是糖尿病时EPCs数目减少和功能降低的机制之一。
3.2.3高血糖的损害作用高血糖引起的EPCs数目减少、存活率降低和迁移能力减弱涉及众多机制。eNOS是高血糖损伤EPCs的一个重要靶点[25]。有研究显示高糖明显降低EPCs内活性eNOS(p-eNOS)的表达,同时高糖处理下EPCs功能明显受损[8]。
综上所述,糖尿病时EPCs数目减少、功能降低。其机制主要涉及eNOS脱耦联和氧化应激增强。eNOS脱耦联所致的eNOS活性下降和O2-生成增加均致NO生成减少;氧化应激增强所致O2-增加也导致NO生成减少。NO生成减少的结局是EPCs功能受损。使eNOS脱耦联的主要原因包括:BH4水平不足、Akt激酶活性抑制、高血糖对eNOS的直接损害作用(Fig 1)。
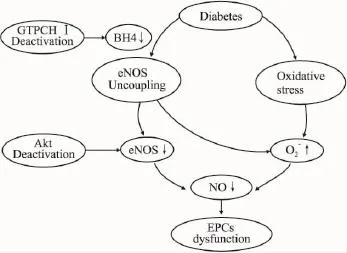
Fig 1 Schematic illustration of possible mechanisms on eNOS uncoupling of EPCs dysfunction in diabetes
4 干预措施
如何运用合适的细胞因子和药物,有效、安全的增加内源性EPCs的数量和提高其质量有重要的临床意义。最新研究显示:自体骨髓EPCs移植,可明显改善冠状动脉、心肌和下肢动脉血管内皮细胞功能并增加灌注血流;药物,如他汀类药物、促红细胞生成素、雌激素和血管内皮生长因子等,能增加循环的EPCs数目、增强其增殖和迁移能力。
5 展望
EPCs参与出生后组织的血管新生和受损血管的修复过程。糖尿病时EPCs数量减少、功能受损与糖尿病血管病变密切相关。研究表明其机制主要涉及eNOS脱耦联和氧化应激,详细机制仍待进一步阐述。EPCs数目和功能作为血管内皮功能的替代标志已经逐渐为人们所接受,进一步阐明糖尿病患者EPCs功能失调机制将为糖尿病EPCs治疗奠定理论基础。
[1]Fadini G P,Sartore S,Agostini C,et al.Significance of endothelial progenitor cells in subjects with diabetes[J].Diabetes Care,2007,30:1305 -13.
[2]Li D J,Evans R G,Yang Z W,et al.Dysfunction of the cholinergic anti-inflammatory pathway mediates organ damage in hypertension[J].Hypertension,2011,57:298 -307.
[3]Xie H H,Zhou S,Chen D D,et al.GTP cyclohydrolase I/BH4 pathway protects EPCs via suppressing oxidative stress and thrombospondin-1 in salt-sensitive hypertension[J].Hypertension,2010,56:1137 -44.
[4]Rosso A,Balsamo A,Gambino R,et al.p53 mediates the accelerated onset of senescence of endothelial progenitor cells in diabetes[J].J Biol Chem,2006,281:4339 -47.
[5]Gehling U M,Ergun S,Schumacher U,et al.In vitrodifferentiation of endothelial cells from AC133-positive progenitor cells[J].Blood,2000,95:3106 -12.
[6]Leone A M,Valgimigli M,Giannico M B,et al.From bone marrow to the arterial wall:the ongoing tale of endothelial progenitor cells[J].Eur Heart J,2009,30:890 -9.
[7]Krankel N,Adams V,Linke A,et al.Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells[J].Arterioscler Thromb Vasc Biol,2005,25:698 -703.
[8]Chen Y H,Lin S J,Lin F Y,et al.High glucose impairs early and late endothelial progenitor cells by modifying nitric oxide-related but not oxidative stress-mediated mechanisms[J].Diabetes,2007,56:1559 -68.
[9]Huang P H,Tsai H Y,Wang C H,et al.Moderate intake of red wine improves ischemia-induced neovascularization in diabetic mice-roles of endothelial progenitor cells and nitric oxide[J].Atherosclerosis,2010,212:426 -35.
[10]Tepper O M,Galiano R D,Capla J M,et al.Human endothelial progenitor cells from typeⅡdiabetics exhibit impaired proliferation,adhesion,and incorporation into vascular structures[J].Circulation,2002,106:2781 -6.
[11]Jarajapu Y P,Grant M B.The promise of cell-based therapies for diabetic complications:challenges and solutions[J].Circ Res,2010,106:854 -69.
[12]Hamed S,Brenner B,Aharon A,et al.Nitric oxide and superoxide dismutase modulate endothelial progenitor cell function in type 2 diabetes mellitus[J].Cardiovasc Diabetol,2009,8:56.
[13]Thum T,Fraccarollo D,Schultheiss M,et al.Endothelial nitric oxide synthase uncoupling impairs endothelial progenitor cell mobilization and function in diabetes[J].Diabetes,2007,56:666 -74.
[14]许惠琴,农伟虎,刘成鼎,李 莉.山茱萸最佳配伍组分对高糖致ECV304细胞氧化损伤的保护作用伤的保护作用[J].中国药理学通报,2011,27(8):1077 -80.
[14]Xu H Q,Nong W H,Liu C D,Li L.The effect of the best compatibility of components in Fruetus Corni of protecting the oxidative damage of vascular endothelial cells cultured in high glucose medium[J].Chin Pharmacol Bull,2011,27(8):1077 -80.
[15]Leo C H,Hart J L,Woodman O L.3’,4’-dihydroxyflavonol reduces superoxide and improves nitric oxide function in diabetic rat mesenteric arteries[J].PLoS One,2011,6:e20813.
[16]Katusic Z S.Vascular endothelial dysfunction:does tetrahydrobiopterin play a role[J]?Am J Physiol Heart Circ Physiol,2001,281:H981-6.
[17]Serizawa K,Yogo K,Aizawa K,et al.Nicorandil prevents endothelial dysfunction due to antioxidative effects via normalisation of NADPH oxidase and nitric oxide synthase in streptozotocin diabetic rats[J].Cardiovasc Diabetol,2011,10:105.
[18]马凤霞,任 倩,韩忠朝.洛伐他汀保护内皮祖细胞的机制研究[J].中国药理学通报,2009,25(8):1090 -4.
[18]Ma F X,Ren Q,Han Z C.The mechanisms of lovastatin protecting endothelial progenitor cells[J].Chin Pharmacol Bull,2009,25(8):1090-4.
[19]Davel A P,Wenceslau C F,Akamine E H,et al.Endothelial dysfunction in cardiovascular and endocrine-metabolic diseases:an update[J].Braz J Med Biol Res,2011,44:920 -32.
[20]Meininger C J,Cai S,Parker J L,et al.GTP cyclohydrolase I gene transfer reverses tetrahydrobiopterin deficiency and increases nitric oxide synthesis in endothelial cells and isolated vessels from diabetic rats[J].FASEB J,2004,18:1900 -2.
[21]Xu J,Wu Y,Song P,et al.Proteasome-dependent degradation of guanosine 5’-triphosphate cyclohydrolase I causes tetrahydrobiopterin deficiency in diabetes mellitus[J].Circulation,2007,116:944-53.
[22]Wang S,Xu J,Song P,et al.In vivoactivation of AMP-activated protein kinase attenuates diabetes-enhanced degradation of GTP cyclohydrolase I[J].Diabetes,2009,58:1893 -901.
[23]Morello F,Perino A,Hirsch E.Phosphoinositide 3-kinase signalling in the vascular system[J].Cardiovasc Res,2009,82:261 -71.
[24]Fulton D,Gratton J P,McCabe T J,et al.Regulation of endothelium-derived nitric oxide production by the protein kinase Akt[J].Nature,1999,399:597 -601.
[25]Hur J,Yoon C H,Kim H S,et al.Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis[J].Arterioscler Thromb Vasc Biol,2004,24:288 -93.

