脂联素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白表达的影响
郭 佳,肖传实,白 瑞,边云飞
(山西医科大学1.临床技能实验培训中心、2.第一医院心内科、3.第二医院心内科,山西太原 030001)
缺血心肌在恢复血流后,引起心肌结构、功能及代谢等方面的进一步损伤即心肌缺血/再灌注损伤(myocardial ischemia and reperfusion injure,MIRI)。研究表明心肌细胞凋亡可能是心肌细胞MIRI发病机制中的重要环节之一[1-2],如何减少心肌细胞凋亡已成为缺血/再灌注(ischemia/reperfusion,I/R)研究领域中的热点。近年来有基础和临床研究表明脂联素(adiponectin,APN)对 MIRI具有保护作用[3-4],但其机制仍不清楚。本研究通过建立大鼠I/R模型,经舌静脉注射脂联素,观察脂联素对I/R心肌梗死面积和心功能的影响,并经透射电镜观察心肌超微结构的变化,TUNEL法观察心肌细胞凋亡情况,同时观察凋亡相关蛋白Bcl-2、Bax、Caspase-3蛋白的表达,探讨脂联素减轻MIRI的机制,从而为进一步防治MIRI,恢复心肌细胞功能提供理论基础。
1 材料与方法
1.1材料
1.1.1试剂与仪器脂联素购自Sigma公司,批号:SRP4593;兔抗鼠 Bcl-2、Bax、Caspase-3 多克隆抗体均购自Santa Cruz Biotechnology;细胞核-胞质-胞膜制备试剂盒:普利莱基因技术有限公司。细胞凋亡原位检测试剂盒(In Situ Cell Death Detection Kit,POD)购自Roche公司。动物人工呼吸机:成都泰盟科技有限公司,HX-100E;多道生理信号采集处理系统RM6240BD购自成都仪器厂;电泳仪:北京六一仪器厂;透射电镜:JEM-CX100;激光扫描共焦显微镜:日本,Olympus FV1000。
1.1.2动物及分组♂健康SD大鼠48只,由山西医科大学实验动物中心提供(清洁级),体质量200 g~220 g,随机分为3组,每组16只。即假手术组(sham group)、缺血/再灌注组(I/R group)、脂联素预处理组(APN+I/R group)。假手术组与I/R组于缺血前30 min经舌静脉给予生理盐水,脂联素预处理组于缺血前30 min经舌静脉给予脂联素(1 μg·kg-1)后行I/R。各组内随机选取8只大鼠用于心肌梗死面积的测定,另外8只大鼠用于监测血流动力学指标并于再灌注3 h后取左心室游离壁和心尖部心肌组织做各项指标检测。
1.2方法
1.2.1动物模型制备戊巴比妥钠麻醉,仰卧固定。记录Ⅱ导联心电图,气管插管,小动物呼吸机辅助呼吸,经胸骨左缘第2~3肋间打开胸腔暴露心脏,于左心耳根部下方2 mm处用5/0线结扎冠状动脉前降支,将丝线两端穿过一根聚乙烯小管,止血钳夹持细管,结扎线以下心肌组织颜色变暗,在Ⅱ导联心电图见R波明显增大伴ST段即刻抬高,说明心肌已缺血。30 min后予以再灌注,以缺血区转红,相关导联ST段明显回落为再通标志,并持续3 h。
1.2.2心肌梗死面积的测定大鼠经再灌注3 h后再次原位结扎左冠状动脉,经颈动脉注入伊文氏蓝。取出心脏,切片,TTC染色,蓝色为未缺血区域、红色为缺血区域。将红色的缺血心肌片置于TTC磷酸缓冲液染色。缺血但未梗死心肌染成红色,梗死心肌则为灰白色,称量缺血未梗死心肌和梗死心肌湿重。心肌缺血范围:缺血心肌面积/左心室面积(AAR/LV)来计算;心肌梗死范围:坏死区/危险区面积(NEC/AAR)来表示。
1.2.3血流动力学指标的测定大鼠经颈动脉插管至左心室,以生物信号采集系统监测记录各组左心室舒张末期压(LVEDP)、左心室压力最大上升(+dp/dtmax)、下降速度(-dp/dtmax)及心率(HR)。
1.2.4心肌超微结构观察迅速取下心尖部心肌组织切成1 mm3,戊二醛磷酸盐缓冲液、饿酸各固定2 h,脱水、包埋、切片、醋酸双氧铀、枸橼酸双重染色,透射电镜下观察心肌细胞超微结构。
1.2.5心肌细胞凋亡测定采用TUNEL凋亡试剂盒检测各组心肌组织中的凋亡细胞,激光扫描共焦显微镜下观察,TUNEL阳性细胞核呈绿色荧光。
1.2.6Western blot法测定Bcl-2、Bax、Caspase-3蛋白表达提取组织蛋白,使用BCA Protein Assay kit(Beyotime,Haimen,China)测定蛋白浓度。加入蛋白上样缓冲液、加热变性蛋白、聚丙烯酰胺凝胶电泳分离蛋白质、电转膜至硝酸纤维膜、BSA封闭、兔抗鼠 Bcl-2(1 ∶200)、Bax(1 ∶200)、Caspase-3(1∶200)、β-actin 多克隆抗体(Santa Cruz CA,USA)及二抗孵育,化学发光剂显色。Gel Imaging System(Bio-Rad)进行灰度分析。
1.3统计学处理计量资料采用进行描述,用统计软件SPSS 13.0统计处理,多组间比较采用方差分析。
2 结果
2.1心肌梗死面积假手术组心肌缺血范围为0,缺血/再灌注组与脂联素组AAR/LV差异无统计学意义(P>0.05),说明实验操作手法基本一致,排除了由此而造成的误差。与I/R组比较,APN+I/R组NEC/AAR明显下降(P<0.05)。见Tab 1。
2.2心功能指标与假手术组比较,I/R组LVEDP升高、+dp/dtmax和 -dp/dtmax降低(P<0.05);与 IR组比较,APN+I/R组的LVEDP降低、+dp/dtmax和-dp/dtmax明显升高(P<0.05)。见Tab 2。
2.3各组心肌细胞超微结构观察假手术组线粒体外膜完整,峭密集,排列整齐,线粒体基质致密,内有电子致密颗粒。胞核呈椭园形,异染色质呈连续薄层依附在核膜内侧面。I/R组出现广泛的线粒体损伤。虽然大多数线粒体外膜连续,但基质明显变淡,峭排列紊乱。胞核皱缩,染色质凝集。脂联素预处理组心肌超微结构除某些区域的线粒体有改变外,与对照无明显区别(Fig 1)。
Tab 1 The infarct size of myocardium at the end of reperfusion(±s,n=8)

Tab 1 The infarct size of myocardium at the end of reperfusion(±s,n=8)
*P<0.05 vs sham;#P<0.05 vs I/R
Group AAR/LV NEC/AAR Sham 0 0 I/R 0.55 ±0.03* 0.41 ±0.03*APN+I/R 0.53 ±0.04* 0.36 ±0.05*#
Tab 2 Hemodynamics(±s,n=8)

Tab 2 Hemodynamics(±s,n=8)
*P<0.05 vs sham;#P<0.05 vs I/R
Group LVEDP/kPa+dp/dtmax/kPa·s-1-dp/dtmax/kPa·s -1 Sham 0.43 ±0.12 1038.82 ±159.30 -901.68 ±132.53 I/R 0.96 ±0.26* 673.7 ±115.2* -609.17 ±126.33*APN+I/R 0.51 ±0.24*# 961.34 ±130.30*# -766.20 ±141.18*#
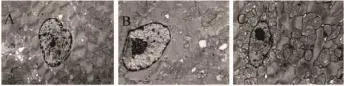
Fig 1 The ultrastructural change of myocardial tissue in groups(×12 000)
2.4各组心肌组织中的细胞凋亡情况TUNEL染色结果显示:Sham组未见明显细胞凋亡现象,I/R组心肌组织可见大量凋亡细胞,APN+I/R组凋亡细胞较I/R组明显减少(Fig 2)。
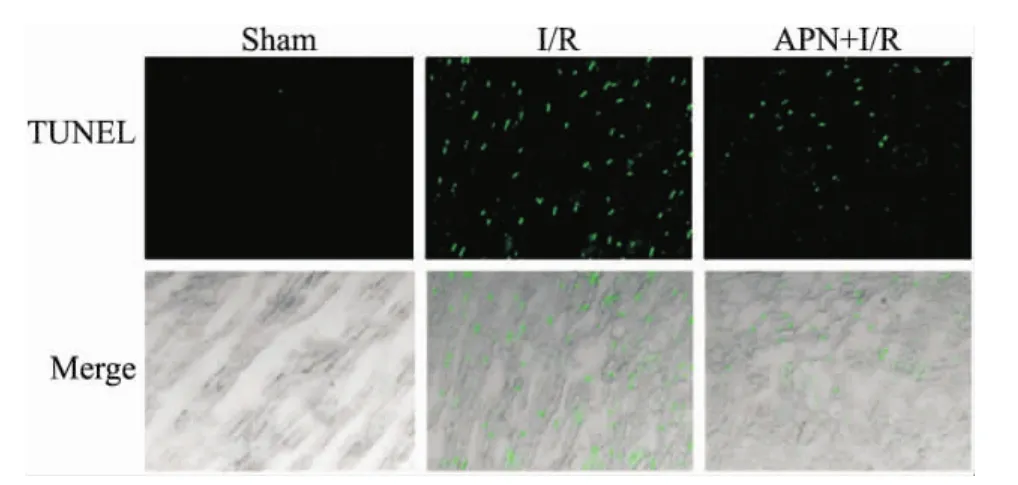
Fig 2 Effect of adiponectin on apoptosis in cardiac tissues of rats in various groups by TUNEL staining(×400)
2.5心肌组织凋亡相关蛋白Bcl-2、Bax、Caspase-3表达I/R组较 Sham 组Bcl-2、Bax、Caspase-3蛋白表达均上调,但以Bax升高为主,而脂联素预处理可明显增加心肌组织Bcl-2表达,降低Bax、Caspase-3蛋白的表达(Fig 3)。
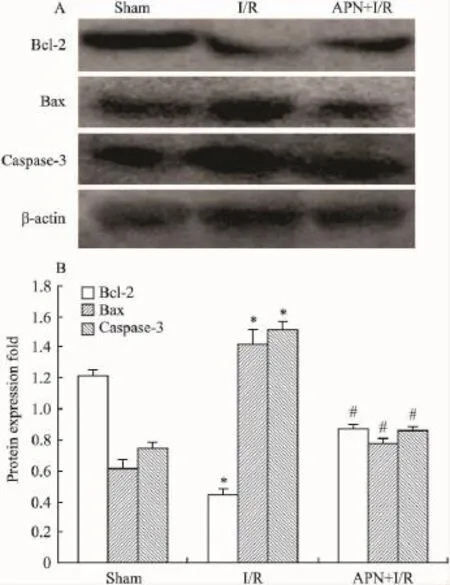
Fig 3 Western blot analysis of Bcl-2,Bax and Caspase-3 in rat cardiomyocyte(±s,n=3)
3 讨论
近年来研究表明,在冠心病、高血压、心肌梗死的患者中,血浆脂联素水平明显低于正常人[5-6],脂联素具有心血管系统保护作用[7]。在前期的实验中,我们已经证实脂联素通过减少肌酸激酶、升高SOD和NO活力有效减轻心肌I/R损伤[8-9]。本研究通过舌静脉注射脂联素,建立大鼠在体I/R模型,观察脂联素对大鼠缺血/再灌注所致心肌细胞凋亡的影响,并进一步探讨其作用机制。
MIRI是急性冠脉综合征经皮穿刺冠状动脉腔内成形术及心脏移植术后心功能不全和心律失常的主要病理基础。本实验结果显示再灌注3 h后,脂联素预处理组大鼠心脏血流动力学明显改善;心肌梗死区面积较I/R组明显减小。近年来已有基础和临床实验研究结果证实,细胞凋亡可能是心肌细胞MIRI发病机制中的重要环节之一,是心肌梗死早期细胞死亡的主要方式,抑制细胞凋亡便能明显缩小I/R所致心肌梗死的面积[1-2]。TUNEL方法是定量检测细胞凋亡的一种技术手段[10],本文经 TUNEL染色,I/R组可见大量凋亡细胞,脂联素明显减少I/R诱导的心肌细胞凋亡。透射电镜心肌超微结构也充分显示了这一点。脂联素预处理可明显逆转I/R所致的心肌细胞形态、细胞膜、细胞核、线粒体等结构的改变。以上结果提示,脂联素预处理对在体大鼠MIRI具有保护作用,其保护作用和其抑制心肌细胞凋亡有关。
细胞凋亡的发生受到细胞内凋亡调节蛋白的调控,这些凋亡调节蛋白分为促凋亡基因(Bax、Fas等)和抗凋亡基因(Bcl-2等)两大类。在调控凋亡的基因中,Bcl-2基因家族是目前较公认与凋亡密切相关的基因[11],其中Bcl-2具有抗心肌细胞凋亡作用,而Bax可以促进心肌细胞凋亡。在细胞中Bcl-2和Bax蛋白是以异二聚体的形式存在,阻止Bax插入线粒体外膜,保护线粒体电势梯度,调节细胞内Ca2+的自稳状态和氧化还原状态来抑制凋亡。因此常用两种蛋白表达比率(Bcl-2/Bax)表示心肌细胞凋亡的程度[12]。研究表明,半胱天冬酶家族(Caspases)是哺乳动物细胞凋亡的启动者和执行者,其中Caspase-3作为细胞凋亡的关键性蛋白酶,直接导致凋亡细胞解体,并包裹形成凋亡小体[13]。Bcl-2抑制细胞色素C的释放,阻断上游Caspase蛋白酶的激活,抑制细胞的凋亡。Bax蛋白作为线粒体膜上离子通道的组成成分,使细胞色素C得以穿过线粒体膜,激活Caspase-3,导致细胞凋亡。本文通过 Western blot检测发现:I/R组 bcl-2、Bax及Caspase-3蛋白表达明显增加(P<0.05),但以Bax升高更为明显,Bcl-2/Bax比值明显降低;而脂联素预处理可明显抑制I/R诱导的Bax及Caspase-3升高,增加Bcl-2表达,使Bcl-2/Bax比值明显升高(P<0.05)。因此,脂联素抑制心肌I/R损伤引起细胞凋亡的机制可能与下调 Bax、Caspase-3和上调Bcl-2的蛋白表达,升高Bcl-2/Bax比值有关,但它减轻I/R诱导的心肌细胞凋亡的机制,还需要进一步的深入研究。
综上所述,心肌I/R过程中细胞凋亡明显增多,脂联素可明显减轻I/R损伤,其机制与减轻心肌细胞凋亡,下调Bax、Caspase-3水平,上调抗凋亡基因Bcl-2水平,提高Bcl-2/Bax比值有关。因此,给予外源性的脂联素可能成为治疗I/R损伤的一种新途径。
[1]史婷婷,白建平,梁月琴,等.芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白Bcl-2、Bax、Caspase-3表达的影响[J].中国药理学通报,2011,27(5):666 -71.
[1]Shi T T,Bai J P,Liang Y Q,et al.Effect of apigenin on the cardiomyocyte apoptosis in rats with ischemia and reperfusion and the expression of Bcl-2,Bax,Caspase-3[J].Chin Pharmacol Bull,2011,27(5):666-71.
[2]Jiang C M,Han L P,Li H Z,et al.Calcium sensing receptors induce apoptosis in cultured neonatal rat ventricular cardiomyocytes during simulated ischemia/reperfusion[J].Cell Biol Int,2008,32(7):792-800.
[3]Goldstein B J,Scalia R G,Ma X L.Protective vascular and myocardial effects of adiponectin[J].Nat Rev Cardiol,2009,6(1):27-35.
[4]Yang Z,Berr S S,Gilson W D,et al.Simultaneous evaluation of infarct size and cardiac function in intact mice by contrast-enhanced cardiac magnetic resonance imaging reveals contractile dysfunction in noninfarcted regions early after myocardial infarction[J].Circulation,2004,109(9):1161 -7.
[5]Kawanami D,Maemura K,Takeda N,et al.Direct reciprocal effects of resistin and adiponectin on vascular endothelial cells:a new insight into adipocytokine endothelial cell in teractions[J].Biochem Biophys Res Commun,2004,312(2):415-9.
[6]Tao L,Gao E,Jiao X Y,et al.Adiponectin cardioprotection after myocardial ischemia/reperfusion involves the reduction of oxidative/nitrative stress[J].Circulation,2007,115:1408 -16.
[7]Takahashi T,Saegusa S,Sumino H,et al.Adiponectin replacement therapy attenuates myocardial damage in leptindeficient mice with viral myocarditis[J].J Int Med Res,2005,33:207 -14.
[8]陈 君,边云飞,郝小燕,肖传实.不同浓度脂联素通过减轻氧化应激损伤保护缺血/再灌注心肌[J].中国动脉硬化杂志,2010,18(11):857 -60.
[8]Chen J,Bian Y F,Hao X Y,Xiao C S.Protective effect of different concentrations of adiponectin on ischemia reperfusion myocardium by relieve oxidative stress[J].Chin J Arterioscl,2010,18(11):857-60.
[9]陈 君,边云飞,刘 钊,肖传实.脂联素对大鼠心肌缺血再灌注损伤的保护研究[J].中国药物与临床,2011,11(2):154-5.
[9]Chen J,Bian Y F,Liu Z,Xiao C S.Research of adiponectin’s protective effect on ischemia reperfusion injury[J].Chin Remed Clin,2010,11(2):154 -5.
[10]姚玲玲,黄晓伟,朱依纯.离体和在体大鼠心肌细胞凋亡模型的建立[J].中国药理学通报,2011,27(6):879-81.
[10]Yao L L,Huang X W,Zhu Y C.Establishment of thein vitroandin vivocardiomyocyte apoptosis model[J].Chin Pharmacol Bull,2011,27(6):879 -81.
[11]Lockshin R A.Programmed cell death:history and future of a concept[J].J Soc Biol,2005,199(3):169 - 73.
[12]Gustafsson A B,Gottlieb R A.Bcl-2 family members and apoptosis,taken to heart[J].Am J Physiol Cell Physiol,2007,292(1):C45-51.
[13]李 琴,郭云良,李 震,徐新颖.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J].中国药理学通报,2010,26(3):342 -5.
[13]Li Q,Guo Y L,Li Z,Xu X Y.The interference of picrosideⅡ on the expressions of Caspase-3 and PARP following cerebral ischemia reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(3):342-5.

