低分子量肝素联合吉西他滨对乳腺癌细胞侵袭和迁移能力的影响
赵素容,刘 浩,吴成柱,王 秀,梁 颖,陈 超,蒋志文
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽蚌埠 233030)
乳腺癌是女性最常见的恶性肿瘤,其发病率不断上升,并且发病年龄趋于年轻化。目前,含蒽环类和紫杉类药物的化疗方案是治疗乳腺癌的首选方案,尽管疗效显著,但易发生耐药,一旦出现耐药,临床治疗就相当困难。吉西他滨(gemcitabine,GEM)是一种嘧啶类抗代谢药,主要杀伤S期细胞,也可以阻止细胞由G1期向S期进展。GEM对蒽环类和紫杉类药物耐药的乳腺癌有较高的疗效,且耐受性较好[1]。是目前治疗转移性乳腺癌、晚期乳腺癌和复发性乳腺癌的主要药物之一。研究表明,肝素及其类似物具有延长肿瘤患者生存期,抑制肿瘤细胞增殖、血管生成、侵袭、迁移以及增强肿瘤细胞对化疗药物的敏感性等生物活性,其抗肿瘤作用日益受到重视[2-5]。本实验研究低分子量肝素(low molecular weight heparin,LMWH)对GEM抗肿瘤作用的影响,并分析可能的作用机制,以期为乳腺癌的治疗提供新的思路和方法。
1 材料与方法
1.1细胞株人乳腺癌细胞株 MDA-MB-231、MDA-MB-435由蚌埠医学院生化药理研究室保存。培养条件:含10%新生牛血清的DMEM高糖培养基,37℃,5%CO2饱和湿度培养箱。
1.2主要试剂DMEM高糖培养基、胰蛋白酶、新生牛血清:Gibco公司;低分子量肝素钠注射液(克赛,平均分子质量为3 500~5 500 u):Sanofi-Aventis公司;注射用盐酸吉西他滨:江苏豪森药业股份有限公司;Transwell小室:Costar公司;Matrigel基质蛋白:BD公司;MMP-9抗体、β-actin抗体:武汉博士德生物工程有限公司;山羊抗兔IgG:中杉金桥生物技术有限公司;人乙酰肝素酶ELISA试剂盒:R&D公司。
1.3MTT法检测细胞存活率取对数生长期细胞,0.25%胰蛋白酶消化制成单细胞悬液,并调整细胞密度为3×107·L-1,接种于96孔板中,每孔200 μl,于5%CO2饱和湿度37℃培养箱中培养24 h,不同浓度 LMWH(6.25 ×104、12.5 ×104、25 ×104、50×104、100 ×104IU·L-1)、GEM(0.625、1.25、2.5、5、10 mg·L-1)以及 60 ×104IU·L-1LMWH 联合GEM(0.625、1.25、2.5、5、10 mg·L-1)处理,同时设阴性对照组和空白对照组,每个处理3个复孔,继续培养 24、48、72 h 后每孔加入 10 μl浓度为 5 g·L-1的MTT溶液继续孵育4 h,弃去培养液,每孔加入150 μl DMSO,37℃孵育30 min,微量振荡器振荡10 min使结晶物充分溶解,用酶标仪在570 nm波长下检测每孔的吸光度(D)值,计算细胞存活率:细胞存活率/%=实验组D570nm/对照组D570nm×100%,绘制剂量效应曲线,采用Logit法计算半数抑制浓度(IC50)。以上实验重复3次。
1.4细胞划痕实验将对数生长期细胞制成单细胞悬液接种于24孔细胞培养板,每孔3×105个细胞,培养24 h,用无菌枪头沿孔中心划出一道“伤痕”,PBS冲洗干净,每孔加入含2%新生牛血清的DMEM高糖培养基500 μl。实验分为对照组和药物处理组(30 ×104IU·L-1LMWH 组、2.5 mg·L-1GEM 组、30 ×104IU·L-1LMWH 联合2.5 mg·L-1GEM组)。处理24 h后观察细胞向中间迁移的情况并拍照。
1.5Transwell细胞迁移与侵袭实验细胞迁移实验:取对数生长期细胞,消化离心,用含30×104IU·L-1LMWH、2.5 mg·L-1GEM、30 ×104IU·L-1LMWH联合2.5 mg·L-1GEM的无血清培养基稀释细胞至5×108·L-1,每个 Transwell小室中加入100 μl,下室每孔加入含5%胎牛血清的DMEM高糖培养基600 μl,培养24 h后取出小室,用棉签擦去小室上层未迁移的细胞,4%多聚甲醛室温固定15 min,0.1%结晶紫染色15 min,各取5个400×视野显微镜下观察拍照。迁移抑制率/%=(1-实验组迁移细胞数/对照组迁移细胞数)×100%。
细胞侵袭实验:每个Transwell小室的聚碳酸酯微孔膜铺50 μl Matrigel基质蛋白,药物处理36 h,其余操作同细胞迁移实验。侵袭抑制率/%=(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
1.6Western blot检测MMP-9的蛋白表达将对数生长期的细胞接种于6孔细胞培养板中,培养至90%融合,换液加入含60×104IU·L-1LMWH、5 mg·L-1GEM、60 ×104IU·L-1LMWH 联合5 mg·L-1GEM的培养基继续培养。处理24 h后消化收集细胞,用预冷PBS洗2次,每个处理加入70 μl预冷的蛋白裂解液[20 mmol·L-1Tris-HCl(pH 7.5),150 mmol·L-1NaCl,1 mmol·L-1EDTA,1 mmol·L-1EGTA,1 mmol·L-1原矾酸钠,1 mmol·L-1PMSF,体积分数为1%的Triton X-100,2.5 mmol·L-1焦磷酸钠,40 mmol·L-1β-甘油磷酸,10 mg·L-1的亮肽素、抑肽酶和大豆胰蛋白酶抑制剂],冰上裂解30 min,提取细胞总蛋白,BCA蛋白定量法测定各组蛋白浓度。每组取40 μg蛋白,10%SDS-PAGE 电泳(70 V,30 min;120 V,90 min);转膜(50 V,120 min)至PVDF膜;5%脱脂牛奶室温封闭2 h;一抗1∶200室温孵育2 h;TPBS洗膜3次;二抗1∶2 000室温孵育1 h;TPBS洗膜3次;ECL发光试剂盒显影;Bio-Rad凝胶成像系统获取图像。
1.7ELISA法检测乳腺癌细胞培养液中HPA的表达将对数生长期细胞制成单细胞悬液接种于96孔细胞培养板,每孔1×104个细胞,细胞充分贴壁后换液加入含60×104IU·L-1LMWH、5 mg·L-1GEM、60 ×104IU·L-1LMWH 联合 5 mg·L-1GEM的培养基继续培养,每个处理设3个复孔。处理24 h后收集上清,按试剂盒说明书进行检测。结果以实验组D450nm/对照组D450nm确定各组HPA的分泌情况。
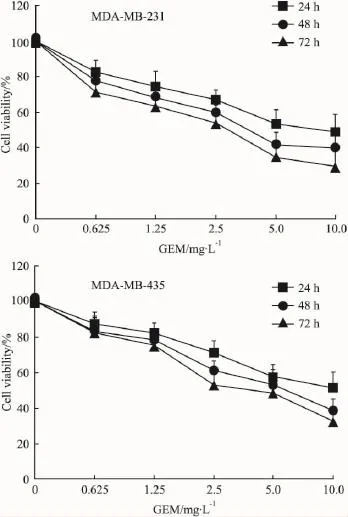
Fig 1 Proliferation of breast cancer cells inhibited by GEM
1.8统计学方法实验数据以±s表示,采用SPSS13.0软件对数据进行单因素方差分析,各组间比较用双侧Dunnettt检验。

Fig 2 Inhibitory effect of LMWH,GEM,and LMWH combined with GEM on the migration of breast cancer cells by wound healing assay
2 结果
2.1细胞增殖情况MTT结果显示,不同浓度GEM 处理 MDA-MB-231、MDA-MB-435 细胞 24、48、72 h,对细胞增殖具有抑制作用,且具有时间和浓度依赖性。MDA-MB-231细胞作用48 h的IC50为4.2 mg·L-1,MDA-MB-435 细胞作用48 h 的 IC50为 5.6 mg·L-1(Fig 1)。但 LMWH 在6.25×104~100×104IU·L-1浓度范围内对 MDA-MB-231、MDA-MB-435细胞增殖的影响不明显。与此同时,60×104IU·L-1LMWH 与不同浓度(0.625、1.25、2.5、5、10 mg·L-1)GEM合用结果显示,LMWH亦不能增强GEM对MDA-MB-231、MDA-MB-435细胞增殖的抑制作用(数据未列出)。
2.2细胞迁移情况细胞划痕实验结果显示,30×104IU·L-1LMWH、2.5 mg·L-1GEM 均可抑制MDA-MB-231、MDA-MB-435细胞的迁移,两者合用后对细胞迁移能力的抑制作用更明显(Fig 2)。Transwell细胞迁移实验结果显示,单用GEM时细胞的迁移抑制率分别为47.4%、52.9%;LMWH与GEM合用时细胞的迁移抑制率增加,分别为66.3%、76.5%,提示LMWH能增强GEM对乳腺癌细胞迁移的抑制作用(Fig 3)。
2.3细胞侵袭情况Transwell细胞侵袭实验结果表明,LMWH、GEM以及LMWH与GEM合用均可明显抑制MDA-MB-231、MDA-MB-435细胞对Matrigel基质蛋白的破坏作用,单用GEM时对MDA-MB-231、MDA-MB-435细胞的侵袭抑制率分别为37.8%、46.0%,LMWH与 GEM合用时分别为64.9%、71.4%,提示LMWH可增强GEM对乳腺癌细胞侵袭的抑制作用(Fig 4)。
2.4MMP-9的蛋白表达情况Western blot结果显示,60 ×104IU·L-1LMWH、5 mg·L-1GEM 作用于MDA-MB-231、MDA-MB-435细胞24 h后,MMP-9蛋白表达下调,合用时下调更加明显(Fig 5)。
2.5HPA的表达情况LMWH与GEM均可抑制MDA-MB-231、MDA-MB-435细胞HPA的分泌,合用时抑制作用更强,与对照组比较差异具有统计学意义(P<0.05)(Fig 6)。
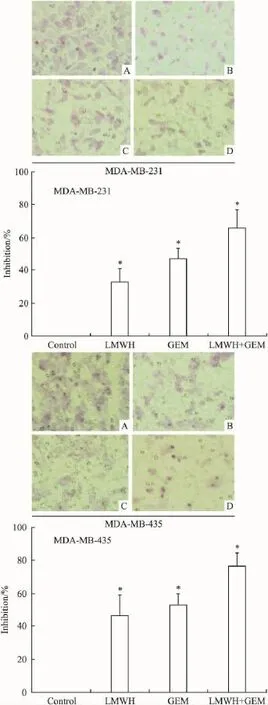
Fig 3 Inhibitory effect of LMWH,GEM,and LMWH combined with GEM on the migration of breast cancer cells by Transwell migration assay
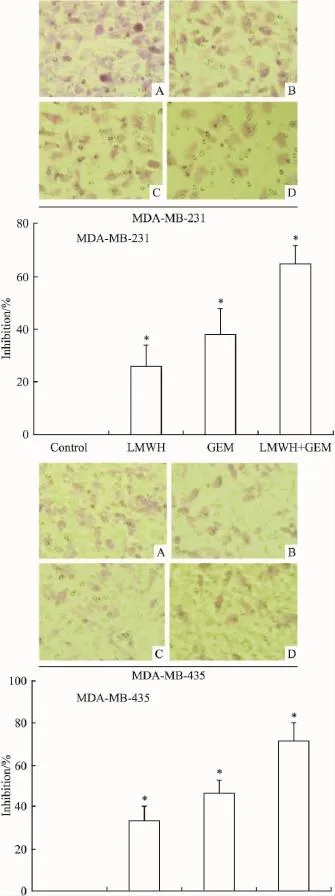
Fig 4 Inhibitory effect of LMWH,GEM,and LMWH combined with GEM on the invasion of breast cancer cells by Transwell invasion assay
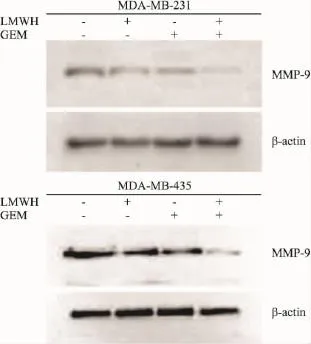
Fig 5 Expression of MMP-9 in breast cancer cells after exposure to LMWH,GEM,and LMWH combined with GEM for 24 h
3 讨论
目前乳腺癌的治疗以外科手术、化疗、放疗、内分泌治疗、基因治疗、中医中药治疗等多种手段为主,但效果多不甚理想,尤其是单一药物治疗,存在严重的不良反应且容易产生耐药,联合不同作用机制的药物,提高现有抗肿瘤药物的疗效、降低其毒副作用以及延缓耐药性的产生,是肿瘤治疗的一个重要策略[6]。本实验观察了LMWH联合GEM对乳腺癌细胞增殖、侵袭、迁移以及MMP-9和HPA表达的影响。结果表明,LMWH具有增强GEM抑制乳腺癌细胞侵袭和迁移的作用,但对GEM的增殖抑制作用没有明显影响。
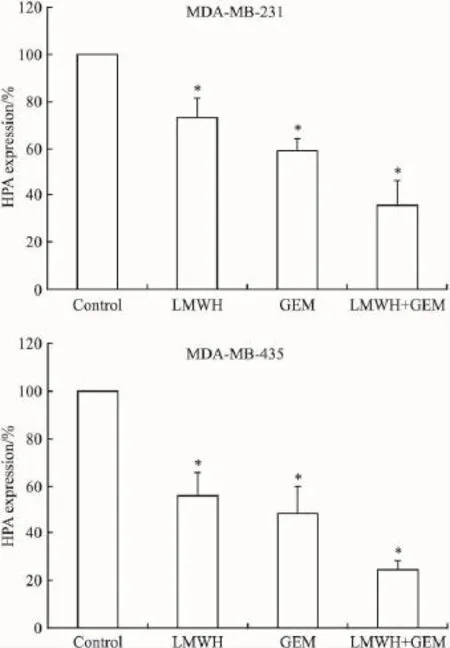
Fig 6 Expression of HPA in breast cancer cells after exposure to LMWH,GEM,and LMWH combined with GEM for 24 h
肿瘤细胞转移包括肿瘤生长侵袭、细胞脱落进入循环流动、与脉管内皮或组织基质黏附、通过组织和间隙变形移动、降解破坏细胞间质和定植生长等主要过程。侵袭转移是肿瘤恶性程度的重要生物学特性和影响肿瘤预后的主要因素,因此对侵袭转移机制的深入研究对肿瘤治疗方案的选择和判断预后具有重要的意义[7]。细胞外基质(extracellular matrix,ECM)的降解是肿瘤侵袭转移的关键步骤之一,主要依靠蛋白水解酶的作用。MMPs是一类锌离子依赖性蛋白酶,通过降解ECM中的绝大部分组分促进肿瘤细胞侵袭转移,其过表达与乳腺癌的高转移潜能和不良预后相关[8]。MMPs也参与调节肿瘤细胞增殖、生长因子的释放和肿瘤血管生成[9]。MMP-9是其中的关键分子之一,在乳腺癌患者中的高表达与肿瘤转移的发生密切相关[10]。同时,硫酸乙酰肝素蛋白聚糖(heparin sulphate proteoglycans,HSPG)作为ECM的另一主要成分,其降解也是肿瘤细胞侵袭转移的重要环节。HPA是目前已知体内唯一能够降解HSPG的β-D-葡萄糖醛酸内切酶,可识别并降解HSPG的硫酸肝素(heparan sulfate,HS)侧链,破坏由ECM组成的屏障结构,并释放结合在HS上的生长因子(如 bFGF、PDGF、VEGF等),从而刺激肿瘤细胞的生长和转移[11]。HPA在正常组织中基本不表达,但在包括乳腺癌在内的许多人类恶性肿瘤中高表达,可望成为理想的抗肿瘤靶点[12]。本实验结果显示,LMWH能增强GEM下调MMP-9和HPA的表达,可能是其增强GEM抑制乳腺癌细胞侵袭和迁移的作用机制之一。
本实验证明了LMWH具有增强GEM抑制MDA-MB-231、MDA-MB-435细胞侵袭和迁移的作用,二者联合应用在抑制肿瘤侵袭转移方面可能具有协同作用,具体的作用机制尚需进一步研究。
[1]Dent S,Messersmith H,Trudeau M.Gemcitabine in the management of metastatic breast cancer:a systematic review[J].Breast Cancer Res Treat,2008,108(3):319 -31.
[2]Phillips P G,Yalcin M,Cui H,et al.Increased tumor uptake of chemotherapeutics and improved chemoresponse by novel non-anticoagulant low molecular weight heparin[J].Anticancer Res,2011,31(2):411-9.
[3]Ishida K,Wierzba MK,Teruya T,et al.Novel heparan sulfate mimetic compounds as antitumor agents[J].Chem Biol,2004,11(3):367-77.
[4]Dredge K,Hammond E,Handley P,et al.PG545,a dual heparanase and angiogenesis inhibitor,induces potent anti-tumour and anti-metastatic efficacy in preclinical models[J].Br J Cancer,2011,104(4):635 -42.
[5]Ritchie J P,Ramani V C,Ren Y,et al.SST0001,a chemically modified heparin,inhibits myeloma growth and angiogenesis via disruption of the heparanase/syndecan-1 axis[J].Clin Cancer Res,2011,17(6):1382 -93.
[6]苏 方,刘 浩,程 秀,等.塞来昔布联合多柔比星对乳腺癌细胞增殖及凋亡的影响[J].中国药理学通报,2011,27(5):632-8.
[6]Su F,Liu H,Cheng X,et al.Effects of celecoxib combined with doxorubicin on the proliferation and apoptosis of breast cancer cells[J].Chin Pharmacol Bull,2011,27(5):632 -8.
[7]吴 静,雷艳丽,金 坚,等.rhddADAM15蛋白抑制小鼠黑色素瘤细胞生长及其机制[J].中国药理学通报,2011,27(9):1218-23.
[7]Wu J,Lei Y L,Jin J,et al.Inhibitory effects and mechanism of rhddADAM15 on the growth of melanoma B16 cells[J].Chin Pharmacol Bull,2011,27(9):1218 -23.
[8]Duffy M J,Maguire T M,Hill A,et al.Metalloproteinases:role in breast carcinogenesis,invasion and metastasis[J].Breast Cancer Res,2000,2(4):252 -7.
[9]Freije J M,Balbín M,Pendás A M,et al.Matrix metalloproteinases and tumor progression[J].Adv Exp Med Biol,2003,532:91-107.
[10]Incorvaia L,Badalamenti G,Rini G,et al.MMP-2,MMP-9 and activin A blood levels in patients with breast cancer or prostate cancer metastatic to the bone[J].Anticancer Res,2007,27(3B):1519-25.
[11]Zcharia E,Jia J,Zhang X,et al.Newly generated heparanase knock-out mice unravel co-regulation of heparanase and matrix metalloproteinases[J].PLoS One,2009,4(4):e5181.
[12]Barash U,Cohen-Kaplan V,Dowek I,et al.Proteoglycans in health and disease:new concepts for heparanase function in tumor progression and metastasis[J].FEBS J,2010,277(19):3890 -903.

